培养皿中的眼睛:眼组织类器官技术发展与应用
2022-04-01李金燕综述罗莉霞刘奕志陈舒怡审校
李金燕 综述 罗莉霞,刘奕志,陈舒怡 审校
(中山大学中山眼科中心,眼科学国家重点实验室,广东省眼科视觉科学重点实验室,广州 510060)
眼睛负责视觉接收,约80%的外界信息由眼睛接收,是最重要的感觉器官之一。眼球由屈光传导系统和视觉感知神经系统2个部分组成:角膜和晶状体是主要的屈光传导系统,视网膜负责视觉感知和视觉信息初步处理。经眼睛感知和初步加工形成的视觉神经信号由视神经投射到大脑视觉中枢,最终形成视觉。眼睛各组分的结构、功能异常都将影响视力,甚至失明。位于眼球最外层的是角膜,作为外界光线进入眼球的窗口,角膜起着屏障和屈光的作用。全球因角膜完整性破坏或混浊而致盲的患者数超过490万人[1]。角膜移植是角膜不可逆性损伤的唯一有效治疗方法,但角膜供体不足、术后免疫排斥等问题是角膜移植术的应用瓶颈[2]。晶状体位于角膜后,外界光线进入眼球后经晶状体完成第2次屈光。白内障是全球首位的致盲性眼病,它是晶状体光学质量下降的一类退行性病变,全球有超过1700万人因白内障致盲[3]。当前,白内障摘除联合人工晶体植入术已相当成熟,可有效治疗大多数老年白内障。但一方面,人工晶体植入术后可诱发青光眼、角膜内皮损伤等并发症;另一方面,由于婴幼儿晶状体仍然处于发育状态,白内障摘除后不适宜人工晶体植入,严重阻碍了患儿的视觉发育,是当前白内障治疗的难点问题[4-5]。视网膜是光线经角膜、晶状体屈光后最终到达的部位。青光眼、年龄相关黄斑变性和糖尿病性视网膜病变均为全球主要致盲性眼病,是一类最终以视网膜细胞受损,导致感光或投射功能失代偿为特点的视网膜退行性疾病[6]。虽通过控制病因或激光等治疗方法可改善或延缓早期视网膜损伤,但对于晚期病例,因人类视网膜再生修复能力几乎为零,终将导致不可逆性盲[7-9]。调查[3]显示:直至2020年,全球有超过4300万盲人和2.9亿患者罹患中度或重度视力障碍;由于视功能受损导致残疾、失业等问题,造成全球生产力损失超过4100亿美元。
对于致盲性眼病防、诊、治新方法的开发,需要我们对眼睛各组份的发育、生理和病理调控机制有全面、深入的理解。基于斑马鱼、小鼠等动物模型的研究为揭示眼组织发育、生理和病理机制以及诊疗方法开发提供了宝贵信息。但由于物种间存在差异,动物模型无法完全模拟人器官发育和病理过程,限制了这些基础研究成果向临床应用的转化。干细胞是具有自我更新和多向分化潜能的特殊细胞,可在体外扩增、分化,已成为研究发育、疾病病理、药物筛选的有力工具,还具有发展为细胞替代治疗的应用前景。近年来发展迅速的类器官技术将干细胞体外定向分化推向新的高度,而眼组织类器官技术发展和应用成为其中典型代表。目前已实现了视网膜、角膜、晶状体等类器官诱导[10-11],为眼发育、眼病的机制研究、药物筛选和替代治疗开辟了新的道路(图1)。本文将针对眼组织类器官的诱导体系发展和相关应用进行综述。
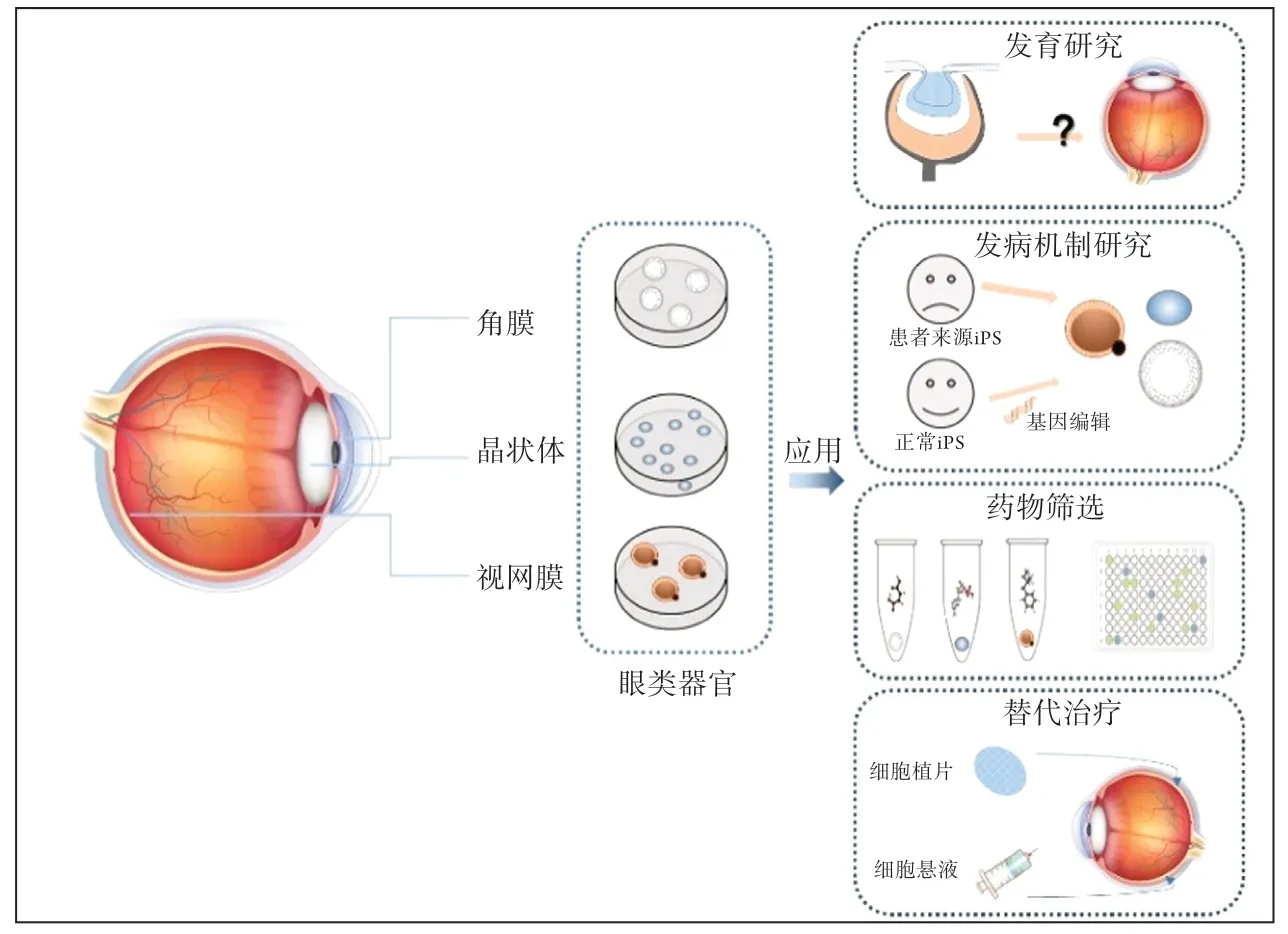
图1 眼类器官及其应用Figure 1 Ocular organoids and their application
1 类器官概述
1.1 类器官的定义
类器官是指通过类似体内发育过程中的细胞归集和空间定向谱系命运分化过程,干细胞或组织祖细胞在体外自我组装,最终形成具有组织特异性细胞组份的三维细胞培养产物,并可在体外部分再现该器官特有的功能[12-14]。
并不是所有干细胞的诱导产物都可称为类器官。类器官技术实现了从细胞层面向组织层面的转化,与传统的平面干细胞诱导培养相比,类器官技术对培养体系细节要求(如细胞品系、细胞密度等)更高,但优势也是明显的:类器官培养可更好模拟了组织特异的生长或形态发生过程;此外,产物具有与原生器官/组织相似的细胞组成和组织结构,产生器官特异的大部分细胞类型,还具有器官部分特异生理功能[12]。
1.2 类器官的技术发展
虽然类器官在近十年来发展迅猛,但是人们很早就开始尝试在体外再现类似体内组织/器官结构的培养。1975年Michalopoulos和Pitot团队[15]提取鼠尾胶原悬浮培养原代的肝细胞,在体外重现了类似肝小叶的结构,还可分泌细胞色素P450。这些早期由组织细胞/干细胞/前体细胞自我组装形成的类组织结构相对简单,使用的细胞来源非常有限,限制了这些技术的推广应用。
胚胎干细胞(embryonic stem cells,ESC)/诱导多能干细胞(induced pluripotent stem cells,iPSC)由于其强大的自我更新和多向分化潜能,早已被广泛开发,定向诱导分化成各胚层的终末分化细胞,以用于理论研究和临床转化。过去的定向诱导方案多以二维平面培养形成分散存在的各种终末分化细胞为终点。2008年,Eiraku等[16]改良悬浮培养方法,利用低黏附V孔板,促进小鼠胚胎干细胞形成快速成团无血清拟胚体(quickly aggregated serum free embryonic body,SFEBq),经进一步定向分化培养,体外重现了体内大脑皮层的发育过程,分化为皮层特异各种神经元,形成与皮层类似的立体结构,并具有一定的电生理功能,首创了利用胚胎干细胞构建类器官的培养体系。从2008年至今的十余年间,各种类器官的体外诱导体系不断涌现,基于ESC或iPSC已实现肝、肺、大脑皮质等组织/器官特异种子细胞的体外分化[17-19]。
原发组织来源的种子细胞,包括发育期组织中的祖细胞或成熟组织中的成体干细胞,解决了多能干细胞成瘤性高、目标器官分化调控不明确的问题。2009年,Muthuswamy等[14]将Lgr5+小肠成体干细胞在悬浮培养体系中培养,发现该体系可体外自组装为小肠微绒毛单位,建立了利用成体干细胞构建类器官的培养体系。目前,利用成体干细胞已实现了胰腺、肝、乳腺小叶、小肠和胃等类组织/器官的体外诱导分化[19]。
作为良好的研究工具,类器官可结合生物信息学技术,拓宽了对发育过程、特别是人体组织/细胞发育过程的了解;可结合重编程技术、基因编辑技术,构建了疾病模型用以发病机制的研究;可结合药物学和化学,促进了药物筛选进程;还可结合组织生物工程,拓展了细胞/组织替代治疗新途径[20-21]。其中,眼类器官作为其中典型的代表,在生物和转化医学领域应用前景广阔,或许可成为一些致盲性眼病的最终解决方案。
2 眼组织类器官研究进展
2.1 角膜
角膜是位于眼球最外层的无血管透明组织,主要由前部的上皮层、后部的内皮层和位于中间的基质细胞组成。角膜发育源于表皮外胚层和神经嵴:表皮外胚层经神经嵴来源的眼周间充质细胞的作用分化为角膜上皮细胞;而这些间充质细胞则形成部分角膜基质细胞和角膜内皮细胞[22-23]。角膜上皮类似皮肤上皮,每天都有细胞从表面脱落丢失。目前认为,角膜上皮的自我更新由角膜缘干细胞(limbal stem cell,LSC)维持。角膜缘干细胞缺陷(limbal stem cell deficiency,LSCD),是导致角膜混浊的主要病因[24]。以干细胞为基础的替代治疗有望解决角膜移植供体不足等临床治疗难题。
2.1.1 角膜类器官技术的发展
目前角膜体外诱导研究可分为角膜缘干细胞-复层角膜上皮组织和角膜类器官2个研究方向。
角膜缘干细胞-复层角膜上皮组织的研究旨在探究角膜缘干细胞/角膜上皮细胞的体外扩增方案。Pellegrini团队[25]最早利用3T3细胞作为支持细胞,对人角膜缘干细胞体外扩增进行了探索,并建立了体外长时间存活和扩增的培养方案。随着多能干细胞技术的发展,研究者们通过模拟角膜发育的体内调控分子机制,在体外重现角膜上皮组织/角膜类器官的发展过程。例如,通过序贯性抑制Nodal和Activin通路、抑制SMAD信号通路,可激活Zic和Fox家族,使多能干细胞向神经外胚层细胞分化;进一步抑制TGFβ和WNT信号通路,神经外胚层细胞将趋向分化为角膜上皮细胞[26-27]。此外,通过与角膜缘基质细胞共培养,多能干细胞可在神经生长因子、内皮生长因子和表皮生长因子的作用下分化出角膜上皮样细胞[28]。2014年,Ouyang等[29]发现在PAX6和WNT7A是维持角膜上皮细胞命运的关键因子,并结合重编程技术,在皮肤上皮干细胞中过表达PAX6可将其重编程为LSC,解决了角膜缘干细胞来源缺乏的问题。2016年,Hayashi团队[30-31]创建多外胚层自主分化体系,将iPSC诱导出具有分化为角膜缘干细胞、角膜上皮及结膜上皮的眼表面外胚层原基,经分离培养后可成功诱导为复层的角膜上皮组织,并具有修复兔角膜上皮缺损的能力。
角膜类器官的研究旨在探究体外建立与角膜类似的多层角膜类器官。早在1993年,Minami等[32]制作牛角膜缘活组织切片,在体外扩增出具有典型3层结构的类角膜组织。而后,研究者们改进了基质成分或支持细胞,将角膜上皮、基质和内皮等成体细胞结合,在体外重现具有与角膜相似形态、透明度和组织学特性的类角膜组织[33-34]。多能干细胞来源的角膜类组织诱导体系见报道于2017年,Foster等[35]基于人iPSC-拟胚体诱导体系,分离其中的角膜原基进行悬浮培养,获得了表达角膜上皮、基质及内皮细胞标志物的角膜类组织,电镜还可见基质板层的形成。同年,Susaimanickam 等[36]则改进了Hayashi 等[30]创建的角膜上皮细胞诱导体系,将人iPSC来源的眼表面外胚层原基进行分离悬浮,诱导产物不仅可角膜各层细胞的分子标志物,还具有复层角膜上皮-形成板层的角膜基质-角膜内皮结构,此外,经15 周的培养,还可见角膜缘、结膜等类似结构,一定程度上模拟了体内眼前段的发育过程。
2.1.2 角膜类器官的应用
角膜缘干细胞-复层角膜上皮组织的研究可为治疗LSCD提供潜在的种子细胞,有巨大的临床应用前景。R ama等[37]通过体外扩增自体角膜干细胞,制备了角膜上皮薄片并移植治疗LSCD患者,经长期随诊发现,如果移植物中携带了足够数量的角膜缘干细胞,超过70%的病例可实现角膜再生。随后,研究者们开始关注角膜缘上皮细胞移植的安全性和有效性。Kolli团队[38]建立了符合GMP标准的自体角膜干细胞体外扩增技术,临床实验中显著改善了LSCD患者的主观及客观检查结果。Zakaria等[39]进行的临床II期试验结果显示,经标准化、同种培养系统、减少操作培养和手术入路的角膜缘上皮细胞移植术可安全有效减少角膜新生血管。Tsai团队[40]发现经自体角膜干细胞移植术后,患者角膜可完成再上皮化,并有83%患者的视力得到了改善。Lopez-Garcia等[41]则对自体角膜缘移植联合羊膜移植进行前瞻性研究,进一步改善了再上皮化和间质再生。如今,角膜缘干细胞治疗眼烧伤已被欧盟监管部门批准,在干细胞应用于眼科治疗方向走在了前列[42]。
角膜类器官的研究则可作为研究角膜发育和疾病病理研究的有力工具。有研究团队将微流体芯片(microfluidic chip)和细胞培养技术结合,对眼表组织结构进行了体外模拟,为体外研究功能性干眼提供了良好的疾病模型。Bennet等[43]最先利用微流体芯片构建了具有角膜上皮细胞层、基底层和Bowmen’s膜的角膜复层结构,并利用微流体模拟了眼泪动力学体系。Seo等[44]进一步构建了包括角膜上皮层和基质层、结膜上皮和杯状细胞的复合体系,并设计了穹顶样细胞灌注系统,通过减少细胞灌注频率以模拟功能性干眼,并发现该模型中角膜上皮细胞过表达了IL-1β、TNF-α和基质金属蛋白酶MMP-9,与临床表型一致性。此外,角膜类器官还为基质、内皮相关的角膜受损/角膜穿孔提供替代治疗的可能,或许在不久的将来,人造角膜将成为事实。
2.2 晶状体
与角膜相似,晶状体也是无血管的透明组织,由表面的晶状体上皮细胞包裹内部洋葱状层叠的特化纤维细胞组成。晶状体的发育起源于表面外胚层,在外凸的视网膜原基和眼周间充质的作用下,视网膜原基附近的表面外胚层增厚,特化为晶状体基板。晶状体基板向内膨出,与表面外胚层逐渐分离,形成具有晶状体原始结构的晶状体囊。晶状体囊前端细胞成为晶状体上皮细胞;后端细胞分化为纤维细胞,形成胚胎核,被称为初级纤维;晶状体上皮细胞保持增殖能力,在赤道部活跃增殖,所产生的子代细胞向晶状体内部迁移并分化为纤维细胞包裹胚胎核,被称为次级纤维[45-46]。
人们对于体外构建晶状体组织的尝试也是从原发组织细胞开始的。1980年,有学者[47]利用小鼠晶状体上皮细胞,首次诱导出表达晶状体特异蛋白、具有类似透镜样形态的细胞团,称之为晶状体小体,这是人们首次在体外培养出晶状体类器官样结构。30年之后,人们参考体内晶状体发育所经历的信号调控过程,序贯性利用Noggin早期抑制BMP信号通路,依次通过再激活BMP、FGF和WNT信号,可模拟体内晶状体发育过程,将人ESC经定向诱导形成晶状体小体样结构,所得晶状体小体高度表达晶状体特异蛋白α-、β-及γ-晶状体蛋白,以及晶状体骨架蛋白BFSP1、BFSP2和MIP、并具有一定的透明性。但其实际上为晶状体上皮细胞和纤维细胞的混合物,且所得晶状体小体太小,缺乏屈光能力[48]。之后,Fu等[49]利用人iPSCs,对该晶状体小体诱导体系进行了改良,通过机械富集E-cadherin+的上皮样细胞,使其形成巨大的“煎蛋样”克隆岛,并经定向诱导为FOXE3+的类晶状体前体细胞,从而获得了更大的晶状体小体,该晶状体小体不仅表达晶状体细胞的分子标志物,其晶状体上皮及纤维细胞的排列还与体内晶状体类似,并可观察到晶状体纤维细胞细胞器降解过程。而Murphy等[50]发现ROR1可作为晶状体上皮细胞的表面标记受体,通过流式分选富集,并利用微孔板及琼脂胶对定向诱导所得的晶状体上皮细胞进行成团培养,得到了大量的晶状体小体,除了表达晶状体特异的蛋白,改良后产物形成了双凸结构并具有屈光能力。
建立晶状体类器官诱导培养体系可为研究晶状体发育和病理机制提供理想模型。研究者们利用人晶状体类器官诱导体系,揭示了人晶状体纤维细胞分化的新机制和长非编码RNA在晶状体细胞脱细胞器过程中的作用[51-52]。也有研究者们[53]利用紫外线照射处理晶状体小体,建立年龄相关性白内障的疾病模型,并阐明了蛋白聚集在年龄相关性白内障致病中的作用。2016年,Lin等[54]明确了晶状体上皮干细胞的存在,展示了晶状体上皮细胞可在体外形成晶状体类器官。总之,晶状体类器官培养体系的建立和进一步完善将为晶状体的发育、病理和转化研究提供宝贵的模型工具。
2.3 视网膜
视网膜是眼球中结构最复杂的组织,包含六大类神经细胞(视锥感光细胞、视杆感光细胞、双极细胞、水平细胞、无长突细胞和视网膜节细胞)和一类神经胶质细胞(Müller细胞)。这些数目众多的视网膜细胞高度有序地排列为3个细胞层(外核层,内核层和视网膜节细胞层),并由2个神经突触层相连接(外丛状层和内丛状层)。在胚胎发育过程中,视网膜发育起始于间脑部位的神经管原基,其向外膨出形成视泡,外膨视泡在到达表面外胚层附近后开始内凹,形成具有两层结构的视杯。视杯外层分化为视网膜色素上皮(retina pigment cell,RPE),内层分化为神经视网膜(neural retina,NR)。NR中的视网膜祖细胞增殖并有序退出细胞周期,陆续分化形成各类视网膜细胞[55-57]。在低等动物如斑马鱼中,成体周边视网膜的睫状缘带细胞及Müller细胞仍保留再生潜能,视网膜损伤后可进行再生修复[58-59]。而在哺乳动物中,视网膜无法再生。视网膜退行性疾病,如视网膜色素变性、年龄相关性黄斑变性、Stargardt’s综合征、青光眼、Leber先天性黑朦等,均以视网膜某一类或多类视网膜神经元丢失为特征。目前仍缺乏针对这些视网膜退行性疾病的有效治疗手段,是防盲致盲的难点问题,也促使人们利用各种传统与前沿的生物医药技术,开发视网膜疾病防、诊、治新策略[25]。
2.3.1 视网膜类器官技术的发展
2011年,Eiraku等[60-61]基于他们前期对脑组织类器官构建和视网膜细胞体外分化的研究基础,成功建立了由小鼠ESC构建三维视网膜类器官的诱导培养体系。该体系构建的视网膜类器官高度模拟视杯发育过程,多能干细胞经由Matrigel的支持,自我组装为立体的视网膜祖细胞球,通过调控WNT通路和FGF通路,平衡神经视网膜和视网膜色素上皮的细胞分化命运选择,从而得到视网膜前体细胞球。令人惊喜的是,视网膜前体细胞球具有分化为各类视网膜细胞的能力,并可类似体内视网膜组织结构高度有序排列。这是人类第1次人工合成如此复杂的类器官,极大提升了人们对类器官研究的热忱。2012年,Nakano等[62]团队进一步建立了人视网膜类器官的诱导体系。在Nakano等[62]开创性的视网膜类器官工作之后,人们通过各种方法进一步完善这一系统。Zhong等[63-64]改进了拟胚体的形成策略,利用贴附培养的方法提高类视杯的诱导效率。同时,Lowe等[64]还通过利用搅拌式生物反应器(spinning bioreactor),提高类视杯的存活时间,从而收获了具有成熟外节和电生理功能感光细胞的视网膜类器官。
在过去十年里,视网膜类器官的诱导策略在不断改进,目前大致可分为4种:1)基于SFEBq策略、在悬浮体系中完成类视杯诱导[60-62,65-66];2)悬浮形成拟胚体-贴附诱导类视杯的策略[63,67];3)在平板中进行神经外胚层定向诱导,机械富集类视杯后悬浮培养[68-69];4)利用matrigel包埋ESC形成上皮样囊腔,对囊腔进行类视杯诱导[64,70]。通过不断改进视网膜诱导体系,所得的视网膜类器官结构更加成熟。Kuwahara等[66]使用BMP4替代matrigel,提高了基于SFEBq策略诱导类视杯的效率,并摸索出稳定获得类视网膜睫状缘区的诱导体系;Capowski等[69]利用16种不同品系的iPSC,阐明了成熟视网膜类器官分化过程的3个阶段。Kim等[70]改良了Lowe体系,发现所得的视网膜类器官中感光细胞的视杆、视锥细胞比例与人黄斑结构相似。Cowan等[71]通过棋盘式刮板分离视网膜前体细胞,进一步获得了更多的视网膜类器官。Achberger等[72]利用微流体芯片在NR类器官旁加入iPSC分化的RPE,以模拟体内NR和RPE的作用,进一步促进了感光细胞的外节分化。
2.3.2 视网膜类器官的应用
视网膜类器官技术目前已广泛应用于视网膜发育、疾病发病机制的研究,以及药物筛选和替代治疗的探索。结合基因组学、蛋白组学测序,多个研究团队已揭示了在视网膜类器官的分化过程中,其基因表达谱、组蛋白修饰和DNA甲基化图谱与体内胚胎视网膜发育相似,以此阐明视网膜各类细胞的分化轨迹和调控机制[71,73]。结合CRISPR等基因编辑技术,视网膜类器官技术已用于研究基因在视网膜发育中作用:Takata等[74]发现敲除Rspo2和Six3后的小鼠视网膜类器官形态发育异常,揭示了Rspo2和Six3在神经视网膜上皮发育中的作用;Capowski等[75]发现MITF突变可导致类视泡组织体积减小,揭示了MITF可调控早期视泡细胞的增殖能力。研究者们还利用视网膜类器官诱导体系,构建了视网膜疾病模型以探究发病机制:Li等[76]将RPE65突变的iPSC诱导为视网膜类器官,构建了Leber先天性黑朦的疾病模型;Quinn等[77]利用CRB1突变的iPSC,通过诱导视网膜类器官构建了视网膜色素变性的视网膜类器官模型;Gao等[78]利用PDE6B突变的iPSC,构建了迟发性视网膜色素变性的视网膜类器官模型。
此外,与二维视网膜细胞培养相比,视网膜类器官是更可靠的药物筛选工具。有研究者[79]构建了晚期视网膜母细胞瘤(retinoblastoma,RB)类器官模型,发现该模型能重现拓扑替康、甲氨蝶呤等化疗药物对RB的临床效果。此外,视网膜类器官还可模拟羟基他莫昔芬(4-OHT)、乙酚对视网膜的药物不良反应和维生素E、叶黄素对视网膜的保护作用[80]。
最后,研究者们已尝试分离视网膜类器官中的各细胞组分,通过细胞悬液注射或植片移植,进行不可逆性视网膜疾病的替代治疗。感光细胞丢失是多种不可逆性视网膜疾病的共通结果。Lakowski等[81]利用人视网膜类器官筛选出感光前体细胞的表面受体组合,从而富集视网膜类器官中的感光前体细胞并移植入小鼠视网膜下,发现移植物可在小鼠中成功存活。Garita-Hernandez等[82]通过富集视网膜类器官的视锥前体细胞,用于治疗视网膜变性小鼠,发现可部分恢复其对光的感应。而在视网膜退行性疾病的终末期,视网膜受累细胞不局限于单一的细胞类型,甚至会导致外核层消失。针对这种情况,Zou等[83]从视网膜类器官中分离出C-Kit+/SSEA4-的早期视网膜祖细胞,并移植入晚期视网膜变性小鼠模型体内,发现祖细胞在体内可形成成熟的感光细胞层,与宿主细胞产生突触联系并改善视功能。虽然在小鼠的替代治疗初见效果,我们仍需要对视网膜前体细胞的筛选、移植策略、视网膜细胞间整合机制等问题作更深层次的研究,以实现人视网膜退行性疾病的替代性治疗。
除了角膜、晶状体和视网膜已实现了类器官的诱导培养,泪腺类组织诱导技术也亦见报道。Hirayama等[84]等在2013年分离胚鼠泪腺和Harderian腺原基中的上皮干细胞和间充质干细胞,利用胶原将这两种成体干细胞混合形成细胞团,并移植入去泪腺的成年小鼠中,发现细胞团可在小鼠体内存活并自我组装,形成了表达泪腺上皮标志物、结构相似的类泪腺组织。此外,它还具有分泌泪液的功能,并可与受体的泪液排出通道形成连接。随后,研究者们开发了泪腺的去细胞骨架,利用成年鼠、兔和猪中的泪腺上皮细胞作为种子细胞,诱导出具有功能的泪腺类器官,移植体内后发现可代偿的泪腺功能[85-87]。
3 结语
类器官技术为眼发育提供了新的工具,更为研究遗传性眼病、实现个体化治疗提供可能性。尽管如上所述,眼类器官研究领域已取得长足进展,但所得产物与真实的组织/器官仍存在较大的差异,这限制了它们的应用。
首先,类器官诱导产物的结果分化并不理想。得益于先前发育生物学的研究积累,研究者们掌握了体内各类细胞的发育来源及调控网络,可使干细胞经调控通路向单一的祖细胞定向分化,获得了从该祖细胞来源的大部分子细胞,但实际上,诱导产物的各细胞组分的数量、比例及进一步细胞间的结构分化并不理想。如晶状体类器官,研究者们实现了晶状体祖细胞的定向分化,获得了同时具有晶状体上皮细胞和纤维细胞的诱导产物,但现有的产物中细胞数量、细胞排列、形态与真实的晶状体仍相去甚远。
其次,目前所得的眼类器官为单一胚层的组织/器官。与眼类器官不同,眼组织是由多胚层组成的:与体内相比,目前多数角膜类器官缺乏神经嵴来源的基质层及内皮层;而现有的视网膜类器官仍缺乏了内胚层来源的小胶质细胞和血管组织支持。此外,当前缺乏由多个眼组织构成的眼前节/眼后节模型。眼发育或疾病的产生通常是多个眼组织间共同作用的结果,比如晶状体发育需视泡的作用、角膜发育需晶状体的作用等。建立不同眼组织之间相互作用的模型,可为研究眼系统性疾病的机制提供工具。
此外,虽然利用类器官技术已在体外获得具有多能分化潜力的组织特异的前体细胞,但由于各实验室所用种子细胞品系、培养基、培养方案的细微差异,即使同一诱导体系在不同实验室间诱导效率也存在较大的差异。比如,研究者们发现,与其他非视网膜来源的体细胞相比,由RPE重编程而得的iPSC向RPE诱导的效率更高。相似地,由视网膜感光细胞重编程而得的iPSC的视网膜类器官诱导效率更高[88-89]。随着对表观遗传修饰的深入研究,目前认为这是因为不同品系的ESC、不同体细胞来源的iPSC的表观印记不同。由于表观印记的存在,不同ESC或iPSC在同一分化体系下的诱导效率存在较大的差异[90]。因此,对于类器官再生的技术细节,如细胞来源、细胞密度、细胞外基质的选择等,均需进一步细化。
针对这些问题,有研究者利用搅拌式生物反应器(spinning bioreactor)、微流体芯片(microfluidic chip)等生物工程技术的结合应用,以及多胚层细胞的联合培养等策略可更好模拟体内器官发育状态,有望突破眼睛类器官结构分化不成熟、单一胚层的技术颈瓶。同时,通过建立标准化诱导体系,可利于破除实验室间由于系统误差带来的结果偏倚,扩大利用类器官进行药物测试的可信度。另一方面,虽然通过对分子机制及细胞微环境的探索,我们可得到眼组织的前体细胞,但前体细胞之间如何更好组装也亟待探索,因此应进一步探索眼类器官立体结构形成的分子机制,为改进眼类器官提供线索。或许在未来,基于对类器官结构、细胞组成和分化机制的更成熟的认识,研究者们可创建更复杂、与体内更相似的眼类器官,进一步促进眼组织发育和疾病发病机制的研究,以及药物筛选和替代治疗的探索。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CCBY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。
