新疆家蚕肠道菌群多样性分析
2022-04-01刘语涵李莉张来斌马光皇陈家力肖海兵朱天生杨明禄
刘语涵 李莉 张来斌 马光皇 陈家力 肖海兵 朱天生 杨明禄






摘要:家蚕肠道菌群与蚕体对营养物质的消化吸收及健康密切相关。通过饲喂苏优一号家蚕3种不同处理的桑叶,探讨不同处理桑叶饲喂对家蚕肠道菌群的影响及可能的作用机制,为新疆蚕区家蚕肠道微生物种类组成及多样性差异提供一定的理论依据。以正常饲喂组、含沙桑叶组、高湿桑叶组等3种处理方式,饲喂5龄幼虫,采用十六烷基三甲基溴化铵(CTAB)法对家蚕肠道微生物进行DNA提取,之后通过琼脂凝胶电泳检测DNA的浓度,以16S rDNA高通量测序技术研究不同饲喂组家蚕肠道微生物种类组成及多样性。结果表明,苏优一号优势菌门为变形菌门(Proteobacteria),优势菌科为Chloroplast-norank科和伯克氏菌科(Burkholderiaceae),优势菌属为Chloroplast-noranks属、水杆菌属、Tyzzerella-3属等。正常桑叶饲喂组水杆菌属的含量显著高于其他处理,肠球菌属(Enterococcus)仅存在于含沙桑叶饲喂组,而不动杆菌属(Acinetobacter)仅在正常饲喂组。α多样性指数分析发现Simpson指数B处理显著高于其他处理,Chao1、Faith_pd、Goods_coverage和Observed_species指数组间无差异,而Shannon和Pielou_e指数有差异但不显著。说明桑叶表面沙尘和水分都能影响家蚕肠道微生物丰度,其中沙尘能够影响肠道微生物群落结构。
关键词:家蚕;肠道菌群;多样性;干旱蚕区;丰度
中图分类号:S881.2 文献标志码: A
文章编号:1002-1302(2022)05-0156-06
收稿日期:2021-07-13
基金项目:新疆建设兵团南疆重点产业科技支撑计划(编号:2018DB004)。
作者简介:刘语涵(1993—),山东菏泽人,硕士研究生,研究方向为农业昆虫与害虫防治。E-mail:569175037@qq.com。
通信作者:杨明禄,博士,教授,硕士生導师,研究方向为农业昆虫与害虫防治。E-mail:ymlzkytd@163.com。
家蚕(Bombyx mori L.)属于鳞翅目(Lepidoptera)蚕蛾科(Bombycidae),起源于我国北方野桑蚕(Bombyx mandarina),幼虫均以桑叶为食,家蚕经过几千年的驯化与选育,已有3 000多个品种[1-3]。家蚕也是重要的生物学模型和模式昆虫之一,具有遗传背景清楚、个体大、易饲养等优势,在生物学、遗传学和昆虫免疫学领域发挥着重要的作用[4]。对于家蚕肠道微生物,早在20世纪60年代日本学者就利用培养基对家蚕幼虫的肠道细菌有了初步的研究[4]。早期主要研究家蚕疾病相关微生物,如白僵菌、绿僵菌、微孢子虫、病原细菌及病毒等病原微生物经消化道的侵染过程。目前,越来越多的研究人员开始关注鳞翅目昆虫肠道微生物的多样性与宿主的关系及在昆虫资源和保护中的作用[5]。家蚕肠道微生物以细菌为主,优势菌有微球菌科、芽孢杆菌科、短杆菌科、乳杆菌科、肠杆菌科、Peudomonadaceae、伯克氏菌科、毛螺菌科、针叶树科,其次丰富的菌种为表皮葡萄球菌属、Tyzzerella-3属、Aquabacterium属,蜡样芽孢杆菌属、金黄色葡萄群菌属、克雷伯氏菌属。1996年,孙雪奇等通过不同的培养基分离出家蚕肠道中的好氧微生物,并检测出部分兼厌氧微生物,证明它们分别属于16个属[6]。1999 年鲁兴萌等运用 API 20 STREP(V.5.0)系统对正常的家蚕消化道来源的89株肠球菌进行研究,发现 Ent .casselif lavus 和 Ent .faecalis是家蚕消化道内的主要肠球菌菌丛[7]。2006 年袁志辉等采用传统培养法和非培养法研究家蚕肠道的细菌群体结构,显示家蚕肠道中节杆菌属(Arthrobacter)、乳杆菌属(Lactobacillu)、大肠杆菌属(Escherichia coli)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcu)、假单胞菌属(Pseudomonas)丰度较高[8]。2007年田贞华等对家蚕 4 龄幼虫肠道通过16S rDNA-RFLP分析,分离出14个不同类群,发现它们主要分布在10个细菌属及其分支中[9]。近期对家蚕肠道菌群基因组分析的报道表明,家蚕肠道菌在属水平上主要包括肠球菌属(Enterococcus)、不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、寡养单胞菌属(Stenotrophomonas)、芽孢杆菌属和葡萄球菌属[10]表明了家蚕肠道菌群的多样性。
家蚕肠道微生物与其消化吸收和生长状况息息相关。研究家蚕肠道菌群有利于改善家蚕的健康状况、减少疾病的发生从而提高蚕茧的产量和质量。之前的研究是利用传统的培养方法来检测家蚕肠道菌群结构,不能全面地反映出家蚕肠道细菌的真实状况,因此本试验利用16S rRNA基因高通量测序数据分析来全面准确地了解家蚕肠道菌群的结构。
新疆地处亚欧大陆腹地,属于典型的温带大陆性气候,是丝绸之路的重要通道。最早的种桑养蚕起源于和田地区,和田地区位于新疆最南端,南枕昆仑山和喀喇昆仑山,北部深入塔克拉玛干沙漠腹地,处于干旱荒漠气候区,风沙天气频发[11-12],形成具有新疆特色的养蚕方式——水洗桑叶饲喂。本研究利用16S rDNA高通量测序技术,研究不同饲喂处理对其肠道微生物的影响,为研究家蚕对桑叶湿度和沙尘耐受性奠定基础,阐明肠道微生物与家蚕之间的互作可以为通过改变肠道微生态改善家蚕生长状况及提高经济效益提供线索。
1 材料与方法
1.1 材料
苏优一号三眠蚕由新疆维吾尔自治区和田蚕桑科学研究所提供;桑树品种为桂桑12,沙地滴灌栽培,三年生条桑桑叶。
1.1.1 试验地设置
试验地位于新疆维吾尔自治区和田桑蚕科学研究所。新疆最早的种桑养蚕起源于和田,和田位于新疆最南端,地处喀喇昆仑山与塔克拉玛干大沙漠之间,属于干旱荒漠性气候,四季多风沙,形成新疆独具特色的养蚕方式。
1.2 试验方法
1.2.1 家蚕饲育及取样
2020年8月,取同一批次的家蚕,桑叶水洗晾干后饲喂4龄起蚕,挑选 1 200 头长势均一的家蚕用于试验。试验设置3个处理、重复4次。将饲喂水洗高湿桑叶(洗净桑叶,补水20%,SY1-A)、水洗晾干正常桑叶(饲喂前 2 h 用水洗净的桑叶,桑叶表面干爽无水珠,SY1-B)和采回含沙桑叶(采摘回来的新鲜桑叶,补水20%,SY1-C),其中SY1-B为对照组。取5龄第3天的家蚕肠道为样本,每个重复取10头家蚕,取其肠道,并置于离心管中,放入-80 ℃冰箱保存。
1.2.2 提取家蚕肠道微生物DNA
每个离心管内的中肠进行匀浆后,采用十六烷基三甲基溴化铵(CTAB)法取样提取DNA基因组,以琼脂糖凝胶电泳检测DNA的浓度和纯度,用无菌水稀释至1 ng/μL备用。
1.2.3 16S rDNA V3-V4区高通量测序
以稀释的DNA为模板进行PCR扩增,选择通用引物(27F:ACTCCTACGGGAGGCAGCA;1492R:GGACTACHVGGGTWTCTAAT),采用北京全式金生物技术有限公司的Pfu高保真DNA聚合酶进行PCR扩增,采用相同的扩增条件,并设置阴性对照,保证操作过程无污染。以Illumina公司的TruSeq Nano DNA LT Library Preparation Kit制备测序文库,采用Agilent High Sensitivity DNA Kit将构建好的测序文库在Agilent Bioanalyzer上进行质检,合格后采用Illumina平台对群落DNA片段进行双端测序。
1.2.4 生物信息学分析
1.2.4.1 测序数据处理
首先使用cutadapt切除序列的引物片段(设置-O为10),弃去未匹配引物的序列用Vsearch的fastq_mergepairs模块拼接序列;使用fastq_filter模块对拼接序列进行质控;使用 derep_fulllength模块去除重复序列;使用cluster_size模块,在98%相似度水平对去重后的序列聚类,并使用uchime_denovo模塊去除嵌合体;再使用perl脚本(https://github.com/torognes/vsearch/wiki/VSEARCH-pipeline),过滤质控后序列集中的嵌合体,从而获得高质量序列;使用cluster_size模块,在97%相似度水平对高质量序列聚类,并分别输出代表序列和OTU表,去除OTU表格中的singletons OTUs及其代表序列。
1.2.4.2 数据质控与分析
使用QIIME2 (2019.4)、自编perl脚本等绘制物种分类组成图表;使用QIIME2 (2019.4)、R语言、ggplot2包,计算Chao1、Observed species指数、Shannon、Simpson指数、Faiths PD指数、Pielous evenness 指数和Goods coverage指数;使用QIIME2 (2019.4)软件绘制稀释曲线;R脚本将上表中数据绘制Alpha多样性指数箱线图和PCoA点图。
2 结果与分析
2.1 家蚕肠道微生物16S rDNA序列组装和拼接
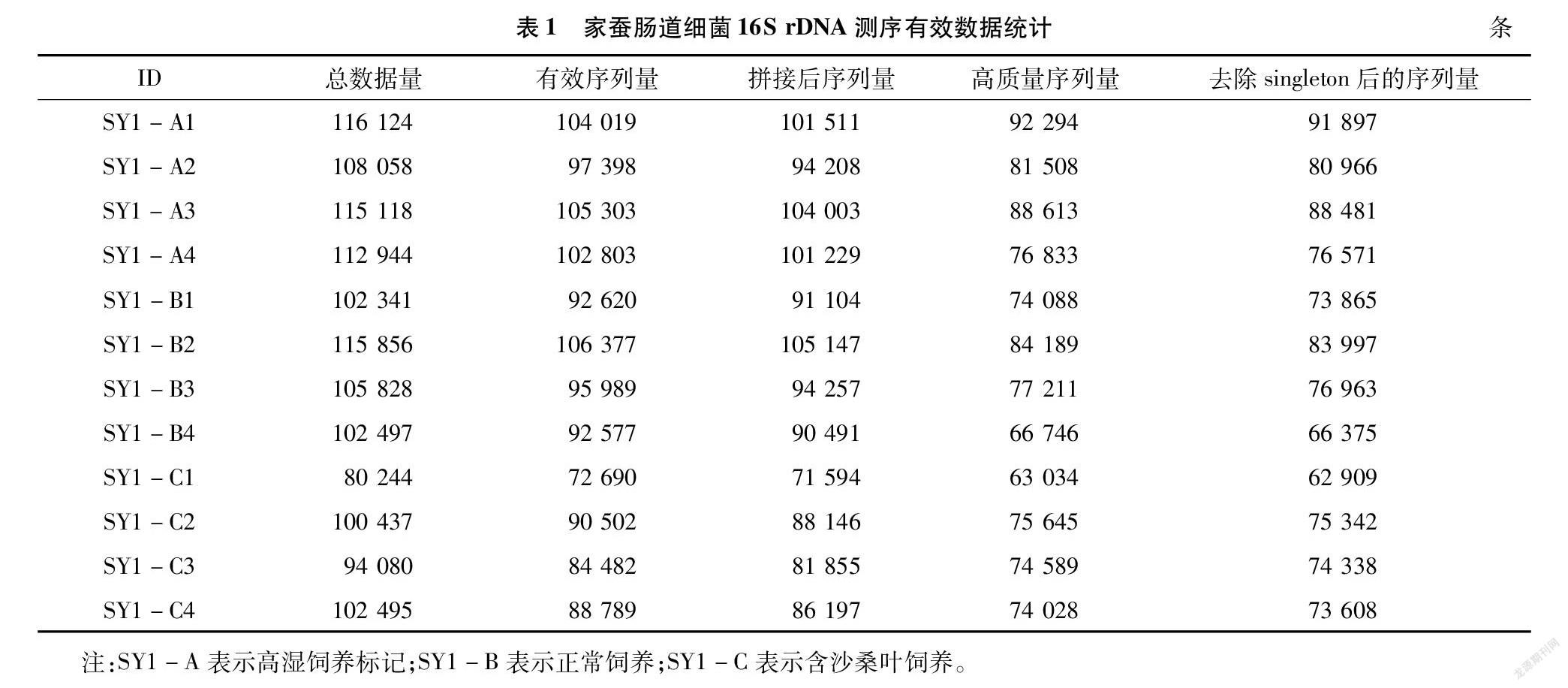
对不同饲育处理组家蚕肠道的有效测序数据进行分析。由表1可知,SY1-B2的有效序列数据量是最多的,为106 377条,其次为SY1-A3(105 303条)、SY1-A1(104 019条);总有效序列量为1 133 549条,平均有效序列量为94 462.42条,测序数目较大,可以充分保证数据的准确性。
2.2 家蚕肠道细菌的种类及丰度
本研究分别从界、门、纲、目、科、属、种 7 种不同分类阶元水平分析分类序列的变化情况。在界、门、纲、目、科 5 种分类阶元水平上,序列的减少比较缓慢,而在科、属、种 3 个分类阶元水平上序列数骤减,表明待测样本菌群中微生物的差异主要集中在科、属、种的分类水平上。基于 OTUs 注释结果,所测样本在门水平分布最多的优势菌门为厚壁菌门( Firmicutes) 、蓝细菌门(Gyanobacteria)和变形菌门( Proteobacteria) 。SY1-A组和SY1-B的优势菌门是变形菌门、蓝细菌门、拟杆菌门(Bacteroidetes)、厚壁菌门,SY1-C组的优势菌门为变形菌门、蓝细菌门、厚壁菌门(图1)。
科水平上SY1-A组的优势菌科为Chloroplast-norank科、伯克氏菌科(Burkholderiaceae)、毛螺菌科(Lachnospiraceae),SY1-B组的优势菌科为伯克氏菌科、Chloroplast-norank科,SY1-C组的优势菌科为伯克氏菌科、Chloroplast-norank科、肠球菌科(Enterococcaceae)(图2)。
属水平上SY1-A组的优势菌属为Tyzzerella-3属、Chloroplast-noranks属、水杆菌属(Aquabacterium)等;SY1-B组的优势菌属菌为水杆菌属、新鞘氨醇杆菌属(Novosphingobium);SY1-C组的优势菌属为Chloroplast-noranks属、水杆菌属、肠球菌属(Enterococcus)(图3)。
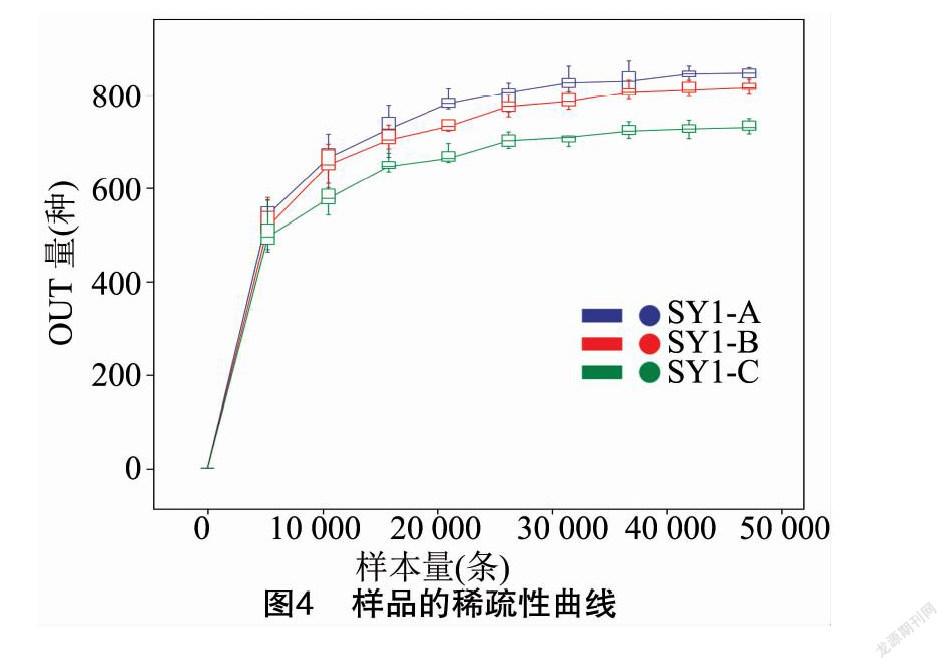
根据OTU数据绘制稀疏性曲线(图4),Spe-caccum 物种累积曲线(图5)。稀疏性曲线末端趋于平缓,说明测序数据有效反映了家蚕肠道微生物菌群的多样性。物种累积曲线反映了持续抽样下新OTU(新物种)出现的速率。在样本量为1~10组内,曲线急剧上升,表示群落中有大量物种被发现,样本量约为11组左右时,曲线趋于平缓,表示微生物的种类不会随饲喂的增加而有明显的增加。
分析各组样本属水平的韦恩图可知,对照组独有的OUT数量为1 321种,SYI-C组和SYI-A组独有的OUT数量分别为1 355、1 758种,说明各个组在属水平上的肠道微生物存在一定差异;SYI-C和 SYI-A 组与对照组共有的OUT数量分别为268、211种,SYI-C和SYI-A共有的OUT数量为92种,说明SYI-A肠道菌属的数量影响较大,但是在属水平的物种丰富度上SYI-C和SYI-A均高于对照组(图6)。
2.3 家蚕肠道细菌多样性分析
分析α多样性指数可知,Goods-coverage指数为0.99,说明对16S rDNA进行测序分析有一定的代表性;从Chao1指数可以看出SY1-A组和 SY1-B 组的群落丰富度大于SY1-C组;从Shannon指数和Simpson指数可知,SY1-A组和SY1-B组细菌的物种多样性大于SY1-C组(图7)。
3 结论与讨论
家蚕肠道菌群结构与其生长发育、生理变化、机体免疫密切相关,同时受品种、性别及发育时期、生长环境、饲料的影响。本研究中以正常家蚕为对照,运用高通量测序技术,为全面了解家蚕肠道细菌种群的组成提供了强有力的手段,本研究通过高通量测序16S rRNA 基因序列的方法,从家蚕品种苏优一号的中肠中所检测到的细菌种类大大多于简单纯培养或变性梯度凝胶电泳(DGGE)检测到的细菌种类[4-5],表明家蚕肠道细菌类群非常丰富,通过16S rRNA高通量测序技术可获得更加全面的家蚕肠道细菌多样性信息。探究饲喂不同处理桑叶后家蚕苏优一号肠道微生物结构,并分析菌群结构的共性与差异。
苏优一号在门分类水平上的优势菌门为变形菌门,科分类水平上为Chloroplast-norank科、伯克氏菌科,在属分类水平上优势菌属为Chloroplast-noranks属、水杆菌属、Tyzzerella-3属等。与正常桑叶饲喂组相比Chloroplast_norank的含量均低于高湿桑叶饲喂组和含沙桑叶饲喂组,而水杆菌属的含量显著高于其他2个组;水杆菌属的含量显著高于其他2个组;肠球菌属只存在于 SY1-C 组中,在其他2个组中均未发现;不动杆菌属只在SY1-B组中被发现,其他2个组均未发现该属细菌。
对柞蚕5龄中肠微生物研究发现优势菌群中包含Tyzzerella-3属[13],有研究发现在人体肠道中存在该属,与人类抑郁症有关[14-15]。含沙桑叶饲喂组的优势菌属肠球菌属也是一类较为常见的细菌,在家蚕肠道内是主要的消化细菌之一[16-17],许多昆虫体内含有大量的肠球菌,肠道细菌影响昆虫消化液的pH值,并与对家蚕的致病性相关联。肠球菌属是家蚕肠道中的优势菌属,能产生乙酸盐,导致消化液的pH值降低[18],也可以保护寄主免受一些毒素的攻击[6],家蚕在受到BmBDV病毒感染时肠道内肠球菌的比例也会逐渐增加[19]。鲁兴萌等的研究在一定程度佐证了家蚕肠道细菌有抑制致病微生物感染的作用[7]。3种桑叶处理饲喂对家蚕的肠道微生物组成和多样性有较大影响,桑叶表面沙尘可改变家蚕肠道微生物的结构,高湿度可能在一定程度上造成家蚕肠道微生物结构改变,湿度对家蚕的取食量也影响较大,桑叶不进行处理直接饲喂家蚕取食量明显降低。
参考文献:
[1]Hegedus D D,Toprak U,Erlandson M. Peritrophic matrix formation[J]. Journal of Insect Physiology,2019,117:103898.
[2]陳东斌. 线粒体基因组分析揭示中国野桑蚕北方和南方群体间存在显著遗传分化[D]. 沈阳:沈阳农业大学,2020.
[3]钱荷英,张 潇,叶夏裕,等. 中国家蚕种质资源与品种选育研究进展[J]. 江苏农业科学,2020,48(24):1-7.
[4]Iizuka T,Takizawa Y. The aerobic bacterial flora in the gut of larvae of the silkworm,Bombyx mori L.[J]. The Journal of Sericultural Science of Japan,1969,38(2):95-102.
[5]Liu Y Q,Li Y P,Li X S,et al. The origin and dispersal of the domesticated Chinese oak silkworm,Antheraea pernyi,in China:a reconstruction based on ancient texts[J]. Journal of Insect Science,2010,10(1):180.
[6]孙雪奇,黄玉祥,董长江,等. 家蚕肠道好氧和部份兼厌氧微生物及蚕用微生态制剂的研究[J]. 四川蚕业,1996,24(1):13-15.
[7]鲁兴萌,金 伟,钱永华,等. 肠球菌在家蚕消化道中的分布[J].蚕业科学,1999,25(3):158-162.
[8]袁志辉,蓝希钳,杨 廷,等. 家蚕肠道细菌群体调查与分析[J].微生物学报,2006,46(2):285-291.
[9]田贞华,惠丰立,柯 涛,等. 家蚕肠道细菌种群结构分析[J].蚕业科学,2007,33(4):592-595.
[10]Chen B S,Yu T,Xie S,et al. Comparative shotgun metagenomic data of the silkworm Bombyx mori gut microbiome[J]. Scientific Data,2018,5:180285.
[11]田世英,祝 婕,杨 静. 1959—2016年和田地区气候要素变化特征分析[J]. 新疆环境保护,2019,41(3):45-50.
[12]买托合提·居来提. 历史与现状:新疆蚕桑丝绸产业的探析[J]. 广东蚕业,2017,51(3):14-16.
[13]张静雨,王 欢,边海旭,等. 柞蚕肠道细菌菌群结构与多样性[J]. 蚕业科学,2018,44(5):678-685.
[14]Zhou Y M,Chen C,Yu H B,et al. Fecal microbiota changes in patients with postpartum depressive disorder[J]. Frontiers in Cellular and Infection Microbiology,2020,10:567268.
[15]Li G N,Xia X J,Zhao S,et al. The physiological and toxicological effects of antibiotics on an interspecies insect model[J]. Chemosphere,2020,248:126019.
[16]李蒙英,許宏庆,虞晓华,等. 家蚕肠道菌群的研究[J]. 江苏蚕业,2000,22(2):5-7.
[17]Broderick N A,Raffa K F,Goodman R M,et al. Census of the bacterial community of the gypsy moth larval midgut by using culturing and culture-independent methods[J]. Applied & Environmental Microbiology,2004,70(1):293-300.
[18]Mead L J,Khachatourians G G,Jones G A.Microbial ecology of the gut in laboratory stocks of the migratory grasshopper,Melanoplus sanguinipes (Fab.) (Orthoptera:Acrididae)[J]. Applied and Environmental Microbiology,1988,54(5):1174-1181.
[19]王永生,范永慧,刘位芬. 家蚕细菌性肠道病的发生与防治[J]. 云南农业科技,2019(4):52-53.
