六溴环十二烷环境研究进展
2022-04-01卜德志孙霞劳齐斌等
卜德志 孙霞 劳齐斌等


关键词:HBCDs;多介质;极地;赋存水平;生物富集
中图分类号:P76;X524 文献标志码:A 文章编号:1005-9857(2022)01-0065-12
0引言
1,2,5,6,9,10-六溴环十二烷(Hexabromocyclododecane,HBCDs)是一种典型的疏水性高溴含量脂环族添加型阻燃剂,是除多溴联苯醚(PBDEs)和四溴双酚α(TBBPA)之外的全球第三大溴代阻燃剂[1]。其作为一种非键合的添加型阻燃剂,极易通过多种方式进入环境中,且在环境中残留期长、检出率高、具有生物毒性,目前已被联合国列入《关于持久性有机污染物的斯德哥尔摩公约》(以下简称《公约》)中。我国自2016年12月26日起,禁止六溴环十二烷的生产、使用和进出口[2],并在2017年12月,制定了《优先控制化学品名录(第一批)》,并将HBCDs列入其中[3]。但由于HBCDs的难降解性,目前仍在全球范围内广泛存在,并通过“蚱蜢效应”不断向极地区域富集。
极地区域由于独特的地理位置和自然条件,在全球气候变化和环境污染的研究中占有举足轻重的地位,是对全球气候变化和环境污染响应和反馈最为敏感的区域之一[4],且极地生态系统的生物和物理过程会在时间、空间尺度上对地球生态系统产生反馈作用,并与之相互影响[5]。极地区域又是世界气候系统中最活跃的部分,可以通过冰盖、大气以及和周围海域的强烈耦合过程而影响全球[6]。极地区域常年温度较低,有利于各种持久性有机污染物(POPs)的沉降,可能通过全球蒸馏效应积累来自中低纬度的HBCDs等POPs,对简单脆弱的极地生态系统造成压力[7]。近年来,全球气候变暖引起极地区域气候环境快速变化,导致极地冰川融化、冻土退化等过程,这可能使得先前埋藏于冰雪中的POPs重新释放进入大气,这种“二次”污染可能成为极地环境中POPs的重要来源[8],进而影响全球。
1 HBCDs简介
1.1 HBCDs物理化學特性
HBCDs的分子式为C12H18Br6,溴含量为74.7%[1]。热稳定性较差,分解温度低,在自然界中为白色结晶。HBCDs的立体结构非常复杂,其工业化生产以1,5,9-环十二烷三烯(1,5,9-cyclododecatriene,CDTs)为原料,经溴化反应制得[9]。理论上共有16种异构体,分别是6对对映异构体和4种内消旋体[10],但目前仅分离出(±)α-HBCD、(±)β-HBCD和(±)γ-HBCD3对对映异构体和2种内消旋异构体。在化工产品中主要包含α-HBCD,β-HBCD和γ-HBCD3种异构体,其百分含量分别为10%~13%、1%~12%和75%~89%[11],另外还含有少量的δ-HBCD(0.5%)和ε-HBCD(0.3%)[12]。
不同异构体因物理化学性质不同,呈现不同的环境行为。Zhao等[13]通过对HBCDs3种主要异构体热力学和光化学性质研究发现,α-HBCD 光化学性质最稳定,而光暴露条件下,γ-HBCD可以转化为α-HBCD,这也与Stuart等[14]的研究结果相同。另外β和γ 异构体的降解速率分别是α 异构体的1.6倍和1.8倍[15]。异构体差异性环境行为研究也是当前HBCDs相关研究的热点。
1.2 HBCDs的POPs特性
HBCDs作为一种典型持久性有机污染物,具有环境持久性、生物蓄积性、远距离传输性和生物毒性等POPs的一系列特点。
现有研究表明HBCDs在水相和气相中的半衰期均高于《关于持久性有机污染物的斯德哥尔摩公约》(以下简称《斯德哥尔摩公约》)筛选POPs的标准[10]。Kohler 等[16] 发现12 年前的沉积物中HBCDs的浓度是其表层浓度的50%;Remberger等[17]发现斯德哥尔摩群岛的沉积物下层30~40年前的HBCDs浓度是其顶部浓度的25%~33%。上述研究均表明其能在环境中长时间存在。
HBCDs具有较高的辛醇-水分配系数,这使得HBCDs容易在脂肪中蓄积。Tomy 等[18]通过研究安大略湖中浮游生物、糠虾、杜夫鱼、胡瓜鱼及鳟鱼中的HBCDs浓度发现,随着营养级的升高,HBCDs总含量表现出升高的趋势,且营养级与lnΣHBCD呈线性相关,表明HBCDs具有生物放大效应。Palace等[19]通过对虹鳟鱼中HBCDs的研究发现其生物浓缩因子约为13085;Veith等[20]研究鲦鱼中的HBCDs浓度发现其生物浓缩因子为18100;Law等[21]发现加拿大温尼伯(Winnipe)湖中生物体α-HBCD的生物浓缩因子高达50000~125000,均远远大于《斯德哥尔摩公约》关于POPs生物浓缩因子限值为5000的标准。表明HBCDs具有高生物蓄积性。
Beyer等[22]利用几种迁移模型评估研究了HBCDs的远距离传输能力,认为其远距离迁移能力主要依靠气溶胶,即很有可能通过吸附于空气中的颗粒上进行迁移。可以通过“蚱蜢效应”,在温度升高时挥发,并且随着空气流动进行迁移,遇冷时凝结沉降,最终通过反复进行上述过程迁移至全球。20世纪60年代,HBCDs开始工业生产,80年代末开始大量产出,主要产自中国、美国、欧洲和日本。现有研究检测到HBCDs在20世纪60年代便出现在挪威北极的冰芯中[23],80年代中期开始在各环境介质中被大量检出,其环境浓度随时间逐年增加。到目前为止,HBCDs已在全球多种环境介质,甚至在极地区域中被广泛检出。
研究表明,HBCDs的急性毒性较低[1],3种主要异构体的细胞毒性由大到小依次为γ-HBCD、β-HBCD、α-HBCD,3对对映异构体(手性异构体)中右旋体的毒性显著大于左旋体的毒性[24-26]。HBCDs能导致大鼠甲状腺增生[27],肝脏重量增加,脂肪变性,卵子发育抑制[28],抑制神经递质正常吸收,影响神经发育,严重时会出现肝组织坏死及肝脏肿瘤[29],其对人体肝细胞也会产生一定毒害[30]。HBCDs对水体生态系统中的动物也会产生慢性毒性[31],对海洋桡足类动物的急性毒性较低,但对其生殖发育具有显著的毒性效应[32],另外其可能和滴滴涕以及多溴联苯醚一样,能够导致人体基因重组,引发进一步疾病,进而导致癌症等重大灾难。易姗等[33]结合中国HBCDs相关行业的生产状况,对中国六溴环十二烷的职业环境健康做出了风险评估,结果表明,16%的职业人群具有反复染毒的风险,69%的职业人群具有产生生殖毒性的风险,总计职业人群中具有健康风险的人数高达70%。另有研究表明,HBCDs可通过反馈抑制影响甲状腺激素受体数目,从而导致甲状腺激素水平下降[34-35],而人体孕妇血清中的甲状腺激素水平可以直接影响胎儿的甲状腺激素水平,HBCDs又能通过母乳摄入的方式进入婴儿体内,对下一代身体健康造成潜在影响。人类处在食物链的最顶端,HBCDs具有生物蓄积性和生物放大效应,其生物毒性最终将危害人类的自身健康。
2 HBCDs极地高纬度研究
20世纪90年代末期,瑞典研究者首次关注环境中的HBCDs。受限于仪器条件,最初大多数数据都是HBCDs的总量信息,随着科技的进步以及检测设备的改进,有关HBCDs环境行为的进一步研究得以充分开展。至今,HBCDs来源、毒理学性质、异构化及其各异构体间的转化、各环境介质中的分布、迁移及环境归趋研究已在世界范围内取得诸多成果。
2.1 HBCDs在极地区域的分布特征
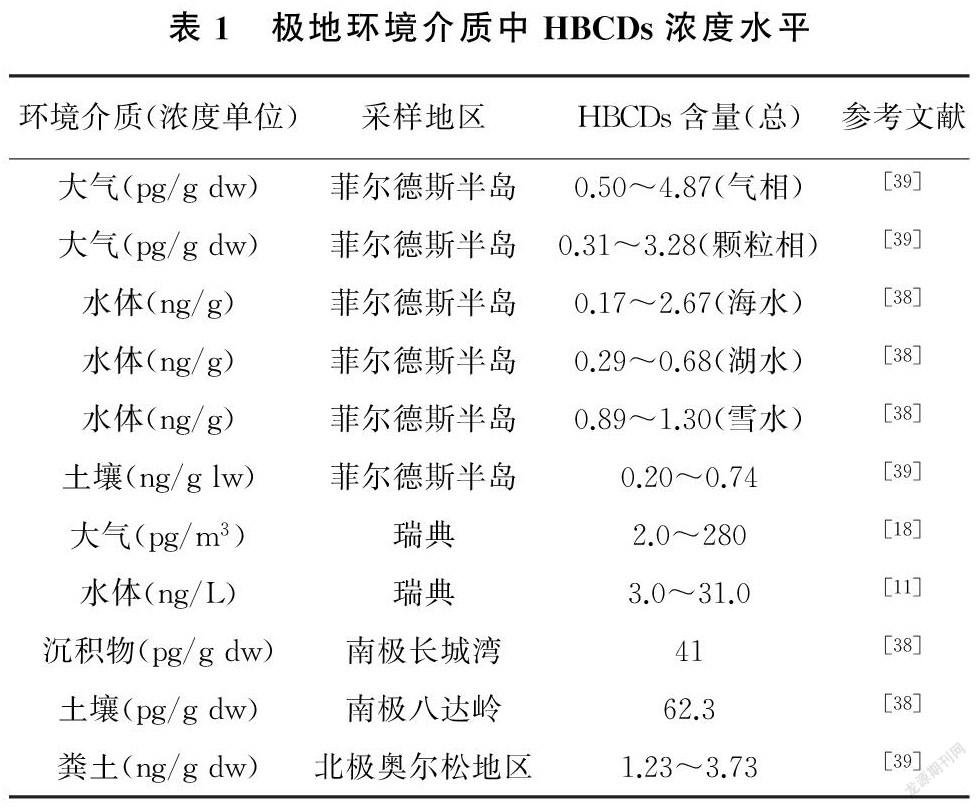
近几年,从整体上看极地区域HBCDs的研究主要集中在北极的鸟类、海洋哺乳动物及鱼类,而南极地区环境和生物介质中HBCDs的污染情况研究相对较少,但其在已检测的南极环境介质和生物样品中普遍存在。极地区域环境及生物介质中的HBCDs浓度水平如表1所示。
相对而言,国外对极地区域HBCDs研究较早,已有诸多成果。Katrin等[36]研究了1986—2008年东格陵兰岛海豹体内HBCDs浓度随时间的变化趋势,发现自1986年起,HBCDs浓度从2.0ng/g湿重增长到了8.7ng/g 湿重,随时间逐年上升。Miljeteig等[37]通过对挪威北极和俄罗斯北极的象牙鸥蛋的研究,发现其HBCDs检出率为100%,浓度为38.1~136ng/g湿重。国内对HBCDs的研究虽然起步比较晚,但也取得了重要成果。张晓岭[25]2008年在国内首次创立了高效液相色谱———质谱联用测定HBCDs非对映体和手性对映体的分离方法,并分离制备出了HBCDs手性对映体标样,并在国际上首次研究了它们的毒性。2010 年,李红华[38]采集了长城湾附近的动物、植物样本并进行分析测定,所得HBCDs浓度水平与国外结果[36]相近。2016年,张丽[39]首次揭示了南极地区环境多介质中HBCDs污染水平、空间分布及异构体组成变化,发现南极环境多介质中HBCDs 的检出率约为100%,表明HBCDs已在南极环境广泛存在。
总体来看,HBCDs在南北极环境及生物介质中普遍存在,但浓度处于较低水平,相同介质中HBCDs含量南极地区相较于北极浓度更低。不同环境介质中,水体内HBCDs含量最低,土壤和沉积物中含量较高,苔藓等植被中HBCDs含量最高。分析原因是地衣仅由真菌和藻类构成,没有表皮,使得地衣表面直接暴露于空气中,可以直接从大气中吸收并富集HBCDs,且地衣生长周期长,长时间富集大气中的HBCDs使得其含量自然升高[43]。而苔藓没有根,只由茎和叶构成,叶片为单细胞结构,对周围污染物变化较为敏感[44],且较大的比表面积使得其对大气中有机物的吸收能力较强,可以有效富集HBCDs[45]。苔藓还可以用来重建过去数十年的大气污染水平变化[46],使得其在极地污染物研究中占据重要地位。南极科学考察站附近样品中HBCDs浓度较周边区域无明显增加,推测该地区的HBCDs污染可能不是来自人类活动,而主要与HBCDs远距离大气传输有关(表2)。
2.2 HBCDs在极地多介质间的异构体组成
南极环境中HBCDs主要来源于远距离大气传输,由于其环境浓度为痕量,异构体理化参数及多介质间分配作用的研究尚未发现显著相关性[39]。现有研究结果表明,HBCDs在极地检出率较高,部分研究达到100%[38]。不同环境及生物介质中各异构体百分组成不同,具体如图1及图2所示。
从图中可以看出,环境介质中γ-HBCD含量最高。尽管各介质中异构体组成整体趋势相符,即γ>α>β,但各异构体所占比例差异较为明显。工业生产中α-HBCD、β-HBCD 和γ-HBCD3种异构体的百分含量分别为10%~13%、1%~12%和75%~89%。大气中气相和颗粒相分配模式相似,3种异构体百分含量整体趋势不变,γ-HBCD依然最高,分别为50%和52%,α次之,分别为28%和31%,β最低。分析从工业生产到极地大气中γ异构体浓度降低的原因为远距离传输过程中,γ-HBCD 发生异构化,向α-HBCD 转化[47],另外还可能与各异构体间不同的辛醇-空气分配系数导致其环境中多介质传输和分配差异有关[48]。水体中各异构体百分含量与大气中相似。到土壤中时,α异构体比例进一步增大,再到沉积物中比例接近总量的一半[49],分析原因是在光照、温度以及微生物的长期作用下,异构体间发生异构化及选择性降解(厌氧环境下β异构体和γ异构体的降解速率是α异构体的1.6倍和1.8倍)所致[13]。地衣(α-HBCD:33%;β-HBCD:27%;γ-HBCD:40%)和苔藓(α-HBCD:37%;β-HBCD:25%;γ-HBCD:38%)中3種异构体比例与土壤(α-HBCD:43%;β-HBCD:24%;γ-HBCD:33%)中相似,而与大气中相差较大,推测地衣和苔藓中HBCDs可能主要来源于土壤而非大气。相对于其他介质而言,粪土中β-HBCD 所占比例明显增大,这可能是由于粪土中HBCDs含量及比例主要来源于生物体,而生物体选择性吸收代谢,及体内HBCDs发生异构化[50]所致。Law 等[51]首次报道虹鳟鱼幼体具有将β-HBCD 和γ-HBCD 异构化为α-HBCD 的能力。Du 等[52]检测到斑马鱼在暴露28天之后具有将γ-HBCD生物异构化为α-HBCD的能力。张晓岭[25]通过研究HBCDs的生物累积,发现田螺选择性地累积(- )α-HBCD 和(- )γ-HBCD,而鱼类选择性地累积(+)α-HBCD 和(-)γ-HBCD,表明手性对映体生物累积具有选择性和物种差异。以上研究解释了不同生物体内异构体差异可能的原因。张丽等[39]通过研究南极典型食物网9种生物体内HBCDs富集特征,发现HBCDs异构体富集过程中具有明显的异构体选择性,该发现与Sormo等[53]及Tomy等[54]的研究结果相互印证。相对于环境介质,生物介质中α-HBCD 是多数生物中的主要异构体,但不同生物体内各异构体比例与营养级并无明显对应关系,不同生物异构体含量差异明显,推测可能由上文所述生物体选择性吸收代谢有关。此外,现有研究中生物体内异构化多发生于β-HBCD 和γ-HBCD[55],Taylor等[50]研究发现生物体在α-HBCD中暴露后没有观察到异构化。就HBCDs含量来看,现有研究显示生物体内HBCDs含量随营养级明显增高,但不同异构体生物放大程度不同,表明生物体对HBCDs的富集过程也伴随明显的异构体选择性。
3 HBCDs中低纬度污染水平
3.1 大气和室内灰尘中HBCDs浓度水平
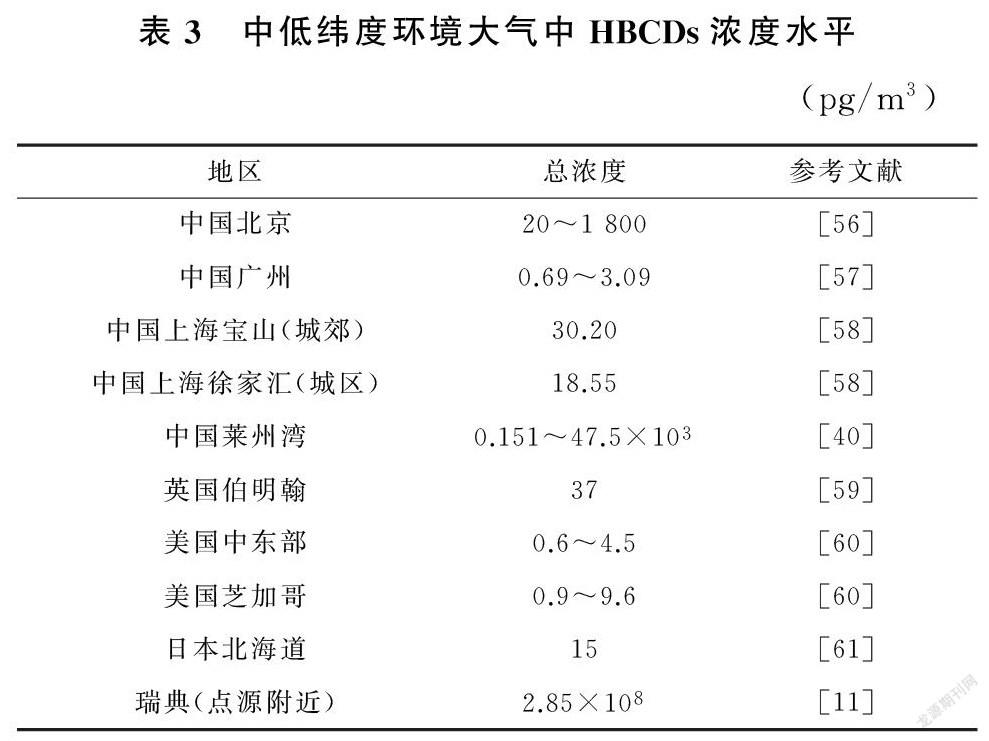
大气传输是HBCDs的主要传播途径,且更多依附于大气颗粒相进行传播。大气也是日本和欧洲HBCDs的主要释放介质。Yu等[66]通过对城市大气的研究发现69.1%~97.3%的HBCDs分布在大气颗粒相中。大气中HBCDs浓度的空间分布呈点源高于偏远地区、下风向地区高于上风向地区的趋势[17]。
Gerecke等[11]研究发现瑞典点源附近大气中HBCDs浓度高达2.85×10pg/m,中国的主要HBCDs产地之一莱州湾HBCDs浓度也高达4.75×10pg/m,相对其他非点源地区如中国广州(0.69~3.09pg/m)、上海宝山(30.2pg/m)、徐家汇(18.55pg/m)、美国芝加哥(0.9~9.6pg/m)、日本北海道(15pg/m)而言,其浓度高出至少2个数量级(表3)。
Li等[85]通過对室内外环境中大气颗粒物分级采样,发现α-HBCD是HBCDs在大气中的主要存在形式,且主要分布在大颗粒(4.7~10.0μm)上。在封闭及自然通风状态下的办公室中,HBCDs暴露量分别为0.09~9.25pg/(h·kg),0.07~1.75pg/(h·kg),表明自然通风有利于室内污染物向室外环境中扩散,从而降低呼吸暴露风险。就全球浓度来看,HBCDs浓度分布呈现欧洲高于亚洲,点源高于周边的趋势。且相对于气相而言,HBCDs主要分布在大气颗粒相中,依据“全球蒸馏效应”和“蚱蜢效应”,能够发生远距离迁移(表4)。
3.2 土壤和水体底泥中HBCDs浓度水平
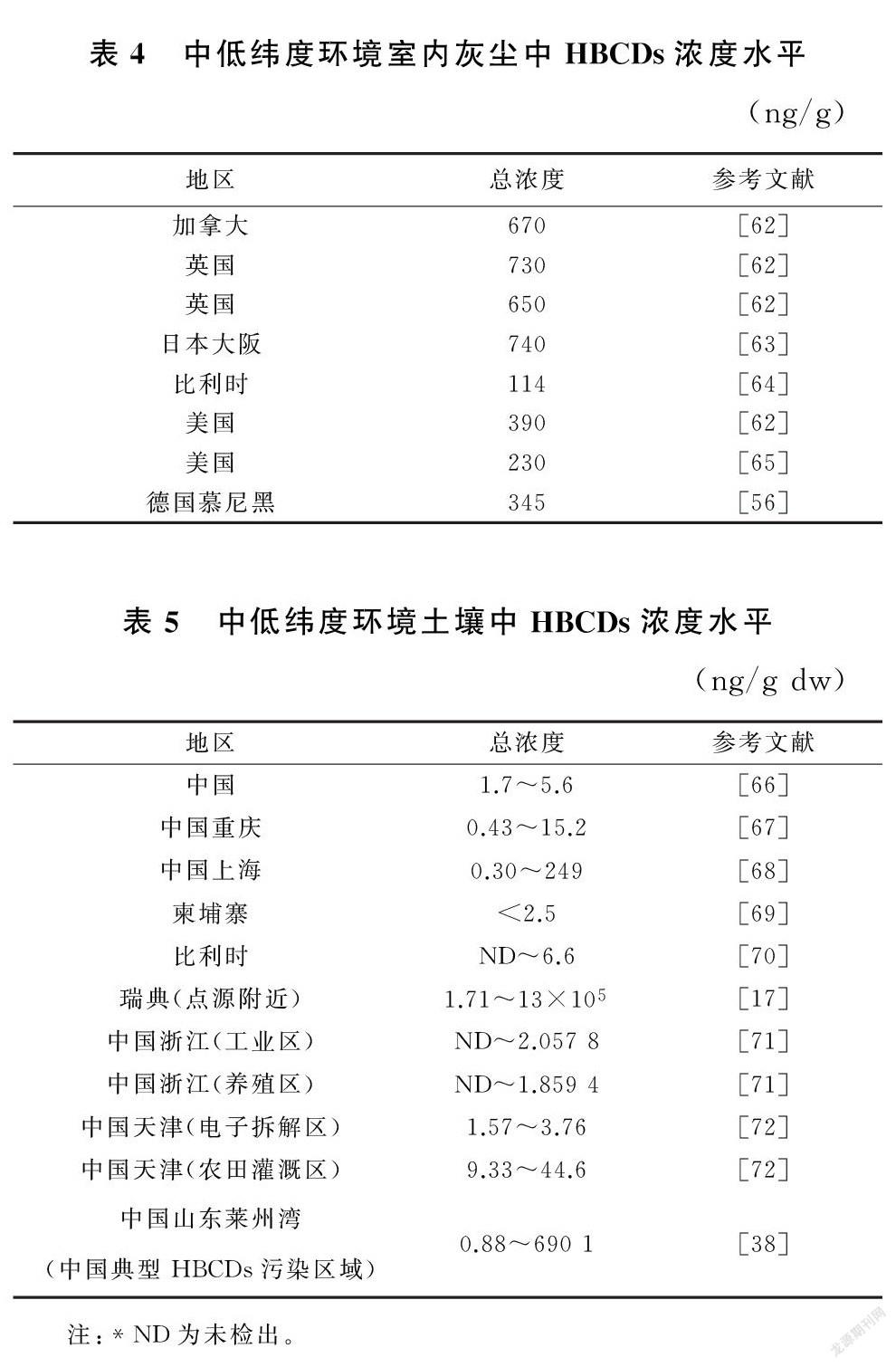
现有研究显示,土壤中HBCDs主要以γ异构体为主,不同类型土壤中HBCDs含量不同,农业区、养殖区土壤中HBCDs浓度普遍低于工业区。对土壤中HBCDs的分布特征及来源分析得出,含量较高的站点多集中于工业区,且呈现明显的点源分布。HBCDs浓度与点源距离成明显负相关,生产过程中的排放是厂区点源周边土壤中HBCDs的主要来源。随点源距离增加,HBCDs浓度下降,土壤中前2km 距离HBCDs浓度下降较快,之后趋于平缓[86]。且随点源距离增加,大气沉降逐渐成为HBCDs主要来源,即主要通过源-大气-土壤的方式影响环境,因此风速、风向条件也是影响点源周边HBCDs空间分布的主要因素之一[71](表5)。
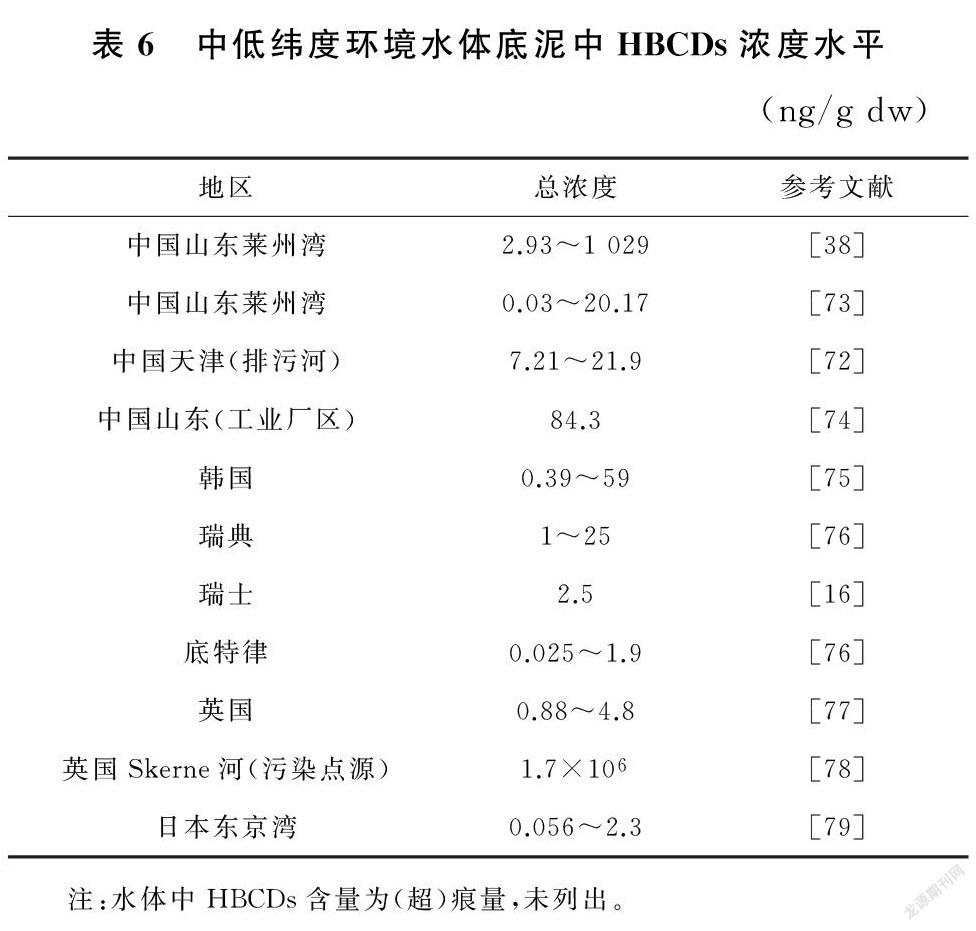
李红华[38]通过对中国典型HBCDs污染区域莱州湾各环境介质中HBCDs的浓度调查发现,γ-HBCD在土壤、水体底泥占据优势,还通过对中国七大水系底泥(长江、黄河、珠江、塔里木河底泥中HBCDs总浓度分别为1.77ng/cm、2.50ng/cm、18.3ng/cm、3.92ng/cm)的研究发现,中国东部和东南部HBCDs污染浓度高于西部和西北部,人口密集的大城市和工业区是HBCDs主要扩散源,这一发现与其他国家和地区底泥中HBCDs分布趋势相似[75,79]。但也有个别研究发现不同,Wang等[87]对西北渭河流域表层沉积物中HBCDs的含量、空间分布及危害进行了研究,发现HBCDs平均浓度为0.45ng/gdw。其中区别于其他研究,α-HBCD为大多数站点的主要异构体。出现这种情况可能是因为当地HBCDs使用情况不同,也可能是由于其他环境因素导致异构体之间发生相互转化的概率上升,α-HBCD作为半衰期最长的异构体,占比逐渐增大(表6)。
3.3 生物介质中HBCDs浓度水平及生物放大效应
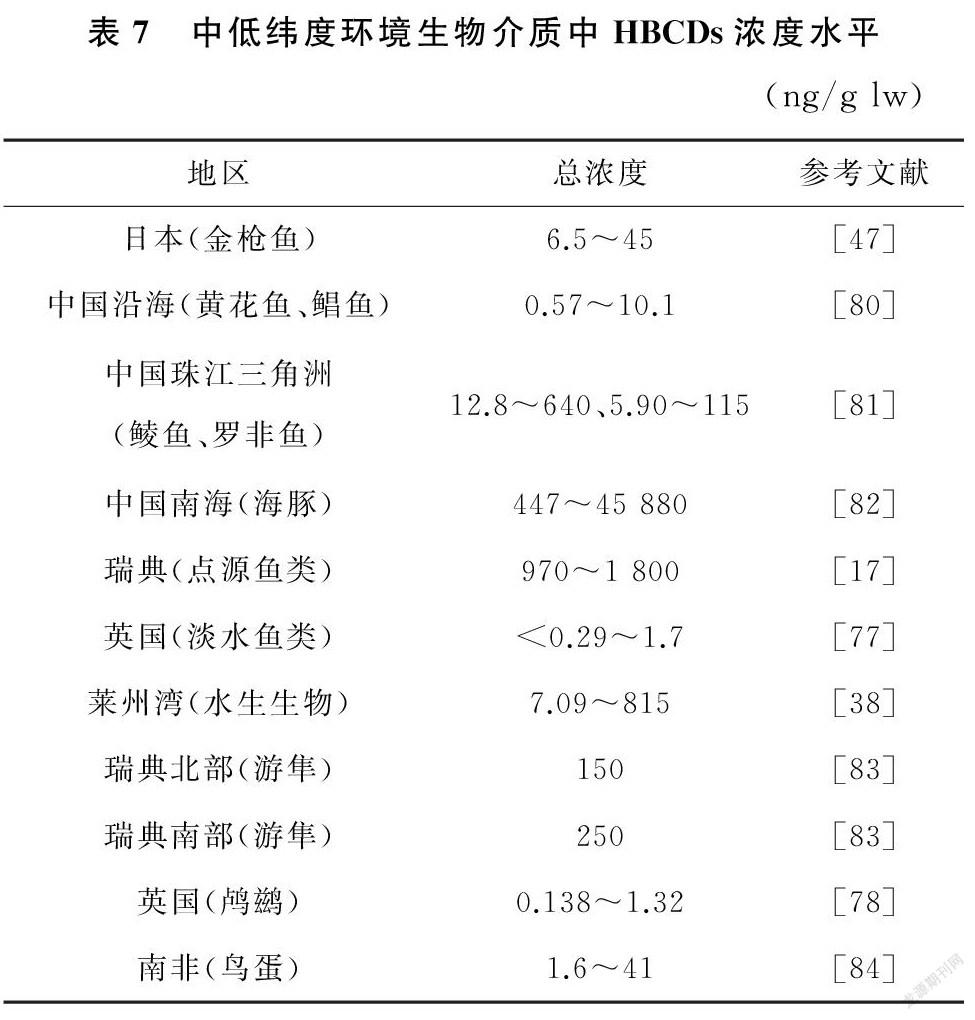
对于同一地区,各环境介质中,水体HBCDs含量最低,土壤沉积物中相对具有较高浓度和检出率,且浓度水平呈现点源分布。这可能与HBCDs具有高辛醇-水分配系数,属于强憎水性的持久性有机污染物有关,而憎水性化合物易吸附在有机质或有机碳上[88]。而同一地区生物体内HBCDs含量较环境介质中而言,具有更高浓度,这也反映了HBCDs的生物蓄积性,且随营养级升高,HBCDs含量也有升高的趋势,表现出了HBCDs的生物放大效应(表7)。
一般在大气、水体、土壤等环境介质中,γ-HBCD为主要异构体,而生物介质中α-HBCD占主导地位。对比表3 至表7 中的数据不难看出,HBCDs浓度分布呈现欧洲地区高于其他地区,点源生物高于非点源生物,高营养级生物高于低营养级生物的特征。目前生物体中的HBCDs研究多集中在鱼类、鸟类、贝类和海洋哺乳动物中,且单个研究多限于少数物种,没有充分考虑捕食者与被捕食者的关系,关于HBCDs在生态系统食物链中如何传递的研究相对较少。Zhang 等[89]对中国最大HBCDs生产地之一——潍坊的沿海生物进行了调查,利用元素分析和同位素分析的方法确定食物网结构和生物营养级,研究表明HBCDs在食物链中存在生物放大效应,HBCDs总含量与营养级呈正相关,导致在食物链顶端的捕食者,如人体中HBCDs水平最高。此外,选择性生物放大改变了生物体内非对应异构体的组成,随营养级的提高,α-HBCD在总含量中所占比例也随之增加,且具有生物放大作用,β-HBCD 和γ-HBCD 则无生物放大作用。另外研究还发现不同水生物种中,HBCDs浓度差异较大,最大可达3个数量级。Du等[52]也通过研究发现在3种异构体中,α-HBCD 具有最高的同化效率、最低的降解速率和最长的半衰期,这使得其在高营养级生物中占据优势。
4 HBCDs时空分布趋势
时间上来看,自然光照射可以改变粉尘中HBCDs各异构体结构,有研究显示,在经过5周的自然光暴露之后,γ-HBCD 含量从62% 下降到43%,α-HBCD含量从25%上升到43%,因此不同季节采样会对HBCDs各异构体浓度造成影响。另外不同研究中采样点与HBCDs点源距离不同,也会导致HBCDs残留浓度不同。因此时间上多个研究之间无法进行准确横向对比。
空间上来看,结合表1至表7中数据分析,在世界范围内,高纬度极地地区相对中低纬度而言,总体浓度偏低,但土壤及生物介质中浓度水平与部分中低纬度郊区相当。中低纬度中,欧洲国家相对其他地区而言HBCDs环境浓度更高,这可能与其使用全球近半的HBCDs产品有关。就我国国内而言,渤海莱州湾、河北沧州、山东潍坊、江苏苏州和连云港等HBCDs产地污染浓度相对较高,另外城市之间浓度差异较大,这可能是由于其历史产量以及排放强度不同导致的。另外在以往的研究中,调查规模不同,采样点与点源距离不同等因素,也会导致浓度不同,给世界范围内HBCDs浓度对比带来困难。
5人体HBCDs浓度与饮食摄入
统计数据表明,HBCDs生产设施多位于沿海,生产或使用过程中排放的HBCDs可能通过海岸生态系统,进入食物链,最终转移到当地居民的饮食中。Zhang等[89]对山东潍坊,居民从海产品中摄入的HBCDs进行估计,成人摄入量为5.22ng/(kg·d),儿童每日摄入量为16.3ng/(kg·d),相对世界其他地区而言是最高的。虽然最终评估风险较低,但幼儿更容易摄入HBCDs。Lu等[67]估算了重庆市居民HBCDs摄入量,结果为住宅区成人8.50pg/(kg·bw·d)、幼儿17.3 pg/(kg· bw · d),商业区成人8.97pg/(kg·bw·d)、幼儿18.3pg/(kg·bw·d),工业区成人9.26 pg/(kg· bw · d)、幼儿18.9pg/(kg·bw·d),郊区成人7.04pg/(kg·bw·d)、幼儿14.4pg/(kg·bw·d),并且进行了健康风险评估,结果表明其并不存在健康风险。该地区浓度相对于韩国成人0.068 ng/(kg·bw·d)、幼儿0.47ng/(kg·bw·/d)[90],瑞典成人0.095ng/(kg·bw·d)、幼儿0.40 ng/(kg·bw·d)[91],比利时成人0.052ng/(kg·bw·d)、幼儿0.67ng/(kg·bw·d)[92],美国成人0.12 ng/(kg·bw·d)、幼儿1.0ng/(kg·bw·d)和加拿大成人0.21ng/(kg·bw·d)、幼儿1.68ng/(kg·bw·d)[62,90]而言,其浓度处于较低水平。上述研究中,虽然人类健康风险评价都较低,但幼儿相对成人更容易摄入HBCDs,其剂量约为成人的两倍,应予以更多关注。
6结论与展望
HBCDs主要通过大气传输,依靠气溶胶,吸附在空气中的颗粒相中,以源—大气—水体/土壤的方式进行环境迁移。同一环境介质,在世界范围内,欧洲国家相对其他地区而言HBCDs环境浓度更高,就国内而言,莱州湾、江苏等典型HBCDs污染区域浓度更高。不同环境介质中,γ-HBCD在大气、土壤、底泥中为主要异构体。生物介质中α-HBCD多占主导地位,各异构体的分布呈明显的种属特异性和組织特异性。土壤中HBCDs浓度受点源影响明显,距离污染源越远,土壤中HBCDs含量越低。另外土壤中HBCDs含量还与土地利用类型有关,工业区土壤中HBCDs浓度最高,其次分别为城市土壤、农业和郊区土壤。
南极环境中HBCDs主要来自于远距离大气传输,南极科考站对该地区HBCDs浓度分布没有明显影响。HBCDs在极地生物体内存在生物放大效应,γ-HBCD为极地环境介质中的主要异构体,α-HBCD为多数生物体内的主要异构体,但不同种生物体内HBCDs异构体比例存在显著差异。由于极地环境中HBCDs浓度为痕量,关于异构体的理化参数及其在多介质间的分配作用尚未发现显著相关性。
目前的研究多集中于HBCDs在各地大气、水体、土壤、沉积物等环境介质及生物体内含量的研究,有关其在各介质中的降解过程及生物体内的转化过程仍然需要大量的补充工作,对环境中HBCDs各异构体的转化及环境归趋也需要进行更多的研究。HBCDs虽已禁止生产,但其产品在使用寿命结束后可能成为新的HBCDs来源,因此要注意HBCDs产品废弃物的管理工作。另外可以加强对HBCDs降解产物如五溴环十二烷的污染水平及时空分布特征的研究,进一步阐明其在环境中的转化和归趋。对人体暴露的研究较少,尤其是幼儿相对成人更易摄入HBCDs,需给予足够关注,对HBCDs的人类暴露风险作出正确评估。
