短期牦牛放牧强度对川西北高原高寒草甸土壤细菌群落的影响
2022-03-31王永宏田黎明陈仕勇泽让东科
王永宏,田黎明,艾 鷖,陈仕勇,泽让东科,*
1 西南民族大学青藏高原研究院, 成都 610041
2 四川大学生命科学学院, 成都 610065
3 西南民族大学畜牧兽医学院, 成都 610041
草地是陆地生态系统的重要组分之一,全球草地覆盖面积约为3.42×109hm2,约占陆地总面积的40%[1—2],对区域乃至全球生态系统平衡有着至关重要的作用。在过度放牧与气候变化的共同作用下,草地出现了不同程度的退化。据报道,20世纪初我国退化草地面积已达草地总面积的90%以上[3]。青藏高原作为我国主要牧区之一,近几十年来超过50%草地出现不同程度的退化[4]。天然草地的大面积退化不仅影响生态平衡与稳定,给环境问题带来巨大的威胁,还影响我国畜牧业发展和广大牧民的生活水平。青藏高原及其周边地区牦牛保有量约占世界总量的92%(2009年统计数据)[5],但前期基于牦牛放牧同草地生态系统构件耦合关系的分析研究相对薄弱,成为探究青藏高原牦牛放牧强度对于高寒草地影响的瓶颈因子。
放牧主要通过践踏、采食和排泄等途径影响草地地上生物群落、土壤养分及地下微生物群落的组成和结构。大型食草动物的践踏行为对土壤物理特性具有直接影响,研究表明冬季牛群2—3天的高强度践踏后,土壤大孔隙减少导致水分入渗率下降,这些指标的恢复需要6个月[6]。放牧家畜对牧草的选择性采食会改变植物群落结构,采食后通过对牧草营养成分的吸收与转化再通过排泄的方式回归土壤,虽然家畜的尿液和粪便仅覆盖4%—20%和1%—5%的放牧地[7],但促进了营养物质的快速循环,从而进一步影响土壤化学性质。已发表的许多研究通过草地退化程度或与定居点和饮水点的距离来定义放牧强度大小,导致放牧强度的确定存在很大主观性和差异,不能反映真实的放牧强度状况,牦牛放牧强度的控制实验结果十分缺乏。
微生物的繁殖速率快,对土壤理化性质变化的反应迅速,放牧会改变土壤pH、水分和土壤有机质等要素,进而影响土壤微生物群落的组成、结构及功能[8—9]。已有研究表明放牧可以通过增加氮矿化、反硝化、碳固定、碳降解等基因的丰度,改变微生物群落功能,增加微生物功能基因的α多样性[10]。放牧通过家畜对营养物质的利用与转化,改变土壤碳输入形式,使得微生物由以真菌为主的群落结构向以细菌为主的群落转变[11]。尽管部分研究表明放牧对细菌的α多样性没有显著影响,但会影响特定细菌群落的相对丰度,从而影响细菌的群落结构[12]。全球范围的整合分析发现,放牧通过影响地下与地上生物量使细菌生物量减少8.85%;重度放牧影响更显著,降低幅度达16.48%[13]。现阶段的研究多集中于禁牧与放牧对微生物群落的影响[10,14],土壤性质与微生物群落的相互关系则集中于土壤水分、土壤碳和土壤氮等土壤性质[12,15],而牦牛放牧强度对细菌群落结构及其调控因素的影响却鲜见报道。
本文以青藏高原东缘典型高寒草甸为研究对象,分析不同牦牛放牧强度在短期放牧条件下(2年)对土壤理化性质和细菌群落结构的影响,并探讨了二者关系,为青藏高原高寒草甸的放牧强度控制提供理论依据。
1 材料与方法
1.1 研究区概况
本试验研究区位于青藏高原东缘的四川省阿坝藏族羌族自治州红原县西南民族大学青藏高原基地(32°48′N,102°33′E),海拔3504 m,年均降水量为747 mm,暖季降水可达全年降水量的80%,年均气温为1.5℃。试验区的优势植物种类为高山嵩草(Kobresiapygmaea)、垂穗披碱草(Elymusnutans)和矮生嵩草(Kobresiahumilis),土壤类型为高山草甸土。
1.2 试验设计与样品采集
通过对当地牧区的载畜量和退化情况进行实地调查,并对牧民进行走访,结合相关文献,将试验地划分为4个放牧处理:对照组(禁牧)、轻度放牧(1头牦牛/hm2)、中度放牧(2头牦牛/hm2)和重度放牧(3头牦牛/hm2)。每个处理随机设置3个重复,其中放牧样地面积均为1 hm2,非放牧样地面积均为0.33 hm2,样地总面积为10 hm2[16]。试验地从2008年至2014年均为当地牦牛夏季牧场,草场利用状况较为均一,属于中等放牧强度。为确保试验地初始状况较为均一,2014年将试验地用围栏围封一年。放牧试验于2015年5月下旬开始。放牧时间为每年的5月下旬到9月下旬,期间牦牛可以在样地里自由活动、采食和饮水。2016年8月底,在各样地中随机选取6个50 cm×50 cm样方,在收集地上生物量后每个样方用土钻采集5个0—10 cm土样,混合成一个土壤样品;然后将其分为两部分,一部分带回实验室后在-80℃冷冻保存用于土壤细菌群落测定,另一部分自然风干后用于土壤理化性质测定。
1.3 土壤理化性质测定
将自然风干土样去除石块、草根等杂质后碾磨、过筛后测定土壤理化性质。各指标的测定方法分别为:土壤含水率用烘干法测定,容重用环刀法测定;土壤全氮、全磷和全钾均使用过0.15 mm筛网的风干土样测定,其中全氮用凯氏定氮法测定,全磷用NaOH熔融—钼锑抗比色法测定,全钾用火焰分光光度计法测定;土壤速效养分为过2 mm筛网后的风干土样测定,其中有效氮用碱解扩散法测定,有效磷用NaHCO3浸提—钼锑抗比色法测定,速效钾用乙酸铵浸提—火焰光度计法测定,pH用电位法测定,土壤有机质采用重铬酸钾氧化外加热法测定[17]。
1.4 土壤细菌DNA提取与PCR扩增
土壤总DNA用QIAamp® DNA Stool Mini Kit (QIAGEN, 德国)试剂盒进行提取,并用0.8%琼脂糖凝胶电泳检测DNA质量,用核酸检测仪对DNA进行定量。用引物515F(5′-GTGCCAGCCGCGGTAA-3′)和907R(5′-GTGCCAGCCGCGGTAA-3′)对细菌16rRNA基因的V4—V5区进行PCR扩增,聚合酶为NEB公司的Q5高保真DNA聚合酶。反应条件为98℃预变性2 min、98℃变性15 s、55℃退火30 s、72℃延伸30 s,共循环25次,最后一次循环72℃延伸5 min。将PCR扩增产物用2%琼脂糖凝胶电泳检测后,用AXYGEN公司的凝胶回收试剂盒进行切胶回收。用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,采用Illumina MiSeq测序平台测序。
1.5 统计分析
利用Quantitative Insights Into Microbial Ecology (QIIME, v1.8.0)对测序数据进行处理,识别、检查并剔除疑问序列和嵌合体序列[18],将剩余序列以97%的同一性聚类为可操作分类单位(OTU)[19]。使用QIIME的OTU表计算出OTU的α多样性指数,并用SPSS对α多样性指数进行单因素方差分析, 对OTU丰度矩阵在不同深度随机抽样绘制稀释曲线;用UniFrac距离度量法对细菌群落结构进行β多样性分析[20],对非加权和加权的UniFrac距离矩阵分别进行非度量多维尺度分析(NMDS)[21];用韦恩图确定土壤中的主要细菌群落,用Excel绘制门分类水平下的细菌组成丰度图。使用SPSS对土壤理化性质进行单因素方差分析,使用Canoco 5.0分析环境因子对细菌的影响,用主成分分析(PCA)表明两者间的相互关系。
2 结果与分析
2.1 不同放牧强度下的土壤理化性质
在短期放牧条件下,除土壤容重、pH、有效磷外,其它各土壤指标对不同放牧强度的响应均没有显著性差异(P>0.05;表1)。与对照组相比,不同放牧强度的土壤容重与土壤pH均有所降低,轻度放牧和重度放牧的土壤容重显著小于对照组(P<0.05),土壤pH随放牧强度的增加而减小。其它指标在不同放牧强度处理下有不同程度的增加,土壤含水率和碱解氮在各放牧强度的增加幅度相似,平均增加幅度分别为16.20%和20.37%。
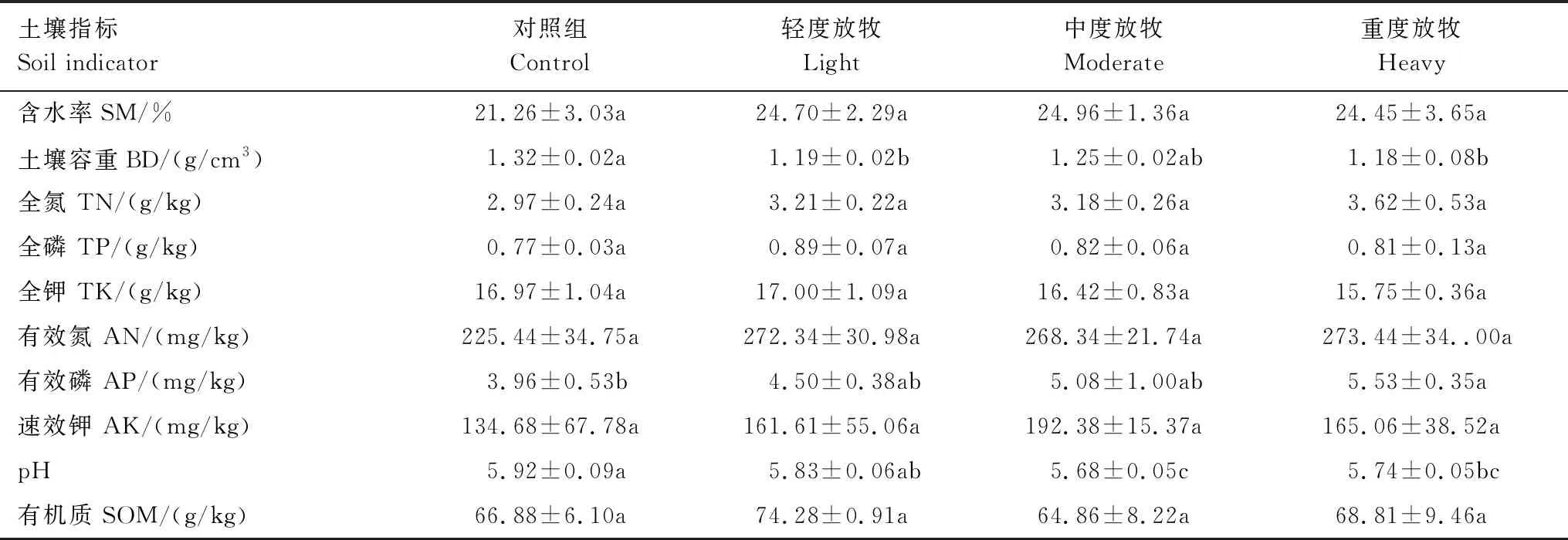
表1 不同放牧强度对土壤理化性质的影响
2.2 不同放牧强度下的细菌群落多样性
2.2.1土壤细菌OTU分布特征
通过Illumina MiSeq平台对不同放牧强度0—10 cm土壤进行细菌群落DNA片段双端(Paired-end)测序,样本共测得有效序列663764条。对土壤细菌群落有效序列按97%的序列相似度进行归并和OTU划分,将细菌大致分类至分类学的种水平。对照组、轻度放牧、中度放牧、重度放牧的OTU种类分别为5671、5958、6231、5647,通过韦恩图呈现出各放牧强度细菌群落共有或独有的OTU数量(图1)。试验区不同种类OTU 共8492个,4个放牧强度共享的OTU占总量的37.15%;对照组独有的OTU数占总量的4.19%;轻度放牧独有OTU占总的4.09%;中度放牧独有OTU占总数的5.16%;重度放牧独有OTU占总数的3.98%。
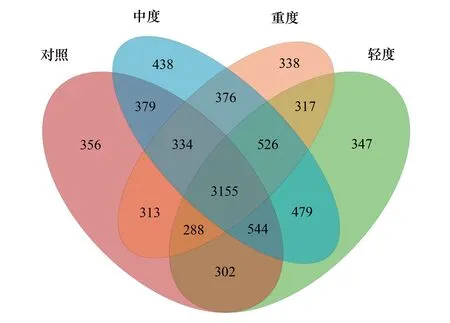
图1 不同放牧强度土壤细菌OTU维恩图
2.2.2土壤细菌α多样性
稀释曲线能够反映样本的测序深度对群落微生物多样性的说明程度(图2),平台期出现的测序深度顺序依次为:中度放牧>轻度放牧>重度放牧>对照组,表明中度放牧处理的土壤细菌种类更多,对照组土壤细菌多样性更低,但是各放牧强度之间的土壤细菌α多样性指数均无显著性差异(表2)。放牧处理的Simpson指数大于对照组,但各组间的差异很小,可见短期牦牛放牧对土壤细菌群落的均匀度和优势OTU影响小;Chao 1与ACE指数呈现相同的规律,均为中度放牧>轻度放牧>对照>重度放牧,Shannon指数则为中度放牧>重度放牧>轻度放牧>对照组。各放牧处理间的α多样性不存在显著差异(P>0.05);但结果表明中度放牧处理会增加细菌群落的丰富度与多样性。
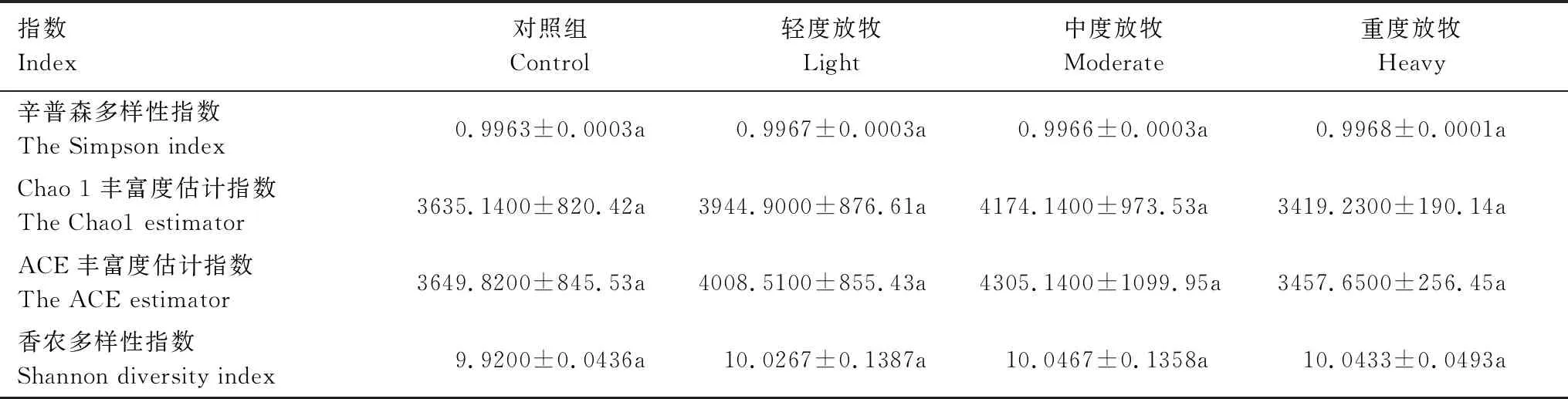
表2 不同放牧强度的土壤细菌α多样性指数
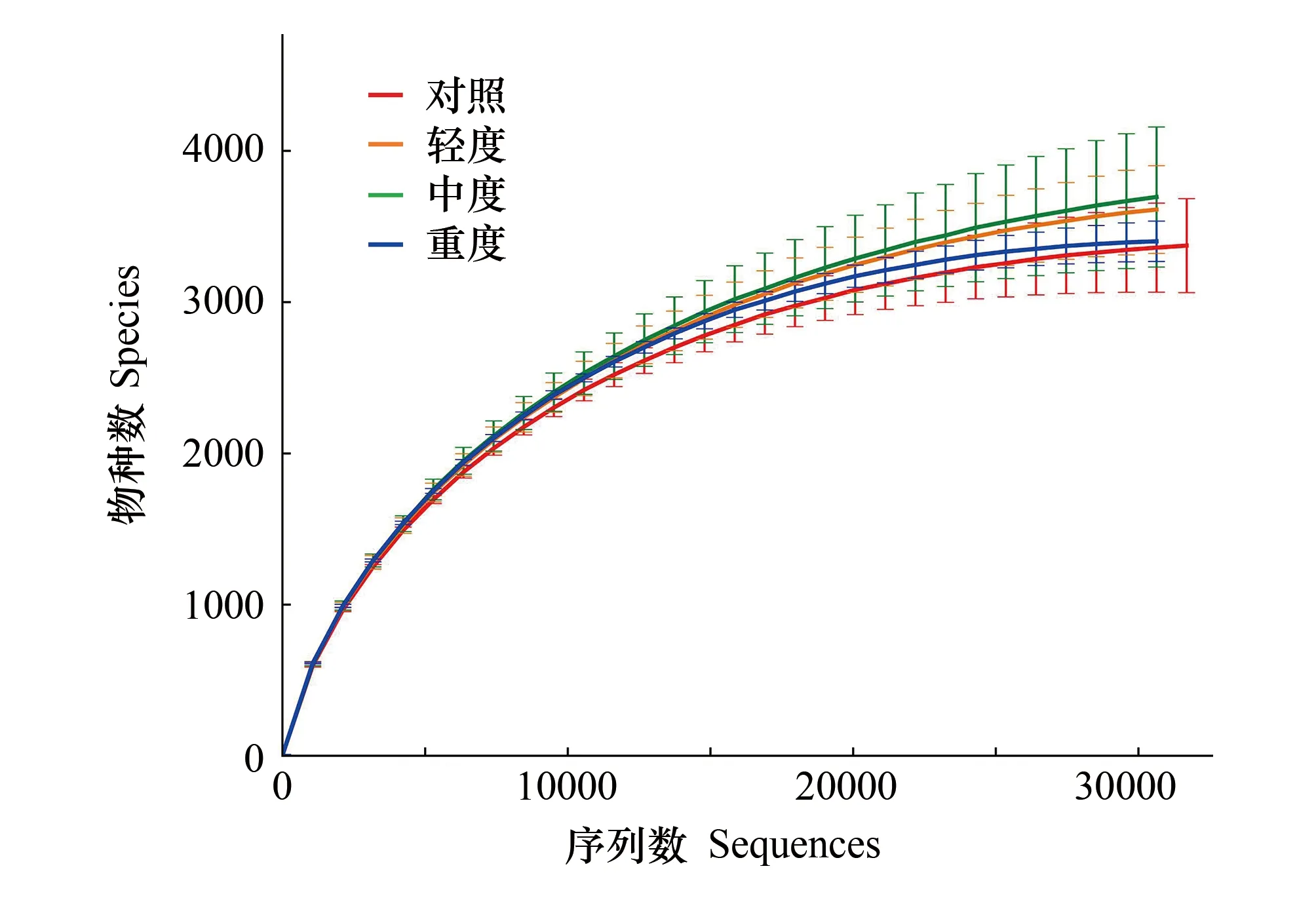
图2 不同放牧强度的细菌样品稀释曲线
2.3 不同放牧强度下的细菌群落组成结构
2.3.1门分类水平下的细菌群落相对丰度
在门分类水平下(图3),土壤中相对丰度>2%的细菌分别为:变形菌门(Proteobacteria,24.7%)、酸杆菌门(Acidobacteria,21.0%)、放线菌(Actinobacteria,13.7%)、绿弯菌门(Chloroflexi,13.7%)、疣微菌门(Verrucomicrobia,6.6%)、厚壁菌门(Firmicutes,4.2%)、芽单胞菌门(Gemmatimonadetes,4.2%)、硝化螺旋菌门(Nitrospira,4.0%)及浮霉菌门(Planctomycetes,2.8%)。除重度放牧的土壤绿弯菌门显著高于对照组外,其它各菌门在不同放牧强度下没有显著差异。随放牧强度的增加,放线菌、厚壁菌门、浮霉菌门的相对丰度呈先增加后减少的趋势,酸杆菌门、芽单胞菌门则呈现先减少后增加的趋势;疣微菌门呈现递减趋势,硝化螺旋菌门呈现递增趋势。
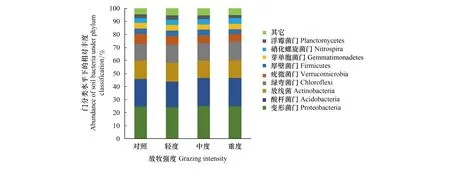
图3 门分类下细菌相对丰度
2.3.2β多样性分析
Unweighted UniFrac距离用来描述群落的组成成分差异导致的群落差异,同一放牧强度的样本间距离较大,各样本的群落组成成分差异明显;不同放牧强度样本的群落组成重合度高,表明放牧强度对土壤细菌群落组成成分变化影响不明显(图4)。Weighted UniFrac距离既描述了群落组成成分间的系统发育关系,又描述了各成分在群落中的丰度高低,相同放牧强度下,对照组和轻度放牧的样本间土壤细菌群落成员丰度相近;但不同放牧强度间的UniFrac距离并没有明显差别,表明各放牧强度间细菌群落结构差异相似(图4)。
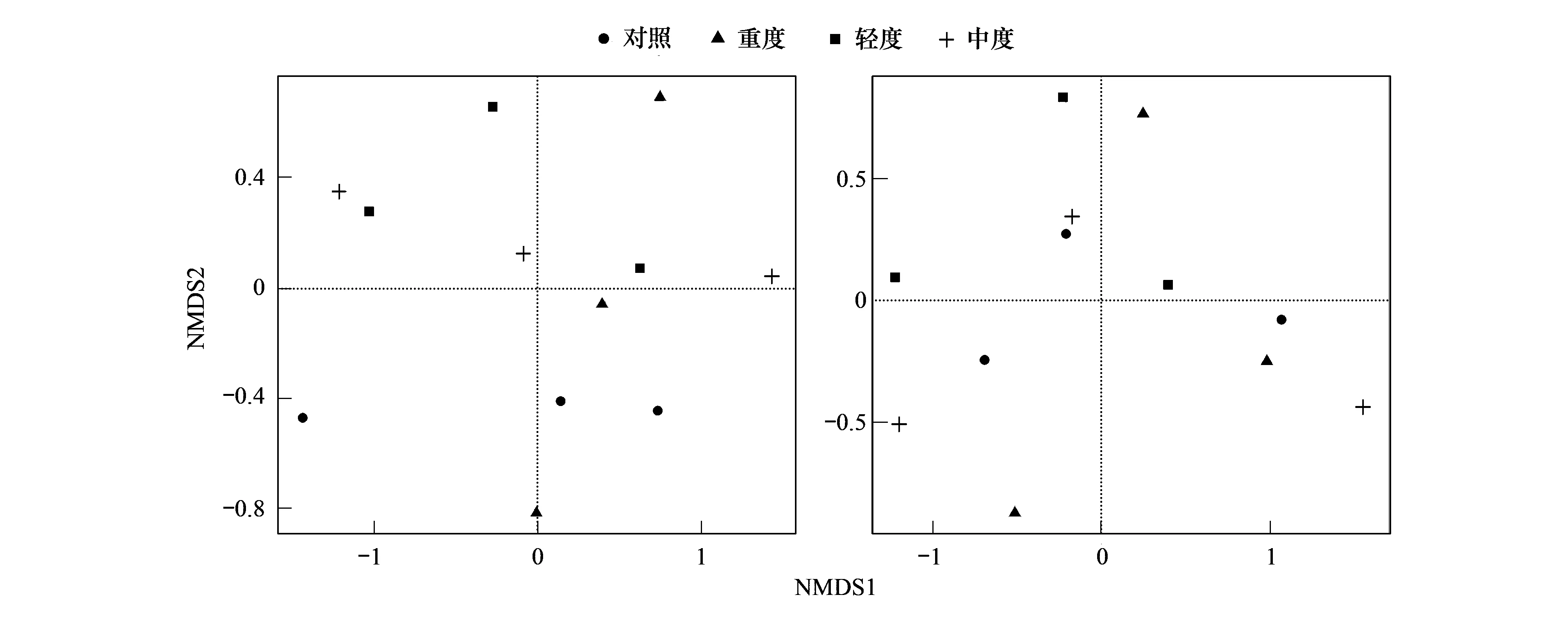
图4 不同放牧强度土壤细菌群落非加权与加权UniFrac距离 NMDS分析
2.4 不同放牧强度下细菌群落与土壤因子间的相关性分析
PCA分析(图5)描述了门分类水平下的优势细菌类群与土壤条件的相互关系。以土壤因子为解释变量,第一、第二主成分的解释率分别为53.03%和40.36%,可以很好地解释各环境因子与细菌种群的关系。土壤全磷与酸杆菌门两者极显著负相关(P<0.01),与绿弯菌门为显著正相关(P<0.05);全钾与浮霉菌门、厚壁菌门显著正相关,与芽单胞菌门极显著正相关,与硝化螺旋菌门极显著负相关;有效磷与酸杆菌门正相关,与硝化螺旋菌门显著正相关;而速效钾与疣微菌门,容重与绿弯菌门呈现显著负相关。
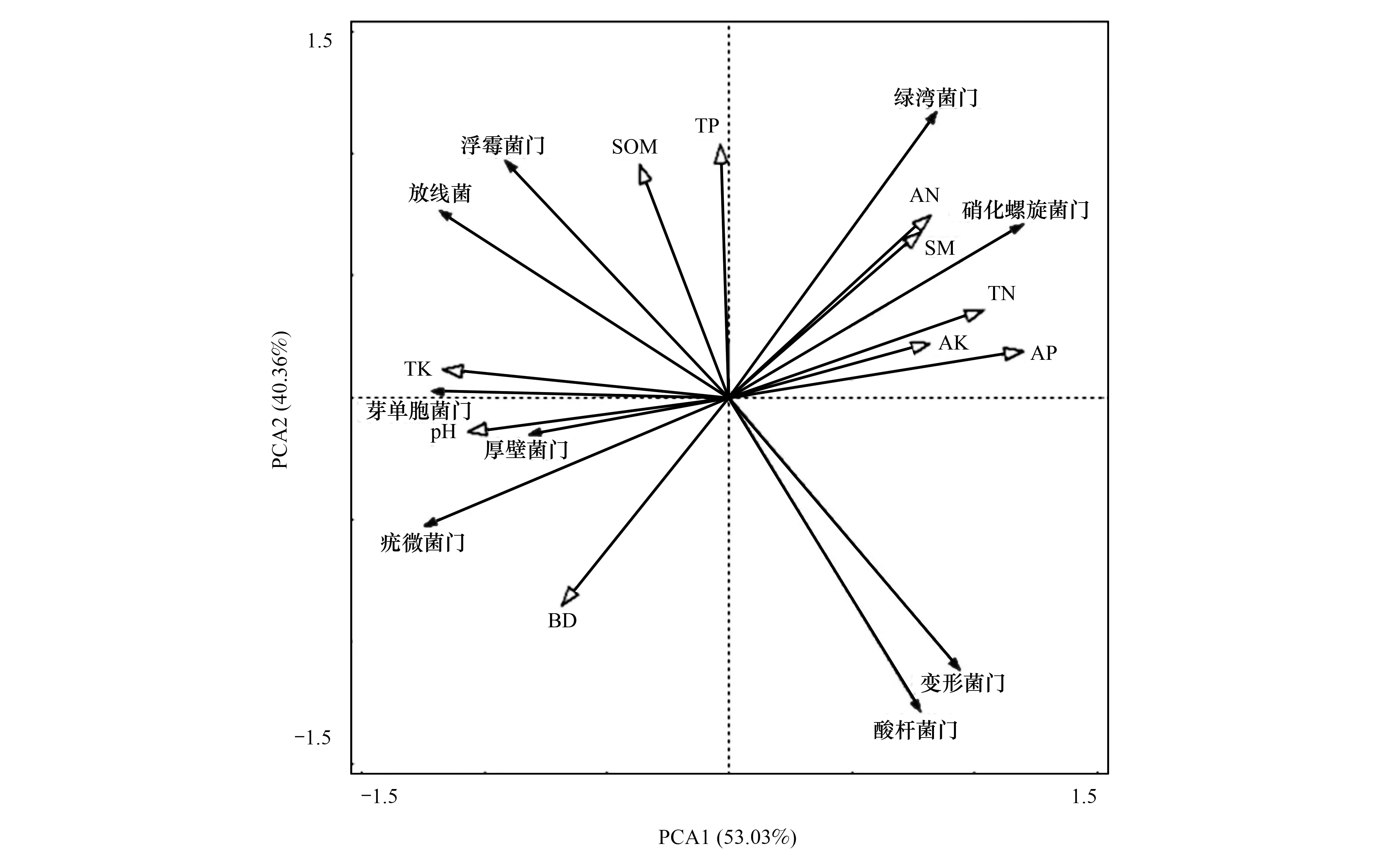
图5 细菌类群与土壤因子的PCA分析
3 讨论
3.1 短期牦牛放牧对土壤理化性质的影响
土壤-植被-家畜三个界面共同组成放牧系统,三者间相互影响。大量研究表明,随放牧强度的增加,家畜的践踏效应增强,土壤团聚体更加稳定且土壤透水性更差[22],土壤孔隙度减小,通气性变弱,土壤持水性降低[23]。表层土壤容重随放牧强度的增加呈现上升趋势,土壤含水量和孔隙度则呈现递减趋势[24—25]。但本研究发现,不同放牧强度的含水率均高于对照组;而各放牧处理土壤容重均小于对照组,并且轻度放牧和重度放牧显著小于对照组。这可能与试验区的植被覆盖情况和地下根系情况有关,本试验为短期放牧,根据“中度干扰理论”,放牧对植被的采食行为促进植物的生长[16],地下根系更加发达,形成更稳定的草皮,有效保持了土壤含水率,降低土壤容重[26]。也可能是本试验样地面积较大导致土壤质地存在一定差异,从而影响土壤含水量与容重[27]。Teague等发现土壤物理性质变化是放牧长期作用的结果[28],本研究是短期放牧的结果,试验长期进行可能会使土壤含水量降低、容重增加。
放牧活动除了影响土壤物理特性外,还能通过排泄物归还等影响土壤化学性质。研究发现氮是决定草地初级生产力的主要因子,随放牧强度增加土壤氮呈现增加、降低或不变的结果[29]。本研究的结果表明,全氮含量随放牧强度增加呈上升趋势,放牧处理的碱解氮含量也均高于对照组,但是不同放牧强度间的差异没有达到显著水平。这可能是因为放牧降低植物根茎的碳氮比,土壤中的分泌物减少,可利用碳不足,氮的固定减少,向氮矿化方向进行,土壤中的氮含量升高[30]。而且全氮、碱解氮与变形菌呈正相关,这与Thomson等[31]发现的高土壤碳氮含量更适合变形菌门生长的结果一致。已有研究显示,自由放牧与围栏封育相比全磷下降了16%,下降的主要原因是家畜的放牧活动向系统外输出磷[32]。而本研究为短期放牧,并且排泄物完全保留于该系统内,向系统外输出的元素含量较少;放牧使植物根系向土壤深层延伸,植物可以吸收土壤中更深层的营养元素,而牦牛采食后通过排泄物将这些营养元素回归到土壤表层,使得放牧处理的土壤全磷含量大于对照组;粪便中的磷含量更高,放牧强度越高牦牛的排泄量越多,所以有效磷含量随放牧强度递增[33]。蒋建生等[34]发现家畜返还草地的钾元素中,70%—90%通过排尿的方式,10%—30%通过排便的方式。本研究发现随放牧强度的增加全钾和速效钾含量均呈先增加后减少趋势,且放牧处理的速效钾含量均高于对照组,这与苏振声等[35]的研究结果一致。牦牛从植物中采食的钾通过排泄物,大部分以速效钾形式回归到土壤中,使得放牧处理的速效钾含量高于对照组[36];但当放牧强度增加到一定程度时,植物的补偿性生长吸收了大量的钾元素,并且由于结合在土壤胶体中的钾很容易代换出来,使得土壤中的全钾与速效钾含量有所减小[35]。
3.2 短期牦牛放牧对表层土壤细菌群落组成与结构的影响
土壤微生物是生态系统中的分解者,是有机质分解与养分循环等过程中的驱动者,而细菌是这一功能群中的最大类群[37]。本研究中不同放牧强度下土壤细菌α多样性指数差异不显著,但整体上随放牧强度增加呈现先增加后减少的趋势,并且在中度放牧达到最高水平,说明适度放牧会小幅度提高土壤细菌群落的多样性和丰富度。植物生长将土壤深层的营养物质带到地上,再经过牦牛的采食与排泄行为将植物组织转化为微生物容易利用的粪便与残渣,以及牦牛践踏作用将凋落物踏入土壤的行为[7],土壤中易分解碳增加为细菌的生长繁殖提供了有利条件。但重度放牧使地上植被大面积减少,少部分光透过表层2 mm土壤[38],增强的地表紫外线辐射直接抑制[39]或改变土壤水分条件以及通过改变植物及其根部分泌物间接抑制细菌的生长[40],导致细菌多样性下降。杨阳等[41]发现放牧显著降低了细菌的Simpson指数,对其它指数的影响不显著;Li等[42]发现重度退化与不退化草地的微生物多样性没有显著差异,这与本研究结果相似。但是,草地植被组成[43—44]、利用方式[14,45]、地理环境[46]、土壤类型[47]、气候类型[10]以及家畜类型[48]等都影响土壤微生物群落的组成,可见放牧强度对土壤微生物多样性的影响应结合环境因素进行综合考虑。
本研究结果表明,在门分类水平下,优势菌群为变形菌门(24.7%)、酸杆菌门(21.0%)、放线菌(13.7%)、绿弯菌门(13.7%),与本区域伍文宪等[49]对天然和人工草地的土壤微生物群落的调查结果一致。杨阳等[41]发现放牧使荒漠草原的变形菌门丰度降低;高凤等[50]和尹亚丽等[51]均发现在门水平下放牧均降低了优势细菌的丰度,但没有达到显著水平;李海云等[52]对祁连山退化的高寒草地研究发现,优势菌门随草地退化程度加剧呈现不同趋势的变化。本研究发现在相对丰度>2%的9个细菌门中,除重度放牧土壤的绿弯菌门显著高于对照组外,其它各菌门在不同放牧强度下没有显著差异;不同放牧强度的特有OTU占总量的3.98%—5.16%,放牧强度间的OTU相似度高;对样本进行的β多样性分析也表明各放牧强度样本的重合度高,说明短期放牧对细菌群落结构的影响不显著。绿弯菌门包含了不同生活类型的细菌,其中有一部分是自养生物,具有绿色的色素,可以进行光合作用产生能量[53],重度放牧土壤绿弯菌门显著升高的原因可能是重度放牧改变了植被的覆盖度,土壤裸露在阳光中,为绿弯菌门的繁殖提供了有利条件。
3.3 土壤属性与土壤细菌群落的关系
放牧通过改变输入土壤中的有机碳形式影响微生物的群落结构,使以真菌为主、生长速度较慢的群落向以细菌为主、生长迅速的群落结构转变;另一方面,放牧强度增加使植物生长需要更多的有效养分,迫使细菌形成能够更快周转养分的细菌群落[11]。土壤中的有机碳含量以及碳磷比、氮磷比均与细菌群落结构显著正相关[50],使得细菌群落结构能够反映土壤的情况。本试验的有机质与放线菌门呈正相关,这是因为放线菌门与调控麦芽糖酶和淀粉酶表达的易分解有机碳降解基因显著正相关[54];而酸杆菌门与土壤有机质呈负相关,Fierer等[55]通过实验与整合分析结合,证实了酸杆菌门在低碳含量土壤中丰度较高,碳矿化能力低,其原因是酸杆菌门与难降解有机碳降解基因(调控纤维素酶和木聚糖酶等)呈正相关[54],不利于土壤有机质的快速循环,降低了碳矿化能力。
氮是陆地生态系统循环的重要限制因子,微生物参与其固氮、氨化、硝化以及反硝化等过程[56]。变形菌门与酸杆菌门作为本研究区土壤中丰度最高的两种细菌群落,通过冗余分析发现,其比例越高土壤的氮含量越高,Thomson和Smit等人的研究也发现了同样的结果[31,57]。主要因为变形菌门中的部分细菌中检测到nifH基因的存在,对于固氮有重要作用[58]。硝化是氮循环的核心部分,氨氧化作为硝化的限速步骤,在高氮水平下其优势类群之一的硝化螺旋门细菌生长更加旺盛[59],本试验全氮和有效氮均与硝化螺旋菌门呈正相关,但由于短期放牧,各放牧强度间的土壤氮含量差异不显著,土壤氮与硝化螺旋菌门的相关关系并不显著。nirS和nirK作为氮循环反硝化过程的标记基因,广泛存在于变形菌门、酸杆菌门和厚壁菌门中,并且这些反硝化功能基因丰度与土壤的总碳、有机质、速效钾以及有效磷显著相关[58]。这些结果表明,放牧对土壤细菌群落的影响可能是通过改变土壤性质间接实现。
近年来由于人为的氮输入,部分生态系统的氮限制得到缓解,磷限制现象增加[60]。土壤磷对氮有矿化作用[61],可以提高土壤有效氮从而改变微生物群落结构,本研究发现有效磷与酸杆菌门正相关,与硝化螺旋菌门显著正相关,这与上文提到的氮对细菌群落结构影响结果一致。Zheng等[62]通过氮、磷、钾等施肥处理发现,施肥平衡能够显著增加细菌的数量,而导致细菌活性降低缺乏的主要营养物质是有效磷。但本研究短期放牧各强度的主要细菌群落差异不显著,无法确定缺乏有效磷主要通过影响何种细菌种群进而影响细菌群落整体活性的。因此,需要通过长期放牧实验来探究细菌群落结构变化的阈值,从而揭示细菌群落对放牧强度更加明显的响应规律,为生产实践提供更加有效的理论依据。
4 结论
短期的牦牛放牧行为会降低土壤表层的容重,可能是由植物的补偿性生长导致地下生物量增加或土壤异质性引起的;家畜加快物质循环的作用导致短期内有效磷在地表的聚集,使有效磷随放牧强度的增加呈上升趋势。放牧对土壤理化性质的影响是长期的,因此短期牦牛放牧强度变化不容易改变相对数量。牦牛的活动为细菌提供了更有利的营养条件,虽然短期的放牧强度对细菌群落组成的影响不显著,但放牧强度过高改变了植物根系和分泌物以及增加紫外线辐射使细菌的多样性降低。不同细菌类群对土壤碳氮磷的响应通过其功能基因实现,可以由细菌群落结构指示土壤营养成分组成。由于本试验为短期放牧(2年),土壤属性以及细菌群落响应并不显著。由此可见,开展长期牦牛放牧强度控制实验对揭示土壤性质与微生物的影响及其机理以及探究土壤-植物-微生物间的相互关系至关重要。
