1-异丙基咪唑和1-乙基咪唑对抑制铜在3%氯化钠溶液中腐蚀的对比研究
2022-03-31杨君慧陈思屹陈书军
唐 琴,杨君慧,陈思屹,潘 琪,陈书军
(遵义师范学院化学化工学院,贵州 遵义 563006)
金属铜具有良好的导热、导电以及易加工等特性,在机械加工、微电子、航天航空等领域具有广泛的应用。然而铜的化学性质相对比较活泼,在侵蚀性介质中易发生腐蚀[1]。铜的腐蚀会缩短其使用寿命,每年由腐蚀造成的经济损失占国民经济总产值的2%~4%[2]。目前,添加缓蚀剂是减缓金属腐蚀的常用手段。缓蚀剂一般含有N、O、S、P等杂原子,这些原子中均具有孤对电子,能与金属未排满的d轨道形成配位键,在金属表面发生化学吸附,因此,可以从这类带有电负性较大原子的有机物中寻找金属缓蚀剂[3]。全贞兰[4]研究了两种不同结构席夫碱自组装膜分子对铜缓蚀性能的影响,实验发现邻香兰素邻氨基酚对铜在0.5 mmol/L氯化钠腐蚀介质中的缓蚀能力低于邻香兰素十八胺;王其[5]合成了四种苯并三唑衍生物,实验发现这四种缓蚀剂在3.5%氯化钠溶液中的缓蚀效率与连接碳链的长度有关。因此,研究缓蚀剂分子结构与缓蚀效率的关系,对缓蚀剂的发展具有重要意义。
本文通过电化学分析和金相显微镜观察,研究了两种咪唑类缓蚀剂(1-异丙基咪唑和1-乙基咪唑)对铜在3%氯化钠溶液中的缓蚀效果。
2 实验
2.1 仪器与试剂
所有化学试剂均为分析纯,购买于探索平台,后期直接使用未进一步纯化。
2.2 电极的制备
选 1cm×1cm×1cm 的铜作为金属材料,留出1cm2作为待测面,其余铜面用环氧树脂包裹。实验前先用滤纸擦去待测面上的凡士林,接着用酒精超声15~20s,然后用不同规格的砂纸(400#,600#,800#,1200#,1500#,3000#)逐级打磨至光亮,再用酒精超声15s,最后用蒸馏水冲洗并吹干备用。
2.3 自组装膜的制备
用无水乙醇配制浓度为0.25mol/L的1-异丙基咪唑和0.50 mol/L的1-乙基咪唑,将备用电极放入咪唑类溶液中,经不同成膜时间处理后,将电极取出并用蒸馏水充分冲洗。
2.4 电化学阻抗测试
在室温下,使用电化学工作站和三电极体系进行电化学测试。制备的铜电极作为工作电极,铂片作为辅助电极,饱和甘汞电极作为参比电极。电化学阻抗谱(1-乙基咪唑)的测量采用ZSimDemo 3.30d软件拟合得到电化学相关参数。按公式(1)计算得到缓蚀效率EIS。式中Rct,0和Rct分别是空白溶液和不同浓度缓蚀剂的电荷转移电阻。
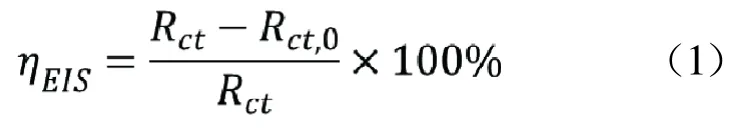
2.5 金相显微镜测试
取0.5cm×0.5cm×0.5cm的铜方块,分别用不同规格的砂纸(400#,600#,800#,1200#,1500#,2500#,3000#5000#,7000#)逐级打磨抛光,蒸馏水冲洗后分别在丙酮与乙醇中超声清洗2次,自组装后放入3%氯化钠溶液中浸泡20d,取出试样清洗干净,用金相显微镜观察其表面形貌。
2.6 量子化学计算
通过 Gaussian 03软件,利用密度泛函理论(DFT)中的B3LYP方法,在6-311G(d,p)基组下计算1-异丙基咪唑和1-乙基咪唑的相关量子化学参数。
3 结果与分析
3.1 电化学阻抗测试
图1表示铜在添加不同浓度1-异丙基咪唑和1-乙基咪唑的3%氯化钠溶液的电化学阻抗图。从图中可以看出,相对于空白溶液,添加缓蚀剂后铜试样的容抗弧半径增大,且随着缓蚀剂浓度的增加,容抗弧半径逐渐增大,表明这两种缓蚀剂分子对铜在3%氯化钠溶液中均具有缓蚀效果。对比图1中(a)和(b)可以看出,与Cu/1-异丙基咪唑修饰电极的阻抗谱相比,Cu/1-乙基咪唑的高频段半圆弧直径明显增加,说明1-乙基咪唑修饰后的铜电极在腐蚀介质中的缓蚀效果比1-异丙基咪唑好。电化学阻抗数据采用图2的等效电路进行拟合,其中RS是溶液电阻、Rf是铜表面自组装膜电阻、Q1和Q2是恒定的相位角原件,分别对应膜电容和双电层电容,Rct是电荷转移电阻,W是Warburg阻抗[6]。
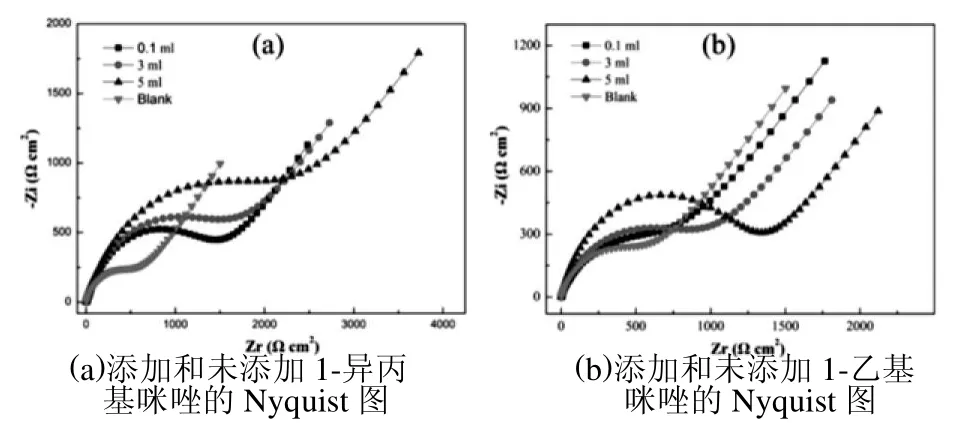
图1 不同缓蚀剂分子对铜在3%氯化钠溶液的电化学阻抗图

图2 拟合电化学图谱的等效电路图
电化学阻抗数据的拟合结果如表1、表2所示,由表可知:随着1-异丙基咪唑、1-乙基咪唑浓度的增加,Rct的值均逐渐增大,当1-异丙基咪唑浓度为0.25mol/L时,缓蚀效率为51.60%;当1-乙基咪唑浓度为0.50 mol/L时,缓蚀效率为74.56%。这可能是由于1-乙基咪唑中含有的直链烷基有利于形成效果较好的保护膜,1-异丙基咪唑的支链位阻较大导致缓蚀剂不能较好地吸附在铜表面,产生显著的抑制作用,从而对铜的缓蚀效果减弱[7]。

表1 1-异丙基咪唑缓蚀剂不同浓度的交流抗腐蚀电化学参数
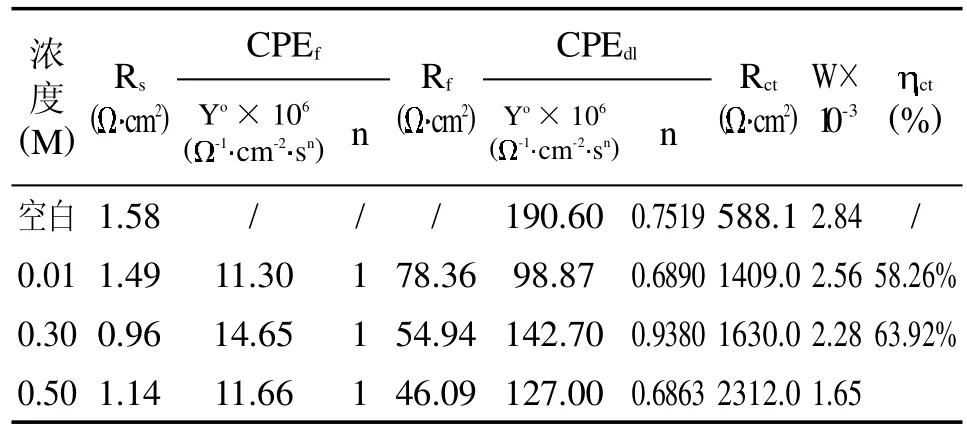
表2 1-乙基咪唑缓蚀剂不同浓度的交流抗腐蚀电化学参数
3.2 腐蚀形貌分析
金相显微镜测试结果如图3所示。其中(a)为打磨抛光后的铜表面,(b)是铜在未添加缓蚀剂的3%氯化钠溶液中浸泡后的表面形貌;(c)和(d)为铜在添加不同缓蚀剂的腐蚀溶液中浸泡后的表面形貌。由图3可见,铜在未添加缓蚀剂的腐蚀溶液中浸泡后表面形貌腐蚀严重(如图b),而在添加缓蚀剂的腐蚀介质中浸泡后铜表面仍能看见金属打磨后的划痕,添加1-乙基咪唑缓蚀剂后的铜表面划痕比1-异丙基咪唑的明显,说明1-乙基咪唑能更好地抑制铜在3%氯化钠溶液中的腐蚀[8]。

图3 裸铜或被修饰铜在3%NaCl溶液中浸泡20 d后的金相显微镜图
3.3 量子化学计算
采用量子化学计算,可从理论上分析讨论不同缓蚀剂的缓蚀性能与机理。图4为1-乙基咪唑与1-异丙基咪唑分子的结构示意图、前线轨道与静电势图。从优化结构图中可以发现,1-乙基咪唑与1-异丙基咪唑分子具有相同的氮杂环结构,然而由于烷基异构化的原因,1-异丙基咪唑分子具有更大的分子空间结构。这种具有更为复杂空间结构的分子,不利于分子在金属表面吸附后的自组装,导致形成的薄膜疏松多孔,这便是在相同条件下1-异丙基咪唑分子形成自组装膜的缓蚀性能比1-乙基咪唑差的原因。此外,1-乙基咪唑与1-异丙基咪唑的HOMO与LUMO轨道电子云分布在分子的氮杂环结构上,这表明两种分子主要通过氮杂环吸附在金属表面形成自组装膜。HOMO与 LUMO轨道能反应出分子的供电子和失电子能力,轨道能隙(E=ELUMO-EHOMO)越低分子越容易吸附在金属表面。1-乙基咪唑的E为6.79 eV,1-异丙基咪唑的E为6.88 eV,因此1-乙基咪唑更易吸附在金属表面,表现出更佳的缓蚀性能。分子静电势图主要由区域1和区域2构成,区域1富电子具有亲核性,区域2贫电子表现出亲电性。从图4中可以发现两种分子的区域1主要分布在氮原子上,因此分子中的氮原子易与金属表面空轨道结合,形成化学吸附。

图4 1-异丙基咪唑与1-乙基咪唑的构型、静电势图、HOMO和LUMO轨道的电子云分布
4 结论
(1)通过电化学测试和形貌分析,1-异丙基咪唑和1-乙基咪唑在3%氯化钠溶液中对铜电极的腐蚀有一定程度的缓蚀作用,表明铜电极通过对1-异丙基咪唑和1-乙基咪唑的吸附效应产生保护膜,从而抑制铜的腐蚀。
(2)1-乙基咪唑中含有的直链烷基有利于得到效果较好的保护膜,而1-异丙基咪唑的支链位阻较大,导致缓蚀剂不能较好地吸附在铜表面产生显著的抑制作用,从而对铜的缓蚀效果减弱。
(3)量子化学计算结果表明,两种分子的吸附活性位点集中在N原子上,能与金属原子形成配位键,发生化学吸附。
