新疆哈萨克族食管鳞癌差异表达mRNA的筛选
2022-03-31林怡秀邵生辉陈卫刚
林怡秀,向 辉,李 阳,邵生辉,张 健,郑 勇,陈卫刚
食管癌是常见的恶性肿瘤之一,2018年世界卫生组织的全球癌症统计数据显示,全球食管癌新增病例57.2万例,新增死亡病例50.9万例[1]。我国是食管癌发病率最高的国家之一[2],新疆是我国食管癌的高发区[3]。食管癌早期无明显症状,其诊断和治疗多在晚期,此时癌细胞已转移至全身,治疗生存率低,然而其发生机制并不明确,需要进一步探索。研究显示[4-5],mRNA的差异表达与肿瘤诊断、发生、发展及判断预后密切相关。该研究选取哈萨克族食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者作为研究对象,利用基因芯片对哈萨克族ESCC患者组织中的mRNA进行全面分析,筛选差异表达的mRNA并探讨其在ESCC发生发展中的作用,进一步完善ESCC基因表达谱,为后续寻找哈萨克族ESCC更有价值的生物标志物提供可能性。
1 材料与方法
1.1 材料取新疆石河子大学医学院第一附属医院兵团内镜中心经内镜及病理诊断确诊的哈萨克族ESCC确诊患者手术所得癌组织及癌旁正常组织(距癌组织>5 cm)各5例,其中男2例,女3例,年龄47~85(60.80±11.17)岁。所有患者均未合并其他严重疾病,未接受放化疗,所有组织都为中分化鳞癌,TNM分期为T2N1M0,均由2名以上高级病理学家独立诊断。每个组织样本均转移到液氮中,24 h后转移至-80 ℃冰箱保存,微阵列实验在北京博奥公司完成。另收集新疆石河子大学医学院第一附属医院2009年9月—2019年10月病理科存档的23例哈萨克族ESCC患者手术切除的癌组织标本,其中20例患者术中取得距离癌组织>5 cm的癌旁组织,病理切片证实没有癌变。男15例,女8例。年龄48~77(62.39 ± 8.16) 岁。本方案由石河子大学医学院第一附属医院伦理委员会批准,所有标本由患者或家属授权。
1.2 方法
1.2.1RNA提取与全基因组mRNA分析 使用Trizol 试剂(Life,USA)按照制造商协议从组织中提取总RNA。用紫外分光光度计测定总RNA的浓度和纯度,制备了OD260/OD280值在1.8~2.0之间的RNA用于微阵列分析。采用甲醛变性凝胶电泳法检测总RNA的质量,当28S ∶18S核糖体RNA≥1 ∶1时,可用于基因芯片分析实验。采用Agilent人类长链非编码RNA(long non-coding RNA,lncRNA)芯片V4.0(北京博奥晶典生物技术有限公司)检测样品中的mRNA,使用晶芯生物芯片通用标记试剂盒(CapitalBio,北京)对所有mRNA进行荧光标记,并进行芯片杂交及数据分析。
1.2.2RNA序列数据的生物信息学分析 利用Agilent Feature Extraction (v10.7) 软件对杂交图片进行分析并提取相关数据。Agilent GeneSpring软件对数据进行归一化和差异分析,筛选差异基因[差异倍数(FC)≥2.0,且P≤0.01]。使用R软件(3.6.1)对数据进行分析和图形化展示,pheatmap包绘制聚类热图,ggpubr、 ggthemes 绘制火山图。对这些mRNA在metascape网站进行GO分析和KEGG分析。用 Fisher′s 精确检验对 GO term 和 KEGG pathway 进行分类,P<0.01表示GO term或KEGG pathway具有统计学意义。利用STRING网站构建筛选的mRNA PPI互作图,将互作图导入cytoscape软件,使用Cytohubba插件寻找其前25位的核心基因。
1.2.3免疫组化验证芯片结果 免疫组化检测PLAUR相关蛋白。取23例癌组织与20例癌旁组织石蜡标本,5 μm厚度连续切片,后于60 ℃烤箱烤片(>2 h),二甲苯中脱蜡3次(5 min/次),梯度乙醇水化,蒸馏水冲洗3次。切片放置于塑料染色架。取配置好的EDTA缓冲液于塑料缸中,微波炉高火预热3 min至沸腾。切片放入沸腾修复液,同时将装入切片修复盒放入高压锅,待喷气阀开始喷气计时8 min,结束排气。取出切片,将切片在自来水浸洗3次。然后放入3%过氧化氢溶液,37 ℃孵育10 min,自来水浸洗3次,PBS洗3次,每次5 min(后同),去除PBS后滴加一抗,然后置于4 ℃冰箱过夜;次日取出,在37 ℃下恢复温度,PBS冲洗3次后去除PBS,每张切片滴加生物素标记二抗,室温孵育15 min,PBS冲洗3次后去除PBS。接下来继续显色操作,滴加DAB显色试剂,显微镜下观察显色,3~5 min后(出现棕色本底)终止显色,自来水冲洗,给予苏木精复染1 min,酸酒精5 s后自来水冲洗反蓝。最后进行脱水透明并用中性树胶进行封片。
1.2.4结果判定 阳性结果判定阳性结果,判定参考相关文献[6],胞浆内出现黄褐色颗粒为阳性结果。PLAUR阳性表达水平根据染色强度(3分为棕褐色、2分为棕黄色、1分为淡黄色、0 分为无着色)与阳性细胞数百分比(随机选取的5个高倍视野下,阳性细胞率<10%为1分, 10%~50%为2分,>50%为3分)共同确定,二者的乘积>3分为阳性表达,所有免疫组化切片均由2名以上高级病理学家双盲独立观察。
1.3 统计学处理Agilent GeneSpring软件对芯片数据进行归一化和差异分析,筛选差异基因[差异倍数(FC)≥2.0,且P≤0.01]。对筛选mRNA在metascape网站进行GO分析和KEGG分析。Fisher′s 精确检验对 GO term 和 KEGG pathway 进行分类,P<0.01表示 GO term 或 KEGG pathway 有统计学意义。应用SPSS 22.0统计软件,运用χ2检验分析癌组织与癌旁组织PLAUR蛋白表达。P<0.05为差异有统计学意义。
2 结果
2.1 哈萨克族ESCC差异表达mRNA
2.1.1差异表达mRNA火山图 依据ESCC组和癌旁正常对照组的信号值作差异表达mRNA火山图,红色为上调mRNA,蓝色为下调mRNA,并标出差异表达倍数前10位的mRNA (图1)。图1横坐标显示ESCC与其癌旁正常组织比较下log2转换后的改变值,纵坐标显示着由t检验计算出来的log10转换后的P值。其中垂直线与水平线分别代表差异表达2.0倍上下和P值为0.05。
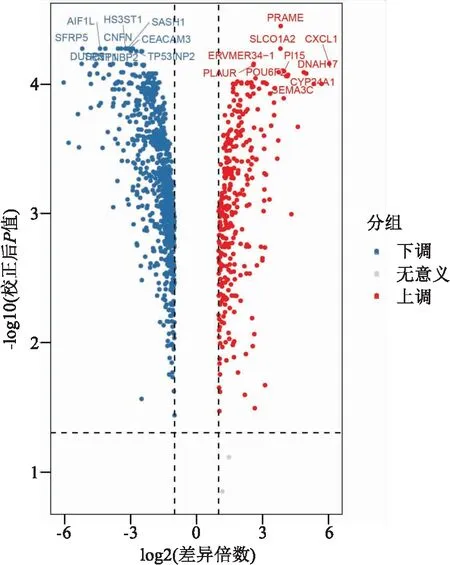
图1 ESCC差异表达的mRNA的火山图
2.1.2差异表达mRNA聚类分析 Pheatmap包分析出癌组织与癌旁正常组织中mRNA不同的表达水平,由聚类分析图展示。图2中红色部分为上调mRNA,蓝色部分为下调mRNA。图2A为哈萨克族ESCC差异表达上调mRNA聚类分析,图2B为哈萨克族ESCC差异表达下调mRNA聚类分析。最终筛s选出哈萨克族差异表达的mRNA 1 764个(差异倍数≥2且P<0.01)。其中上调的mRNA 378个,下调的mRNA 1 368个。差异表达倍数上调前15位的mRNA列在表1,差异表达倍数下调前15位的mRNA列在表2。

图2 ESCC差异表达mRNA聚类分析
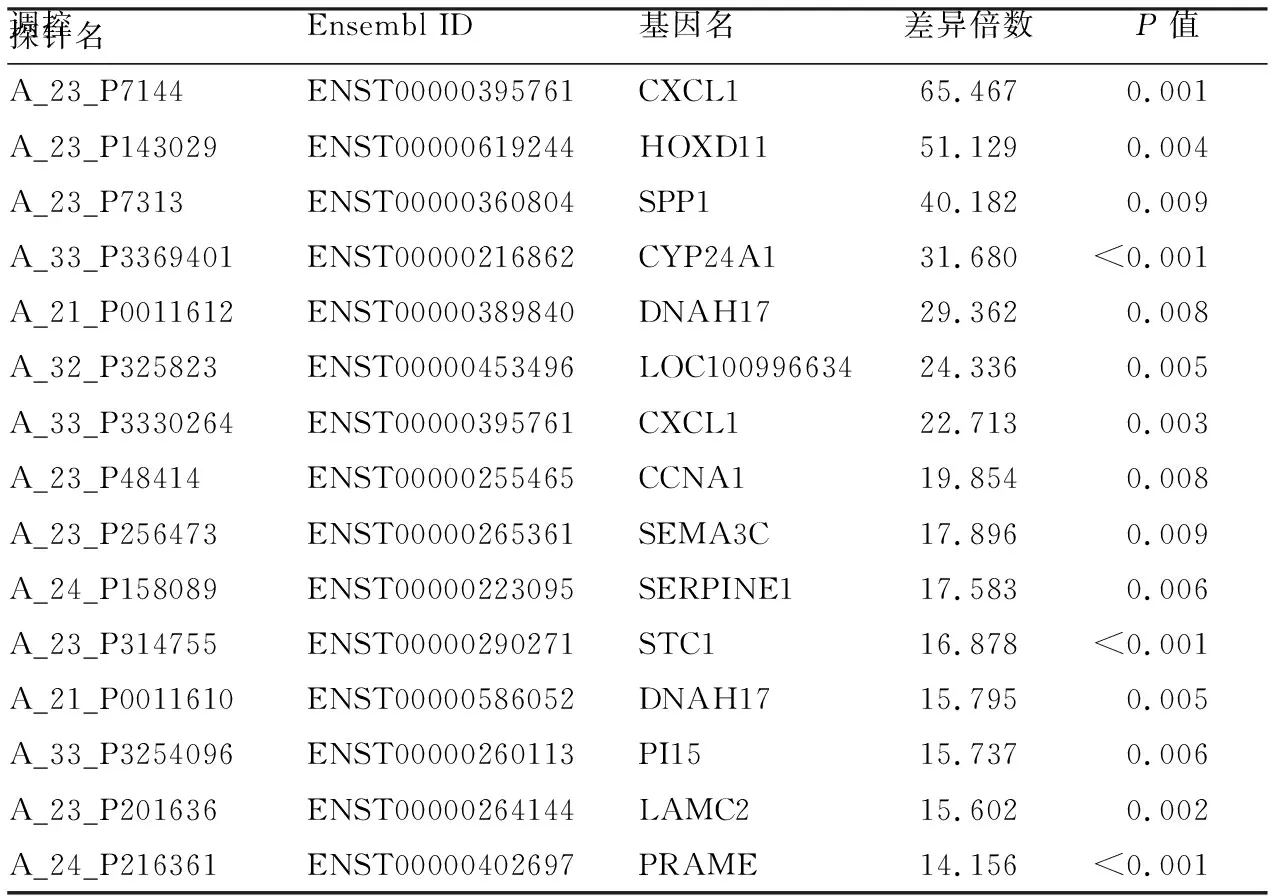
表1 哈萨克ESCC组织中差异表达上调前15位的mRNA

表2 哈萨克ESCC组织中差异表达下调前15位的mRNA
2.2 差异表达的哈萨克族mRNA的富集通路分析为了进一步了解不同表达的mRNA相关功能,本研究利用metascape对最终获得的哈萨克族差异表达的mRNA进行了GO分析和KEGG分析。GO富集分析结果表明,差异表达上调的mRNA(图3A)与细胞外基质组织、超分子纤维组织、细胞黏附调节、骨骼系统发育、细胞连接组织等生物过程相关,差异表达下调的mRNA(图3B)与髓系白细胞介导免疫、蛋白质定位于膜、脂质生物合成过程、蛋白质靶向、体液水平调节、肌动蛋白细胞骨架组织、水解酶活性负调节、神经酰胺代谢过程、去磷酸化、脂质定位等生物过程相关。KEGG结果表明,差异表达上调的mRNA(图4A)与ECM受体相互作用、癌症中的蛋白多糖、癌症中的途径、蛋白质消化和吸收、TNF信号通路、肌动蛋白细胞骨架的调节、MAPK信号通路、松弛素信号通路、细胞衰老、癌症转录调控、自然杀伤细胞介导的细胞毒性等通路相关,差异表达下调的mRNA(图4B)与黏蛋白型o-聚糖生物合成、内吞作用、β-氧化作用、紧密连接、昼夜节律、PPAR信号通路、黏附分子连接等通路相关。
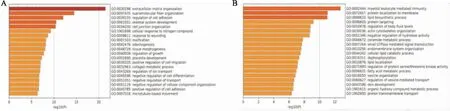
图3 ESCC差异表达mRNA的GO富集通路
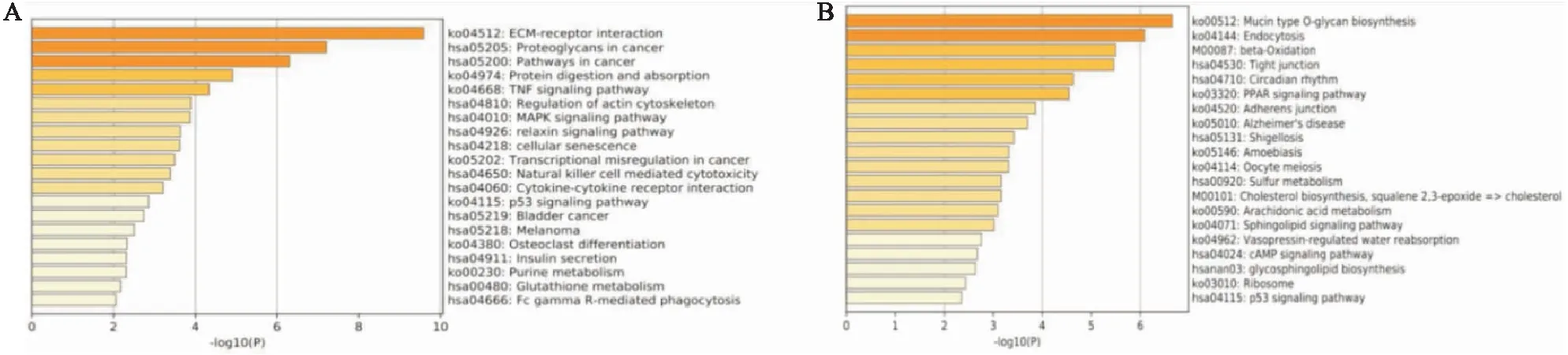
图4 ESCC差异表达的mRNA的KEGG富集通路
2.3 哈萨克ESCC差异表达mRNA的核心基因将筛选的差异mRNA利用STRING网站做出其PPI互作图,将互作图导入Cytoscape,利用cytohubba插件找到哈萨克族ESCC中差异表达的mRNAs中排名前25位的核心基因(图5),这些基因有MMP1、MMP2、PLAUR、PTEN等。
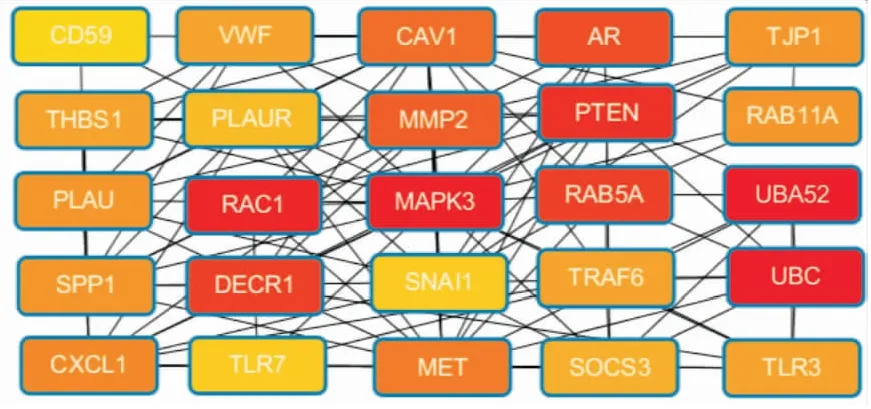
图5 哈萨克族ESCC差异表达的mRNA的核心基因
2.4 ESCC组织、癌旁组织中PLAUR相关蛋白表达情况比较挑选核心基因中的PLAUR进行免疫组化验证。与癌旁组织比较,癌组织中PLAUR蛋白阳性表达率明显升高(P<0.05),结果与芯片分析一致(图6,表3)。

图6 食管癌与癌旁组织中PLAUR的表达 SP×100
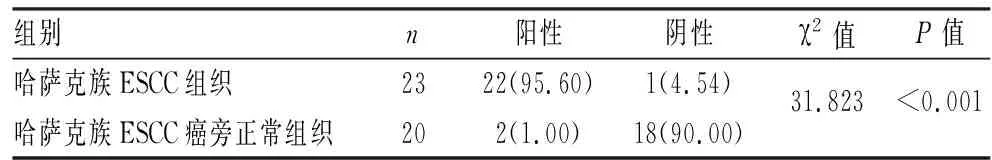
表3 癌组织、癌旁组织中PLAUR相关蛋白表达情况比较[n(%)]
3 讨论
基因芯片技术可以一次性对组织中成千上万个基因的表达进行检测,基因芯片具有高通量、高灵敏度和自动快速等优点[7],在现代分子生物学领域中广泛应用于国内外多种肿瘤及癌前疾病的诊疗和预后研究,如胃癌、卵巢癌、乳腺癌和肺癌等[8]。随着此项技术的发展,其在食管癌中的应用也对阐明食管癌发病机制以及对食管癌诊疗和判断预后起到巨大作用[9]。在Liu et al[10]的研究中,发现ESCA中有145个lncRNA、112个miRNA和2 000个蛋白编码的mRNA差异表达,它们与细胞周期、凋亡和cGMP-PKG信号通路相关;本课题组前期利用基因芯片发现在新疆哈萨克族ESCC中有23个microRNA差异表达[11]。
mRNA的差异表达与肿瘤发生、发展、诊断及判断预后密切相关。在食管癌中,MMP-7、MMP-10和TIMP-1等mRNA表达增加与临床病理特征相关[4]。Zhang et al[5]认为VEGF、HER-2、EGFR 在新疆汉族、维吾尔族、哈萨克族ESCC患者中的表达水平有差异,且与ESCC的淋巴结转移情况与病理分期关系密切。此次,本研究将哈萨克族ESCC与癌旁正常组织差异表达mRNA进行芯片筛选,并对其中的差异表达的mRNA进行了生物信息学分析,发现差异表达的mRNA参与了多种通路。相较于其他食管癌基因筛选的研究,本研究针对新疆高发病率地区的人群,对其进行全基因谱的筛选,分析更加全面,结果也更加有针对性。
将mRNA筛选结果与 Oncomine 数据库中的其他ESCC与癌旁差异表达的芯片结果比较,本研究筛选出的差异表达倍数高的上调基因中CYP24A1、DNAH17、CCNA1、DNAH17、PI15、PRAME均未见高表达,数据库中其差异表达倍数均小于两倍;下调基因中CRISP3、CRISP2、HPGD、CAPN14、HPGD差异表达倍数也小于两倍。其中,PI15暂未见在食管癌中有报道。故认为新疆哈萨克族ESCC差异表达基因存在一定不同,有进一步研究的价值。
本研究进一步分析筛选了mRNA的核心基因,发现其中的PLAUR暂未见在哈萨克族ESCC中有相关研究。PLAUR是尿激酶型纤溶酶原激活物(urokinase plasminogen activator,uPA) 的受体,识别细胞膜上的纤溶酶,与uPA结合,从而参与细胞外基质降解,影响肿瘤细胞的增殖、迁移[11]。肿瘤细胞分泌uPA促使成纤维细胞转化为ICAF,并通过PLAUR/AKT/NF-κB通路,增加白细胞介素-8(interleukin-8,IL-8)的表达和分泌,从而促进食管癌的增殖和迁移[12],在ESCC中,IL-8直接与CXCR1/2结合促进ESCC的侵袭和转移[13]。 PLAUR增高如何促进IL-8分泌间的关系仍需进一步研究。对23例哈萨克族ESCC及其20例对应癌旁正常组织进行免疫组化检测,发现PLAUR在哈萨克族ESCC组织中高表达。它可能成为一个哈萨克族ESCC诊断、预后的新的标志物。后续实验中,可对PLAUR在哈萨克族ESCC的表达进行进一步研究,进一步了解PLAUR与哈萨克族ESCC发生机制、临床表现、淋巴结转移情况、病理分期及生存率等的关系。
本研究仍有并未涉及的方向,如等位基因的研究,一些基因在ESCC发展机制仍需进一步讨论。本研究提示了后续的试验方向,如对差异倍数较大的基因进行进一步生物学功能鉴定。影响ESCC发生发展的因素仍有很多,仍要在今后的研究中不断探索。
综上所述,本研究利用基因芯片技术基于人类全基因谱筛选了新疆哈萨克族ESCC差异表达基因,完善了新疆哈萨克族ESCC基因谱,提示了若干可能在ESCC的诊治及判断预后方面有价值的生物标志。
