慢性不可预知应激所致抑郁小鼠性行为受损及VTA脑区BDNF的表达下降
2022-03-31邱长云孟凡涛刘翠兰王文涛
王 丹,邱长云,孟凡涛,赵 娣,刘翠兰,刘 晶,李 晨,王文涛
性爱行为对于物种延续是必不可少的,嗅觉运动发生在行为交互中,并引导性行为的发生[1]。啮齿类动物中,嗅觉帮助动物发现配偶,决定它们的行为输出[2],对动物嗅觉行为的检验可作为评价小鼠性相关行为的指标[3]。腹侧被盖区(ventral tegmental area, VTA)是调控性奖赏行为的主要脑区。VTA-多巴胺环路系统处理动机以及与社会奖赏相关的需求[4-6]。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是大脑中含量最丰富、分布最广的一种神经营养因子,研究报道BDNF能够调控动机行为和影响性行为[7-9],性行为也能影响VTA脑区BDNF的表达[10]。但是,慢性不可预知应激(chronic unpredictable stress,CUS)致小鼠抑郁后,小鼠性行为表现及VTA脑区BDNF的表达尚未报道。该研究利用CUS小鼠抑郁模型,结合性相关行为测定方法及综合运用免疫荧光、Western blot、荧光定量PCR的方法检测VTA脑区BDNF的变化,为研究抑郁降低小鼠性相关行为提供实验基础。
1 材料与方法
1.1 材料
1.1.1实验动物 20只C57BL/6J雄鼠,从美国Jackson实验室购买,并在SPF级动物房进行繁殖饲养,小鼠3~5只/笼,自由饮水和饮食,环境温度19~22 ℃,相对湿度40%~60%,维持12 h光照/12 h黑暗的昼夜节律。小鼠饲养到8周后开始进行实验,实验动物许可证:SYXK(鲁)2018 022,所有行为学实验均于滨州医学院附属医院动物行为学实验室进行。
1.1.2主要试剂与仪器 兔抗BDNF单克隆抗体(英国Abcam公司);鼠抗β-actin单克隆抗体(美国Cell signaling公司);鼠抗TH抗体(美国immunostar公司);羊抗兔二抗IR Dye800CW,驴抗鼠二抗IR Dye680LT,ALexa fluor 488山羊抗兔荧光二抗、ALexa fluor 546驴抗鼠荧光二抗(美国Thermo Fisher公司)。双红外激光成像系统Odyssey Sa(美国Li-COR公司)。共聚焦显微镜购自日本奥林巴斯有限公司(FV1200)。总RNA提取试剂盒(美国Omega公司);RNA反转录试剂盒(大连宝生物工程有限公司);RIPA裂解液(上海碧云天生物技术有限公司);Real-time PCR仪(StepOnePlus)(美国麻省ABI公司)。
1.2 方法
1.2.1实验步骤 小鼠随机分为Control组和CUS组,每组10只。CUS组单笼饲养,方法参照文献[11],对照组3~5只/笼,不给于任何干预,放置在另一房间。CUS结束后,小鼠进行糖水偏好实验和强迫游泳实验检测CUS的效果;通过嗅觉偏好测试和雌鼠尿液嗅实验检测CUS对小鼠性行为的影响。小鼠进行自主活动实验检测小鼠的活动能力。最后小鼠断头取脑,提取小鼠VTA脑区组织,检测BDNF蛋白及mRNA的水平。
1.2.2CUS抑郁模型的建立 CUS抑郁模型参考文献的方法[11],CUS组给予21 d CUS结合单笼饲养:第1、8、15天束缚2 h,第2、9、16天给与24 h光照,第3、10、17天电击10 min(0.3 mA电击2 s,间歇16 s,共10 min),第4、11、18天夹尾15 min,第5、12、19天高台30 min,第6、13、20天给与24 h湿盒并倾斜45°,第7、14、21 天冷水游泳(8 ℃)。整个应激在尽力减少小鼠不舒适性的前提下让刺激达到最大的不可预知性,应激结束后经抑郁样行为实验评判模型是否成功。
1.2.3糖水偏好实验 小鼠在进行糖水偏好实验前先适应双瓶水1周。然后小鼠在居住笼中进行测试,测试前小鼠剥夺饮水5 h,然后小鼠笼中一侧放平时用的饮水,另一侧放置饮水配置的1%的蔗糖水,测试夜间12 h内小鼠摄取的饮水量和糖水量,然后计算糖水偏好指数(糖水偏好指数=糖水消耗/总液体消耗×100%),糖水偏好指数反映小鼠快感缺乏程度。
1.2.4强迫游泳实验 小鼠在测试房间适应2~3 h后开始进行强迫游泳实验,实验装置为一个高度25 cm、直径10 cm的透明树脂圆筒,实验时注入深度为15 cm、温度为24 ℃的自来水,将小鼠放置进水中,放置小鼠时要避免小鼠头部入水,用摄像头记录小鼠6 min的行为视频,其中前2 min为小鼠适应阶段,分析小鼠后4 min的静止不动时间。以小鼠在绝望环境中试图逃脱又无法逃脱的状态评判小鼠的抑郁程度,每只小鼠都需更换新水。
1.2.5自主活动实验 小鼠在测试房间适应2~3 h后开始进行自主活动测试。小鼠放置在40 cm×40 cm×40 cm的旷场装置中自由探索30 min,通过装置上方摄像头跟踪记录小鼠的运动,然后通过Anymaze软件对小鼠运动的距离进行分析。
1.2.6嗅觉偏好测试 参照文献[12]的方法测试前先要进行适应1 d,小鼠放置于装置中自由探索15 min,允许它们能够自由探索整个装置,以便排除对一侧有偏好的小鼠。接下来的2 d,测试小鼠在此装置中对发情期雌鼠污染过的垫料或者雄鼠污染过的垫料以及干净垫料的偏好(垫料的顺序需要在小鼠之间进行平衡)。10 min适应之后,30 ml干净的垫料放置于一侧的塑料杯中,另一侧放置相同量的污染过的垫料,两个塑料杯分别放在2个箱室的一个角落。小鼠自由探索5 min。记录小鼠分别与两个杯子交互的时间和在两侧箱室的时间,通过Anymaze软件对小鼠运动的轨迹进行记录。
1.2.7雌鼠尿液嗅实验 实验开始前,小鼠单笼适应2~3 h。然后笼子中放入一个灭菌的棉签适应1 h。整个实验都要在灯光昏暗的房间进行,亮度为3 lux。实验开始后小鼠笼中放置蘸有水的棉签测试3 min,测试蘸有水的棉签45 min后,小鼠笼中放置蘸有来自发情期雌鼠的尿液的棉签测试3 min。3 min测试期间记录小鼠嗅闻棉签的时间。实验中需要排除在笼中不动,不闻嗅棉签的小鼠。
1.2.8Western blot CUS结束后,小鼠断头,并在冰上迅速分离海马,置液氮中速冻,-80 ℃保存备用。取出海马用含1% PMSF的RIPA裂解液进行裂解,然后加入5×上样染料,沸水煮10 min,然后用12%或15%的SDS-PAGE胶进行分离,并转到PVDF膜上,膜用TBST buffer(20 μmmol/L TRIs-HCl,pH7.4,150 μmmol/L NaCl,0.1% Tween-20)配制的5%脱脂奶粉封闭1 h,然后经过一抗(兔抗BDNF 1 ∶500,鼠抗β-actin 1 ∶1 000)过夜孵育,加荧光二抗(羊抗兔1 ∶5 000,驴抗鼠1 ∶5 000)室温孵育1 h,经Odyssey Sa双红外激光成像系统成像并进行灰度识别分析。
1.2.9免疫荧光 脑片制备C57BL/6小鼠,4%水合氯醛深度麻醉后,4%多聚甲醛固定,取脑组织,经30%蔗糖水脱水进行冰冻切片,厚度40 μm。免疫荧光染色:取VTA脑区的脑片经封闭液封闭后,加入稀释后的一抗(兔抗BDNF 1 ∶200,鼠抗TH 1 ∶1 000)4 ℃孵育过夜,加入二抗混合液(ALexa fluor 488山羊抗兔荧光二抗1 ∶400、ALexa fluor 546驴抗鼠荧光二抗1 ∶400)室温避光孵育4 h,抗猝灭封片剂封片,最后用共聚焦观察并拍照。
1.2.10RNA提取、cDNA合成及Q-PCR 按照总RNA提取试剂盒说明书提取VTA总RNA,然后利用RNA反转录试剂盒将RNA反转录合成cDNA,最后用AceQ qPCR SYBR Green Master Mix试剂盒进行Q-PCR检测相关基因表达水平。反应体系及计算基因相对表达量方法参考文献[11]。
2 结果
2.1 CUS后小鼠表现出抑郁样行为小鼠进行21 d的CUS后,通过糖水偏好实验,强迫游泳实验检测CUS后小鼠的表型,测试示意图见图1A。结果显示CUS组糖水偏好降低,差异有统计学意义(t=2.336,P<0.05),见图1B。强迫游泳结果显示CUS组小鼠不动时间长于Control组,差异有统计学意义(t=4.273,P<0.05),见图1C。小鼠自主活动结果显示CUS组小鼠与Control组小鼠比较,差异无统计学意义,见图1D、E。Shapiro-Wilk检验各组数据均符合正态分布。
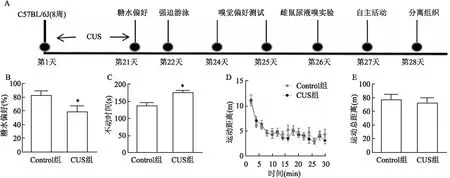
图1 小鼠抑郁样行为测试
2.2 CUS损害小鼠的性行为上述结果已经证实CUS后小鼠表现出抑郁样行为,接下来进一步通过小鼠嗅觉偏好测试实验和雌鼠尿液嗅实验检测抑郁小鼠的性行为表现,小鼠嗅觉偏好测试示意图见图2A。结果显示,Control组小鼠在雌鼠垫料一侧的时间和在雄鼠垫料一侧的时间差异有统计学意义(t=1.801,P<0.05);而CUS组小鼠在雌鼠垫料一侧的时间和在雄鼠垫料一侧的时间无统计学差异(t=0.618,P>0.05),见图2B、C。Control组小鼠与雌鼠垫料交互的时间和与雄鼠垫料交互的时间差异有统计学意义(t=2.996,P<0.05);而CUS组小鼠与雌鼠垫料交互的时间和与雄鼠垫料交互的时间差异无统计学意义(t=0.643,P>0.05),见图2D。雌鼠尿液嗅实验结果显示Control组小鼠和CUS组小鼠闻嗅沾有水的棉签的时间无差异,CUS组小鼠对雌鼠尿液闻嗅的时间减少,差异有统计学意义(t=2.579,P<0.05),见图2E;每只小鼠闻嗅沾有水的棉签的时间和沾有雌鼠尿液的时间,Control组中2只小鼠不动,CUS组1只小鼠不动,需要排除,见图2F。
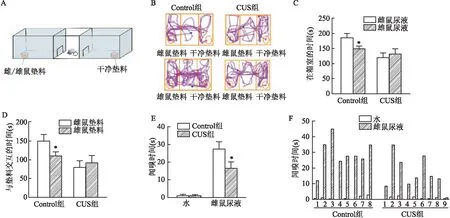
图2 CUS后小鼠性行为测试
2.3 CUS后小鼠VTA脑区BDNF的表达下降对C57小鼠进行免疫组化测定VTA脑区BDNF与神经元的共标情况。BDNF为绿色荧光,TH为红色荧光,BDNF和TH两种蛋白重合之后呈现黄色,见图3,结果表明VTA脑区BDNF基本存在于TH神经元中。
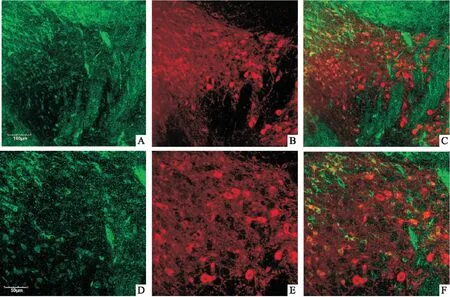
图3 VTA脑区BDNF和TH免疫荧光双标结果
行为测定结束后,取小鼠VTA脑区组织测定BDNF蛋白和mRNA的表达,结果显示,与Control组比较,CUS组BDNF蛋白表达量降低,见图4A,数据统计分析结果差异有统计学意义(t=9.387,P<0.05),见图4B。BDNF总mRNA及Exons mRNA表达量结果显示,与Control组比较,CUS小鼠VTA脑区BDNF总mRNA表达量下降(t=4.652,P<0.05),见图4C;CUS组BDNF Exon Ⅰ mRNA表达量下降(t=4.557,P<0.05),见图4D;Exon Ⅱ mRNA表达量下降(t=3.092,P<0.05),见图4E;Exon Ⅳ mRNA表达量无变化(t=0.919,P>0.05),见图4F;Exon Ⅵ mRNA表达量无变化(t=0.114,P>0.05),见图4G。Shapiro-Wilk检验各组数据均符合正态分布。
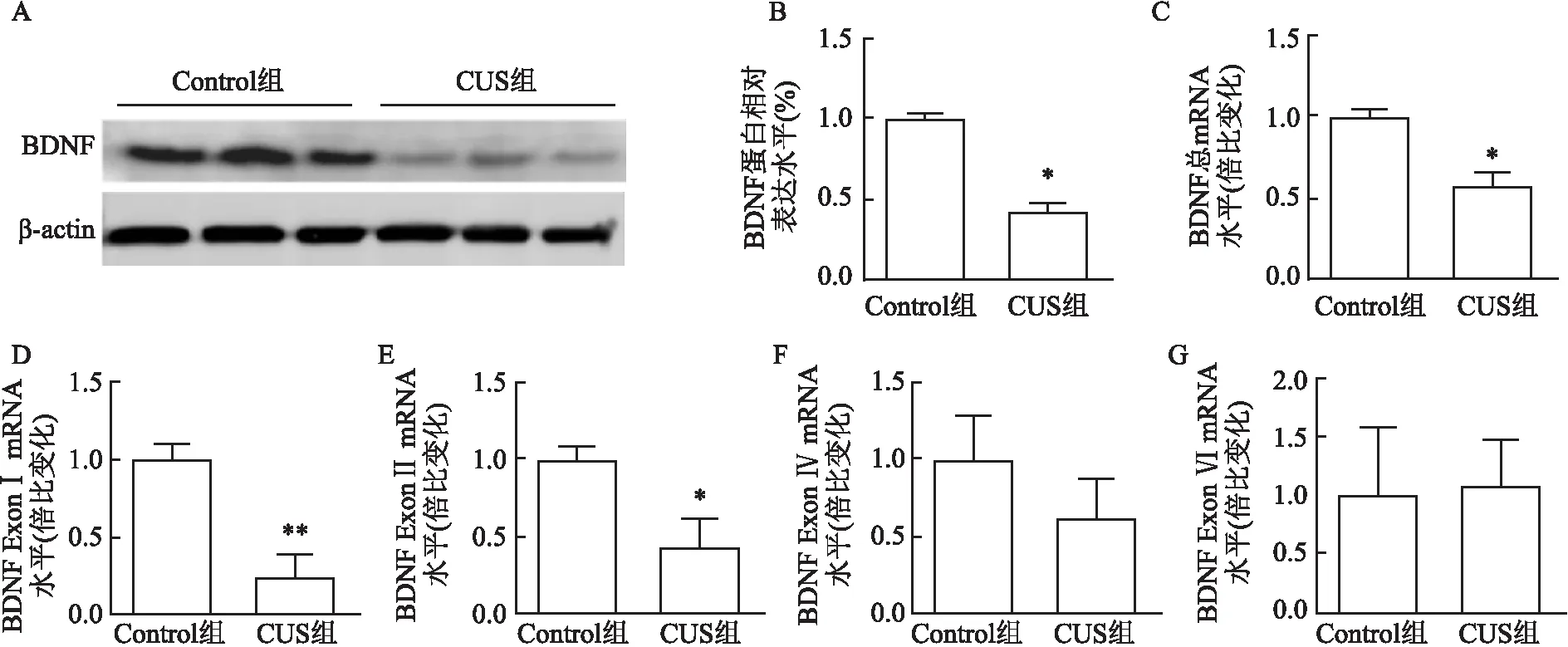
图4 CUS组和Control组VTA脑区BDNF蛋白表达和mRNA表达水平
3 讨论
性行为在哺乳动物和其他物种的繁殖中发挥重要的作用。性爱过程分为两个阶段,欲望阶段和完成阶段。欲望阶段对于动物选择一个合适的配偶至关重要。性爱行为的两个阶段都需要动物的感官参与。啮齿类动物利用他们的嗅觉来控制性爱行为[1]。本研究中通过对雄性小鼠性行为相关的嗅觉行为的测试,检测CUS致小鼠抑郁对小鼠性行为的影响。雌鼠尿液嗅实验和小鼠嗅觉偏好测试实验是性爱过程第一阶段欲望阶段的检测,发现CUS致小鼠抑郁后,小鼠的性行为受损。性行为相关的神经肽和神经递质在多个脑区调控性行为,如VTA、伏隔核(NAc)、前额叶皮层(mPFC)等。VTA脑区是调控性奖赏行为的主要脑区。多巴胺是一种受压力应激很大的神经递质,它与感觉运动功能、激励动机、奖赏进程、强化学习等相关[13]。多巴胺神经元在奖赏的识别和与奖赏相关的动机行为中发挥着关键的作用。VTA-多巴胺环路系统处理情感、动机以及与社会奖赏相关的更多的认知方面的需求。研究[4]发现在性行为活动的奖赏属性中多巴胺能神经元被激活。慢性应激降低VTA-多巴胺环路的活性,从而导致神经元的退化或局部小胶质细胞的激活[8]。
BDNF是大脑中含量最丰富、分布最广的一种神经营养因子,不仅在早期发育中,而且在成年大脑中都被认为是神经元突触可塑性、存活和分化的主要调节因子[5]。研究[6]报道BDNF在前额叶皮层、海马、VTA及NAc的抑郁症的发生发展和抗抑郁治疗中起重要作用。早期的社会行为能够调控BDNF水平和BDNF甲基化[14]。文献[7-8]报道BDNF调控社交行为。在雌鼠特异的社交行为中,BDNF在OXY神经元中调控基因转录和重塑[15]。性行为影响VTA脑区BDNF的表达[10]。BDNF能够调控动机行为并影响性行为[7-9],应激会影响VTA-多巴胺的重塑和连接性[4]。CUS行为是一种具有预测效果、表面效度、结构效度的抑郁动物模型。本研究证实CUS所致抑郁小鼠性行为受损,VTA脑区BDNF与标记多巴胺神经元的TH共存,且VTA脑区BDNF蛋白表达和mRNA表达减少,说明VTA脑区BDNF的表达参与了性行为的调节。在后续的研究中会利用BDNF转基因小鼠及DAT-cre转基因小鼠进一步研究VTA脑区多巴胺神经元中BDNF敲除对小鼠性行为的影响。
综上所述,本研究证实CUS所致的抑郁小鼠性行为受损,并且CUS能降低VTA脑区BDNF的表达。提示VTA脑区BDNF参与性行为的调控,但其发挥作用的机制还需进一步的研究。
