基于基因组学与代谢组学分析肠道菌群及其代谢物改变与心力衰竭发生的相关性
2022-03-31李丽,张昕,邹琳
李 丽,张 昕,邹 琳
心力衰竭(简称心衰)患者多数预后不佳,有临床症状患者的5年存活率与恶性肿瘤相仿,且心衰的发病率持续增长,正在成为21世纪最重要的心血管病症之一。近年来,胃肠道系统与心衰发生的相关性日益受到关注。研究[1]证实,由右心衰导致的血流动力学问题,与心衰和预后不良有关,可能的病理机制为肠道有害菌群生长,有益菌群减少,菌群代谢物氧化三甲胺(trimethylamine oxide,TMAO)增多[2]。该研究通过制作异丙肾上腺素(isoproterenol,ISO)诱导的心衰大鼠模型,对比心衰组与对照组肠道菌群和血清中TMAO水平的差异,探讨肠道菌群参与心衰的发生发展的途径,为指导临床心衰治疗提供新思路。
1 材料与方法
1.1 一般资料60只清洁级3月龄的Wistar雄性大鼠,体质量230~250 g,由内蒙古大学实验动物中心提供。ISO购自大连美仑生物有限公司;超纯水Mill-Q(美国Millipore公司)、彩色多普勒超声诊断仪(IE-33)购自飞利浦电器科技集团(中国)有限公司;高效液相色谱仪(AB SciexExionLCTMAD)、质谱仪(AB Sciex QTRAP®6500+)、粪便DNA提取试剂盒(天根)、紫外分光光度计购自上海精密科学仪器有限公司;引物由上海生工生物有限公司合成;Bio-rad T100梯度PCR仪、PCR产物纯化试剂盒(GeneJET胶回收试剂盒)购自美国Thermo Scientific公司;建库试剂盒购自美国Illumina公司、高通量测序仪(NovaSeq 6000)、NovomMgic云平台等。
1.2 方法
1.2.1Wistar大鼠心衰模型的建立 60只雄性Wistar大鼠随机分为心衰组和对照组,每组各30只,并编号。心衰组予以腹股沟皮下注射ISO,对照组注射生理盐水。用0.9%生理盐水溶解粉剂ISO,浓度为20 g/L,按9 ml/(kg·d)注射,隔天1次,共注射2次,为预防皮肤坏死,第2次注射另一侧,所有大鼠用药后正常进食和活动,饲养6周[3]。注射ISO后,心衰组3只大鼠死亡,均于注射药物后24 h内死亡。对照组未注射ISO,无动物死亡。模型成功的标准:大鼠左心室射血分数(left ventricular ejection fraction,LVEF)比对照组均值降低20%以上[3]。造模结果:心衰组共有27只大鼠存活,有6只不符合心衰标准,舍弃,余21只造模成功。
1.2.2超声心动图检查 造模6周后,用10%的水合氯醛腹腔注射麻醉。麻醉成功后,将大鼠四肢及头部固定在木板上,取仰卧位,用备皮刀将大鼠胸部体毛剃除干净。由同一位有经验的彩超医生用飞利浦彩色超声诊断仪的S4-2高频探头,在二维超声引导下,选取大鼠左室乳头肌短轴切面,测量左室舒张末期内径(left ventricular end diastolic diamete,LVEDD)、左室收缩末期内径(left ventricular end contractile diameter,LVESD)、LVEF、短轴缩短率(fractional shortening,FS)。每只大鼠测8个心动周期,取其平均值。
1.2.3高效液相色谱串联质谱法测定血清中TMAO水平 留取标本前,将大鼠禁食一夜,次日将大鼠用水合氯醛麻醉后,开腹,找到腹主动脉,采集空腹血样,静置30 min后,-4 ℃,3 000 r/min 离心15 min,分离出上层血清,冻存于-80 ℃冰箱中待测。使用TMAO标准品制备浓度为1 mg/ml混标线性母液,使用乙腈稀释线性母液得到系列浓度分别为100 000、50 000、10 000、5 000、1 000、500、100、50、10、5 ng/ml的工作液。配制一定浓度的Creatinine-d3和L-Carnitine-d9溶液,混匀得到内标溶液。将样本稀释后,涡旋混匀,离心,取上清,加入混合内标的乙腈溶液,涡旋混匀,离心,取上清液向高效液相色谱串联质谱仪中进样进行分析[4]。
1.2.4肠道微生物检测与生物学分析 腹主动脉取血后,迅速留取盲肠粪便,速置于液氮中冷冻,保存于-80 ℃冰箱中,用粪便DNA提取试剂盒提取粪便中的DNA,紫外分光光度法检测DNA的浓度和纯度,使用波碎仪将检测合格的DNA样品随机打断成约350 bp的片段,然后通过末端修复、加测序接头、纯化、加A尾、PCR扩增等步骤完成文库构建。库检合格后,按照有效浓度及目标数据量的需求,把不同文库pooling后进行高通量测序[5]。对测序得到的下机数据进行拼接和质控,得到高质量测序数据,再进行嵌合体过滤,得到可用于后续分析的有效数据,对所有样本的有效数据以97%的一致性进行OTUs(Operational Taxonomic Units)聚类,然后对OTUs的序列通过与数据库Silva132比对,进行物种注释。使用R软件(Version 2.15.3)绘制稀释曲线,使用Qiime软件(Version 1.9.1)计算α多样性指数,绘制α多样性盒图;为了寻找各分类水平(界、门、科、目、纲、属、种)下,组间的差异物种,使用R软件做组间的t检验,找出差异显著(P<0.05)的物种。默认展示门水平的结果,若门水平无显著差异物种则展示下一个层级,以此类推。使用R软件进行两组间差异显著性的Anosim分析,检验组间差异是否大于组内差异,来验证分组的合理性。使用LFfSe软件进行线性判别分析(lineardiscriminatanalysis,LDA)默认预设值为4,即认为组间具有显著差异。使用R软件(Version 3.1.0)绘制FAPROTAX聚类热图,分析两组大鼠粪便菌群功能差异。
2 结果
2.1 大鼠心脏结构及功能比较与对照组比较,心衰组LVEDD、LVESD增大,LVEF和FS降低,差异有统计学意义(P<0.05)。见表1,图1。
表1 两组大鼠心脏结构及功能
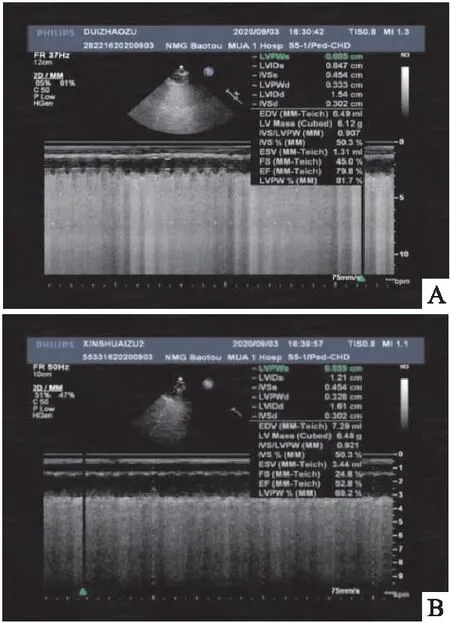
图1 两组大鼠心功能检查情况A:对照组;B:心衰组
2.2 血清TMAO含量检测结果与对照组比较,心衰组血清中TMAO含量升高[(373.38±107.96) ng/mlvs(957.74±71.35) ng/ml,P<0.05]。
2.3 两组大鼠肠道粪便高通量测序结果
2.3.1微生物注释结果与分类特征 每组送检10份样本,共获得268 182个序列,通过与数据库Sil-va132比对,进行物种注释,并对不同分类层级统计发现:4 699个OTUs中,能够注释到数据库的OTUs数目为4 699(100.00%),注释到界水平的比例为100.00%,门水平的比例为83.78%,纲水平的比例为81.68%,目水平的比例为71.85%,科水平的比例为58.08%,属水平的比例为30.01%,种水平的比例为3.30%。物种丰度聚类热图分析两组大鼠粪便主导菌群:根据物种注释结果,选取每个样本或分组在门水平上最大丰度排名前十的物种,生成物种相对丰度柱形累加图,以便直观查看各样本在同一分类水平上,相对丰度较高的物种及其比例。门水平物种相对丰度柱形图(见图2),图中可以见到两组排名前6位的物种一致,含量不同。肠道菌群分类特征为:在门水平上,占据主导地位的主要包括厚壁菌门、拟杆菌门、放线菌门;在属水平上的优势物种为乳杆菌属、Allobaculum属、杜氏杆菌属。得到OTUs后,绘制稀疏曲线(见图3)可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度,当曲线趋向平坦时,说明测序数据量渐进合理,本研究结果中各曲线渐近平坦,测速数据量达到预期。

图2 门水平上的物种相对丰度柱形图

图3 稀释曲线图
2.3.2两组粪便样本菌群多样性与差异物种分析 经α多样性分析,两组ACE指数(P=0.68)、Goods Coverage指数(P=0.47)、Chao指数(P=0.49)、Observed Species指数(P=0.82)、Shannon指数(P=0.71)、Simpson指数(P=0.65),差异均无统计学意义,表明两组间在物种多样性上无显著差异。见图4。
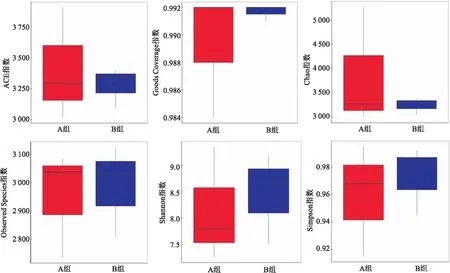
图4 Alpha多样性分析各指数箱式图
PCoA结果显示,两组基于Weighted Unifrace的对照组及心衰组各10个标本,每组选取3个样本作图,A为心衰组,B为对照组,下同横坐标为从某个样品中随机抽取的测序条数,纵坐标为基于该测序条数得到的OTU数量β多样性差异无统计学意义(P>0.05)。见图5。
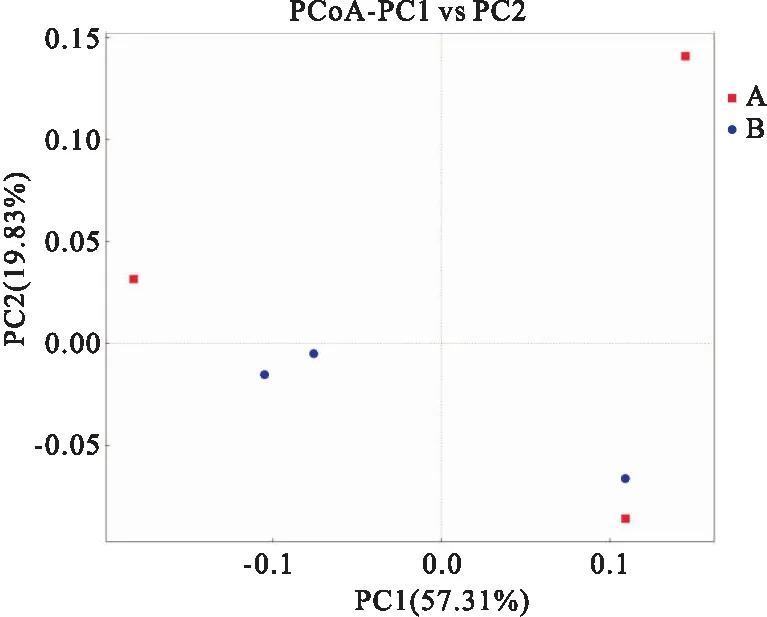
图5 β多样性的PCoA分析图
2.3.3两组间菌群差异物种分析 Anosim分析结果R=0.111 1,P>0.05,表明两组间有差异,但差异未达到统计学意义。t检验组间物种差异分析图显示两组间有差异的菌群前5位为Acidobacteriota门、维鲁士菌门、硝化螺旋菌门、Methylomirabilota门、泉古菌门(P<0.05)。其他菌群的比较差异无统计学意义(P>0.05),见图6。LEfSe分析显示心衰组与对照组间具有显著差异(LDA绝对值>4)的菌种为鼠乳杆菌(Lactobacillusmurinus)、Acidobacteriota、Bacteria,见图7。
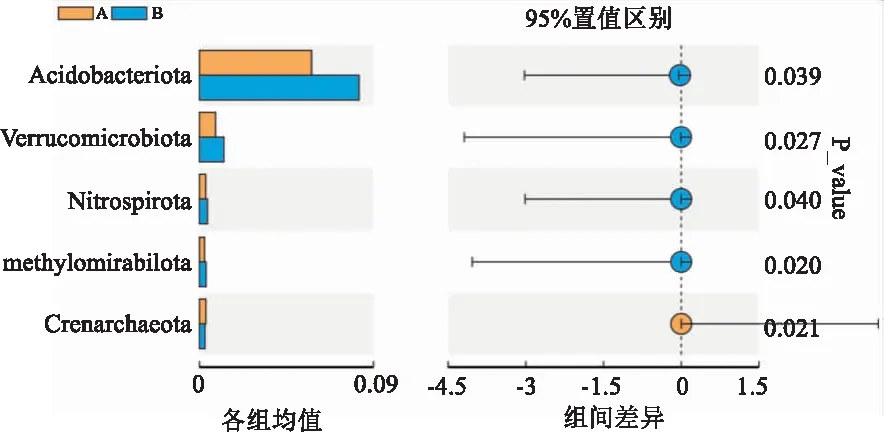
图6 t检验组间物种差异分析图
左图中每个条形分别表示在分组间丰度差异显著的物种在每个组中的均值。右图为组间差异置信度展示,展示结果的最右端是对应差异物种的组间显著性检验P值
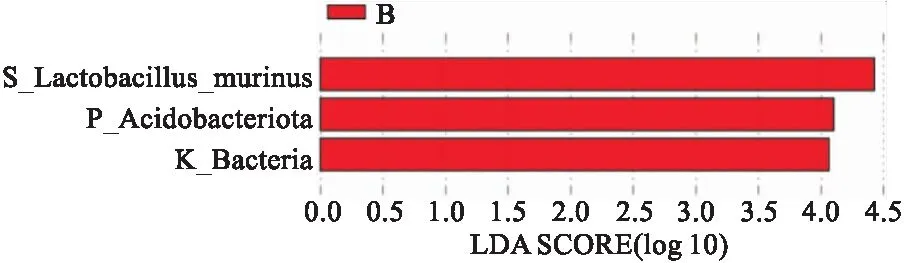
图7 LDA值分布柱状图
3 讨论
肠道菌群在调节肠道炎症及肠道免疫功能方面极其重要,肠道菌群紊乱与肠道炎症的发生直接相关[6]。实验动物和临床研究[7]表明,多种炎症机制可导致心脏重塑,功能障碍和慢性衰竭,促炎性生物标志物和细胞因子升高与心力衰竭的发病率和死亡率相关。本研究显示心衰组及对照组差异最显著的8类细菌中,Acidobacteriota、Bacteria这两种菌群范围太广,不具有分析意义,鼠乳杆菌、Acidobacteriota门、维鲁士菌门、硝化螺旋菌门、Methylomirabilota门、泉古菌门菌群丰度在心衰组中显著降低(P<0.05)。鼠乳杆菌和维鲁士菌门中的代表黏液曲霉菌具有提高肠道免疫功能,改善肠道炎症状态的功能[8-9]。目前对于Acidobacteriota门、硝化螺旋菌门、Methylomirabilota门及泉古菌门在临床上的研究非常少,对于其确切的作用尚不明确。2018年一项研究[10]发现,阻塞性睡眠呼吸暂停患者与非阻塞性睡眠呼吸暂停患者的支气管肺泡灌洗液的微生物组谱出现了差异,差异菌群中包括Acidobacteriota门,但无法确认Acidobacteriota的作用。2020年一项关于癌性和非癌性卵巢组织之间细菌分布差异的研究[11]显示,泉古菌门在癌性卵巢中明显减少,该菌同样在心衰组中明显减少,意味着泉古菌门与卵巢癌及心衰负相关。综上,肠道菌群可能通过降低肠道免疫功能及使肠道处于炎症状态,进而参与心衰的发生发展。
研究[12]证实,TMAO可促使小鼠心肌细胞横管网络损伤和Ca2+操纵功能障碍,影响心脏收缩和舒张功能,从而促进心力衰竭的发生发展。本研究发现,心衰组大鼠血清TMAO水平明显升高(P<0.05),并且心衰组的拟杆菌亚种(0.001 163vs0.000 390)和肠杆菌科(0.004 763vs0.000 787)的平均丰度均高于对照组。相关研究显示虽然内在机制尚不清楚,但脱铁杆菌科、普沃雷氏菌科、肠杆菌科、拟杆菌亚种(B.thetaiotaomicron和B.fragilis)以及厚壁菌门中Erysipelotrichia类参与TMAO代谢[13]。因此,TMAO可能是肠道菌群参与心衰的发生发展的另一个重要途径。
本研究显示,与对照组比较,不论是α多样性还是β多样性,心衰组肠道菌群物种组成多样性无明显差异,说明心衰的发生发展可能与肠道菌群多态性以及整体比例的失衡无关,但不能排除样本量不足导致的假阴性。
本研究也存在着一定的局限性,首先,动物模型不一定全面模拟心衰恶病质患者的肠道情况。第二,大鼠被注射ISO后心率加快,从而致使心肌损伤,这样的病理生理过程制造的心衰模型不能全面代替临床上多见的如基因、病毒、酒精、缺血等原因所致的心衰。
