亚麻籽蛋白特性及营养价值分析
2022-03-30马德坤王汝华杨子彤武淑芬高俊文陈宝仪郭庆彬
马德坤,王汝华,吕 筱,杨子彤,武淑芬,*,高俊文,陈宝仪,韩 钊,郭庆彬
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津兰瑞生物技术有限公司,天津 300384)
近年来,植物蛋白基食品浪潮不断兴起,发展势头迅猛,新型产品层出不穷[1]。动物蛋白缺点的暴露以及对植物蛋白认识的深入使得植物蛋白成为国内外食品领域关注的焦点。相对于动物蛋白,植物蛋白的生产利用具有绿色安全、环境友好和可持续发展的优势,同时植物种植成本低、生产蛋白能力高效,更加符合社会发展需求[2]。从植物源加工工业的副产品中分离有价值的蛋白质并实现其高效利用,不仅可以保证生产的成本效益、可持续性和环境友好性,而且更能保证食品的安全性[3]。
亚麻籽是亚麻的种子,作为油料作物在我国广泛种植,从榨油后的饼粕中提取蛋白质,可大大提高亚麻籽的整体利用度。已有研究证明,亚麻籽蛋白及其多肽具有抑制血管紧张素转换酶活性、抗菌、抗糖尿病等多种生理功效,极具开发潜力和研究价值,但目前仍未实现商业化应用[4]。成熟的亚麻籽为扁平的长圆形,由两个子叶包围着一个薄胚乳和一个光滑的种皮(外壳)组成[5]。亚麻籽外壳中主要含有亚麻胶、木酚素、膳食纤维和生氰糖苷(机体摄入后可降解为有毒的HCN)[6];亚麻仁中主要含有亚麻油和亚麻蛋白[7]。将亚麻籽的壳、仁分离,亚麻仁榨油后的饼粕用于提取蛋白,不仅提高蛋白提取率,同时还能达到脱毒目的;从亚麻籽壳中提取亚麻籽胶、木酚素和膳食纤维,如此可使亚麻籽的综合开发利用走向高效、低耗的良性轨道[8]。现已有一些物理或化学方法用于壳仁分离,亚麻仁较易获取[9-10]。
亚麻籽蛋白的提取方法多样,包括除盐沉淀法、碱提酸沉法和超声法等,目前国内外广泛使用的是碱提酸沉法[11],相较于其他方法,该方法可实现重复提取。Tirgar等[12]发现碱提酸沉法提取的亚麻籽蛋白的表面疏水性以及乳化能力明显高于酶法和酶溶剂萃取法;Kaushik等[13]首先使用水浸提法除胶,然后通过碱提酸沉获取蛋白,使用该方法得到的亚麻籽蛋白具有极高的纯度(90%以上)和较好的热稳定性,在pH 9.0缓冲液中溶解度可达76%,并且形成的乳液具有较高的酸稳定性;孔惠广等[14]以冷榨亚麻籽粕为原料,同样采用碱提酸沉法提取蛋白,并采用冷冻干燥和喷雾干燥两种方法对亚麻籽蛋白进行干燥,结果表明,干燥方式也会对蛋白的结构功能造成显著影响;许光映等[15]以脱壳亚麻籽为原料,使用碱提酸沉法提取蛋白,但其只通过正交试验确定了最佳工艺条件(提取pH值、温度、料液比和时间),并未对所提取蛋白的性质进行系统分析评价。
基于以上研究背景,本研究以亚麻仁为原料,通过机械冷榨结合有机溶剂浸提方法除亚麻油,然后利用碱提酸沉方法提取亚麻蛋白;采用多种分析表征手段,对所提取的粗蛋白各组分含量、溶解度、分子质量、持水性、持油性、乳化性以及氨基酸组成进行分析检测,同时借助在线酶解网站分析潜在的活性多肽序列。研究结果将为亚麻蛋白的高效利用提供参考,并为日后开发应用亚麻蛋白及其活性多肽提供数据支撑。
1 材料与方法
1.1 材料与试剂
脱壳亚麻仁购于日照孚洽贸易有限公司;大豆油购自当地超市。
正己烷、氢氧化钠、盐酸、硫酸(均为分析纯)天津市江天化工技术有限公司。
1.2 仪器与设备
Alpha-2LDplus真空冷冻干燥机 德国Charist公司;Kjeltec凯氏定氮仪 福斯(中国)有限公司;IS50傅里叶红外光谱(Fourier transform infrared,FTIR)仪美国尼高利仪器公司;Infinite M200 Pro酶标仪 瑞士Tecan公司;CS7小型榨油机 深圳奥斯达科技有限公司;DYY-8C电泳仪 北京六一仪器厂;TGAQ50热重分析仪美国TA仪器公司;90PLUS/BI激光粒度仪 美国布鲁克海文仪器公司。
1.3 亚麻籽蛋白提取
1.3.1 亚麻籽油脂的脱除
采用机械冷榨与有机溶剂浸提相结合的方法,使用小型榨油机将原料连续冷榨3 次,将榨油后饼粕磨碎成粉,与正己烷以液料比1∶5(mL/g)混合置于烧杯中,室温下搅拌(750 r/min、12 h),更换有机溶剂并继续搅拌12 h,最后将除油固体置于培养皿中,在通风橱内使残余有机溶剂完全挥发尽,即得到脱脂亚麻籽粉。
1.3.2 亚麻籽蛋白的提取
参考Lan Yang等[16]的方法并稍作修改,采用碱提酸沉法提取亚麻籽蛋白。具体如下:将脱脂亚麻籽粉与水按料液比1∶15(g/mL)混合置于烧杯中,使用0.1 mol/L NaOH溶液调节pH值至9.0,室温搅拌2 h,同时维持pH值恒定,搅拌结束后离心(4 ℃、8 000 r/min、20 min),取上清液置于烧杯中;使用0.1 mol/L HCl溶液调节pH值至4.2~4.6,离心(4 ℃、5 000 r/min、5 min),取沉淀,真空冷冻干燥即得亚麻籽蛋白。
1.3.3 亚麻籽蛋白理化性质测定
1.3.3.1 蛋白纯度及提取率的测定
参考GB 5009.5—2016《食品中蛋白质的测定》,采用凯氏定氮法测定粗提亚麻籽蛋白以及脱壳亚麻仁中的氮含量。亚麻籽蛋白纯度、提取率及得率分别按式(1)~(3)计算:


1.3.3.2 SDS-PAGE分析
根据孙媛[17]的改良Osborne分级法从亚麻籽粗蛋白中分离提取水溶性蛋白和盐溶性蛋白。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)对亚麻籽粗蛋白及2 种分级提取蛋白的分子质量进行分析。
1.3.3.3 溶解度测定
分别配制不同pH值的Tris-HCl缓冲溶液(0.1 mol/L,pH 2.0~11.0),取一定质量的亚麻籽蛋白分别溶于上述缓冲溶液中,蛋白质量浓度0.2 g/100 mL,室温下振荡60 min,离心(4 ℃、8 000 r/min、20 min),取上清液;采用考马斯亮蓝法测定上清液中蛋白质含量,进而计算不同pH值条件下亚麻籽粗蛋白的溶解度。
1.3.3.4 Zeta电位分析
将亚麻籽蛋白溶于0.1 mol/L Tris-HCl(pH 8.6)缓冲液中,蛋白质量浓度0.2 g/100 mL,经0.45 μm滤膜过滤后均分于8 支试管中,使用0.1 mol/L NaOH溶液或0.1 mol/L HCl溶液分别调节各试管pH值为2.0~8.0。使用激光粒度仪测定各溶液Zeta电位。每组平行3 次。
1.3.3.5 热重分析
借助热重分析考察亚麻籽蛋白的热稳定性。称取8 mg亚麻籽蛋白样品置于坩埚中,设置温度量程为20~600 ℃,升温速率为10 ℃/min。以温度(℃)为横坐标,样品质量损失率(%)为纵坐标,记录样品在加热过程中质量(m)随温度(T)的变化,从而得到热重曲线,并对质量损失率求一阶导(dΔm/dT)得到质量损失率的变化速率曲线。
1.3.3.6 FTIR光谱表征
采用FTIR和曲线拟合方法分析蛋白二级结构。测试光谱区域400~4 000 cm-1,分辨率4 cm-1。使用Omnic软件对谱图进行平滑,然后利用Peakfit软件选取1 600~1 700 cm-1(酰胺I带)区域求得二阶导,进行高斯拟合,根据各区域峰面积计算4 种二级结构相对含量。
1.3.3.7 持水力与吸脂力评价
将0.5 g亚麻籽蛋白置于预先称质量的离心管中,添加5 g蒸馏水,于2 500 r/min条件下涡旋振荡5 min,室温静置30 min后离心(5 000 r/min、10 min),小心倒出上清液,并再次称量带有沉淀物的试管质量,测定亚麻籽蛋白持水力。称取0.5 g 亚麻籽蛋白加入5 g大豆油按照上述步骤测定亚麻籽蛋白吸脂力。持水力与吸脂力分别按式(4)、(5)计算:

1.3.3.8 EAI和ESI测定
乳化活性指数(emulsifying activity index,EAI)和乳液稳定性指数(emulsifying stability index,ESI)是评价乳液形成能力和稳定性的重要指标。参考叶凤凌等[18]的方法并稍作修改。以磷酸盐缓冲液(含0.6 mol/L NaCl,pH 7.0、50 mmol/L)配制亚麻籽蛋白溶液(1.0 mg/mL),将大豆油分散于蛋白溶液(1∶4,V/V)中,室温下经乳化(10 000 r/min、1 min)和均质(500 bar、1 次),制备水包油型乳液。分别在均质后0 min和10 min,距离离心管底部5 mm处取40 μL乳液,分散于4 mL 0.1% SDS溶液中,室温静置10 min,于500 nm波长处测定吸光度,分别记为A0和A10,以SDS溶液作空白。亚麻籽蛋白乳液的EAI和ESI分别按式(6)、(7)计算:
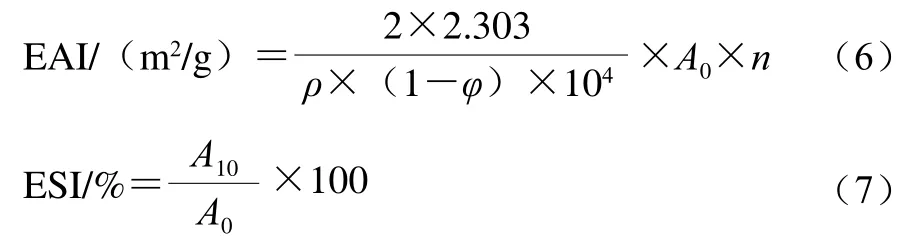
式中:ρ为乳化前蛋白溶液质量浓度/(g/mL);φ为油相体积分数(20%);n为稀释倍数(100)。
1.3.4 亚麻籽蛋白营养价值评价
1.3.4.1 氨基酸组成分析
氨基酸组成分析委托杭州研趣信息技术有限公司进行测定。
1.3.4.2 一级序列(部分)分析
结合酶解和高分辨生物质谱技术,对蛋白样品进行分析,该工作委托杭州景杰生物科技有限公司完成;利用NCBI蛋白数据库和MaxQuant软件分析样品蛋白一级序列(部分)片段。
1.3.4.3 活性多肽片段预测
借助BioPD数据库(http://www.uwm.edu.pl/biochemia/index.php/en/biopep)提供的在线酶解功能与活性多肽数据库,分别采用胰蛋白酶、胃蛋白酶、木瓜蛋白酶单独酶解以及复合酶解的方式,分析潜在的活性多肽片段。
1.4 数据统计分析
实验结果采用SPSS 20.0软件进行显著性差异分析,以P<0.05为显著性检验标准,所有结果均以平均值±标准误表示,采用Origin 8.5进行作图。
2 结果与分析
2.1 亚麻籽蛋白纯度与提取率
经凯氏定氮分析与计算,去壳亚麻籽仁蛋白质量分数为24.82%,经除油、提取所得蛋白纯度为98.86%,提取率为47.20%。Lan Yang等[16]使用碱溶酸沉法从亚麻籽饼粕中提取亚麻籽蛋白,纯度不足65%;Tirgar等[12]使用碱性分离结合纤维素酶处理和乙醇沉淀法提取的亚麻籽粗蛋白仍含有10%的非蛋白杂质。而本实验提取的亚麻籽蛋白具有更高的纯度和较高的提取率。其原因可能在于使用亚麻仁为原料,排除了亚麻籽外壳中大部分糖类物质对蛋白提取的干扰,机械榨油和有机溶剂结合的两步除油法也使油脂去除率较高。高纯度的蛋白意味着极低的油脂含量,这在工业应用中具有重要意义,因为这可减少蛋白制品中残余油脂氧化变质带来的感官及质量上的不良影响,延长产品保质期。此外,研究证实亚麻籽蛋白自身作为功能食品成分具有抗氧化活性,可进一步抑制变质,保护食品感官品质并提供自身营养价值[19]。
2.2 亚麻籽蛋白亚基组成
针对亚麻籽粕蛋白的结构已进行了相关研究。例如,Oomah等[20]通过SDS-PAGE分析发现亚麻籽蛋白中含有4 种主要条带(分别位于14、24、25 kDa和34 kDa);Tirgar等[12]报道亚麻籽蛋白主要条带分布于25~30 kDa及35~40 kDa,并提出20~27 kDa的条带对应蛋白碱性亚基,30~39 kDa的条带对应蛋白酸性亚基。不同品种亚麻籽蛋白亚基组成并非完全相同[21]。如图1所示,在亚麻籽蛋白的SDS-PAGE图谱中,21 kDa和33 kDa的谱带较为强烈,分别对应蛋白酸性亚基和碱性亚基,Nwachukwu等[22]研究结果中也有相似分子质量的2 条强烈谱带。全蛋白、水溶性蛋白和盐溶性蛋白条带没有明显差异,可能是由于样品在提取以及电泳前处理过程中,加样几乎为水溶性蛋白。然而三者条带强度存在差异,这种差异可能与蛋白含量及溶解度有关。此外,蛋白预处理也会导致蛋白电泳图谱的差异,例如,Perreault等[23]使用高静水压进行蛋白预处理,促使亚麻籽蛋白大小亚基结合形成聚集体,导致了高分子质量电泳谱带强度明显提高。

图1 亚麻籽蛋白的SDS-PAGE图谱Fig. 1 SDS-PAGE profile of flaxseed proteins
2.3 亚麻籽蛋白溶解度分析
蛋白质的溶解性与pH值密切相关,不同pH值通过影响蛋白颗粒的净电荷量以及颗粒之间的静电斥力,进而影响蛋白的溶解稳定性,溶解度最低时的pH值被认为是蛋白等电点(pI)。如图2所示,pH 4.0附近,蛋白溶解度最低,这是因为静电排斥作用减弱,蛋白颗粒稳定性下降,导致蛋白颗粒聚集或沉淀,表明亚麻籽蛋白pI约为4.0;当pH值远离pI时,随pH值的升高蛋白溶解度不断增加,pH 11.0溶解度高达68%,绝大部分蛋白处于溶解状态。蛋白溶解度曲线基本符合“V”字形,且蛋白在碱性条件下溶解性较酸性条件更优。

图2 不同pH值下亚麻籽蛋白的溶解度Fig. 2 Solubility of flaxseed protein at different pH values
2.4 亚麻籽蛋白Zeta电位分析
Zeta电位可以反映蛋白颗粒的带电性质,其绝对值越高,颗粒间的斥力越大。如图3所示,当pH值在4.0以下时,蛋白氨基发生质子化现象,蛋白颗粒带正电荷。在pH 4.0~5.0,Zeta电位达到0 mV附近,这与溶解度结果一致,再次说明亚麻籽蛋白pI位于此区间。随着pH值由pI持续升高,蛋白羧基基团电离强度随之增加,导致蛋白颗粒所带负电荷量显著增加[24]。
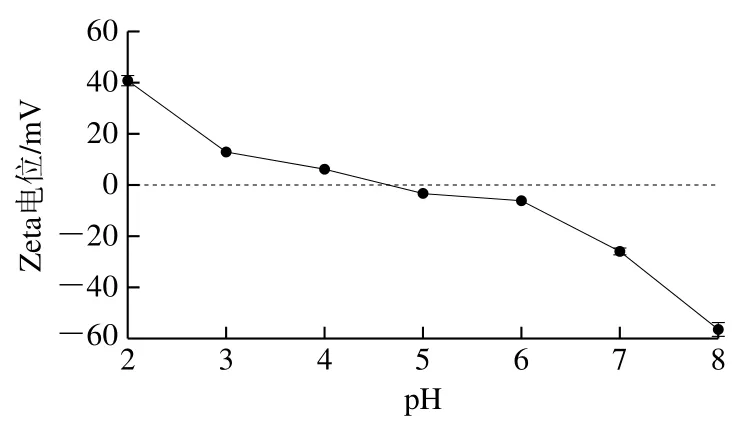
图3 不同pH值下亚麻籽蛋白的Zeta电位Fig. 3 Zeta potential of flaxseed protein at different pH values
2.5 亚麻籽蛋白热稳定性分析
如图4所示,亚麻籽蛋白主要有3 个热降解阶段。第1阶段位于20~150 ℃,质量损失约6.45%,在50 ℃左右出现一个明显的失重峰,这是由样品失水造成的。经过冷冻干燥,样品中的自由水很容易被去除,而结合水仍保留在干燥样品中,并且因干燥样品多孔结构而更容易吸湿,所以在加样过程中会吸收部分游离水,因此这一阶段的失水包括大部分的结合水和一部分游离水[25]。第2个热降解阶段位于200~500 ℃,此阶段质量损失约57.63%,失重峰出现于320 ℃左右,这一温度区间质量损失加快,说明在此过程中样品中的主要成分蛋白质发生化学结构降解。第3阶段位于500~600 ℃,质量损失约7%,此阶段的质量损失可能由于碳化导致的。
食品加工过程中经常使用热处理,而温度的控制则显得尤为重要,温度低时,达不到加工所需预期效果,温度高时,则可能造成某些物质分解,影响有效成分含量、产品品质及产生有害物质等。对亚麻籽蛋白进行热重分析,可以了解其热稳定性,结果表明,亚麻籽蛋白热稳定性良好,在300 ℃下不易分解,与展海军等[26]对大豆蛋白热稳定性测定结果相比,亚麻籽蛋白的热稳定性较好,更适于工业热加工处理。

图4 亚麻籽蛋白热重分析图Fig. 4 Thermogravimetric analysis of flaxseed protein
2.6 亚麻籽蛋白二级结构分析
分析蛋白质二级结构的方法有很多,其中FTIR光谱适用范围广,对样品蛋白纯度、质地、样品量等要求较低[27]。本实验所提取的蛋白在低pH值下溶解度较低,更适于在固体状态下使用FTIR光谱进行蛋白二级结构分析。红外谱图中的酰胺I带(1 600~1 700 cm-1)和酰胺III带(1 220~1 330 cm-1)常被用于分析蛋白质的二级结构,目前对于酰胺I带经过谱峰拟合后各子峰与二级结构对应关系的研究较为成熟。红外光谱中酰胺I带区域的吸收光谱主要是由C=O伸缩振动引起,蛋白质中含有丰富的C=O双键,其二级结构的变化会引起酰胺I带吸收光谱的变化,以1 600~1 639 cm-1为β-折叠,1 640~1 650 cm-1为无规卷曲,1 651~1 660 cm-1为α-螺旋,1 661~1 700 cm-1为β-转角作为定量指标,进而可以准确分析蛋白质的二级结构信息[28]。
如图5所示,经计算可知,α-螺旋、β-折叠、β-转角和无规卷曲结构的相对含量分别为14.58%、28.48%、41.42%、15.52%。本实验提取的亚麻籽蛋白含有较高比例的β-转角,α-螺旋和β-折叠结构相对含量之和略高于β-转角,无规卷曲相对含量较低。据报道,蛋白质分子中α-螺旋和β-折叠能够形成紧密的无空腔结构,而与α-螺旋和β-折叠结构相比,无规卷曲结构的构象稳定性和紧密程度则相对较差。因此,亚麻籽蛋白中较低含量的α-螺旋和β-折叠使其分子的无序性较高,结构更加疏松开放,表明亚麻籽蛋白的二级结构稳定性一般,这可能是由于除油过程中螺旋挤压对稳定结构造成破坏[29]。
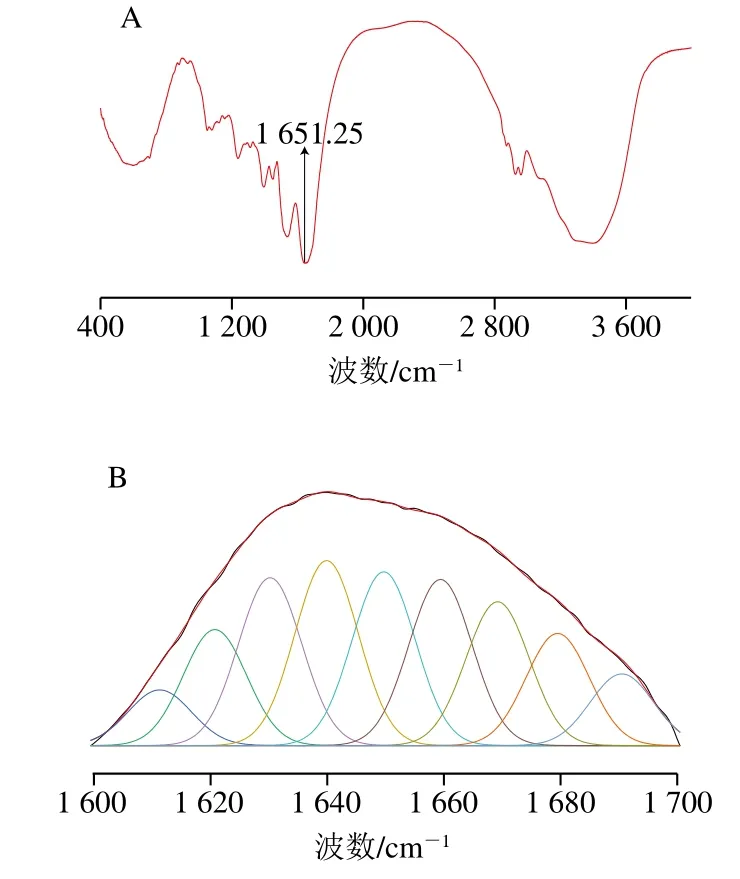
图5 亚麻籽蛋白FTIR谱图(A)和酰胺I带曲线拟合图谱(B)Fig. 5 FTIR spectrum (A) and curve fitting results of amide I band of flaxseed protein (B)
2.7 亚麻籽蛋白持水、持油能力评价
蛋白质的持油性、持水性和起泡性是蛋糕、肉制品、面包、冰激凌等食品加工过程中重要的特性和质量控制指标。蛋白质良好的持水性有利于提高焙烤面团的结构稳定性,而良好的吸油性能则有利于肉制品、奶制品等的加工生产。
与大豆蛋白等其他植物蛋白相比,亚麻籽蛋白的脂肪吸收能力较高,达5.288 g/g,这可能是由于其具有更高的亲脂性。脂肪吸收能力受到蛋白质中非极性氨基酸的影响,非极性氨基酸含量越高,亲脂性越强[13]。亚麻籽蛋白的持水力为1.175 g/g,本实验中亚麻籽蛋白提取后经冷冻干燥,亲水性相比其他方法要低得多,这可能归因于亚麻籽黏液的低残留率。从亚麻仁中提取的蛋白含酚类物质较少,这也是蛋白持水能力相对较差的原因之一[30]。良好的亲水性和亲油性可以更好地将亚麻籽蛋白作为表面活性成分应用于相关溶液中,有望为食品工业或者医药加工带来新的突破口,也可用于制备新型健康代餐食品。
2.8 亚麻籽蛋白乳化活性和乳化稳定性分析
蛋白多肽链上的两亲性氨基酸侧链可以吸附到油水界面上并包裹由均质化所形成的油滴,同时通过羧基和氨基的解离产生静电斥力发挥稳定液滴、防止聚集的作用。
由图6A可知,在pH值小于4.0和大于5.0时,蛋白颗粒之间的静电排斥作用阻止了油滴间聚合,提高了蛋白的乳化能力。静电排斥导致蛋白疏水性增大,这会导致界面上吸附的蛋白浓度增大,界面张力减小,乳液更稳定,同时足够多的蛋白分子吸附在油水界面形成高强度界面膜也更利于乳液的稳定。高乳化稳定性(ESI>80%,图6B)表明亚麻籽蛋白具有短期稳定食品乳剂的潜力。在pH 4.0~5.0范围内,蛋白颗粒表面净电荷减少,静电排斥力减弱导致油滴聚集,EAI和ESI均降低。此外,本研究结果还显示亚麻籽蛋白EAI与其溶解度呈正相关,ESI的变化趋势与EAI相似,这与刘娟[31]对文冠果种子蛋白乳化性的研究结果一致;但EAI数值稍低而ESI值明显高于其他研究结果[13-14],这可能是由于蛋白质提取条件存在差异,所得蛋白纯度以及蛋白微观结构也不同。

图6 不同pH值下亚麻籽蛋白的EAI(A)和ESI(B)Fig. 6 Emulsification activity index (A) and emulsion stability index (B) of flaxseed protein at different pH values
2.9 亚麻籽蛋白氨基酸组成分析
如表1所示,经过酸解处理,亚麻籽蛋白中共检出17 种氨基酸,色氨酸在酸解过程中被破坏,谷氨酰胺和天冬酰胺经酸解转换成谷氨酸和天冬氨酸。与大豆蛋白类似,亚麻籽蛋白富含天冬氨酸(9.32%)、谷氨酸(24.10%)、亮氨酸(5.95%)和精氨酸(10.11%),但含硫氨基酸蛋氨酸(1.53%)和半胱氨酸(2.07%)含量较低。就必需氨基酸而言,组氨酸(2.69%)、苏氨酸(3.40%)、缬氨酸(5.83%)和异亮氨酸(4.64%)均高于联合国粮食及农业组织/世界卫生组织(Food and Agriculture Organization/World Health Organization,FAO/WHO)的儿童推荐值(分别为1.9%、3.4%、3.5%、2.8%),亮氨酸(5.95%)、苯丙氨酸(5.76%)、赖氨酸(4.71%)和蛋氨酸(1.53%)含量稍低于FAO/WHO的儿童推荐值(分别为6.6%、6.3%、5.8%、2.8%),而除蛋氨酸外的所有必需氨基酸含量均高于FAO/WHO的成人推荐值(分别为蛋氨酸1.7%、苏氨酸0.9%、缬氨酸1.3%、异亮氨酸1.3%、亮氨酸1.9%、苯丙氨酸1.9%、赖氨酸1.6%、组氨酸1.6%)。此外,带负电荷的氨基酸如谷氨酸和天冬氨酸可通过螯合金属铁离子,抑制铁诱导的脂质氧化,从而有助于防止食品的氧化损伤;高精氨酸/赖氨酸比率(2.15∶1)有助于降低血液胆固醇水平和增强心血管健康;必需氨基酸占总氨基酸的比例高于30%,预示亚麻籽蛋白作为优越蛋白质来源的巨大潜力。由于酸水解造成色氨酸的破坏,因此未检测出其含量,但根据前人研究,亚麻籽蛋白中存在色氨酸且含量约为2%[32]。

表1 亚麻籽蛋白氨基酸组成Table 1 Amino acid composition of flaxseed protein
2.10 亚麻籽蛋白蛋白一级结构及在线酶解分析
本研究首先利用高效液相色谱-串联质谱法结合数据库检索对提取亚麻籽蛋白中可能存在的蛋白组分进行初步鉴定,然后通过在线酶解并与活性多肽数据库对比,对潜在活性多肽片段进行初步预测,为评估亚麻籽蛋白生理功效提供数据依据。
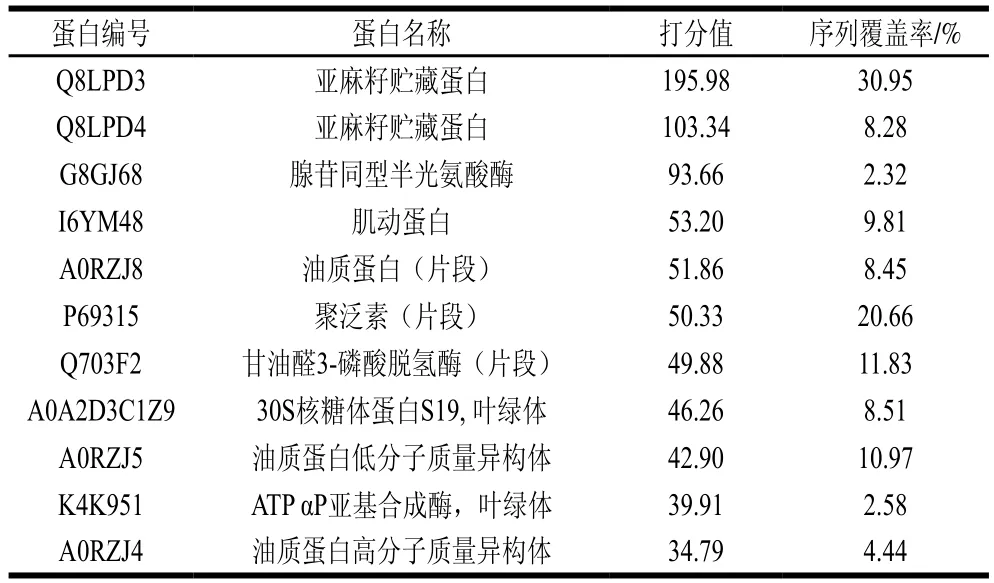
表2 亚麻籽蛋白组分初步分析Table 2 Composition of flaxseed meal proteins
由表2可知,通过BLAST检索与之相匹配的已知序列蛋白,提取的亚麻籽蛋白可能含有11 种已知序列蛋白组分,蛋白打分值依次降低。有报道称,亚麻籽蛋白中贮藏蛋白含量为10%~37%[28],编号Q8LPD3和Q8LPD4两种蛋白片段在数据库中对应一种亚麻籽贮藏蛋白。A0RZJ8、P69315、Q703F2、K4K951这4 种蛋白为部分覆盖,想要精确获得覆盖序列,需利用NCBI数据库,将蛋白名称下的序列全部下载,并利用原始测序数据,在MaxQuant软件上进行分析处理。
通过MaxQuant可视化分析得到亚麻籽蛋白一级序列部分片段,共计45 条片段序列,分别为:QIQEQDYLRSCQQK、DLPGQCGTQPSR、GGGQQSQHFDSCCDDLK、AVGSSPVR、DLPGQCR、QDIQQQGQQQEVER、DLPGQCGTQPSR、QEIQQQGQQQEVQR、AVFPSIVGR、DSYVGDEAQSK、VAPEEHPVLLTEAPLNPK、DLTDYLMK、GYSFTTTAER、SYELPDGQVITIGNER、EITALAPSTMK、IIAPPER、LSLSATR、VLPELNGKLTGMAFR、VPTANVSVVDLTCR、TLLFGEK、AASFNIIPSSTGAAK、VLPELNGKLTGMAFR、IGLDGFGR、ESTLHLVLR、EGLPPDQQR、EVGQEIQ、YEAGVVPPGAR、ETQPASENLAAAAK、ELIIGDR、EAYPGDVFYLHSR、IINEPTAAAIAYGIDK、AAEQAAR、QLAVETR、VLPELDGK、LTGMAFR、LGATAGLR、LITTWSR、LGINGFGR、TLLFGEK、AASFNIIPSSTGAAK、TLSDYNIQK、ESTLHLVLR、HPVGADSLDQAR、IQDKEGIPVGR、YVTGGHPAGGDSLDQAR。由于样品处理采用胰蛋白酶酶解,作用位点为精氨酸和赖氨酸,因此对应片段末端氨基酸均为K或R。此外,由于完整序列未知,在使用胰蛋白酶酶解时,得到的多肽片段长短不一,由于二级质谱依据分子质量进行匹配,片段过长过短都会影响匹配准确度,因此匹配范围设置为5~25 个氨基酸片段,小于5 个或大于25 个氨基酸的片段都被自动忽略。
蛋白样品在处理过程中已被胰蛋白酶酶解,对上述亚麻籽蛋白一级序列片段分别进行在线模拟酶解(http://www.uwm.edu.pl/biochemia/index.php/en/biopep),考察胃蛋白酶、木瓜蛋白酶单独酶解及二者复合酶解后产生活性多肽情况。

表3 亚麻籽蛋白酶解后潜在活性多肽片段Table 3 Potential active polypeptide fragments derived from linseed protease hydrolysis
通过与活性多肽数据库比对,由表3可知,亚麻籽蛋白经酶解后产生的潜在活性肽段多达47 条,均为二肽或三肽,表明亚麻籽蛋白酶解较为彻底。同时短肽更有利于吸收,这些活性片段具有较为广泛的生物活性,如降压、降糖、修护胃黏膜等,其中具有降糖或降压活性的多肽占比较大。据此推测,亚麻籽蛋白经体内消化酶解后,可产生多种活性肽段,为后续蛋白酶解制备活性多肽提供有益指导。
3 结 论
为实现亚麻籽蛋白的高效开发利用,本实验使用亚麻仁为原料,通过碱提酸沉法获得了高纯度的亚麻籽蛋白。研究表明,亚麻籽蛋白具有良好的热稳定性和作为天然乳化剂的潜力,良好的两亲性和碱溶性等理化特性为其工业开发应用奠定了基础。对蛋白进行改性处理,进一步提高其乳化活性,将有利于拓宽亚麻籽蛋白的应用范围。亚麻籽蛋白含有人体必需的8 种氨基酸,通过模拟人体消化系统进行在线酶解,证实其水解产物具有抗高血压、降血糖、抗氧化等功能活性,其潜在的营养价值具有客观的市场竞争力与吸引力。
