发酵玉米-豆粕饲料对蛋鸡小肠组织形态、消化酶活性和屏障功能相关基因表达的影响
2022-03-30刘莹露王雅敏李景河郭丽娟闵育娜
刘莹露 王雅敏 李景河 吕 静 郭丽娟 闵育娜*
(1.西北农林科技大学动物科技学院,杨陵712100;2.铜川市动物卫生监督所,铜川629000)
玉米-豆粕型饲粮是蛋鸡养殖中最常见的饲粮。目前,随着我国蛋鸡养殖业的快速发展,饲料原料缺口进一步扩大,人畜争粮局面愈发严重[1]。玉米、豆粕和麸皮等饲料原料中含有多种抗营养因子,这使得营养物质的利用率下降,并对蛋鸡的机体健康造成负面影响[2]。如何提高饲料消化利用率,改善饲料营养品质,是实现蛋鸡高效养殖的关键所在。发酵饲料是指使用国家相关法规允许使用的饲料原料和微生物,通过人工控制发酵条件,利用微生物自身的代谢活动将蛋白质、糖类和脂肪等大分子营养素降解为多肽、有机酸等小分子物质,最终形成富含大量活菌和功能性代谢产物的生物饲料[3]。此外,微生物发酵是消除饲料原料中抗营养因子的一种有效方法[4]。发酵饲料工艺分为固态发酵和液态发酵,其中固态发酵工艺的成本更低、污染更小[5],所以目前对家禽发酵饲料的研究大部分集中在固态发酵饲料上。相较于普通饲料,发酵饲料的营养特性使其能够促进畜禽生产性能和免疫力的提高[6-7],因此在养殖过程中可作为一种抗生素、化学添加剂等药物的替代品。Wu等[8]研究表明,饲喂发酵饲料能显著提高肉鸡的平均日采食量和平均日增重,且能显著提高肉鸡十二指肠的绒毛高度和绒隐比(绒毛高度/隐窝深度)。Zhang等[9]研究发现,饲粮添加4%和6%发酵饲料能增加肉鸡肠段长度,提高肠绒毛高度和降低隐窝深度。张孟阳等[10]使用蛋雏鸡作为研究对象,发现发酵饲料显著提高了雏鸡盲肠中乳酸杆菌丰度,同时显著降低了脱硫弧菌属、螺杆菌等致病菌的丰度,优化了肠道菌群结构。张俊[11]使用发酵饲料和灭菌发酵饲料作为试验材料,研究益生菌和发酵代谢产物对肉鸡肠道健康的影响,结果表明2个试验组肉鸡回肠黏膜分泌型免疫球蛋白A(sIgA)含量均显著提高,肠道免疫屏障得以增强。这些都说明发酵过程中产生的益生菌和代谢产物对肠道健康都有积极作用。目前,我国养殖业中发酵饲料的研发应及应用尚处于起步阶段,且关于益生菌发酵饲料调节家禽肠道健康的研究大部分集中在肉鸡上,而在产蛋鸡上的研究较少。因此,本试验采用固态发酵工艺,通过对发酵前后饲料菌群结构的检测,并结合蛋鸡饲养试验,研究不同添加水平的发酵饲料对蛋鸡小肠组织形态、消化酶活性和屏障功能相关基因表达的影响,为发酵饲料在蛋鸡生产中的应用提供理论依据。
1 材料与方法
1.1 试验设计
选取360只健康、体况和产蛋性能基本一致的22周龄京粉6号蛋鸡,随机分为4个组,每组用不同比例的发酵饲料替代基础饲粮中的未发酵饲料原料,替代水平分别为0(对照组)、4%、6%和8%,每组6个重复,每个重复15只鸡。试验期29周,其中预试期4周,正试期25周。饲养试验在陕西省铜川区春满园蛋鸡无抗养殖示范场进行。鸡舍条件为:4层阶梯式A字型鸡笼,每3只鸡饲养于同一笼内。将相同组、不同重复的鸡分散排列于鸡舍的不同空间。鸡舍通风良好,温度控制在15~22 ℃,相对湿度控制在30%。保证鸡群自由采食、饮水,每日刮粪板清粪,光照时长为16 h。每日08:00、11:00和16:00进行人工喂料,随时检查鸡群健康情况,及时挑出死淘鸡只并做好记录。常规免疫、消毒。
1.2 饲粮制备
1.2.1 发酵工艺
发酵所用菌粉购自山东某生物科技有限公司,其中含有2×109CFU/g芽孢杆菌、3×109CFU/g乳酸菌和5×108CFU/g酵母。在进行发酵饲料前按说明书要求,将复合益生菌菌粉以1∶40(质量体积比)的比例溶于37 ℃温水中,搅拌均匀,即得稀释混合菌液。发酵流程参考Shi等[12],根据试验鸡场内实际情况做适当调整。将稀释混合菌液加入到发酵底料(玉米60%、豆粕20%和麸皮20%)中充分混匀,调节饲料水分含量为30%。发酵罐中37 ℃好氧发酵24 h,然后将饲料转移到自封袋中,室温厌氧发酵5 d即可。另将37 ℃温水以30%比例加入发酵底料,充分混匀后厌氧放置5 d,作为对照。
1.2.2 饲粮配制
发酵饲料每周制备1次,每周统计蛋鸡采食量,以便对发酵饲料制备量进行调整。发酵前后饲料营养物质和抗营养因子含量的变化见表1。参照NRC(1994)蛋鸡饲养标准,结合试验鸡场内蛋鸡养殖实际情况设计玉米-豆粕型基础饲粮,饲粮组成及营养水平见表2。

表1 发酵前后饲料营养物质和抗营养因子含量的变化(风干基础)

表2 饲粮组成及营养水平(风干基础)
1.3 测定指标及方法
1.3.1 发酵前后饲料菌群结构
将发酵前后的饲料样品各取3份,每份样品50 g。将5 g左右样品放入-80 ℃超低温冰箱中保存。将冻存的饲料样品送至北京诺禾致源科技股份有限公司,采用16S rRNA高通量测序完成饲料菌群结构的测定。
1.3.2 小肠组织形态
试验结束时,从每个重复中随机选取1只健康的蛋鸡,每个组共6只鸡,处死后打开腹腔,用镊子将肠道小心取出,剪取小肠各段的中部2~3 cm,用装有0.9%生理盐水的注射器将肠道食糜轻轻冲净,冲净后的肠段置于含4%多聚甲醛溶液的10 mL离心管中固定过夜。将固定好的肠段经脱水、透明、切片、展片、苏木精-伊红(HE)染色和封片等程序后,在光学显微镜下观察。每个切片在不同视野里选取10根完整的绒毛和隐窝,分别测量各肠段绒毛高度和隐窝深度,并计算绒隐比。
1.3.3 小肠食糜消化酶活性
分别在35周龄和试验结束(50周龄)时,从每个重复中随机选取1只健康的蛋鸡,处死后取出肠道,将十二指肠、空肠和回肠前段的食糜挤到做好标记的冻存管中,液氮速冻。取10 mg食糜样本加100 μL生理盐水匀浆,2 500 r/min离心10 min取上清液,使用试剂盒(泉州市睿信生物科技有限公司)并参照说明书进行胰蛋白酶、脂肪酶和淀粉酶活性测定。
1.3.4 小肠黏膜屏障功能相关基因mRNA相对表达量
试验结束时,从每个重复中随机选取1只健康的蛋鸡,屠宰后取空肠前段2~3 cm,用无菌剪将肠段纵向剖开后,用预冷的生理盐水冲洗掉肠黏膜上附着的肠道内容物,将载玻片轻轻刮取干净的黏膜迅速装入冻存管,液氮速冻。采用Trizol法提取小肠黏膜总RNA,分别用琼脂糖凝胶电泳和微型分光光度计检测所提取的RNA质量和浓度,检测合格后,反转录成cDNA,进行Real-Time PCR反应,检测闭锁小带蛋白-1(zonula occluden protein-1,ZO-1)、黏蛋白2(mucin 2,MUC2)和闭合蛋白(occludin,OCLN)的mRNA相对表达量。PCR引物序列见表3。

表3 PCR引物序列
1.4 数据统计分析
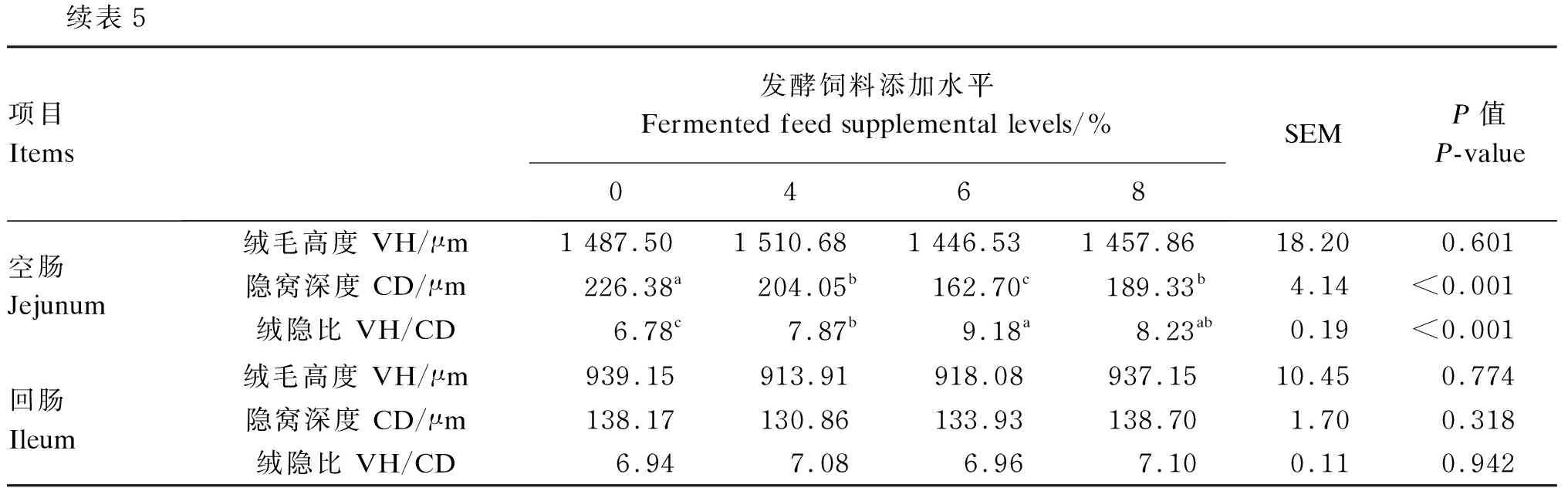
发酵前后饲料菌群结构试验结果数据采用“平均值±标准差”表示,运用t检验法进行差异显著性分析,以P<0.05作为差异显著性判断标准,0.05 饲养试验结果数据采用平均值和均值标准误(SEM)表示,采用SPSS 22.0统计软件one-way ANOVA模块进行方差分析,采用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准,0.05 2.1.1 发酵前后饲料菌群α多样性分析 通过对发酵前后饲料进行16s rRNA高通量测序,共得到370 942条高质量序列,平均每个样本的序列数为61 824条。由表4可知,与发酵前相比,发酵后饲料菌群的Shannon、Simpson、Chao1和ACE指数均出现了不同程度的下降,其中Shannon和Simpson指数的降低达到显著水平(P<0.05),这说明复合益生菌发酵降低了饲料菌群的丰富度和多样性。 表4 发酵前后饲料菌群α多样性分析 2.1.2 发酵前后饲料菌群在门水平上的分布 发酵前后饲料菌群在门水平上的分布如图1所示,以相对丰度≥0.05%为阈值,在发酵前饲料中共检测出6个门,其中的优势菌门为蓝藻菌门(Cyanobacteria),相对丰度为91.92%,存在少量的变形菌门(Proteobacteria,相对丰度为5.23%)和厚壁菌门(Firmicutes,相对丰度为2.22%)。然而,在发酵后饲料中只检测出了4个门,厚壁菌门的相对丰度提高至82.56%(P<0.05),演变为优势菌门;蓝藻菌门的相对丰度降至16.86%(P<0.05),其他各门水平细菌的相对丰度无显著差异(P>0.05)。 Others:其他;Euryarchaeota:广古菌门;Chloroflexi:绿弯菌门;Tenericutes:软壁菌门;Unidentified_Bacteria:未鉴别的细菌;Actinobacteria:放线菌门;Fusobacteria:梭杆菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Firmicutes:厚壁菌门;Cyanobacteria:蓝藻菌门。 2.1.3 发酵前后饲料菌群在属水平上的分布 发酵前后饲料菌群在属水平上的分布如图2所示,在发酵前饲料中的第一优势菌属是未鉴别的蓝藻细菌(unidentified_Cyanobacteria),其相对丰度高达91.92%;其次为泛生菌属(Pantoea),相对丰度为4.67%。益生菌发酵使饲料菌群在属水平上的分布发生了明显的改变,魏斯氏菌属(Weissella)成为了第一优势菌属,相对丰度提高至80.93%(P<0.05);未鉴别的蓝藻细菌为第二优势菌属,但其相对丰度相比发酵前降低了75.06%(P<0.05);此外,发酵后饲料中泛生菌属的相对丰度降低至0.13%(P>0.05)。 Others:其他;Lactobacillus:乳杆菌属;Unidentified_Erysipelotrichaceae:未鉴别的丹毒丝菌科;Klebsiella:克雷白氏杆菌属;Pediococcus:片球菌属;Romboutsia:罗姆布茨菌属;Blautia:布劳特氏菌属;Enterococcus:肠球菌属;Pantoea:泛生菌属;Weissella:魏斯氏菌属;Unidentified_Cyanobacteria:未鉴别的蓝藻细菌;Anaerosporobacter:厌氧孢杆菌属;Xanthomonas:黄单胞菌属;Methylobacterium:甲基杆菌属;Acidovorax:食酸菌属;Bacteroides:拟杆菌属;Peptoniphilus:嗜胨菌属;Massilia:马赛菌属;Unidentified_Rickettsiales:未鉴别的立克次氏体目;Streptomyces:链霉菌属;Unidentified_Ruminococcaceae:未鉴别的瘤胃球菌科;Unidentified_Rhizobiaceae:未鉴别的根瘤菌科;Faecalibacterium:粪杆菌属;Lactococcus:乳酸球菌属;Curtobacterium:短小杆菌属;Serratia:沙雷氏菌属;Unidentified_Clostridiales:未鉴别的梭菌目;Sphingobacterium:鞘氨醇杆菌属;Stenotrophomonas:寡养单胞菌属;Bacillus:芽孢杆菌属;Ochrobactrum:苍白杆菌属;Acinetobacter:不动杆菌属;Terrisporobacter:土孢杆菌属;Fusobacterium:梭杆菌属。 发酵饲料对蛋鸡小肠组织形态的影响见表5。与对照组相比,6%和8%发酵饲料添加组蛋鸡十二指肠隐窝深度显著降低(P<0.05),绒隐比显著提高(P<0.05);各发酵饲料添加组空肠隐窝深度显著降低(P<0.05),绒隐比显著提高(P<0.05),其中以6%发酵饲料添加组效果最优;各发酵饲料添加组回肠绒毛高度、隐窝深度和绒隐比均无显著差异(P>0.05)。 表5 发酵饲料对蛋鸡小肠组织形态的影响 续表5项目 Items发酵饲料添加水平Fermented feed supplemental levels/%0468SEMP值 P-value空肠 Jejunum绒毛高度 VH/μm1 487.501 510.681 446.531 457.8618.200.601隐窝深度 CD/μm226.38a204.05b162.70c189.33b4.14<0.001绒隐比 VH/CD6.78c7.87b9.18a8.23ab0.19<0.001回肠 Ileum绒毛高度 VH/μm939.15913.91918.08937.1510.450.774隐窝深度 CD/μm138.17130.86133.93138.701.700.318绒隐比 VH/CD6.947.086.967.100.110.942 发酵饲料对蛋鸡35和50周龄小肠食糜消化酶活性的影响分别见表6和表7。35周龄时,与对照组相比,饲粮中添加发酵饲料可以显著提高蛋鸡十二指肠食糜中淀粉酶以及空肠食糜中胰蛋白酶和脂肪酶活性(P<0.05),且3个添加组间差异不显著(P>0.05);6%和8%发酵饲料添加组十二指肠脂肪酶活性显著高于对照组和4%发酵饲料添加组(P<0.05)。50周龄时,与对照组相比,饲粮中添加发酵饲料对3个肠段食糜中胰蛋白酶、淀粉酶和脂肪酶活性均无显著影响(P>0.05)。 表6 发酵饲料对35周龄蛋鸡小肠食糜消化酶活性的影响 发酵饲料对蛋鸡空肠黏膜屏障功能相关基因mRNA相对表达量的影响如图3所示。与对照组相比,8%发酵饲料添加组蛋鸡空肠黏膜MUC2 mRNA相对表达量显著提高(P<0.05);6%和8%发酵饲料添加组空肠ZO-1 mRNA相对表达量有提高趋势,但差异未达到统计学显著水平(0.05 本试验采用16s rRNA高通量测序技术,研究发酵前后饲料菌群多样性和结构的变化,结果表明,经过复合益生菌发酵5 d后,饲料菌群的丰富度和多样性与发酵前相比显著降低。这主要是因为第2阶段的厌氧发酵和低pH环境抑制了许多微生物的生长。通过对菌群在门水平上的分析发现,发酵后饲料中的优势菌门由发酵前的蓝藻菌门演变为厚壁菌门。厚壁菌门属于革兰氏阳性菌,包括支原体、产芽孢和非产芽孢菌群,且很多厚壁菌门的细菌都对纤维素、蛋白质和淀粉等大分子化合物具有良好的降解作用[13]。有研究发现,发酵后饲料中厚壁菌门细菌的相对丰度显著上升[14],与本试验结果一致。从属水平上分析菌群可见,魏斯氏菌属的相对丰度在发酵后大幅度升高,成为优势菌属。王格等[15]研究也得到了类似的结果。魏斯氏菌属于乳酸菌,可表达β-葡糖苷酶,从而促进纤维素的降解[16]。此外,在未发酵饲料中检测到大量未鉴别的蓝藻细菌,且在发酵后也是饲料中的第二优势菌群,这可能是因为用于加入到发酵底物中的水未经消毒灭菌。大肠杆菌(Escherichia)和沙门氏菌(Salmonella)等致病菌在本试验的发酵后饲料中没有检测出,表明该发酵饲料安全无毒,可用于畜禽养殖。 蛋鸡小肠绒毛高度、隐窝深度和绒隐比是评价消化吸收功能的重要指标[17]。小肠绒毛与营养物质的吸收与转运有关,其中绒毛高度越高,说明肠黏膜表面积越大,有利于营养物质的吸收利用[18];隐窝深度从一定程度上反映肠黏膜上皮细胞的生成速率;绒隐比则与肠上皮细胞的新陈代谢有关。小肠绒毛缩短和隐窝加深可能会影响养分吸收,使动物生产性能下降[19]。Missotten等[20]研究发现,饲喂发酵饲料的肉鸡肠道绒毛高度和绒隐比显著提高,隐窝深度显著降低。Xie等[21]研究发现,饲喂发酵饲料能显著改善雪峰乌骨鸡的空肠黏膜形态。Li等[22]在饲喂发酵豆粕的肉鸡十二指肠和空肠中也得到了类似的结果。本试验结果表明,饲喂发酵饲料对蛋鸡十二指肠和空肠形态有显著改善作用,与前人研究结果一致。发酵饲料对肠道形态的改善作用可能归因于其对肠道菌群平衡的调节和微生物代谢产物的产生,包括有机酸、氨基酸和小肽等,从而诱导肠细胞分化和增殖[23-24]。此外,有研究发现,豆粕中的胰蛋白酶抑制剂含量与小肠绒毛高度之间存在负相关[25],结合发酵前后饲料中抗营养因子含量的变化,推测发酵饲料中抗营养因子的减少也是肠道形态改善的原因之一。 消化酶是饲料消化吸收的主要媒介,其中胰蛋白酶、脂肪酶和淀粉酶作为三大营养物质的对应消化酶,其活性与机体对养分的消化利用率密切相关。本试验结果发现,发酵饲料能显著提高蛋鸡35周龄十二指肠和空肠的消化酶活性,而对试验后期(50周龄)各肠段的消化酶活性无显著影响。林丽花等[26]使用发酵豆粕饲喂黄羽肉鸡发现,十二指肠中的2种消化酶活性较对照组显著提高[26];阮栋等[27]使用添加4%发酵混合饲料的饲粮饲喂蛋鸭,观察到空肠脂肪酶和糜蛋白酶活性显著提高,这都与本试验部分结果基本一致。结合小肠形态结构部分相关结果,发现发酵饲料对小肠形态结构和消化酶活性的影响主要集中于十二指肠和空肠。Hu等[28]研究表明,小肠绒毛高度的提高能增强消化酶活性,因此本试验中,发酵饲料对消化酶活性的提升或许与小肠形态结构的改善有关。此外,发酵过程中微生物产生的外源酶可以补充内源酶的分泌[29],这也同时增强了肠道消化酶活性。有研究报道,在饲粮中添加益生菌能显著提高蛋鸡小肠黏膜消化酶活性[30],可见发酵后饲料中益生菌数量的提高也是消化酶活性增强的原因之一。而发酵前饲料中所含的大量胰蛋白酶抑制剂也会影响消化道胰蛋白酶活性,这进一步扩大了对照组与发酵饲料添加组之间的差异。本研究团队同时进行了发酵饲料对蛋鸡生产性能影响的研究,结果表明,饲粮添加6%发酵饲料能够显著提高蛋鸡的产蛋率和平均蛋重[31]。综上所述,发酵饲料可通过改善肠道形态,增强消化酶的活性,从而促进营养物质的消化吸收,达到提高蛋鸡生产性能的目的。 OCLN和ZO-1是形成肠道细胞外屏障的特有蛋白质[31],这种屏障被称为紧密连接,它构成了抵御肠道中病原体入侵的物理屏障,紧密连接蛋白的相对表达量可用于评价肠道通透性[32-33];MUC2是肠道黏膜主要的黏蛋白,其能为宿主细菌提供营养和附着位点,并有助于特定肠道菌群的物种选择[34]。本试验中,饲粮添加8%发酵饲料对蛋鸡空肠黏膜MUC2 mRNA相对表达量有显著上调作用,而对空肠ZO-1和OCLNmRNA相对表达量未见显著影响,表明发酵饲料对肠道屏障功能的改善主要侧重于上调MUC2的表达。目前关于发酵饲料对蛋鸡肠道屏障功能相关基因表达的研究较少。张俊[11]使用益生菌发酵饲料及其灭菌饲料饲喂肉鸡,结果表明,二者都能上调肉鸡回肠紧密连接蛋白的基因表达量,说明发酵过程中产生的微生物及其代谢产物对肠道屏障的改善也具有重要作用。发酵产物包括益生菌[35]和有机酸[36]等已被证实可显著提高家禽肠道屏障功能相关基因表达量,但其作用机制有待深入研究。 ① 发酵后饲料中的菌群多样性和丰富度下降,绝对优势菌群发生改变。 ② 使用发酵玉米-豆粕饲料饲喂蛋鸡,能够改善蛋鸡的十二指肠和空肠组织形态,提高小肠消化酶活性,上调空肠MUC2基因表达,增强蛋鸡肠道健康。 ③ 综合分析,建议蛋鸡养殖中发酵玉米-豆粕饲料的添加水平为6%。2 结果与分析
2.1 发酵前后饲料菌群结构变化



2.2 发酵饲料对蛋鸡小肠组织形态的影响

2.3 发酵饲料对蛋鸡小肠食糜消化酶活性的影响

2.4 发酵饲料对蛋鸡空肠黏膜屏障功能相关基因mRNA相对表达量的影响
3 讨 论
3.1 发酵前后饲料菌群结构变化
3.2 发酵饲料对蛋鸡小肠组织形态的影响
3.3 发酵饲料对蛋鸡小肠食糜消化酶活性的影响
3.4 发酵饲料对蛋鸡小肠黏膜屏障功能相关基因表达的影响
4 结 论
