甘蔗糖蜜酵母发酵浓缩液对泌乳奶牛瘤胃发酵参数和微生物区系的影响
2022-03-30张宜辉宁丽丽武小姣张笑然赵国琦
张宜辉 宁丽丽 武小姣 郭 静 张笑然 赵国琦,4,5*
(1.扬州大学实验农牧场,扬州225009;2.扬州大学动物科学与技术学院,扬州225009;3.广西丹宝利酵母有限公司,来宾546100;4.扬州大学农业科技发展研究院,扬州225009;5.扬州大学教育部农业与农产品安全国际合作联合实验室,扬州225009)
甘蔗糖蜜酵母发酵浓缩液(cane condensed molasses soluble fromSaccharomycescerevisiae,CMS)是甘蔗糖蜜经酿酒酵母菌发酵浓缩而成的产品,其中富含蛋白质、氨基酸、有机酸、维生素、矿物质以及在发酵过程中合成的未知生长因子[1-2]。发酵液中微生物产生的蛋白酶可以将大分子的蛋白质分解为小分子肽,进而提高动物肠道对营养因子的利用效率[3]。CMS具有芳香气味,呈液体黏稠状,可提高饲料适口性,降低粉尘,改善饲料质量。已有研究表明,猪[4]和牛[1,5-6]饲粮中添加1%~5% CMS后采食量、平均日增重和饲料转化率可显著提高。适量添加CMS还可以改善瘤胃发酵,提高瘤胃微生物活性,促进蛋白质合成,降低瘤胃液中的氨浓度[7]。因此,CMS作为一种新型绿色饲料,对缓解饲料资源紧张和环境污染具有重要意义。饲粮中添加CMS可提高奶牛生产性能可能是因为其对瘤胃微生物区系产生了一定影响,但目前尚没有相关报道。为了探明CMS对瘤胃内微生物区系产生的具体影响,有必要进行相关的深入研究。高通量测序技术[8-9]可以进行全基因组测序,为胃肠道微生物区系的深入研究提供了可能。因此,本试验采用高通量测序技术,探讨CMS对泌乳奶牛瘤胃发酵参数和瘤胃微生物区系的影响,以期为CMS在泌乳奶牛饲粮中的应用提供科学的理论依据。
1 材料与方法
1.1 试验材料
本试验所用的CMS由广西某酵母有限公司提供。它是甘蔗糖蜜的酵母培养物离心分离出酵母后的液体,经蒸发浓缩成红褐色的黏稠液体。CMS营养成分见表1。
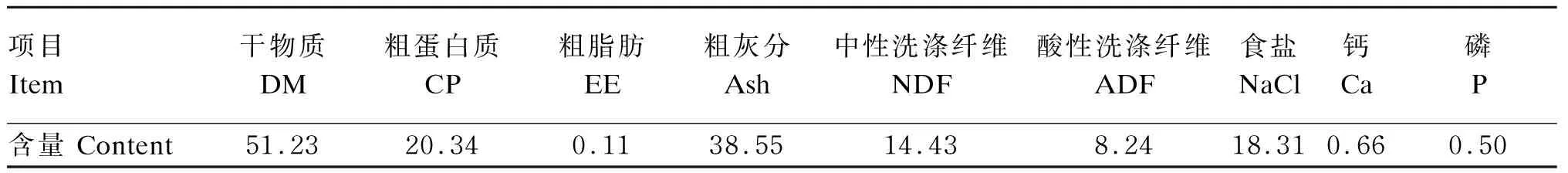
表1 CMS营养成分(风干基础)
1.2 试验设计
饲养试验于扬州大学实验农牧场进行。选取胎次(2~3胎)、产奶量[(29.1±2.2) kg]、泌乳天数[(116±25) d]和体况等情况相似的健康荷斯坦奶牛60头,随机分为4组,每组15头牛。对照组饲喂基础饲粮,试验组在基础饲粮干物质基础上分别添加1%(CMS1组)、3%(CMS2组)和5%(CMS3组)的CMS,各组饲粮基本保持能氮一致。预试期14 d,正试期54 d。基础饲粮参照NRC(2001)奶牛营养需要配制,饲粮组成及营养水平见表2。
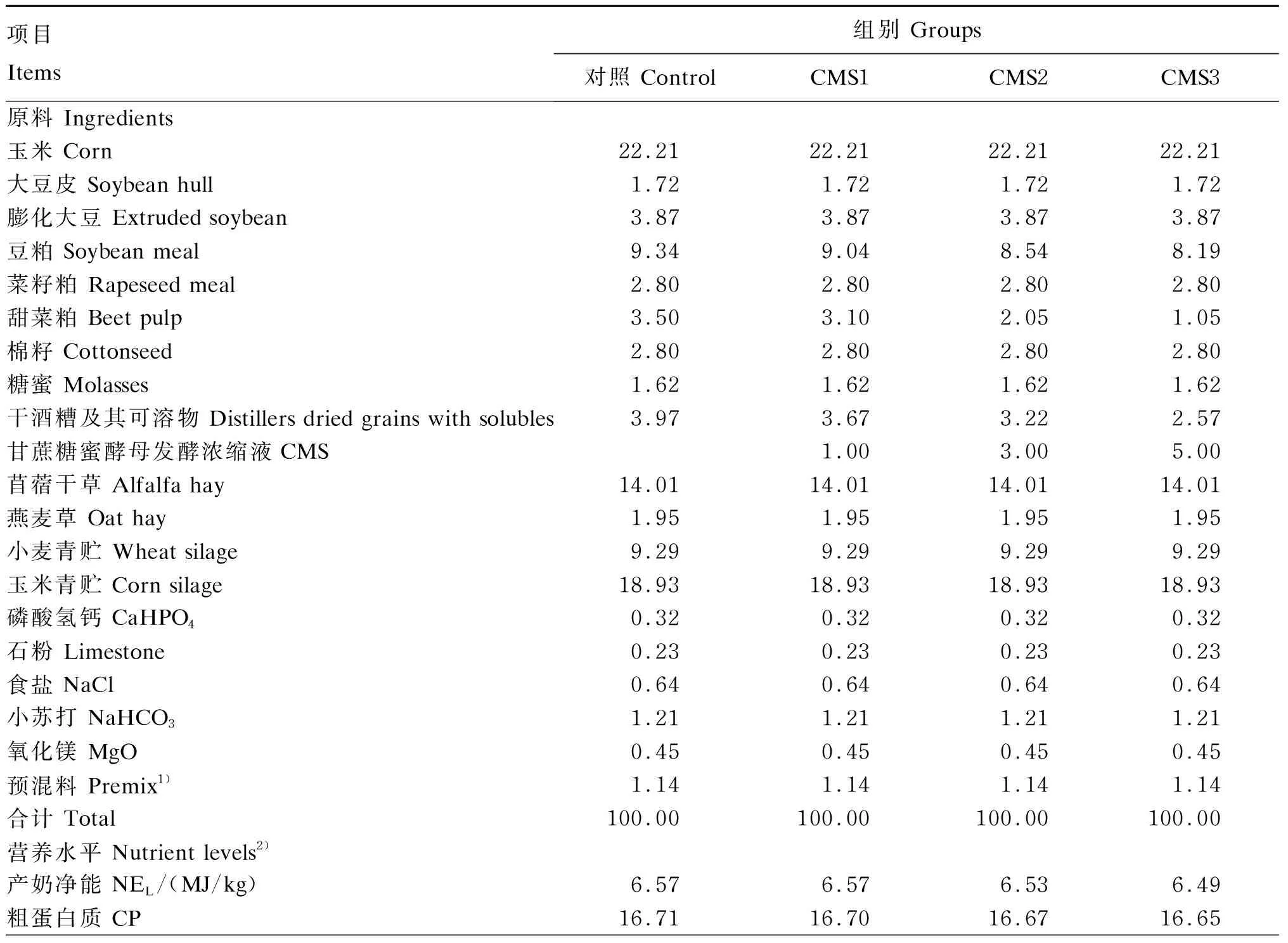
表2 饲粮组成及营养水平(干物质基础)
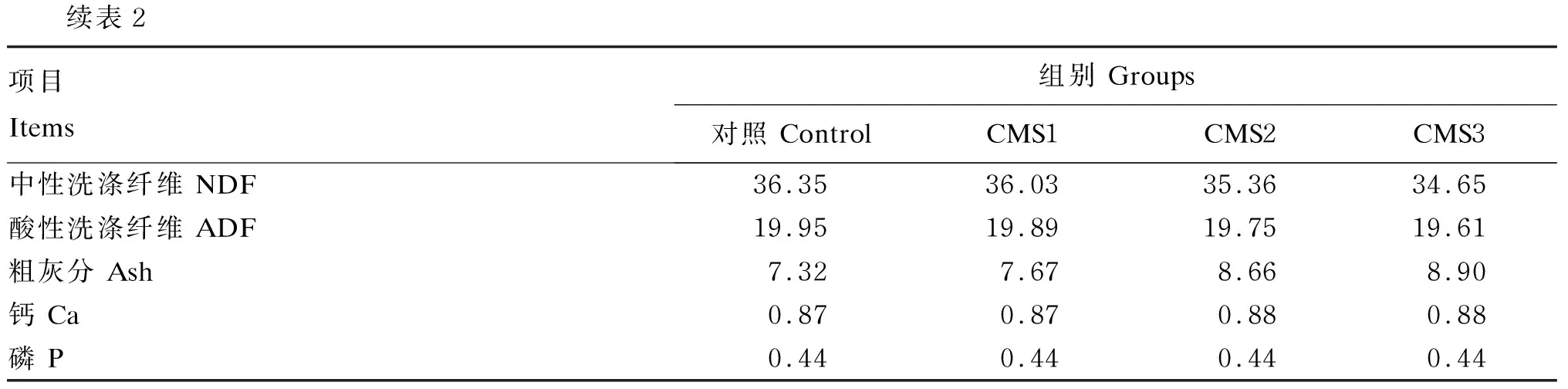
续表2项目Items组别 Groups对照 ControlCMS1CMS2CMS3中性洗涤纤维 NDF36.3536.0335.3634.65酸性洗涤纤维 ADF19.9519.8919.7519.61粗灰分 Ash7.327.678.668.90钙 Ca0.870.870.880.88磷 P0.440.440.440.44
1.3 饲养管理
试验牛只采用拴系式饲养,每2头牛食槽之间用石块隔开,保证其可以自由采食饲粮,并且槽内有3%~8%的剩料量,CMS每日分3次(06:00、13:00和20:00)与饲粮混匀后饲喂,自由饮水,保持舍内环境卫生。
1.4 样品的采集与测定
1.4.1 采食量的测定
每日单头测定各组牛的饲粮供给量和剩余量,同时每周连续2 d早、中、晚采集饲粮原料与剩料以测定常规营养成分,计算奶牛的干物质采食量(DMI)和饲料转化率。
DMI=(投料量-剩料量)×DM;
饲料转化率=4%标准乳产量/DMI。
1.4.2 产奶量的测定
试验牛只采用管道式挤奶方式,每日跟随工作人员记录每头奶牛的产奶量,计算产奶量和4%标准乳产量。
4%标准乳产量=产奶量×(0.4+15×乳脂率)。
1.4.3 瘤胃液样品的采集
正试期第54天,每组选取12头牛,于晨饲后3 h用口腔采集器(武汉科立博有限公司)从奶牛瘤胃中采集100 mL瘤胃内容物,用灭菌4层纱布过滤,之后用便携式pH计立即测定其pH,过滤后的瘤胃液样品分装至5 mL冻存管中,分成4份保存。1份加入25%偏磷酸混匀后放置在-20 ℃冰箱中用于挥发性脂肪酸(VFA)含量的测定[10];1份添加0.5 mol HCl放置在-20 ℃冰箱中用于氨态氮(NH3-N)含量的测定[11];1份放置在-20 ℃冰箱中用于微生物蛋白(MCP)含量的测定[12];1份保存在-80 ℃超低温冰箱中用于高通量测序。
1.4.4 瘤胃发酵参数的测定
瘤胃液的pH采用便携式pH计(PB-21型,北京赛多利斯科学仪器有限公司)测定;NH3-N含量采用苯酚-次氯酸钠比色法测定;MCP含量采用嘌呤法测定;VFA含量采用气相色谱法(7890A-7697A,顶空气相色谱仪)测定。
1.4.5 瘤胃微生物区系的测定
瘤胃细菌群落结构分析采用高通量测序HiSeq2500 PE250平台(上海华大基因科技有限公司)。引物选用16S V4区的515F(5′-GTGCCAGCMGCCGCGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行扩增。按邓波波[13]的方法处理序列,使用Qiime2软件以一致性(identity)为99%将序列聚类成为操作分类单位(OTUs),绘制韦恩图分析共同存在的OTUs和特有的OTUs,并通过Excel绘制各样本菌群在门和属水平相对分布情况柱形图;通过Qiime2 diversity分析样本内细菌α多样性和样本间细菌β多样性。
1.5 数据处理与统计分析
利用Excel 2016整理数据,然后使用SPSS 23.0软件的one way-ANOVA程序进行单因素方差分析,使用Duncan氏法进行多重比较,以P<0.05作为差异显著性的判断标准。
2 结果与分析
2.1 添加CMS对泌乳奶牛生产性能的影响
由表3可知,饲粮中添加CMS对泌乳奶牛DMI、产奶量、4%标准乳产量和饲料转化率均无显著影响(P>0.05)。CMS1组的DMI、产奶量、4%标准乳产量比对照组分别提高了6.0%、7.7%和7.9%(P>0.05)。
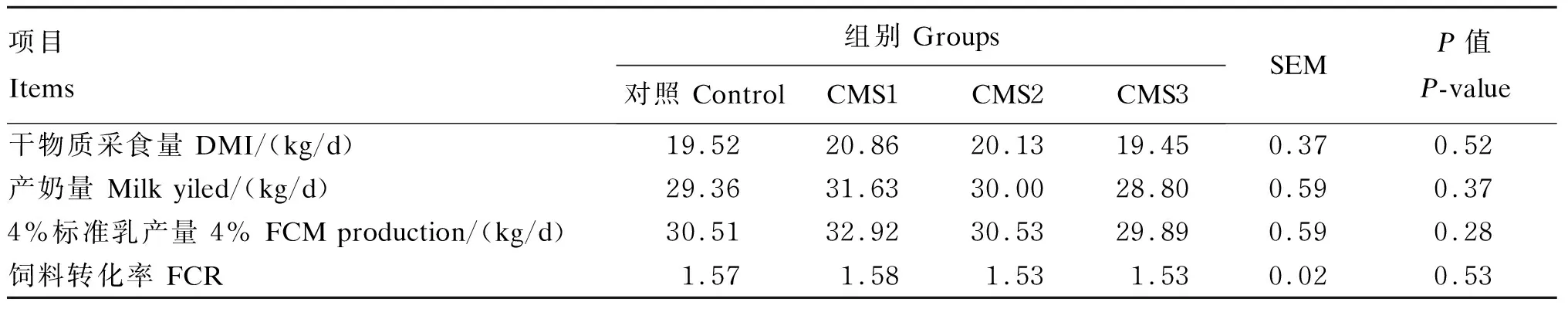
表3 添加CMS对泌乳奶牛生产性能的影响
2.2 添加CMS对泌乳奶牛瘤胃发酵参数的影响
由表4可知,饲粮中添加CMS对泌乳奶牛瘤胃液pH、NH3-N、VFA含量和乙酸/丙酸值无显著影响(P>0.05)。CMS1组和CMS2组的瘤胃液MCP含量显著高于对照组(P<0.05)。瘤胃液NH3-N含量随CMS添加量的增加而逐渐降低(P>0.05)。
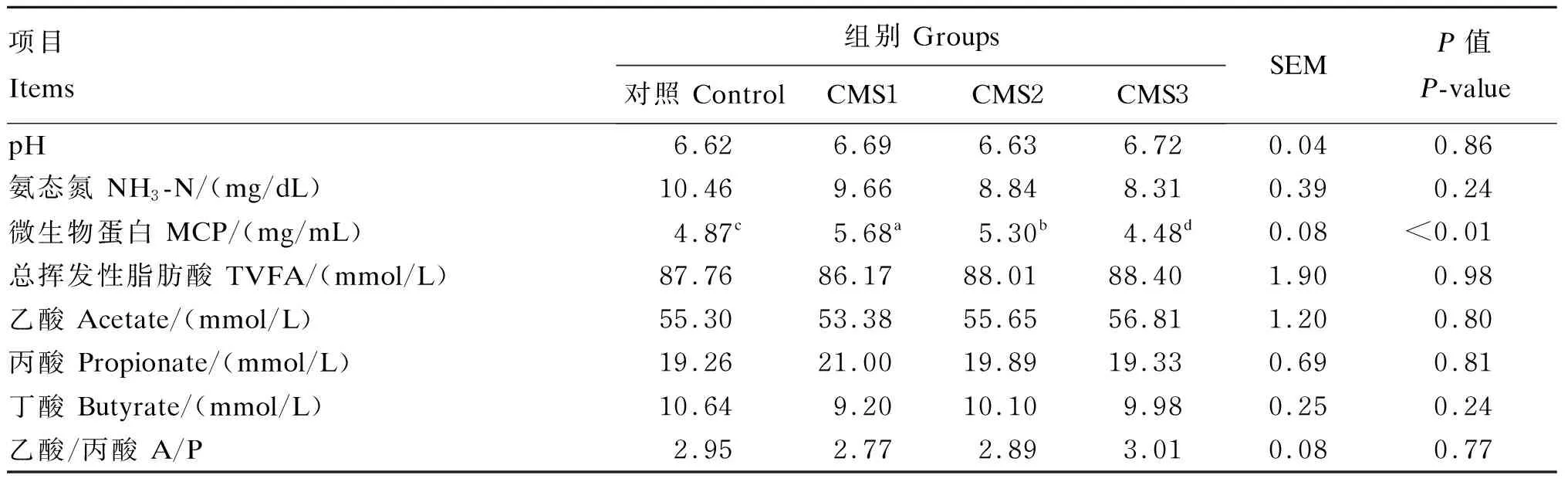
表4 添加CMS对泌乳奶牛瘤胃发酵参数的影响
2.3 测序数据量及物种丰度分析
从图1可以看出,曲线末端趋于平缓,说明本次测序的采样量足够,测序量近似覆盖了所有物种[14]。
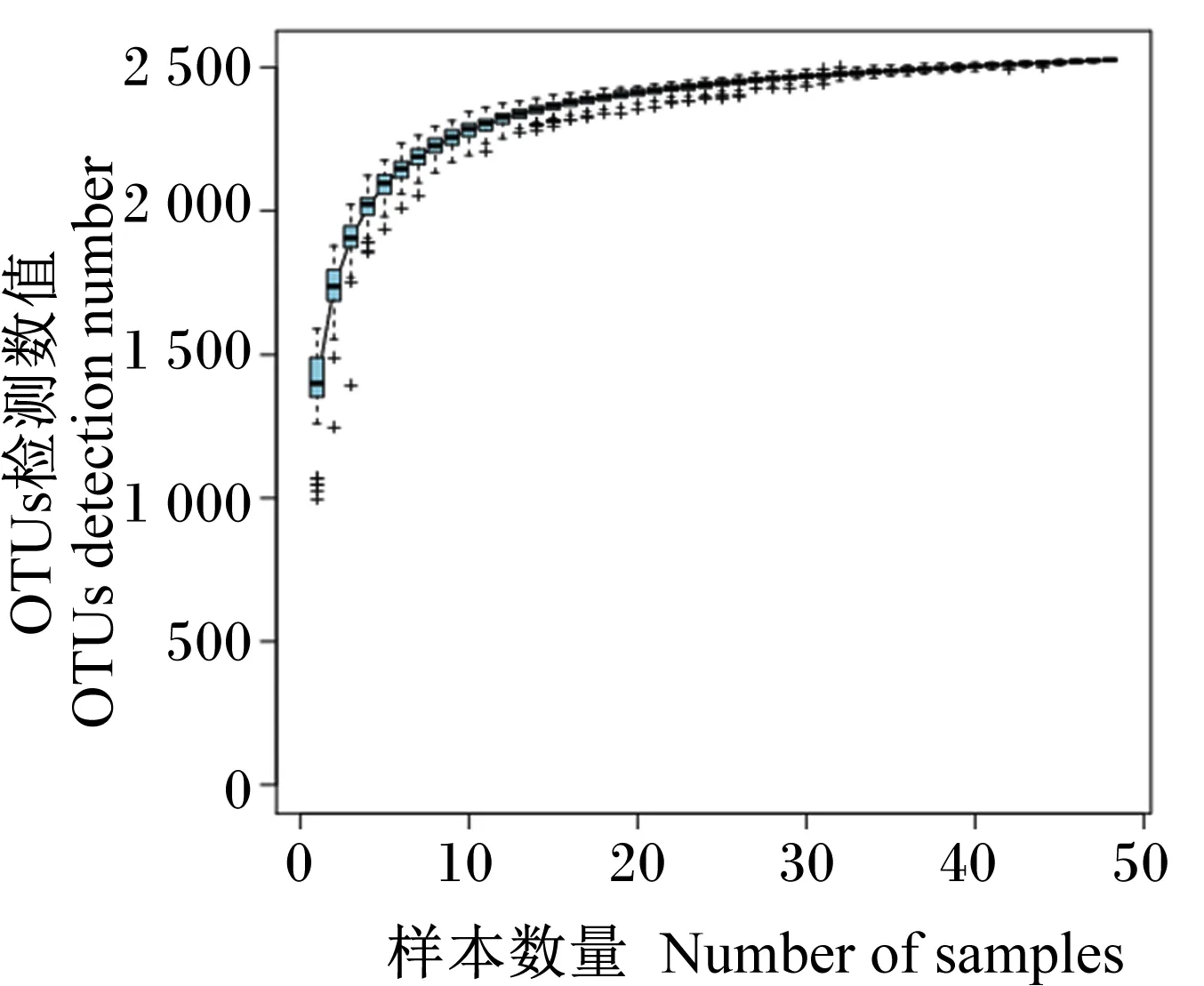
图1 物种累积曲线
2.4 韦恩图分析
韦恩图可以反映多个样品之间共有和特有的OTUs,能够直观表现出样品间OTUs的重叠情况。从图2可以看出,各组共有的OTUs为2 101个,其中对照组特有的OTUs为36个,CMS1组特有的OTUs为44个,CMS2组特有的OTUs为36个,CMS3组特有的OTUs为29个。因此,CMS1组特有的OTUs高于其他各组,并且CMS1组和CMS2组共有相同的OTUs较多。
2.5 添加CMS对泌乳奶牛瘤胃细菌多样性的影响
2.5.1 添加CMS对泌乳奶牛瘤胃细菌α多样性的影响
覆盖率数值越高,样品中序列没有被测出来的概率越低;Chao1指数和Ace指数反映样品中细菌群落的丰富度;Shannon指数可以反映样品中细菌群落的多样性。由表5可知,各组样品覆盖率均为99%,说明所有样品检测数据可靠。饲粮中添加CMS对瘤胃液中Chao1指数、Ace指数和Shannon指数均无显著影响(P>0.05)。
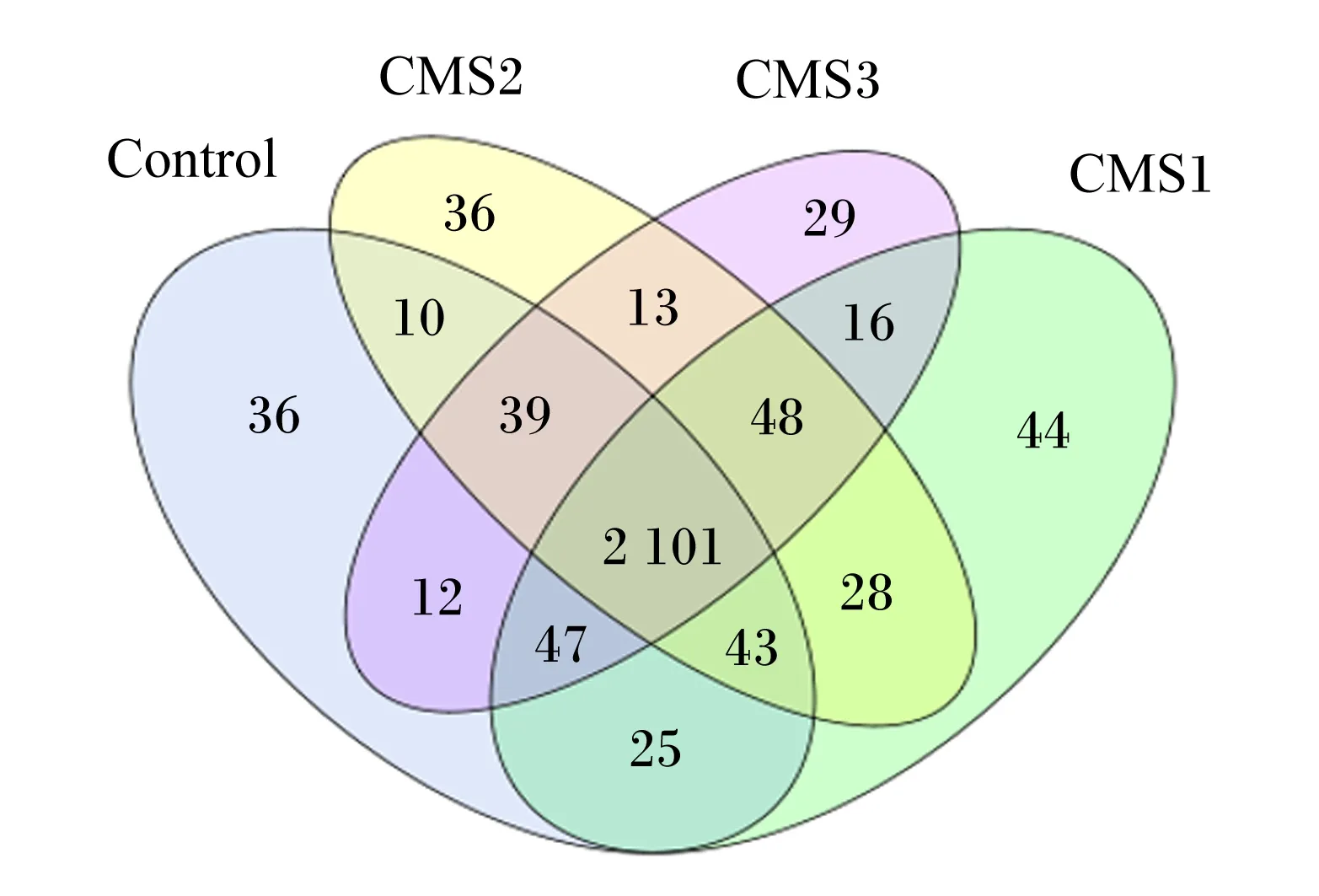
Control、MC1、MC2、MC3分别代表对照组、CMS1组、CMS2组和CMS3组。下图同。
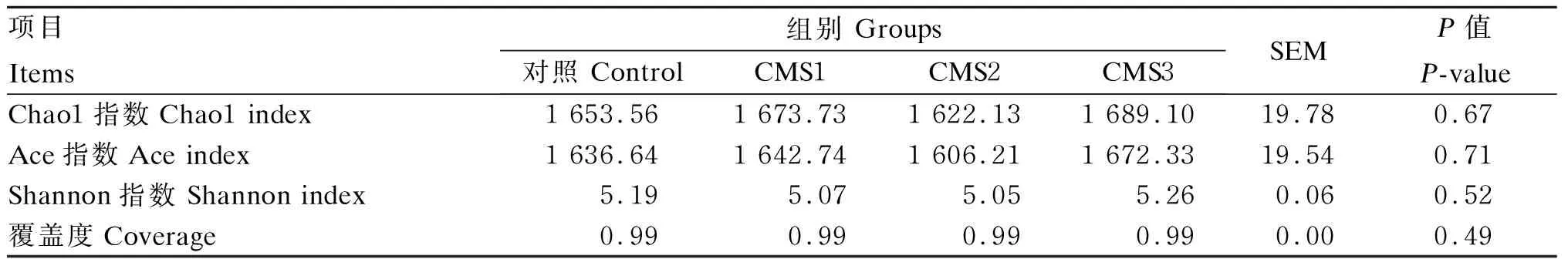
表5 添加CMS对泌乳奶牛瘤胃细菌α多样性的影响
2.5.2 添加CMS对泌乳奶牛瘤胃细菌β多样性的影响
从图3可以看出,对照组、CMS2组和CMS3组的微生物组成相似度很高,CMS1组的微生物组成和其他各组相比差异较大。
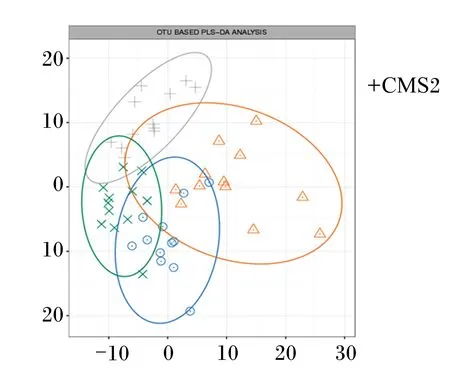
图3 偏最小二乘判别分析
2.6 添加CMS对泌乳奶牛瘤胃菌群结构的影响
2.6.1 门水平上物种的结构和相对丰度
瘤胃液样品分析后,根据物种注释结果制作物种相对丰度柱状图。图4是门水平上排名前10的瘤胃液细菌相对丰度柱状图,其中,门水平上相对丰度较高的菌为:拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。饲粮中添加CMS在门水平上对泌乳奶牛瘤胃菌群相对丰度均无显著影响(P>0.05),但是有增加软壁菌门相对丰度的趋势(P=0.08)。
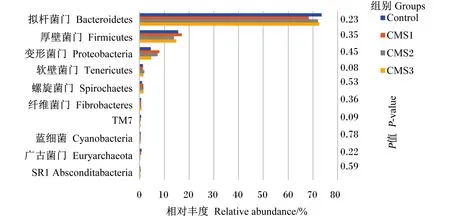
图4 门水平上物种相对丰度柱状图
2.6.2 属水平上物种的结构和相对丰度
瘤胃液样品分析后根据物种注释结果制作物种相对丰度柱状图。图5是属水平上的物种相对丰度柱状图,物种丰富度低于0.5%的物种全部合并成其他(Others)。由图5可以看出,属水平上相对丰度较高的菌为:普雷沃氏菌属(Prevotella)和琥珀酸菌属(Succiniclasticum)。饲粮中添加CMS在属水平上对泌乳奶牛瘤胃菌群相对丰度均无显著影响(P>0.05),但CMS1组的Others菌属相对丰度较对照组提高17.02%。
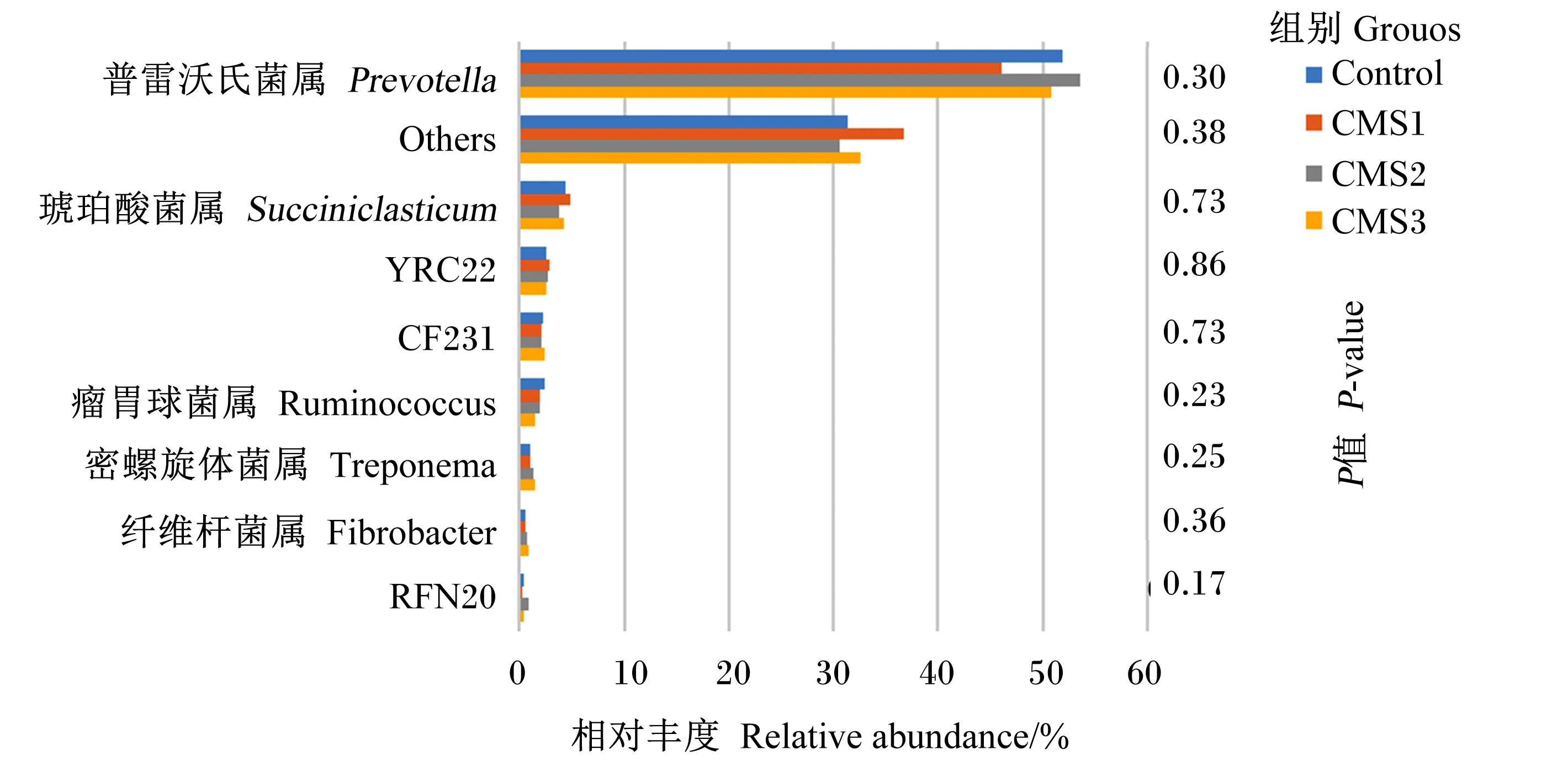
图5 属水平上物种相对丰度柱状图
3 讨 论
3.1 添加CMS对泌乳奶牛生产性能的影响
影响动物DMI除了自身遗传力、年龄、体况、生理状态以外,还与饲粮因素、环境因素和饲养管理技术有关[15]。饲粮是影响奶牛DMI的主要因素[16],包括精粗比、营养成分和适口性等。本试验各试验组饲粮采用等能等氮原则配制,于同一牛舍饲喂。本研究发现,饲粮中添加CMS对DMI无显著差异,但是CMS1组和CMS3组的DMI均高于对照组。这可能是因为CMS中保留了甘蔗糖蜜中的芳香气味,一定程度上增加了饲粮的适口性,使得奶牛更喜欢采食。
产奶量主要受遗传、生理以及外界因素的影响,其中外界因素对奶牛产奶能力的影响比较大,而饲粮配方及营养水平是外界因素中最主要的[17]。吴宗进等[6]和许袖等[18]的研究表明,添加酵母糖蜜对泌乳奶牛的生产性能并无显著影响。而在毛江[5]的研究中,奶牛的采食量和产奶量随着CMS饲喂水平的增加而增加,效果最好的是1.50%替代组。这可能是不同的CMS用量和动物健康状况导致了不一样的研究结果。CMS1组的产奶量和4%标准乳产量均高于对照组,可能是由于DMI不同引起的。除此之外,我们还发现过度使用CMS会降低其采食量和产奶量。因此,奶牛饲粮中适量添加CMS能够提高奶牛的生产性能,这与之前在奶牛饲粮中添加糖蜜的研究结果[19]一致。
3.2 添加CMS对泌乳奶牛瘤胃发酵参数的影响
Schmitz等[20]研究发现,瘤胃液pH范围通常在6.0~7.0,最适于生成VFA的pH范围为6.2~6.6,最适于NH3-N利用的pH范围为5.7~6.2。饲粮中精料比例过高会导致pH下降,pH过低会引起亚急性瘤胃酸中毒、肝脓肿、蹄叶炎、乳脂降低等营养代谢性疾病[21-22]。本研究中,各组pH都处于正常范围,饲粮中添加CMS对泌乳奶牛瘤胃液pH无显著影响,这可能是因为对照组和CMS组的饲粮精粗比一致。
NH3-N含量是瘤胃氮代谢中最重要的指标之一,同时也是MCP合成的底物。瘤胃中NH3-N含量反映了饲粮的降解和NH3-N吸收之间的平衡关系[23-24]。本研究中,饲粮添加CMS对NH3-N含量无显著影响,但随着CMS添加量的增加而降低,这可能是由于瘤胃微生物区系的变化所致。研究表明,适宜MCP合成的NH3-N含量为5~25 mg/dL[25],本试验各组NH3-N含量都处于正常范围。瘤胃MCP为反刍动物提供40%~80%机体需要的蛋白质,MCP含量可以反映瘤胃微生物的丰富度和活性。MCP合成主要受可降解碳水化合物和蛋白质的影响[26-28]。El Khidir等[29]和毛江等[5]的研究表明,糖蜜与粗饲粮结合可以提高瘤胃液中MCP的合成效率。本试验CMS1组和CMS1组MCP含量显著提高,可能是因为CMS是酵母菌发酵浓缩副产物,更容易被瘤胃吸收以及微生物利用。
饲粮组成可以影响瘤胃发酵类型和VFA组成。VFA是饲粮中碳水化合物经过瘤胃微生物发酵后得到的产物,为反刍动物机体提供70%以上的能量[30]。本研究中,饲粮添加CMS对泌乳奶牛瘤胃中的总VFA、乙酸、丙酸和丁酸含量均无显著影响,可能与饲粮等能等氮配制和添加量少有关。Fernández等[31]在安装瘤胃瘘管的美利奴母羊饲粮中添加CMS,发现其对瘤胃中的VFA含量影响不显著,这与本试验的研究结果一致。
3.3 添加CMS对泌乳奶牛瘤胃微生物区系的影响
物种累积曲线图能够反映测序数据量是否合理[32]。本研究中,物种累积曲线图中曲线末端上升趋势逐渐平缓,说明本次测序的采样量足够,测序量近似覆盖了所有物种,测序深度足够。另外各组样品覆盖率均为99%,更说明所有样品测定合宜。韦恩图反映CMS1组特有的OTUs高于其他各组,偏最小二乘判别分析(PLS-DA)图反映CMS1组的微生物组成和对照组相比有一定差异,说明饲喂1% CMS能够提高奶牛瘤胃微生物的多样性。Chaol指数和ACE指数反映样品中细菌群落的丰富度,其数值越高代表丰富度越高;Shannon指数可以反映群落的多样性。本研究中,各组之间瘤胃液中的Chaol指数、Ace指数和Shannon指数无显著差异,说明饲粮中添加CMS对泌乳奶牛瘤胃细菌的丰富度和多样性不会产生显著影响,可能是因为各组饲粮的营养成分差异不大。
反刍动物依赖于宿主与瘤胃微生物的共生关系,饲粮中原有的糖和蛋白质很少或根本没有直接进入动物体内,它们都要先通过瘤胃内的细菌发酵进行处理才能被机体吸收利用[33]。考虑到瘤胃微生物对饲料转化的重要性,许多研究都想要通过调控瘤胃发酵来提高动物生产力。本研究在门水平上对奶牛瘤胃微生物群落进行分析,发现各组奶牛瘤胃中的优势菌群都是拟杆菌门和厚壁菌门,这与Bi等[34]的研究结果一致。拟杆菌门对于瘤胃中非纤维物质的降解十分重要,厚壁菌门、螺旋菌门和纤维杆菌门都有助于降解富含纤维素的饲草[35],属于有益菌。各组之间门水平上菌群相对丰度均无显著差异,但是螺旋菌门和纤维菌门相对丰度随着CMS的添加也在增加,说明饲喂CMS可能会通过调节微生物结构来改善动物健康,提高其生产性能。本研究在属水平上发现,普雷沃氏菌属为泌乳奶牛瘤胃优势菌群。这与Bowen等[36]的研究结果一致,基本上所有反刍动物的优势菌属都是拟杆菌门的普氏菌属。普雷沃氏菌属可以消化利用淀粉,并且可以通过与纤维降解菌共培养有效利用木聚糖和果胶,还能降解非结构性的碳水化合物和蛋白质[37]。
4 结 论
① 饲粮中添加1%和3% CMS能够显著提高泌乳奶牛瘤胃中MCP含量。
② 饲粮中添加1% CMS,泌乳奶牛瘤胃菌群的多样性有提高,优势菌门为拟杆菌门和厚壁菌门,优势菌属为普雷沃氏菌属和琥珀酸菌属。
③ 饲粮中添加1% CMS更有利于泌乳奶牛瘤胃发酵和产奶性能提高。
