白藜芦醇对肉鸡生长性能、血清生化指标和抗氧化能力的影响
2022-03-30亢守亭蔡锋隆秦顺义李留安张建斌
马 政 亢守亭 蔡锋隆 秦顺义 李留安 杨 华 张建斌*
(1.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津300384;2.荷泽学院药学院,荷泽274015;3.天津市广源畜禽养殖有限公司,天津301824)
白藜芦醇(resveratrol,RES)化学名称为3,4′,5-三羟基芪(3,4,5′-trihydroxystilbene),是由日本科学家从毛藜芦中首次发现[1]。RES是自然界中存在的一种植物多酚化合物,具有很高的药理学作用,存在于70多种植物或植物果实中,葡萄皮中含量最高[2]。RES被发现以来,大量试验研究已证明其具有抗氧化[3]、抗菌[4]、抗炎[5]、抗癌[6]、调节脂类代谢[7]、保护肠道[8]以及抑制动脉粥样硬化的发生[9-10]的功能。
RES在医疗美容行业中应用较为广泛,鉴于其具有的多种生物学功能,RES在畜禽生产中的应用也越来越广泛,大部分集中于抗热应激和抗氧化的功能研究。Meng等[11]研究发现,在母猪饲粮中添加300 mg/kg的RES可以显著提高母猪血清超氧化物歧化酶(SOD)活性,降低血清丙二醛(MDA)含量,显著提高后代仔猪的平均日增重以及最终体重。Zhang等[12]研究表明,在Cobb肉鸡饲粮中添加400 mg/kg的RES可以降低肌肉无氧糖酵解代谢和提高肌肉的抗氧化能力,缓解运输应激。Lv等[13]研究发现,在山羊精液补充剂中添加10或50 μmol/L的RES可以抑制活性氧(ROS)的生成,从而达到提高山羊精子质量的目的。国内也有关于RES在肉鸡上的应用研究,但是大部分是通过建立肉鸡热应激模型进行的[14-16]。本试验将RES按照不同剂量添加到肉鸡饲粮中,探究其对肉鸡生长性能、屠宰性能、脏器指数、抗氧化能力以及血清生化指标的影响,旨在为RES成为一种植物源性绿色添加剂提供理论依据。
1 材料与方法
1.1 试验材料
试验动物:罗斯308肉雏鸡(天津市静海区金泉养鸡场)。
添加剂:RES(98%,陕西某生物科技有限公司)。
1.2 试验设计
试验选用1日龄健康的罗斯308肉雏鸡480羽,随机分为4组(每组6个重复,每个重复20羽),A组饲喂基础饲粮,其为参照NRC(1994)营养需要配制的粉状配合饲粮,基础饲粮组成及营养水平见表1;B组饲喂基础饲粮+200 mg/kg RES;C组饲喂基础饲粮+500 mg/kg RES;D组饲喂基础饲粮+800 mg/kg RES。试验期为42 d。试验期间肉鸡采用笼养方式进行饲养,按照常规程序进行免疫,保持鸡舍清洁,确保环境卫生条件达到肉鸡健康的需求。

表1 基础饲粮组成及营养水平(风干基础)

续表1项目 Items1~3周龄 1 to 3 weeks of age4~7周龄 4 to 7 weeks of age贝壳粉 Shell powder1.401.40磷酸氢钙 CaHPO41.651.60预混料 Premix1)1.001.00合计 Total100.00100.00营养水平 Nutrient levels2)代谢能 ME/(MJ/kg)12.3912.92粗蛋白质 CP21.7119.95钙 Ca1.020.97总磷 TP0.730.65赖氨酸 Lys1.181.07蛋氨酸 Met0.490.45
1.3 样品采集与指标测定
1.3.1 生长性能
试验期间,每天观察病死鸡情况,记录各组每个重复的采食量,并对各组个体进行称重,通过统计上述数据计算平均日采食量、平均日增重和料重比。
1.3.2 血清制备及指标测定
在试验第1天,对肉鸡进行心脏采血,在第21、42天,对肉鸡进行翅静脉采血。每个重复选取2只,共48只。每只鸡采血2 mL,2 400×g离心6 min,取上清液冻存备用。
使用酶标仪和南京建成生物工程研究所试剂盒测定血清中总抗氧化能力(T-AOC,ABTS法)、总超氧化物歧化酶(T-SOD,羟胺法)、谷胱甘肽过氧化物酶(GSH-Px)活性。
使用GLAMOUR 3000全自动生化分析仪和中生北控生物科技股份有限公司试剂盒测定血清中白蛋白(ALB,溴甲酚绿法)、胆固醇(CHO,CHOD-PAP法)、葡萄糖(GLU,葡萄糖氢化酶法)、总蛋白(TP,双缩脲法)、高密度脂蛋白胆固醇(HDL-C,直接法)、低密度脂蛋白胆固醇(LDL-C,直接法)、甘油三酯(TG,GPO-PAP法)、尿酸(UA,尿酸酶法)、尿素(UREA,尿素酶-谷氨酸脱氢酶法)的含量及谷草转氨酶(AST,天门冬氨酸底物法)活性。
使用GLAMOUR 3000全自动生化分析仪和英科新创科技股份有限公司试剂盒测定血清中免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、补体4(C4)的含量,以上均采用免疫比浊法测定。
1.3.3 屠宰性能、脏器和肠道指数
屠宰前禁食12 h,试验第42天测量肉鸡体斜长并进行称重屠宰,每个重复选取2只,共48只。屠宰时完整取出腿肌、胸肌、腹脂、各脏器以及肠道各部,对腿肌、胸肌、心脏、肝脏、脾脏、腺胃、肌胃称重计数,测量十二指肠、空肠、回肠以及盲肠长度。
脏器指数(%)=(器官重/宰前活重)×100;肠道指数=肠道长度/体斜长。
1.4 数据分析
利用Excel 2019对原始数据进行处理。使用SPSS 23.0软件进行单因素方差分析(one-way ANOVA),用Duncan氏法进行多重比较。最终结果表示为“平均值±标准差”,P<0.05为差异显著。
2 结果与分析
2.1 添加RES对肉鸡生长性能的影响
由表2可知,C组的第21天末重显著高于D组(P<0.05),各组间第42天末重无显著差异(P>0.05);第1~21天、第22~42天和第1~42天,各组间的平均日增重、平均日采食量和料重比均无显著差异(P>0.05)。

表2 RES对肉鸡生长性能的影响
2.2 添加RES对肉鸡血清生化指标的影响
由表3可知,第42天,C组血清TP含量显著低于A组和B组(P<0.05);第42天,B组和C组血清CHO含量显著低于D组(P<0.05);第42天,B组和C组血清HDL-C含量显著高于A组(P<0.05);第21天,C组和D组血清LDL-C含量显著低于A组和B组(P<0.05)。

表3 RES对肉鸡血清生化指标的影响
2.3 添加RES对肉鸡免疫能力的影响
由表4可知,第1天,A组和D组血清免疫球蛋白M含量显著高于B组以及C组(P<0.05);第21天,C组血清C4含量显著高于B组(P<0.05);第42天,A组以及C组血清免疫球蛋白M含量显著高于D组(P<0.05)。

表4 RES对肉鸡免疫能力的影响
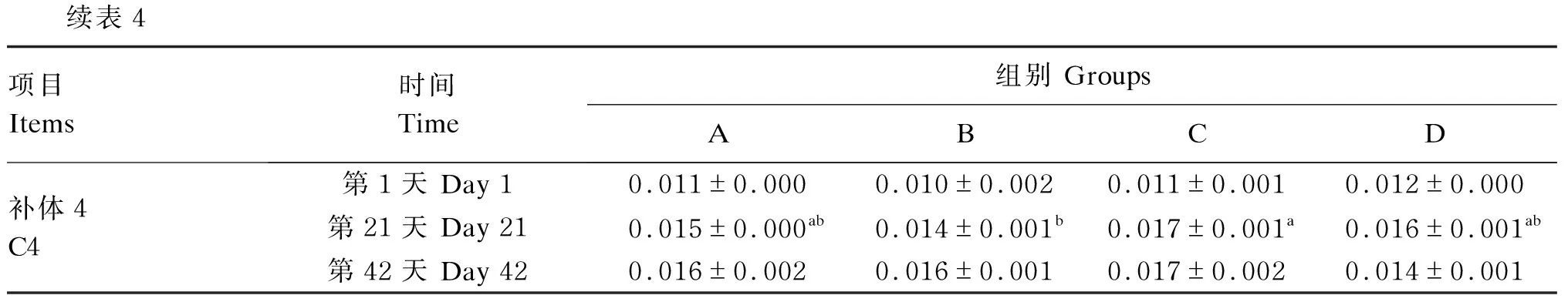
续表4项目Items时间Time组别 GroupsABCD补体4C4第1天 Day 10.011±0.0000.010±0.0020.011±0.0010.012±0.000第21天 Day 210.015±0.000ab0.014±0.001b0.017±0.001a0.016±0.001ab第42天 Day 420.016±0.0020.016±0.0010.017±0.0020.014±0.001
2.4 添加RES对42日龄肉鸡抗氧化能力的影响
由表5可知,C组血清T-AOC显著高于A组和B组(P<0.05);B组、C组和D组的血清GSH-Px活性显著高于A组(P<0.05);C组血清T-SOD活性显著高于A组(P<0.05)。

表5 RES对42日龄肉鸡抗氧化能力的影响
2.5 添加RES对肉鸡屠宰性能的影响
由表6可知,饲粮中添加RES对肉鸡屠宰率、全净膛率、胸肌率、腿肌率和腹脂率均无显著影响(P>0.05)。

表6 RES对肉鸡屠宰性能的影响
2.6 添加RES对肉鸡脏器指数的影响
由表7可知,D组的心脏指数显著高于A组和C组(P<0.05);D组的肝脏指数显著高于其他组(P<0.05);D组的脾脏指数显著高于A组(P<0.05);D组的腺胃指数显著高于A组、B组和C组(P<0.05),B组显著高于A组(P<0.05)。

表7 RES对肉鸡脏器指数的影响
2.7 添加RES对肉鸡肠道指数的影响
由表8可知,饲粮中添加RES的试验组十二指肠指数、空肠指数和盲肠指数均高于A组,但无显著差异(P>0.05)。
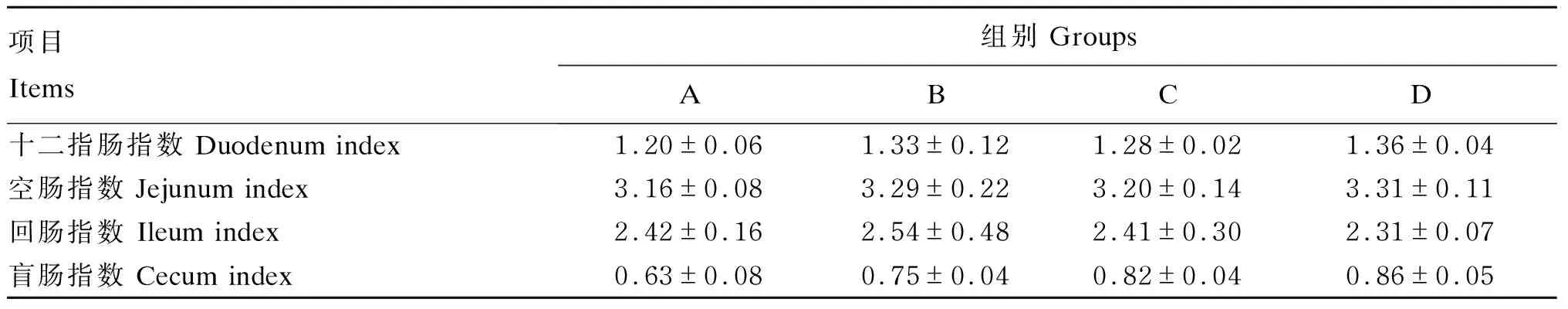
表8 RES对肉鸡肠道指数的影响
3 讨 论
3.1 RES对肉鸡生长性能、屠宰性能的影响
研究表明,RES提高肉鸡生长性能可能是通过增强肠道屏障完整性、改善肠道微生物区系平衡、调节肠道黏膜免疫与抗氧化功能等途径实现的[17]。Zhang等[18]研究发现,在肉鸡饲粮中添加400 mg/kg的RES,与对照组相比平均日增重、平均日采食量和料重比均无显著差异。这与本次试验结果基本一致,添加RES组的平均日增重与料重比与对照组相比虽无显著差异,但是存在增加平均日增重和降低料重比的趋势。
Zhang等[18]结果表明,RES组的屠宰率显著高于对照组,腹脂率显著低于对照组,全净膛率、腿肌率、胸肌率无显著差异。Yu等[19]报道表明,RES的添加有效降低了北京鸭腹部脂肪的沉积,腹脂率显著低于对照组,但是屠宰率、全净膛率、胸肌率、腿肌率并无显著差异。在本试验中通过添加RES,可以降低肉鸡的腹脂率,但是差异不显著,这可能与饲喂品种以及RES的添加量有关,具体原因还有待深入研究。
3.2 RES对肉鸡血清生化指标的影响
肉鸡的肝细胞受损,AST由肝细胞内进入血液中,导致血清中AST的活性升高[20-21],所以血清中AST活性异常是反映组织受损的重要指标[22]。本次试验中,通过添加RES对于血清中AST活性无显著影响。
有研究表明,RES可以改善热应激引起的黑骨鸡热休克蛋白(HSP)mRNA的高表达[23],HSP可能是通过改善胰岛素敏感性来增强胰岛素功能,而胰岛素对于调节机体新陈代谢和三羧酸循环有非常重要作用。因此,可能存在的机制是RES抑制热休克蛋白的表达,降低胰岛素敏感性,加快糖酵解和脂肪合成速率,调节血清中GLU、TP、CHO和TG的含量[22]。He等[22]研究发现,热应激下肉鸡血清中CHO、TG和UA含量升高,GLU和TP含量降低,通过添加RES可以有效地缓解这一趋势,RES剂量为500 mg/kg时效果更为明显。一般认为血清中的GLU和TP含量降低是限制动物生长的重要因素[24],本试验中各组血清CHO、TG、UA和GLU含量并无显著差异,但是通过添加RES我们发现与对照组相比,B组和C组的血清CHO和TG含量均存在降低的趋势;C组的血清TP含量低于对照组,但是C组的生长性能与其他组相比不存在显著差异,生长性能未受到影响。我们推测胰岛素敏感性没有发生变化,因此对三羧酸循环并无显著影响。
3.3 RES对肉鸡免疫能力的影响
脾脏是禽类中最大的外周免疫器官,参与细胞和体液免疫。当肉鸡受到热应激时,脾脏的发育会受到限制,导致脏器指数降低[23]。这与Liu等[14]研究一致,黑腹鸡热应激15 d后,对照组的脾脏指数、法氏囊指数显著低于RES组。RES添加量为400 mg/kg时,脾脏指数达到最大值,其缓解了由热应激引起的免疫器官的发育异常。其中RES通过激活核因子E2相关因子2(Nrf2)信号通路而减少了器官和组织的凋亡可能是原因之一[16]。本次试验,肉鸡处于正常的环境中,添加RES组脾脏指数均高于对照组,证明RES可能具有促进脾脏发育的功能。
补体系统是先天免疫系统的一部分,在炎症调节中起关键作用。C4起着重要作用[25],而C4具有固有的中和活性和独立于所有下游补体成分的免疫功能[26]。He等[23]研究发现,在饲粮中添加RES可以缓解热应激引起的血清中C4含量的降低,通过抑制脾脏热应激诱导的活化核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路的激活,从而调节先天免疫和炎症反应。本试验中,试验组血清C4含量与对照组相比没有显著差异,可能是由于肉鸡并未经受热应激,体内血清中C4含量维持在适当范围。
3.4 RES对肉鸡抗氧化能力的影响
线粒体是细胞内氧化应激的主要靶标,也是氧化损伤的主要细胞器,被认为是内源性ROS的主要来源。受损的线粒体会产生过量的ROS从而激活p53和半胱天冬酶等蛋白质以启动细胞凋亡。线粒体自噬是选择性线粒体自噬的过程,可以有效识别和清洁细胞内受损的线粒体,以改善因过度释放ROS引起的氧化应激。RES是一种强大的抗氧化剂,因为它具有抑制酶和非酶系统形成ROS的能力,以及清除ROS的活性[27]。据报道,RES可以通过恢复线粒体自噬来缓解氧化应激,它可以减少ROS产生和上调抗氧化防御系统以加速ROS清除来降低线粒体ROS水平[28]。
3.5 RES对肉鸡脏器指数的影响
肝脏作为体内主要的代谢和解毒器官,参与众多物质合成与循环。Cheng等[20]研究发现,热应激的条件下自由基和促炎性细胞因子的过度产生会使小鼠肝脏损坏发生病变,而通过添加RES可以抑制MDA和肿瘤坏死因子-α(TNF-α)的水平,并在转录水平下调Toll样受体4(TLR4)和细胞因子的表达,对肝脏损伤发挥了预防和积极的作用。本试验中,我们发现添加RES组的肝脏指数均高于对照组,D组显著高于对照组,但是具体原因及其潜在机理还需进一步研究。
综上所述,畜禽的机体健康对生长性能有着直接的影响,当健康水平降低会造成饲粮的浪费以及导致高病死率,造成一定经济损失。本试验结果表明,RES具有提高平均日增重以及降低料重比的趋势,可能的原因是RES促进脏器的发育,使机体内各项机能更加完善健全,从而提高组织器官对营养物质的吸收利用效率,提高生长性能和饲料转化率。通过添加RES肉鸡血清的抗氧化能力得到提高,机体清除活性物质(活性氧、活性氮)能力得到有效改善,同时,RES对肉鸡血清中TG、CHO、HDL-C和LDL-C有一定积极影响,可见机体内脂质代谢发生改变,脂质过氧化以及细胞损伤得到缓解。RES作为一种潜在的抗氧化剂,可能是通过提高酚类化合物的自由基清除能力以及提供氢的能力来改善动物的抗氧化性能,从而使动物健康水平得到提升,对肉鸡起到保护的作用。
4 结 论
① 饲粮中添加500 mg/kg的RES可以改善肉鸡的脂质代谢能力,降低肉鸡血清中TG、CHO、LDL-C的含量,提高HDL-C的含量。
② 饲粮中添加RES可以不同程度上提高肉鸡血清中T-AOC、GSH-Px和T-SOD活性,且以添加剂量为500 mg/kg时效果更好,可以显著提高肉鸡抗氧化能力。
③ 饲粮中添加800 mg/kg的RES可以显著提高肉鸡心脏指数、肝脏指数、脾脏指数和腺胃指数。
