非小细胞肺癌脑转移危险因素评估及意义
2022-03-30卢春青王盼韩晓蓓李玉杰王玉珏刘明军孙桂荣青岛大学附属医院检验科山东青岛266003青岛大学附属妇女儿童医院生殖中心检验科山东青岛266034
卢春青,王盼,韩晓蓓,李玉杰,王玉珏,刘明军,孙桂荣(.青岛大学附属医院检验科,山东青岛 266003;2.青岛大学附属妇女儿童医院 a.生殖中心,b.检验科,山东青岛 266034)
肺癌是我国发病率和死亡率均居首位的恶性肿瘤[1],以非小细胞肺癌(non-small cell lung cancer,NSCLC)为主,约占85%[2]。约10%~25%的NSCLC患者在首诊时即发生脑转移,约50%的患者在治疗过程中会发生脑转移[3];发生脑转移后不采取任何治疗的患者自然生存时间仅为4~5个月[4],而选择铂类为基础的标准化疗后中位生存期可延长至 8~12个月,采取一线表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)治疗能使患者的中位生存期接近3年[5]。尽管医学影像技术已大大提高了NSCLC脑转移的检出率,但一些隐匿性微转移和浸润性转移仍无法检出,因此,若能在典型脑转移影像学征象出现之前预测脑转移,势必会为临床争取更多的治疗时机。
国内外学者一直在寻找对NSCLC脑转移有预测价值的指标,包括肿瘤驱动基因及肿瘤标志物等,但相关研究尚存争议和不确定性。本研究着重从NSCLC患者的相关肿瘤标志物等实验室指标、EGFR基因突变和临床病理因素中分析NSCLC脑转移的危险因素,旨在为NSCLC脑转移的早诊断、早治疗提供有价值的依据,从而改善和提高NSCLC的预后。
1 资料与方法
1.1研究对象 选取2014年5月至2021年5月青岛大学附属医院住院治疗的NSCLC患者660例,均按照中华医学会肺癌临床诊疗指南(2019 版)[6]明确诊断。根据是否发生脑转移将660例患者分为肺癌脑转移组和肺癌组,其中,肺癌脑转移组患者252例,男性146例,女性106例,年龄26~84岁,中位年龄59岁;肺癌组患者408例,男性233例,女性175例,年龄30~86岁,中位年龄61岁。排除临床病理资料不完整者,合并其他器官恶性肿瘤或其他器官恶性肿瘤转移性肺癌者,合并严重感染性疾病者。肺癌组患者未经任何治疗,肺癌脑转移组患者经过手术或放、化疗、靶向治疗、免疫治疗等治疗。患者临床病理参数如性别、年龄、吸烟史、病理类型、分化程度、胸腔积液、纵隔淋巴结转移、颅外器官转移等信息通过查阅患者病历、病理记录、影像学资料等收集。本研究方案经青岛大学附属医院医学伦理委员会批准(批准文号:QYFYWZLL26663),患者及家属知情同意。
1.2主要仪器及试剂 血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)、 细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)检测试剂盒及Elecsyse 602电化学发光免疫分析仪均购自美国Roche公司,血清鳞状细胞癌相关抗原(squmaous cell carcinoma antigen,SCCA)检测试剂盒及Maglumi X8全自动化学发光免疫分析仪均购自深圳新产业生物医学工程公司,全血白细胞分类计数、血小板计数检测试剂盒及XN-2000全自动血液分析仪均购自日本Sysemx公司,唾液酸(SA)检测试剂盒及日立7600全自动生化分析仪分别购自浙江东瓯诊断产品公司和日本日立公司,D-二聚体检测试剂盒及ACL-top700全自动血凝分析仪分别购自西班牙Werfen公司和上海太阳生物技术公司,人类EGFR突变检测试剂盒及ABI 7500荧光PCR仪分别购自厦门艾德生物医药科技公司和上海赛默飞世尔科技(中国)公司。
1.3标本采集
1.3.1血液标本采集 患者在空腹状态下分别使用非抗凝真空采血管和含枸橼酸钠溶液的真空采血管采集静脉血3 mL,3 000×g离心10 min,分离血清;使用EDTA-K2抗凝真空采血管采集静脉全血2 mL,置于-20 ℃保存。
1.3.2肿瘤组织DNA提取 将石蜡包埋的病理组织或切片样本切成5 μm,取3~8片进行DNA提取,按照人类EGFR突变检测试剂盒说明书提取肿瘤组织或细胞基因组中DNA。DNA样本置于-20 ℃保存。
1.4实验室指标检测
1.4.1血液指标检测 血清CEA、CA125、CYFRA21-1检测采用电化学发光法,按照CEA、CA125、CYFRA21-1检测试剂盒及Elecsyse602电化学发光免疫分析仪说明书检测,参考范围分别为CEA:0~3.4 ng/mL,CA125:0~35 U/mL,CYFRA21-1:0~3.3 ng/mL;SCCA检测采用化学发光法,按照SCCA检测试剂盒及Maglumi X8全自动化学发光免疫分析仪说明书检测,参考范围:0~2.5 ng/mL;血清SA检测采用酶法,按照SA检测试剂盒及日立7600全自动生化分析仪说明书检测,参考范围:45.6~75.4 mg/dL;D-二聚体检测采用透射免疫比浊法,按照D-二聚体检测试剂盒及ACL-top700全自动血凝分析仪说明书检测;白细胞计数检测采用荧光流式细胞技术,按照白细胞分类计数试剂盒及XN-2000全自动血液分析仪说明书检测,参考范围分别为中性粒细胞计数:(1.8~6.3)×109/L,淋巴细胞计数:(1.3~4.5)×109/L,单核细胞计数:(0.1~1.0)×109/L;血小板计数及平均血小板体积(MPV)检测采用阻抗法,按照血小板计数试剂盒及XN-2000全自动血液分析仪说明书检测,参考范围分别为血小板计数:(125~350)×109/L,MPV:7.4~11.1 fL。根据各值计算中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、单核细胞与淋巴细胞比值(monocyte to lymphocyte ratio,MLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)。
1.4.2EGFR基因突变检测 按人类EGFR突变检测试剂盒说明书进行。PCR循环参数:95 ℃ 5 min;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,共15个循环;93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31个循环。于60 ℃时采集FAM和HEX(或VIC)信号,并采用ABI 7500荧光PCR仪自带软件进行熔解曲线分析,同一试验检测中内标、阴性及阳性质控品全部满足条件,且循环阈值(Ct值)<20时,结果方可采用。
1.5统计学分析 采用 SPSS 22.0软件进行,GraphPad Prism 8.0.2软件绘图。采用 Shapiro-Wilk检验连续变量的正态性。单因素分析时,服从正态分布的连续变量采用独立样本t检验,以均数±标准差表示;不服从正态分布的连续变量采用 Mann-WhitneyU检验,以中位数(四分位数)表示;分类变量采用卡方检验。通过ROC曲线确定用于分组的截断值(cut-off值)。多因素分析采用Logistic 回归模型,将单因素分析中P<0.05的变量纳入该回归模型,以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1NSCLC脑转移危险因素的单因素分析 结果显示,血清CEA、CA125、CYFRA21-1、SA、D-二聚体、NLR、PLR和MLR水平、分化程度、病理类型、胸腔积液、纵隔淋巴结转移、颅外器官转移以及EGFR突变是NSCLC脑转移的危险因素(P<0.05);而年龄、性别、吸烟史、SCCA和MPV与NSCLC脑转移无关(P>0.05),见表1。
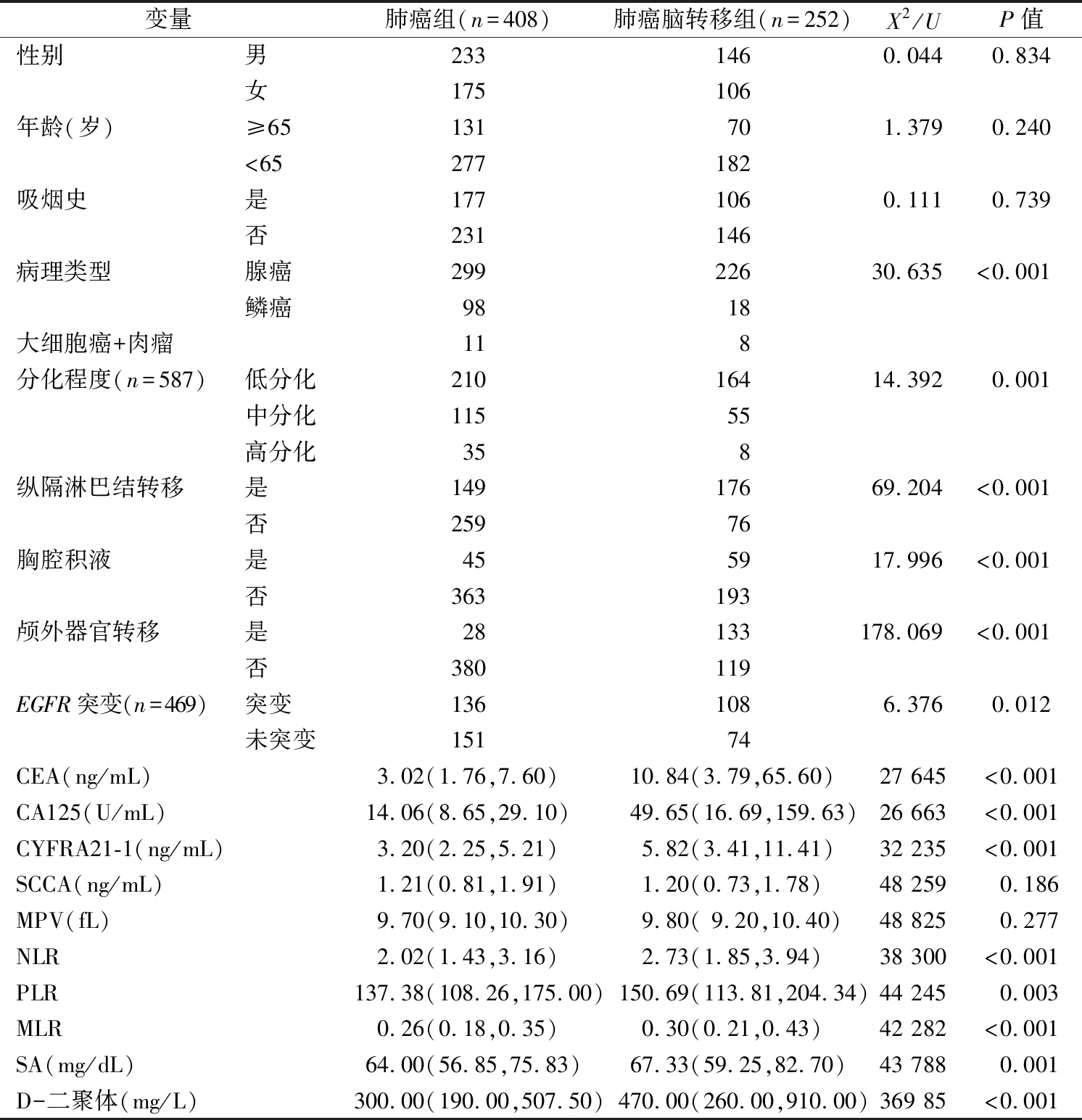
表1 NSCLC脑转移危险因素的单因素分析
2.2单因素分析有意义指标的cut-off值 单因素分析发现,血清CEA、CA125、CYFRA21-1、SA、D-二聚体、NLR、PLR和MLR水平与发生脑转移有关。以肺癌脑转移组作为疾病组,肺癌组作为对照组,采用ROC曲线分析上述各指标诊断NSLCL脑转移的cut-off值,利用这些cut-off值将连续性变量转变为二分类变量,用于进一步多因素分析,结果见表2、图1。
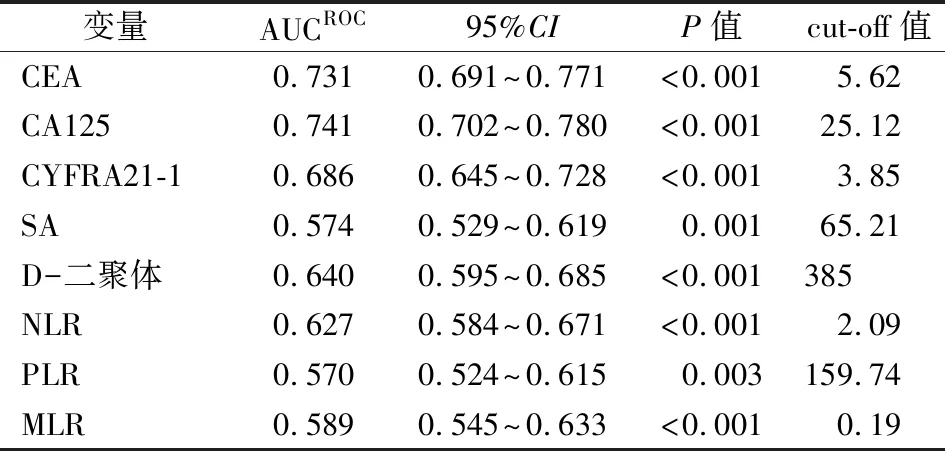
表2 单因素分析有意义指标cut-off值
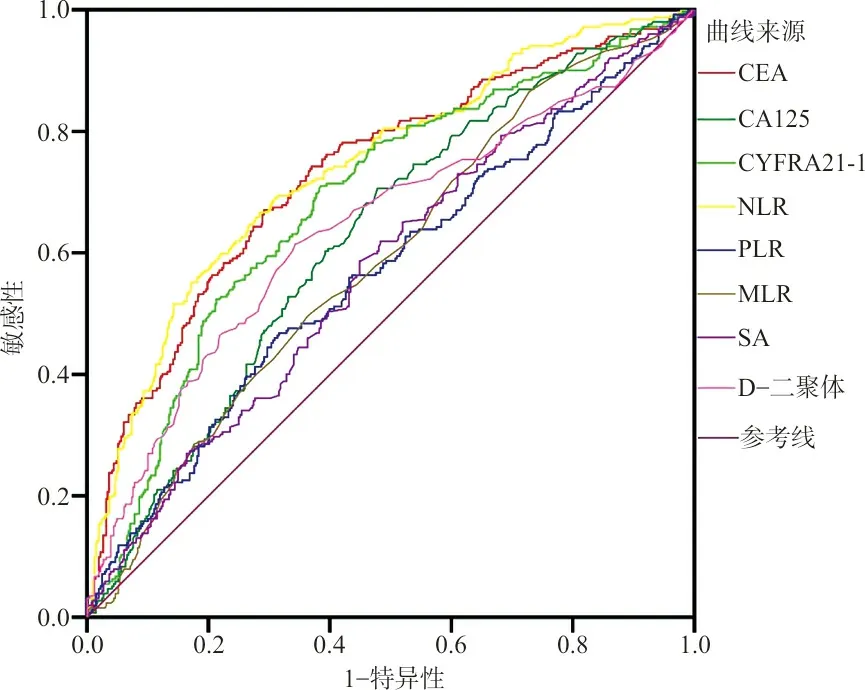
图1 各指标转变为二分类资料的ROC曲线
2.3NSCLC脑转移危险因素的多因素分析 将单因素分析中P<0.05的因素进行Logistic多因素回归分析,结果显示,血清CEA水平≥5.62 ng/mL(OR=2.417,95%CI:1.534~3.810,P<0.001)、CA125水平≥25.12 U/mL(OR=2.172,95%CI:1.311~3.598,P=0.003)、CYFRA21-1水平≥3.85 ng/mL(OR=2.550,95%CI:1.585~4.102,P<0.001)、NLR水平≥2.09(OR=2.389,95%CI:1.374~4.155,P=0.002)、腺癌病理组织学分型(OR=2.597,95%CI:1.239~5.445,P=0.011)、纵隔淋巴结转移(OR=1.737,95%CI:1.081~2.792,P=0.023)、颅外器官转移(OR=5.778,95%CI:3.640~9.172,P<0.001)、EGFR突变(OR=2.883,95%CI:1.859~4.472,P<0.001)是NSCLC脑转移的独立危险因素。其余各指标非NSCLC脑转移的独立危险因素。见表3。
根据表3中Logistic回归的各参数值,得出NSCLC发生脑转移概率预测模型公式:Logit(P)=-3.918+0.883CEA+0.775CA125+0.936CYFRA21-1+0.871NLR+0.552纵隔淋巴结转移+1.754颅外器官转移+0.954腺癌+1.059EGFR突变。通过此模型可得到每例患者的预测概率,利用ROC曲线评价该模型的预测能力,结果显示其ROC曲线下面积(AUCROC)为0.859,根据ROC曲线诊断标准,该模型的诊断准确性为中等。根据约登指数,当cut-off值≥0.427时,其敏感性和特异性最大,分别为0.815、0.766。见图2。
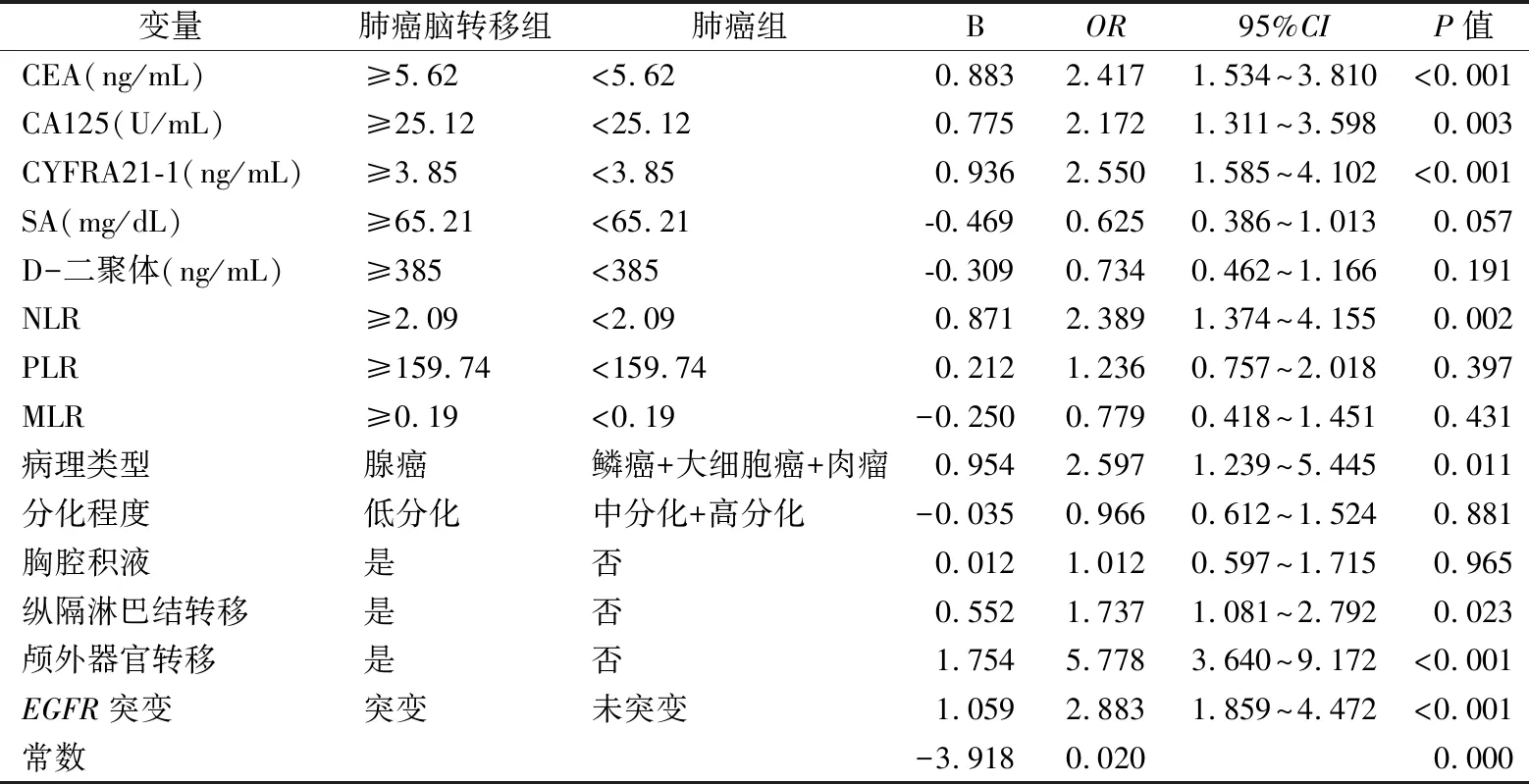
表3 NSCLC脑转移危险因素的Logistic多因素回归分析
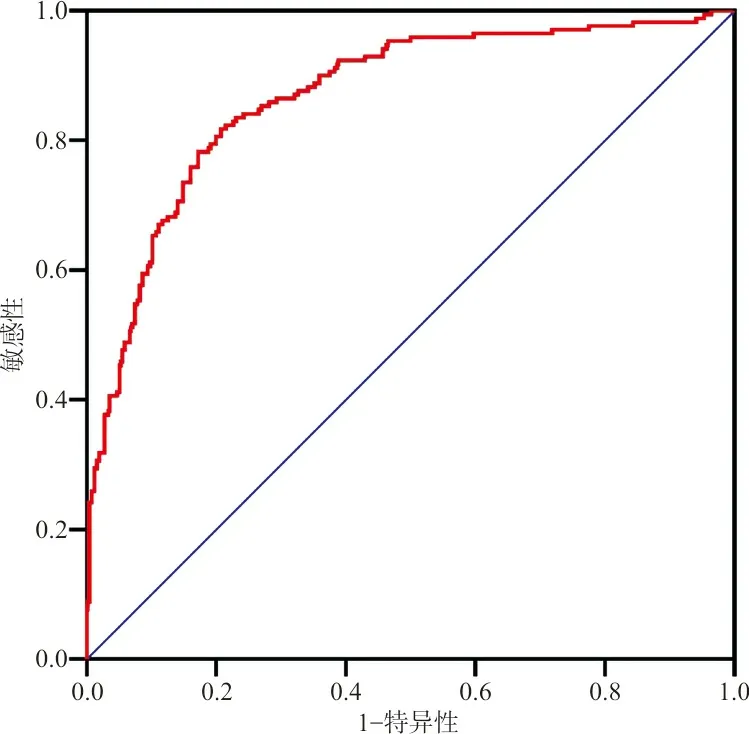
图2 NSCLC脑转移预测能力的ROC曲线
当独立危险因素个数为0时,脑转移发生率为0,随着这些危险因素个数由0增加至8个时,脑转移发生率可升高至94.12%。
3 讨论
血行转移是肺癌常见的转移方式,而脑是晚期NSCLC常见的转移部位。近年来,人们试图建立1个能够准确预测脑转移发生概率的风险评估模型,以便基于该模型预测脑转移的高危患者,进行早期临床干预。肿瘤标志物是由肿瘤细胞产生的生物活性因子,可以释放到体液中被检测出[7],具有创伤小、重复性好、操作简单等优势。理想的肿瘤标志物不仅可以辅助诊断肿瘤,而且可以有效评价疗效及判断预后。单一肿瘤标志物的敏感性较低,常需多种肿瘤标志物联合应用。血清CEA可以通过抑制细胞分化及促进肿瘤血管形成,在肿瘤增殖和转移中发挥重要作用[8]。研究表明,NSCLC脑转移患者血清CEA水平明显升高[9-11]。血清CA125在肺癌中的表达水平亦明显增高[12],并参与癌细胞的扩散和转移[9]。血清CYFRA21-1是NSCLC敏感的肿瘤标志物,其在NSCLC脑转移患者中的表达水平明显高于未脑转移者[9-10]。本研究结果显示,血清CEA水平≥5.62 ng/mL、CA125水平≥25.12 U/mL、CYFRA21-1水平≥3.85 ng/mL是NSCLC脑转移的独立危险因素(P<0.05)。
近年来有资料表明,全身炎症反应与癌症的预后密切相关[13]。NLR是反映机体炎症状态的有效指标,有报道显示NLR>2.5与NSCLC脑转移有关[14]。本研究结果表明,NLR≥2.09是NSCLC脑转移的独立危险因素,结果存在差异可能与地域和种族不同有关。驱动基因突变与肺癌脑转移的相关研究也备受关注,尤其是EGFR突变可作为阳性驱动基因在脑转移中发挥作用[15-16]。本研究结果也证实EGFR突变是NSCLC脑转移的独立危险因素。
NSCLC的转移方式包括血行转移、淋巴结转移和直接蔓延。本研究将血行转移至脑以外器官统称为颅外器官转移,包括骨、肝和肾上腺。淋巴结转移和颅外器官转移不仅是影响NSCLC预后的因素,也是NSCLC发生脑转移的危险因素。以往的报道显示,纵隔淋巴结转移、颅外器官转移与NSCLC脑转移密切相关[17-18]。此外,Naresh等[14]研究表明,腺癌组织学类型是NSCLC脑转移的独立危险因素,本研究结果进一步证实腺癌、纵膈淋巴结转移、颅外器官转移是NSCLC脑转移的独立危险因素。纵观国内外NSCLC脑转移危险因素的报道仅限于对肿瘤标志物或肿瘤驱动基因等单方面的研究,尚未见将二者与炎症指标以及病理因素一并列为研究指标;且国外NSCLC脑转移风险评估对象与我国不同,不能代表我国肺癌患者的疾病发展转归状况,因此,本多因素研究填补了国内该领域的研究空白。
综上所述,血清CEA≥5.62 ng/mL、CA125≥25.12 U/mL、CYFRA21-1≥3.85 ng/mL、NLR≥2.09、EGFR突变、腺癌、纵隔淋巴结转移和颅外器官转移是NSCLC脑转移的独立危险因素。且随着这些危险因素数目从0个依次增加到8个,脑转移的发生率随之增加,因此,可依据该模型来评估脑转移状态,为NSCLC脑转移的早期诊断和防治提供依据。
