BDE-47在紫贻贝中的分布、蓄积、消除和毒性效应
2022-03-29耿倩倩郭萌萌李风铃刘晓玉翟毓秀谭志军
耿倩倩,郭萌萌,李风铃,刘晓玉,2,吴 峰,3,于 鑫,翟毓秀,谭志军,5,6*
BDE-47在紫贻贝中的分布、蓄积、消除和毒性效应
耿倩倩1,郭萌萌1,李风铃1,刘晓玉1,2,吴 峰1,3,于 鑫4,翟毓秀1,谭志军1,5,6*
(1.中国水产科学研究院黄海水产研究所,农业农村部水产品质量安全检测与评价重点实验室,山东 青岛 266071;2.上海海洋大学食品学院,上海 201306;3.青岛科技大学化学与分子工程学院,山东 青岛 266061;4.青岛农业大学植物医学学院,山东 青岛 266109;5.青岛海洋科学与技术试点国家实验室,山东 青岛 266071;6.大连工业大学,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
以紫贻贝()为试验生物,研究了2,2',4,4'-四溴联苯醚(BDE-47)在贻贝组织中的分布、生物蓄积和消除动态,并探究BDE-47对贻贝的毒性作用.结果发现:紫贻贝对BDE-47有较强的生物蓄积能力和一定的消除能力,且蓄积具有组织特异性和浓度依赖性,消化腺和鳃是BDE-47蓄积的靶器官.蓄积和消除阶段各组织中BDE-47含量符合一阶非线性累积/衰减模型.0.01~1μg/L暴露浓度下,BDE-47在贻贝各组织中的半衰期为0.68~7.62d,生物富集系数(BCFs)为3217~140970L/Kg.BDE-47暴露引发消化腺和鳃抗氧化防御系统及组织损伤,其中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和谷胱甘肽-S-转移酶(GST)活性可作为BDE-47暴露的候选生物标志物.
2,2',4,4'-四溴联苯醚(BDE-47);紫贻贝;组织分布;生物蓄积;消除;毒性
BDE-47是环境中丰度较高的多溴联苯醚(PBDEs)同系物之一,在自然环境尤其是海洋环境中分布较广,具有生物蓄积特性和较强的神经毒性、遗传毒性和免疫毒性等,属于新型持久性有机污染物(POPs)[1-4]. BDE-47主要来自电子垃圾拆解区域的废水排泄,也可经高溴代PBDEs脱溴降解生成[5-6]. BDE-47在胶州湾养殖水域浓度可达183.5pg/L[7],在沉积物和海洋生物中的含量分别高达5.50ng/g[8]和29.75ng/g[9].人类经空气、饮水和膳食途径接触BDE-47会引发潜在的健康风险.
贻贝分布范围广,对污染物有较强的蓄积能力和敏感性,是理想的海洋和河口污染指示生物[10].我国山东、浙江和福建等地建有多个氟工业园、溴系阻燃剂工厂和电子垃圾回收拆解工厂,是PBDEs生产和污染排放的重要源头.多种海洋贝类都有PBDEs检出,且BDE-47是主要的检出物,贡献率为38.8%~41.8%[11].目前针对BDE-47蓄积代谢和毒性作用的研究主要针对细胞模型[3,12]、哺乳动物[13]或海洋脊椎动物[14],BDE-47在贻贝组织中的蓄积消除动态和毒性作用的研究较少.
本文以BDE-47污染状况较为严峻的紫贻贝为试验生物,参考环境浓度和生物体BDE-47含量水平,设置梯度暴露实验,探究BDE-47在其各组织中的分布、生物蓄积、消除和毒性作用;构建拟合模型,计算BDE-47在贻贝组织中蓄积和消除动力学参数,明确蓄积靶器官和消除路径;测定抗氧化水平变化,制备组织病理切片,探究贻贝对BDE-47污染的生理生化响应并确定毒性作用靶器官.
1 材料与方法
1.1 试验材料
1.1.1 仪器与试剂 BDE-47(>98%)购自加拿大Wellington Laboratories公司,Captiva EMR-Lipid (6mL,600mg)固相萃取柱购自美国Agilent Technologies公司.HPLC级乙腈、水和二甲基亚砜(DMSO)等购自美国Merck公司.超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量和谷胱甘肽-S-转移酶(GST)活性测定试剂盒购自南京建成生物工程研究所.其他试剂未作说明均为分析纯,购自国药集团化学试剂有限公司.
1.1.2 实验用贝 实验用成年紫贻贝采集自山东青岛胶州湾养殖场,体重(12.9±1.4)g,壳长(5.7±0.74) cm.实验开始前,在洁净过滤海水中暂养10d,水温(15.2±1.9)℃,pH (7.98±0.15),盐度(37.9±2.1)%,期间不断暴氧,每天定时投喂约体重0.06%的螺旋藻粉,暂养期间未发现贻贝死亡.
1.2 试验方法
1.2.1 BDE-47暴露实验 富集与消除实验:以DMSO为助溶剂,配制100μg/mL的BDE-47储备液,实验时用海水稀释到所需浓度.参考环境水体浓度和生物体BDE-47含量水平(pg/L和μg/kg),结合预实验结果,将暴露浓度设置为0.01,0.1,1μg/L,同时设置DMSO和空白海水对照组,每组设置3个平行.将150只紫贻贝随机放入30L暴露溶液中,每24h更换一次相同浓度的暴露溶液,期间定时投喂小球藻粉.暴露试验结束后,将各处理组贻贝转移到洁净海水中净化16d.
1.2.2 BDE-47含量测定 样本采集:在暴露开始后的第1,2,4,8,16和24d,净化的第1,3,5,7,10和16d,各组随机取15~20只贻贝,解剖分离消化腺、鳃、性腺、闭壳肌和外套膜,冻干后研磨成粉末.
样本萃取与仪器分析:BDE-47的提取测定参考Komolafe的方法[15],并根据实际情况优化如下:准确称取0.2g冻干粉,依次加入1.0g氯化钠,10mL乙腈-水(82/20,/),涡旋约30s后置于水浴中超声辅助萃取10min,4000r/min离心5min,取5mL上清液加载于活化后的Captiva EMR-Lipid小柱,保持流速约2mL/min,收集萃取液,40℃氮气吹干,加入1mL正己烷定容.安捷伦7890B气相色谱仪,配备μECD检测器和DB-5MS色谱柱(15m×0.25mm×0.10μm),程序升温条件:100℃保持1min,20℃/min升温至320℃保持5min.进样量:1μL,进样方式:不分流.BDE-47含量以干重计(ng/g dw).
1.2.3 生物蓄积与消除动力学 消除速率常数(e)计算是将BDE-47消除数据按照公式(1)进行一阶非线性拟合:
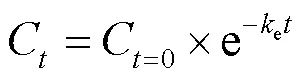
式中:C和C=0是消除实验各取样点贻贝组织中BDE-47含量和净化实验开始时的BDE-47含量, ng/g dw;e是消除速率常数,d-1.
蓄积速率常数(a)是基于e值,按照公式(2)进行拟合:

式中:C是蓄积实验各取样点样本中BDE-47含量, ng/g dw;是暴露溶液中BDE-47浓度,ng/mL;a为蓄积速率常数,mL/(g×d).
消除半衰期(1/2)按照公式(3)计算得出:

生物富集因子(BCF)由蓄积速率常数和消除速率常数比值得出:
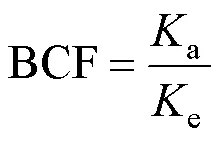
1.2.4 氧化损伤指标检测 在暴露开始后的第8,24d,净化的第16d,各组随机取9~10只贻贝,分离消化腺和鳃组织,置于9倍体积的预冷生理盐水中匀浆,4℃下4000r/min离心10min,取上清液待测.
以超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽-S-转移酶(GST)为测试分子标志物.SOD活性测定选用WST-1法.WST-1和黄嘌呤氧化酶催化产生超氧化物阴离子反应,生成甲臜,该步骤可被SOD抑制.SOD活力以U/mgprot表示.MDA含量测定采用硫代巴比妥酸(TBA)比色法,含量以nmol/mgprot表示;GST活力以谷胱甘肽(GSH)降低的方式反映,活力以U/mgprot表示.
1.2.5 组织切片制备 在暴露实验的第24d,各组随机取10~15只贻贝,冰上解剖分离消化腺和鳃组织,生理盐水清洗后置于Bouin氏液中,4℃固定48h后,转移到梯度乙醇溶液中脱水,之后使用二甲苯、二甲苯-石蜡进行透明处理、浸蜡和包埋,使用切片机制作石蜡切片,切片厚度3~5μm,经过贴片、烤片处理后对切片进行H&E染色,封片后置于显微镜下观察.
1.3 统计分析
实验数据采用Origin 2021软件进行绘图和非线性回归拟合,使用SPSS 20.0软件进行单因素方差统计分析,使用Duncan’s法进行多重比较,显著水平= 0.05.实验数据以均值± SD值表示.
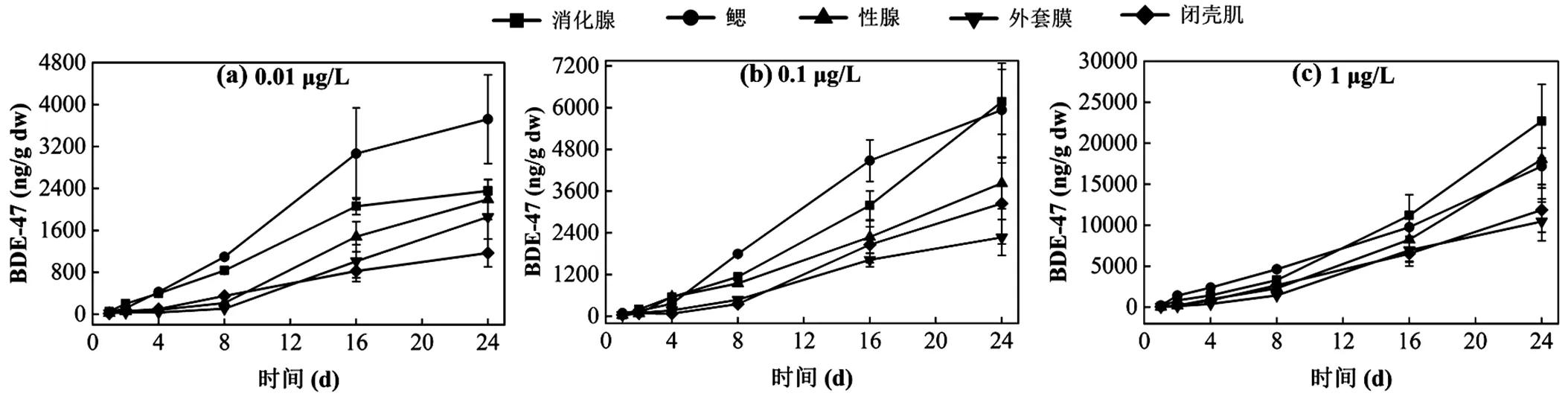
图1 蓄积阶段不同暴露浓度下紫贻贝各组织中BDE-47含量
2 结果与讨论
2.1 贻贝组织中BDE-47分布
暴露实验开始前,随机取各组贻贝测定BDE-47含量,各组BDE-47均在检出限以下(<0.50ng/g dw).试验期间贻贝体重、壳长和干/湿重比均未发生显著变化,说明不存在生长稀释现象.
BDE-47各浓度暴露一段时间后,各取样点贻贝的消化腺、鳃、性腺、外套膜和闭壳肌中BDE-47蓄积水平随暴露时间的延长大致呈线性增加(图1),且各取样点组织中BDE-47的蓄积量与暴露浓度呈正相关.0.01 μg/L暴露组中,鳃和消化腺BDE-47含量增加比其它组织快,暴露24d后,各组织中BDE-47含量顺序为:鳃>消化腺>性腺>外套膜>闭壳肌(图2),其中鳃组织含量为(3720±427)ng/g,是暴露溶液的3.72×105倍,含量水平显著高于其它组织(<0.05);消化腺和性腺中BDE-47含量接近,分别是(2354±214) ng/g,(2190±384)ng/g,约为暴露浓度的2.35×105倍和2.19×105倍;外套膜中BDE-47含量为(1855±422) ng/g,闭壳肌为(1170±267)ng/g是暴露浓度的1.86× 105倍和1.17×105倍.0.1μg/L暴露处理组BDE-47组织含量整体上较0.01μg/L高,除个别组织如闭壳肌和外套膜组织外,在蓄积的1~16d组织分布趋势和0.01μg/L处理组类似,含量顺序为:鳃>消化腺>性腺,且高于闭壳肌和外套膜中BDE-47水平.在第24d,消化腺中BDE-47含量上升较快,略高于鳃组织,此时各组织中BDE-47含量顺序为:消化腺>鳃>性腺>闭壳肌>外套膜,消化腺和鳃组织中的BDE-47含量显著高于其余组织(<0.05),各组织中BDE-47蓄积量分别是暴露浓度的6.17×104倍、5.93×104倍、3.83×104倍、3.23×104倍和2.27×104倍.较高浓度处理组(1μg/L)各取样点的贻贝组织间蓄积浓度差异较0.01和0.1μg/L减小,蓄积的后半段(12~24d),各组织间BDE-47含量水平顺序发生变化:消化腺和性腺蓄积BDE-47速度逐渐高于鳃组织,到第24d时BDE-47含量水平排序为:消化腺>性腺>鳃>闭壳肌>外套膜,消化腺、性腺、鳃之间的BDE-47水平差异不显著,但都显著高于闭壳肌和外套膜(<0.05),组织中BDE-47含量分别是暴露溶液浓度的2.27× 104倍、1.80×104倍、1.72×104倍、1.19×104倍和1.05×104倍.

图2 贻贝各组织中BDE-47含量百分比(24d)
各浓度处理组中,各取样时间点的贻贝消化腺、鳃和性腺中BDE-47含量均高于其余组织,说明BDE-47在贻贝组织中的分配具有特异性,消化腺、鳃和性腺较其它组织对BDE-47有更强的蓄积性.贻贝鳃的鳃片和细微鳃丝结构,相对表面积大,有助于其从外界环境快速吸收污染物,并借助血液循环将污染物分配到其它组织,因此,在1~16d各浓度处理组贻贝中鳃蓄积较多的BDE-47;随暴露时间延长,极性较弱的BDE-47更倾向于在脂质含量较高的消化腺中转移分布(0.01μg/L和0.1μg/L处理组),高浓度处理组(1μg/L)的性腺中BDE-47的分布比例也有升高.消化腺包含贻贝的肝胰腺等脏器,是解毒代谢的关键部位,易于蓄积污染物.外套膜和闭壳肌蓄积BDE-47的能力相对较弱,这可能与外套膜快速消除速率和闭壳肌的低吸收速率有关.
以上结果表明消化腺是BDE-47蓄积的靶器官,这一发现与PBDEs同系物和其它有机污染物在哺乳动物如小鼠[16]、猪[17]、鸟类[18]、水生生物如鱼类和海龟[19]等组织中的分布类似:污染物的蓄积和代谢主要发生在脊椎动物的肝脏部位.
2.2 贻贝组织中BDE-47生物蓄积与消除特征
各浓度处理组的贻贝组织在暴露开始后的48h即可检测到较高浓度的BDE-47,在整个蓄积阶段BDE-47在贻贝各组织中大致呈线性增长,呈浓度依赖性,且BDE-47的分布具有组织特异性(图3).各处理组的贻贝组织中BDE-47含量在净化阶段的1~7d降低明显,在之后的7~14d趋于平缓.整贝(软组织)与各组织中BDE-47的蓄积和清除趋势一致.与蓄积24d的含量相比,净化14d后,各组织/整贝中仍有14.5%~22.1%(0.01μg/L)、7.5%~30.1%(0.1μg/L)和10.1%~30.7%(1μg/L)BDE-47残余,其中残留量较高的组织为消化腺、鳃和性腺,以1μg/L暴露组为例,残留量分别为6261,4234,5129ng/g dw, BDE-47在贻贝中存在残留风险.
蓄积和消除阶段各组织中BDE-47含量符合一阶非线性累积/衰减模型,相关系数范围为0.7801~0.9979.拟合所得消除速率常数(e)、消除半衰期(1/2)、蓄积速率常数(a)和生物富集系数(BCF)列于表1.消化腺、鳃和性腺a值普遍高于其它组织,对BDE-47有较强的蓄积能力;外套膜的e值相对较大,闭壳肌最小,说明外套膜有可能是BDE-47清除的主要部位;除整贝组织外,消化腺、闭壳肌和鳃的消除半衰期较长,所有暴露组中外套膜的消除半衰期最短.此外,消化腺、鳃和性腺的 BCF也高于其它组织.拟合常数中,a值、BCF与暴露浓度呈负相关,消除半衰期1/2与暴露浓度呈正相关,即暴露浓度越高,消除半衰期越长.与已有研究结果相比,BDE-47在贻贝整贝中蓄积和消除规律基本一致[20],但本研究的a值高于文献值,这与暴露浓度、时间和计算方式有关.

14C标记的BDE-47在蛋白核小球藻和大型溞中蓄积和消除研究结果与本研究类似[21],均是经历线性蓄积-短暂快速消除-消除趋于平稳3个阶段,不同的是BDE-47在小球藻和大型溞体内蓄积并快速达到平衡,且消除所需时间较短,说明BDE-47在生物体内的蓄积和消除存在物种差异性,这是由于不同生物的生理结构导致其吸收和清除过程的差异.
以上结果说明BDE-47可在紫贻贝组织中蓄积和消除,且蓄积具有组织特异性和浓度依赖性,贻贝对低浓度BDE-47的蓄积作用更强.消除14d后,仍有相当比例的BDE-47残留在贻贝组织中,说明BDE-47在贻贝组织中有残留风险.
2.3 BDE-47对贻贝毒性效应
本研究基于解毒代谢相关酶活性等防御型生物标志物对污染物反应灵敏的特点,以及组织病理损伤可准确反映污染物毒性效应的特点,选取抗氧化酶等指标,结合病理切片观察,选取蓄积代谢靶器官,探究BDE-47暴露胁迫对贻贝的毒性作用.
2.3.1 BDE-47对贻贝的氧化损伤 氧化损伤也是评估污染物生态毒理的重要指标,研究表明BDE-47暴露会引起多种生物体氧化酶活性、生物标志物水平及相关基因表达紊乱[14,22].本研究基于蓄积和清除实验结果,测定蓄积第8,24d和清除阶段第16d(实验第40d)的靶器官(消化腺和鳃组织)的氧化代谢酶活性(SOD和GST)、膜脂过氧化指标MDA水平(图4).空白对照组SOD活性水平在各取样时间点变化不大,各浓度处理组消化腺SOD活性在蓄积的第8,24d均显著高于对照组(<0.05),低浓度处理组之间差异不显著,1μg/L处理组显著高于其他两组(<0.05).清除16d后,各处理组SOD活性均有所降低,但未恢复至对照组水平.鳃组织SOD含量变化趋势与消化腺类似:蓄积和清除阶段处理组较对照组SOD活性上升,除第8d的0.01μg/L处理组外,均达到显著性水平(<0.05).SOD酶是抗氧化系统的重要组成部分,是生物体内重要的抗氧化酶,可以将氧自由基(·O2-)歧化为H2O2和O2,保护机体免受过氧化损伤.本研究中贻贝消化腺和鳃中SOD含量显著升高,说明BDE-47暴露造成氧化胁迫,且暴露浓度越高,氧化胁迫作用越明显,贻贝抗氧化系统响应, SOD活性受诱导升高以清除过量的氧自由基(·O2-).这与之前BDE-47胁迫增强细胞或个体水平的活性氧生成的报道一致[22-23].解除胁迫后,贻贝SOD水平有所降低,但未恢复至对照水平,说明贻贝消化腺和鳃组织中氧化胁迫程度减轻,未恢复至正常水平可能与组织中BDE-47并未完全清除,仍存在氧化胁迫作用有关.

表1 BDE-47在贻贝各组织和整贝中拟合所得Ke、t1/2、Ka和BCF
蓄积阶段消化腺和鳃组织MDA含量变化与SOD十分类似:与对照组相比,处理组MDA含量升高,且呈现浓度依赖特征(图4c,d).消除阶段(40d)各组织MDA含量总体高于对照组,但变化不显著(>0.05).生物体内MDA主要来自不饱和脂肪酸的氧化,其含量变化与膜脂过氧化有关[24].BDE-47暴露引发贻贝消化腺和鳃组织中MDA累积,间接说明SOD并未将氧自由基(·O2-)完全清除,由此引发膜脂过氧化损伤,在实验浓度范围内,该损伤与暴露浓度呈正相关.经历16d清除后,贻贝组织中BDE-47含量显著降低,膜脂过氧化程度随之降低,恢复至对照组水平,说明贻贝对BDE-47胁迫损伤具有一定程度的自我修复能力.MDA的研究结果与BDE-47对鱼类、苔藓和浮游植物等的影响研究一致[25-26]:MDA受污染物诱导升高.与SOD和MDA变化不同,GST活性在蓄积的第8d低于对照组,第24d活性升高(图4e,f),部分处理组变化显著(<0.05).与对照组相比,清除阶段(40d)贻贝消化腺和鳃中GST含量均有所降低,但仅有鳃组织恢复至对照组水平.GST是生物体解毒代谢的关键酶,催化GSH与污染物亲电基团结合,继而排出体外,同时具有清除体内过氧化物的功能.暴露初期GST活性受抑制,或与组织内蓄积的BDE-47占据GST催化位点有关[27];后期活性受诱导,与组织内GST相关抗氧化酶系被激活有关.本研究中紫贻贝GST活性变化趋势与在罗非鱼[28]和紫贻贝中[20]的报道一致,而在菲律宾蛤仔中,低浓度BDE-47对GST活性有诱导作用,高浓度表现为抑制作用[29].造成这一差异的主要原因有2点,一是暴露浓度的选择差异,二是不同物种对外界污染物胁迫的响应差异.综上,BDE-47暴露引发贻贝消化腺和鳃组织氧化胁迫,其中SOD活性、MDA含量和GST活性水平变化显著,对BDE-47暴露敏感,可作为BDE-47污染的潜在生物标志物.
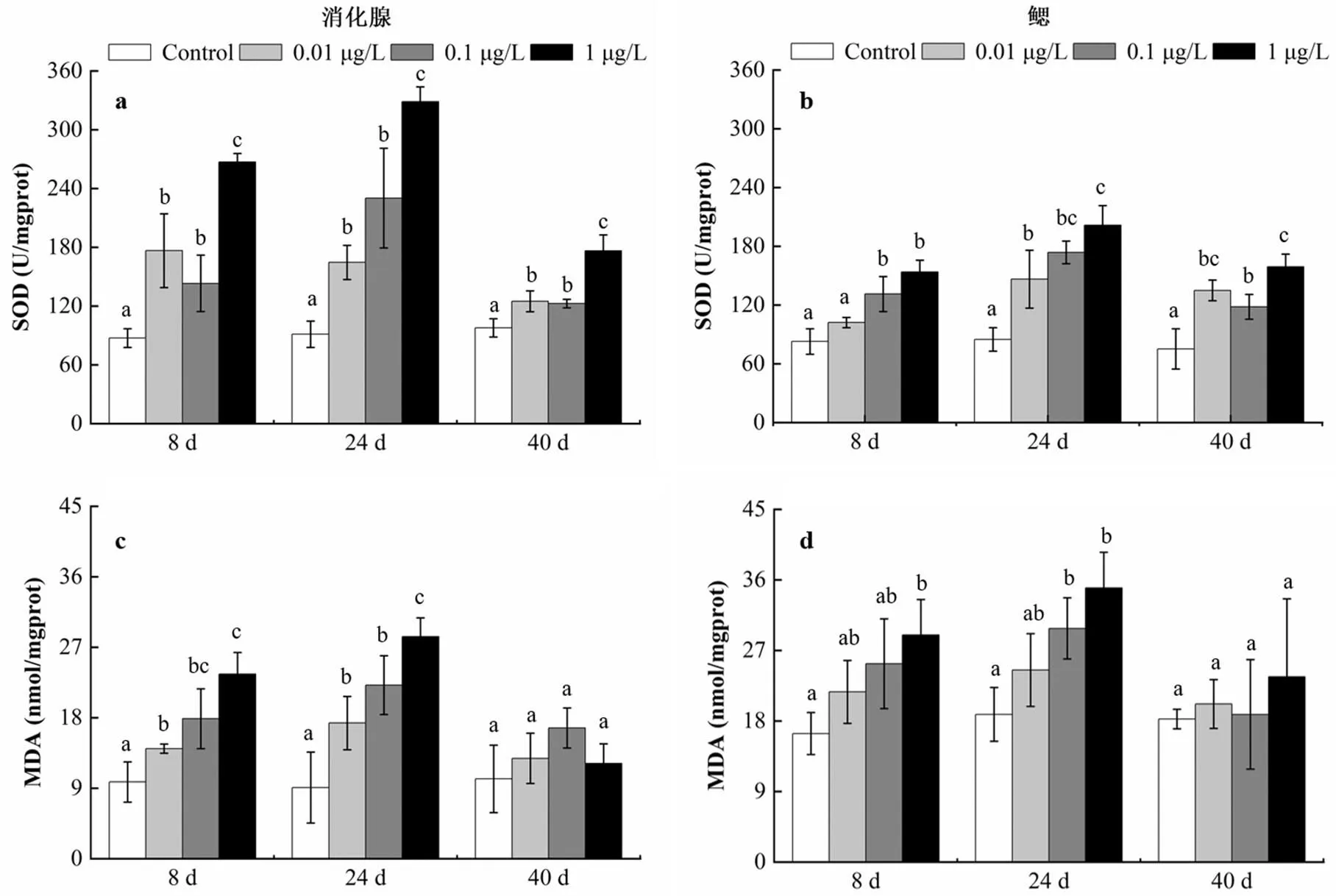
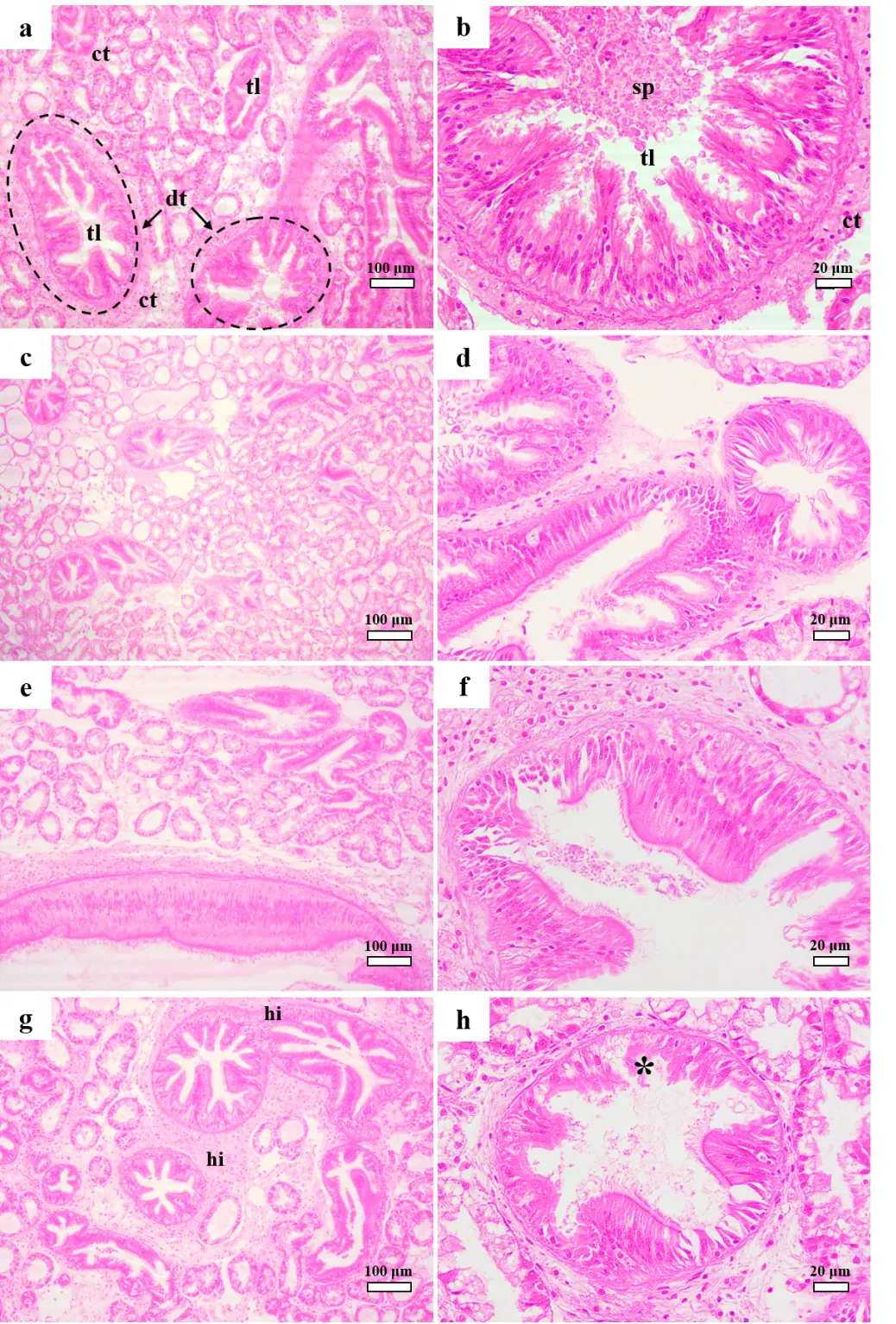
图5 紫贻贝消化腺HE染色显微照片(24d)
a,b:对照组;c,d:0.01μg/L暴露组;e,f:0.1μg/L暴露组;g,h: μg/L暴露组.(ct:连接组织;dt:消化管;sp:分泌物;tl:管腔;hi:血细胞浸润;*:细胞缺失)
2.3.2 贻贝消化腺和鳃组织的病理变化 各浓度BDE-47 暴露24d后,由图5和图6可见,对照组(图5a,b)结构正常的消化管(dt),单层上皮细胞和嗜碱性粒细胞围绕消化管整齐排列,管腔内(tl)可见分泌物(sp);消化管外分布纤维组织和血细胞构成的连接组织(ct).与对照组相比,0.01和0.1μg/L处理组消化腺组织未发生明显改变,仅在较高浓度处理组(1μg/L处理组)观察到消化管组织脱落(*)和血细胞浸润(hi)损伤.
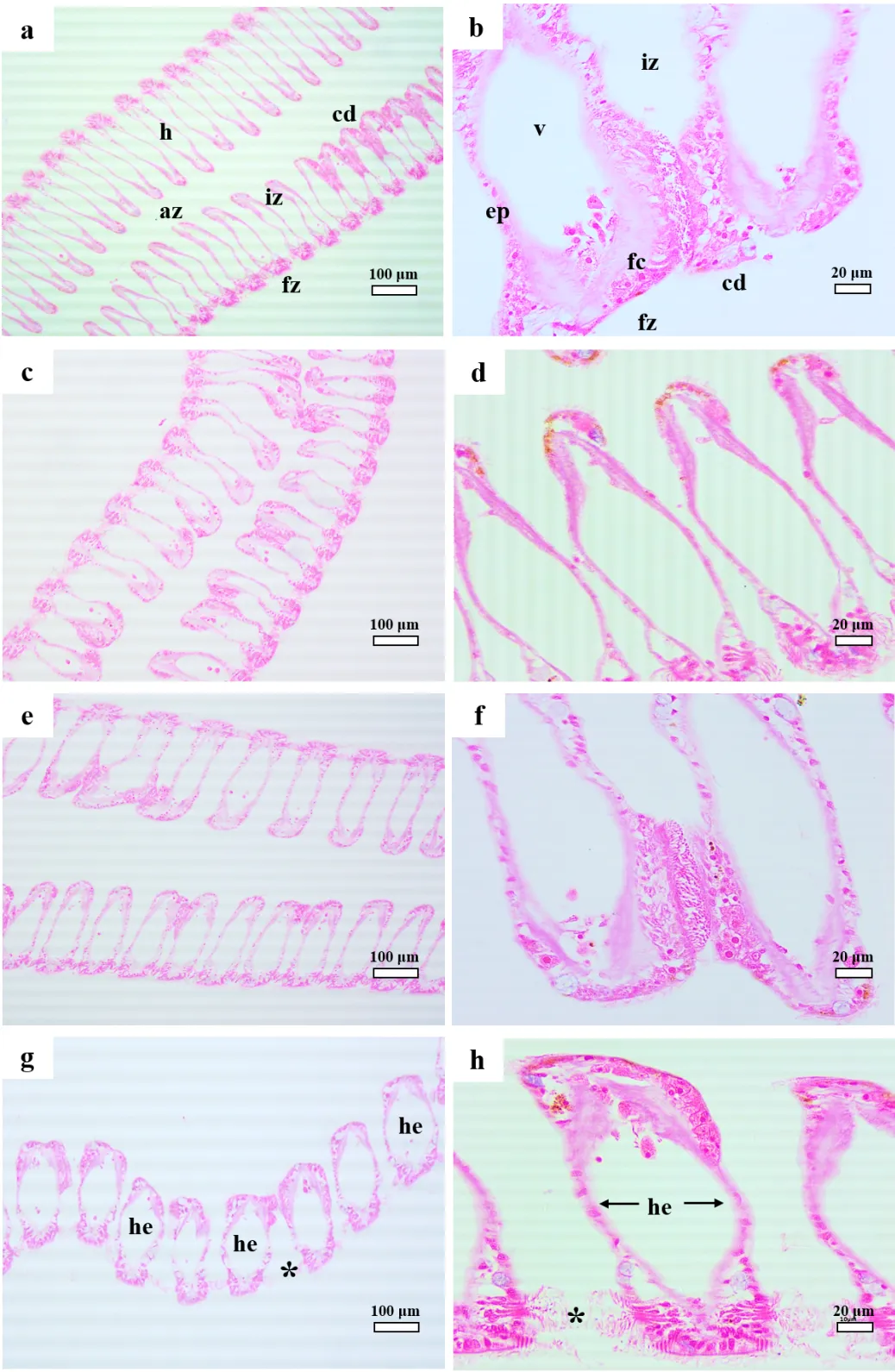
图6 紫贻贝鳃的HE染色显微照片(24d)
a,b:对照组;c,d:0.01μg/L暴露组;e,f:0.1μg/L暴露组;g,h:1μg/L暴露组.(az:内侧区,cd:睫状盘,ep:上皮细胞,fc:额叶细胞,fz: 额区,h:血细胞,iz:间区,v:血淋巴管, he:水肿,hi:血细胞浸润)
类似地,贻贝鳃组织HE染色切片的显微图片中可见结构正常的睫状盘(cd)、上皮细胞(ep)、额叶细胞(fc)和血淋巴管(v)等鳃丝结构(图6a,b).0.01和0.1μg/L处理组鳃组织形态未发生明显改变,仅有轻微水肿现象;而1μg/L处理组血淋巴管发生明显水肿(he)和组织脱落(*),说明BDE-47累积造成贻贝鳃结构损伤(图6g,h).
病理切片结果表明低浓度BDE-47暴露对贻贝消化腺和鳃组织结构的影响较小,高浓度BDE-47 (1μg/L)暴露引发消化腺和鳃结构损伤.组织病理学的变化如水肿和组织脱落通常与外源有毒物质的蓄积引发的膜脂过氧化损伤有关,高浓度处理组贻贝消化腺和鳃蓄积了较高浓度的BDE-47,引发氧化胁迫,造成抗氧化系统紊乱,过量的氧自由基(·O2-)引发组织损伤.组织病理切片结果与BDE-47生物蓄积、分布和氧化损伤的结果一致.研究表明,较低浓度的BDE-47或者其它PBDEs同系物暴露可引发多种生物的组织损伤,如斑马鱼胚胎眼结构损伤、心脏水肿和大鼠肝损伤等[30-31].与贻贝有关的病理切片研究结果表明,低浓度BDE-47暴露并未引发贻贝较为明显的组织损伤[32],这与本研究结果类似.说明贻贝对BDE-47污染具有较强的耐受性,但考虑到其高蓄积能力、残留特性和氧化损伤,BDE-47对贻贝的长期影响不容忽视.
3 结论
3.1 紫贻贝对BDE-47有很强的生物蓄积能力和一定的清除能力,消化腺和鳃是BDE-47蓄积的靶器官,外套膜是重要的BDE-47的清除组织.蓄积和消除阶段BDE-47含量符合一阶非线性累积/衰减模型,0.01~1μg/L暴露浓度下,BDE-47在贻贝各组织中的半衰期为0.68~7.62d,生物富集系数(BCFs)为3217~140970L/kg.
3.2 BDE-47暴露引发贻贝组织氧化胁迫,且氧化胁迫程度与暴露浓度呈正相关;SOD活性、MDA含量和GST活性对BDE-47暴露敏感,可作为BDE-47污染的候选生物标志物.
3.3 贻贝对低浓度的BDE-47暴露有较强的耐受性,当暴露浓度或者组织内BDE-47蓄积量超出耐受限度时,引发组织损伤.因此,贻贝可以作为环境中较低浓度BDE-47蓄积的媒介生物,食用BDE-47污染的贻贝对人体具有潜在的健康风险.
[1] Burreau S, Zebühr Y, Broman D, et al. Biomagnification of PBDEs and PCBs in food webs from the Baltic Sea and the northern Atlantic Ocean [J]. Science of the Total Environment, 2006,366(2/3):659-672.
[2] Ta T A, Koenig C M, Golub M S, et al. Bioaccumulation and behavioral effects of 2,2',4,4'-tetrabromodiphenyl ether (BDE-47) in perinatally exposed mice [J]. Neurotoxicology and Teratology, 2011, 33(3):393-404.
[3] 曹璐璐,李 斐,吴惠丰.BDE-47对人胚肾细胞HEK293的毒理效应及作用机制 [J]. 生态毒理学报, 2015,10(2):236-242.
Cao L L, Li F, Wu H F. The toxicological effects and mechanisms of BDE-47on HEK293cells [J]. Asian Journal of Ecotoxicology, 2015, 10(2):236-242.
[4] 吉贵祥,石利利,刘济宁,等.BDE-47对斑马鱼胚胎-幼鱼的急性毒性及氧化应激作用 [J]. 生态毒理学报, 2013,8(5):731-736.
Ji G X, Shi L L, Liu J N, et al. Acute toxicity and oxidative stress effects of BDE-47 on zebrafish embryos and larvae [J]. Asian Journal of Ecotoxicology, 2013,8(5):731-736.
[5] Gandhi N, Bhavsar S P, Gewurtz S B, et al. Can biotransformation of BDE-209 in lake trout cause bioaccumulation of more toxic, lower- brominated PBDEs (BDE-47,-99) over the long term? [J]. Environment International, 2010,37(1):170-177.
[6] 张付海,陆光华,张 敏.多溴联苯醚在生物体内的代谢转化及代谢产物的生态毒理效应研究进展 [J]. 环境与健康杂志, 2013,(3): 266-270.
Zhang F H, Lu G H, Zhang M. Metabolic transformation of polybrominated diphenyl ethers (PBDEs) in organisms and the ecotoxicological effect of their metabolites: a review of recent studies [J]. Journal of Environmental Health, 2013,(3):266-270.
[7] 周明莹,张惠珍,夏 斌,等.多溴联苯醚在胶州湾养殖水域含量水平与分布 [J]. 海洋环境科学, 2010,(6):884-888.
Zhou M Y, Zhang H Z, Xia B, et al. Residue levels and distribution character of PBDEs in aquaculture zone of Jiaozhou Bay [J]. Marine Environmental Science, 2010,(6):884-888.
[8] Jin J, Liu W, Wang Y, et al. Levels and distribution of polybrominated diphenyl ethers inplant, shellfish and sediment samples from Laizhou Bay in China [J]. Chemosphere, 2008,71:1043-1050.
[9] Liu X, Jiao Y, Lin C, et al. PBDEs, hydroxylated PBDEs and methoxylated PBDEs in bivalves from Beijing markets [J]. Chemosphere, 2014,110:97-103.
[10] Beyer J, Green N W, Brooks S, et al. Blue mussels (spp.) as sentinel organisms in coastal pollution monitoring: a review [J]. Marine Environmental Research, 2017,130:338-365.
[11] 夏 斌,周明莹,陈碧鹃,等.胶州湾养殖区贝类生物体中多溴联苯醚的分布特征 [J]. 海洋环境科学, 2010,(6):879-883.
Xia B, Zhou M Y, Chen B J, et al. Distribution of polybrominated diphenyl ethers in shellfish species in culture area of Jiaozhou Bay [J]. Marine Environmental Science, 2010,(6):879-883.
[12] Saquib Q, Siddiqui M A, Ahmed J, et al. Hazards of low dose flame-retardants (BDE-47and BDE-32): influence on transcriptome regulation and cell death in human liver cells [J]. Journal of Hazardous Materials, 2016,308(may 5):37-49.
[13] Yang C, Zhu L, Kang Q, et al. Chronic exposure to tetrabromodiphenyl ether (BDE-47) aggravates hepatic steatosis and liver fibrosis in diet-induced obese mice [J]. Journal of Hazardous Materials, 2019,378:120766.
[14] Leo-Buchir J, Folle N, Souza T, et al. Effects of trophic 2,2′, 4,4′-tetrabromodiphenyl ether (BDE-47) exposure in: a multiple biomarkers analysis [J]. Environmental Toxicology and Pharmacology, 2021,(1/2):103693.
[15] Komolafe O, Bowler B, Dolfing J, et al. Quantification of polybrominated diphenyl ether (PBDE) congeners in wastewater by gas chromatography with electron capture detector (GC-ECD) [J]. Analytical Methods, 2019,11(27):3474-3482.
[16] Dunnick J K, Pandiri A R, Merrick B A, et al. Mutational analysis of pentabrominated diphenyl-induced hepatocellular tumors in rats and mice, tissue levels of PBDE congeners in rats and mice, and AHR genotyping of Wistar Han rats [J]. Data in Brief, 2018,21(1):2125- 2128.
[17] Li Y F, Yang Z Z, Wang C H, et al. Tissue distribution of polybrominated diphenyl ethers (PBDEs) in captive domestic pigs,, from a village near an electronic waste recycling site in south China [J]. Bulletin of Environmental Contamination & Toxicology, 2017,84(2):208-211.
[18] Zheng S, Pu W, Sun H, et al. Tissue distribution and maternal transfer of persistent organic pollutants in kentish plovers () from Cangzhou wetland, Bohai Bay, China [J]. Science of the Total Environment, 2017,612:1105-1113.
[19] Weltmeyer A, Dogruer G, Hollert H, et al. Distribution and toxicity of persistent organic pollutants and methoxylated polybrominated diphenylethers in different tissues of the green turtle[J]. Environmental Pollution, 2021,277:116795.
[20] Vidal-Liñán L, Bellas J, Fumega J, et al. Bioaccumulation of BDE-47 and effects on molecular biomarkers acetylcholinesterase, glutathione- s-transferase and glutathione peroxidase in mytilus galloprovincialis mussels [J]. Ecotoxicology, 2015,24(2):292-300.
[21] Liu C, Wang B, Zhou B, et al. The responses ofcoping with BDE-47stress via PXR-mediated detoxification and NRF2-mediated antioxidation system [J]. Aquatic Toxicology, 2019, 207:63-71.
[22] 潘鲁青,宫晓莉,许超群,等.四溴联苯醚对菲律宾蛤仔组织解毒代谢基因表达的影响 [J]. 中国水产科学, 2012,19(2):294-300.
Pan L Q, Gong X L, Xu C Q, et al. Effects of tetrabromodiphenyl ether (BDE-47) on the metabolic gene expression in the gills and digestive glands of[J]. Journal of Fishery Sciences of China, 2012,19(2):294-300.
[23] Liu X H, Wang J, Lu C Q, et al. The role of lysosomes in BDE- 47-mediated activation of mitochondrial apoptotic pathway in HepG2cells [J]. Chemosphere, 2015,124:10e21.
[24] Del Rio D, Stewart A J, Pellegrini N. A review of recent studies on malondial-dehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition, Metabolism, and Cardiovascular Diseases, 2005,15:316-328.
[25] Liu Y, Feng Y, Li J, et al. The bioaccumulation, elimination, and trophic transfer of BDE-47 in the aquatic food chain of[J]. Environmental Pollution, 2019,258: 113720.
[26] Zhao J, Zhang M, Zhang W, et al. Insight into the tolerance, biochemical and antioxidative response in three moss species on exposure to BDE-47 and BDE-209 [J]. Ecotoxicology and Environmental Safety, 2019,181:445-454.
[27] Li F, Wu H, Wang Q, et al. Glutathione S-transferase (GST) gene expression profiles in two marine bivalves exposed to BDE-47and their potential molecular mechanisms[J]. Chinese Journal of Oceanology and Limnology, 2015,33(3):705-713.
[28] 肖 丹,王海燕,韩大雄,等.4种典型溴代阻燃剂对离体条件下罗非鱼肝脏抗氧化系统影响的研究[J].环境科学学报, 2014,34(11): 2956-2962.
Xiao D, Wang H Y, Han D X, et al. Effects of four typical brominated flame retardants on hepatic antioxidant system ofin vitro [J]. Acta Scientiae Circumstantiae, 2014,34(11):2956-2962.
[29] 许超群,潘鲁青,王 琳.四溴联苯醚(BDE-47)对菲律宾蛤仔组织解毒代谢酶活力与DNA损伤的影响[J].海洋环境科学, 2011, (5):653-658.
Xu C Q, Pan L Q, Wang L. Effects of tetrabromodiphenyl ether (BDE-47) on metabolic enzymes and DNA damages in tissues of[J]. Marine Environmental Science, 2011,(5): 653-658.
[30] Zezza D, Tait S, Salda L D, et al. Toxicological, gene expression and histopathological evaluations of environmentally realistic concentrations of polybrominated diphenyl ethers PBDE-47, PBDE- 99 and PBDE-209 on zebrafish embryos [J]. Ecotoxicology and Environmental Safety, 2019,183:109566.
[31] Krs A, Mcc B, Dem B, et al. Comparative toxicity and liver transcriptomics of legacy and emerging brominated flame retardants following 5-day exposure in the rat [J]. Toxicology Letters, 2020,332: 222-234.
[32] Messina C M, Ruiz C E, Regoli F, et al. BDE-47 exposure modulates cellular responses, oxidative stress and biotransformation related- genes in mytilus galloprovincialis [J]. Fish & Shellfish Immunology, 2020,107(Pt B):537-546.
Tissue distribution, accumulation, elimination characteristics and toxicity of 2,2',4,4'-tetrabromodiphenyl ether in blue mussel.
GENG Qian-qian1, GUO Meng-meng1, LI Feng-ling1, LIU Xiao-yu1,2, WU feng1,3, YU Xin4, ZHAI Yu-xiu1, TAN Zhi-jun1,5,6*
(1.Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;2.College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;3.College of Chemistry and Molecular Engineering, Qingdao University of Science and Technology, Qingdao 266061, China;4.College of Plant Medicine, Qingdao Agricultural University, Qingdao 266109, China;5.Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;6.Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University, Dalian 116034, China)., 2022,42(3):1385~1393
The distribution, bioaccumulation and elimination dynamics of 2,2',4,4'-tetrabromodiphenyl ether (BDE-47) in mussel () tissues were studied, and the toxic effects of BDE-47 on mussel were investigated. Results showed that blue mussel had strong bioaccumulation ability and certain elimination ability to BDE-47, and the accumulation was tissue-specific and concentration-dependent. Digestive gland and gill were the target organs where BDE-47 accumulated. The content of BDE-47 in tissues at accumulation or elimination stage accorded with the first-order nonlinear accumulation/attenuation model. The elimination half-life and bioconcentration factors (BCFs) of BDE-47 in mussel tissues were 0.68~7.62d and 3217~140970L/Kg under 0.01~1μg/L exposure solution, respectively. BDE-47exposure induced antioxidant defence system and tissue damages in both digestive gland and gill. Superoxide dismutase (SOD) activity, malondialdehyde (MDA) content and glutathione-S-transferase (GST) activity can be used as candidate biomarkers of BDE-47exposure.
2,2',4,4'-tetrabromodiphenyl ether (BDE-47);blue mussel;tissue distribution;bioaccumulation;elimination;toxicity
X174
A
1000-6923(2022)03-1385-09
耿倩倩(1989-),女,河南商丘人,助理研究员,博士,主要从事水产品中污染物形成过程与风险评价.发表论文6篇.
2021-08-09
山东省自然科学基金资助项目(ZR2020QD093);中国博士后科学基金资助项目(2019M662470,2020T130722);青岛市应用研究项目(2019);中国水产科学研究院基本科研业务费资助项目(2020TD71)
*责任作者, 研究员, tanzj@ysfri.ac.cn
