聚苯乙烯微塑料对糖尿病小鼠肾脏的影响
2022-03-29张静丽陈建秋
李 欢,刘 苏,张静丽,陈建秋
聚苯乙烯微塑料对糖尿病小鼠肾脏的影响
李 欢,刘 苏,张静丽,陈建秋*
(中国药科大学工学院,江苏 南京 211198)
以糖尿病小鼠为模式生物,探究了100nm和5μm的聚苯乙烯微塑料(PSMPs)(200μg/L)通过饮水暴露28d后对小鼠肾脏的毒性.结果表明,糖尿病小鼠对PSMPs的暴露更加敏感,100nm和5μm PSMPs暴露导致糖尿病小鼠肾脏出现明显的炎性细胞浸润和淤血等病理损伤,且100nm PSMPs对肾脏造成的病理损伤更为严重.此外100nm PSMPs暴露显著加剧了糖尿病小鼠肾脏炎症因子(TNF-α和IL-6)、超氧化物歧化酶(SOD)和血清肌酐表达水平,并导致肾脏代谢紊乱.与5μm PSMPs相比,100nm PSMPs暴露呈现出的小粒径毒性效应可能与纳米级别PSMPs更易透过肠道屏障在肾脏中累积有关.此外,肾脏代谢通路紊乱引起的糖酵解能力受损和能量代谢水平降低也增加了PSMPs对糖尿病小鼠肾脏的负荷.
聚苯乙烯微塑料;糖尿病小鼠;肾脏;炎症;氧化损伤
微塑料(MPs),粒径小于5mm的塑料颗粒[1],能在环境中长时间迁徙和积累,导致其在海洋、湖泊和陆地环境中被频繁检测到[2].MPs的化学结构稳定且不易降解,进入到环境中不仅对水生和陆地动物有害,还可以通过诸多途径进入哺乳动物甚至人类体内对人类健康造成极大威胁.
MPs可以在生物肠道中积累,并可透过肠道屏障通过循环系统进入其他脏器[3].生物体内MPs的累积对其正常生理功能造成许多不良影响.例如被鱼类误食的MPs可诱导肠道微绒毛损伤,并造成肠道细胞的破裂,产生炎症效应[4].累积在肝脏中MPs可显著诱导小鼠肝脂质紊乱[5].近年来针对MPs毒性的研究主要集中在对肠道和肝脏的毒性效应,对肾脏的影响还研究较少.已有研究表明,经口摄入的MPs随着时间的推移在生物体的肠道、肝脏和肾脏均有明显的累积[6].累积在哺乳动物甚至人类肾脏中的MPs对肾脏的正常生理功能具有潜在的威胁.
糖尿病是一种特征为慢性多病因代谢疾病,糖尿病的发生与病情的加重已不仅限于遗传、肥胖、不良的饮食习惯和生活方式等传统危险因素,环境污染物也影响着糖尿病进程[7-8].研究发现,双酚A的暴露使得小鼠胰岛巨噬细胞的相对数量明显减少,小鼠内膜巨噬细胞的吞噬功能降低,加速了小鼠糖尿病发展[9].糖尿病患者中肾脏功能不全已得到了广泛的报道,其主要的病理表现为肾功能衰竭,代谢紊乱等[10].对于健康人群,完整的肾脏功能在代谢废物和有毒物质的排泄中发挥着重要的作用.肾脏正常功能如果进一步受到破坏,可能会对糖尿病人群的健康造成威胁[11].
本文选择检出频率高、毒性作用明显的聚苯乙烯微塑料(PSMPs) (100nm和5μm)作为研究对象,通过饮水暴露(200μg/L),同等处理健康小鼠和糖尿病小鼠28d,探究不同粒径的PSMPs经消化系统进入糖尿病小鼠体内后对小鼠肾脏产生的毒性.旨在为MPs对小鼠肾脏毒性影响研究提供参考.
1 材料与方法
1.1 实验材料
100nm和5μm粒径的PSMPs购自天津市倍思乐色谱技术开发中心.使用扫描电子显微镜(SU8010,日本)观察PSMPs的表面形貌,利用傅里叶变换红外光谱(Thermo Scientific Nicolet iS5,上海)对PSMPs的表面官能团进行表征.
1.2 实验动物和暴露方式
6周龄雄性C57BL/6J (Norm)健康小鼠和C57BKS/Leprdb (db/db)糖尿病小鼠购买于上海斯莱克实验动物有限公司(上海),置于(22±1)℃,12:12h光照-黑暗循环,以自由摄食和饮水方式驯养1周.待驯养结束后将小鼠随机分为6组,每组6只.具体实验暴露方案如表1所示.暴露期间每7d记录一次体重,每天更换饮用水以保证溶液浓度稳定.在PSMPs暴露过程中,每周从每组中随机挑选4只小鼠测量空腹血糖和血胰岛素水平.暴露28d后进行葡萄糖耐受性检测和胰岛素抵抗检测.利用眼球取血的方式采集新鲜血液3000r/min离心15min以得到血清样本.使用10%水合氯醛(1mL/200g)麻醉小鼠后安乐死.采集小鼠肾脏并立即用10%福尔马林浸泡或用液氮冷冻后置于−80℃冰箱保存用于后续分析.本研究通过了中国药科大学动物伦理委员会的批准.
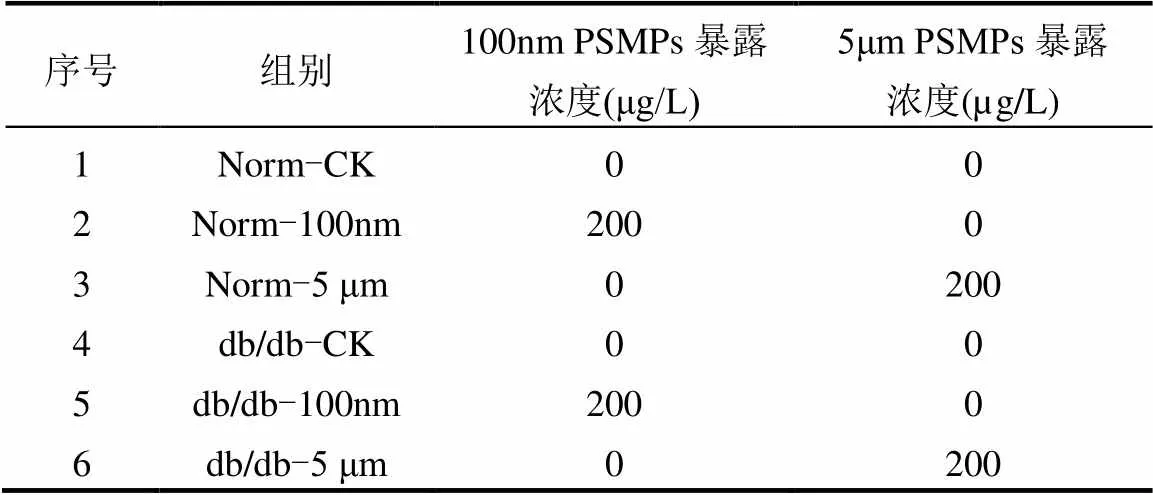
表1 实验暴露方案
1.3 组织病理学检测
将肾脏在10%福尔马林缓冲液中固定24h后,用70%、80%、90%、100%乙醇逐级脱水,将脱水后的组织先后浸渍于无水乙醇、二甲苯混合液及纯二甲苯中进行透明处理,随后经石蜡包埋,垂直切成4µm切片黏附于载玻片上烘干备用.切片在着色前用二甲苯脱蜡,然后经乙醇溶液水化处理.使用苏木精-曙红(H&E)染色,在光学显微镜下观察和拍照,记录肾脏的组织病理学变化.
1.4 炎症因子水平和血清肌酐水平的测定
将冷冻的肾脏融化后称重,加入一定量的磷酸盐(PBS)缓冲液(pH=7.4),用匀浆器在冰上制成10%的组织匀浆液,将组织匀浆液离心20min (2000~ 3000r/min)后仔细收集上清液.上清液中TNF-α和IL-6的水平使用酶联免疫吸附测试(ELISA)试剂盒(南京建成生物工程研究所,中国)测定.小鼠血清肌酐水平使用肌酐(CRE)测定试剂盒(南京建成生物工程研究所,中国)测定.
1.5 氧化应激分析
将冷冻的肾脏融化后称重,加入一定量的PBS缓冲液(pH=7.4),用匀浆器在冰上制成10%的组织匀浆液,将组织匀浆液离心20min (2000~3000r/min)后仔细收集上清液.基于BCA法(蛋白质浓度测定试剂盒,南京建成生物工程研究所)测定小鼠肾脏蛋白质浓度.利用超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所,中国)和还原性谷胱甘肽(GSH)测试盒(南京建成生物工程研究所,中国)检测匀浆上清液中SOD和GSH水平.
1.6 代谢组学分析
将冷冻的肾脏融化后称取50mg肾脏组织,使用预冷的甲醇-水混合物(2/1,/) 600μL混合,利用超声波破碎机(Ymnl-1000T,中国南京)分3次对组织提取.12000×,4℃离心10min后,将上清液合并在2mL离心管中,并在45℃下使用氮吹仪吹干样本.使用600μL含有100% D2O(百灵威科技有限公司,中国)和0.005% TSP-d4(剑桥同位素实验室,美国)的PBS缓冲液(pH=7.4)将水溶性提取物充分溶解.再次(12000×,4℃)离心10min后,将上清液转移到5mm核磁共振(NMR)管中进行测定.采用MestReC软件(Mestrelab Research,西班牙)分析1HNMR谱.先进行化学位移零点的校正,以及谱图信号相位与基线的校正.将0~10.0×10-6化学位移段内的谱峰信号进行分段积分,间距为0.005×10-6,积分时去除4.5~5.0×10-6的水峰.根据NMR谱的化学位移和峰形,识别出相应的代谢分子.化学位移对应的代谢物如表2所示.通过计算每个代谢分子对应化学位移范围的峰积分,分析样品中各代谢物的相对含量.采用单因素方差分析(ANOVA)比较各组间差异,筛选出显著变化的代谢物(SCMs) (<0.05).将所有积分数据导出到Excel文件,使用MetaboAnalyst 4.0软件进行在线分析.
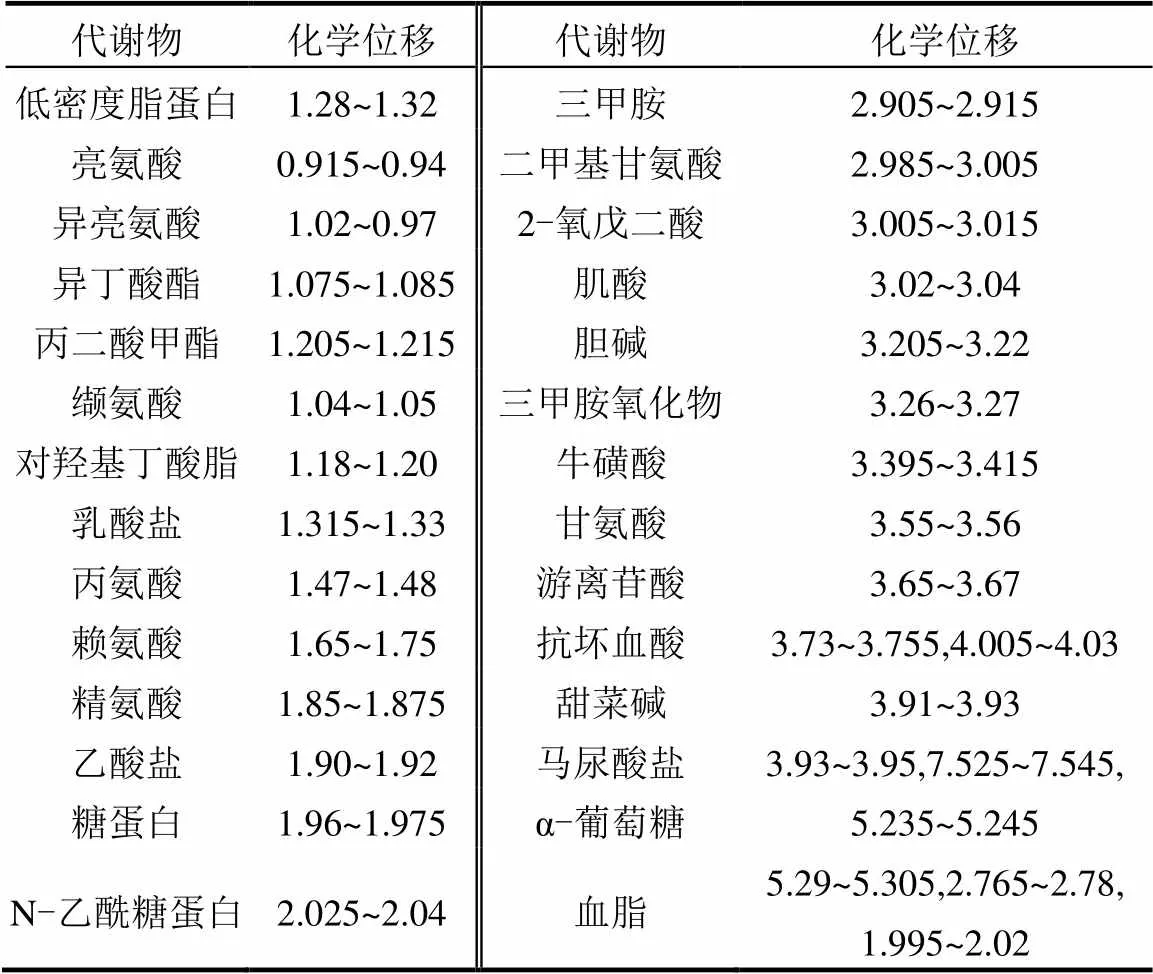
表2 代谢物的化学位移
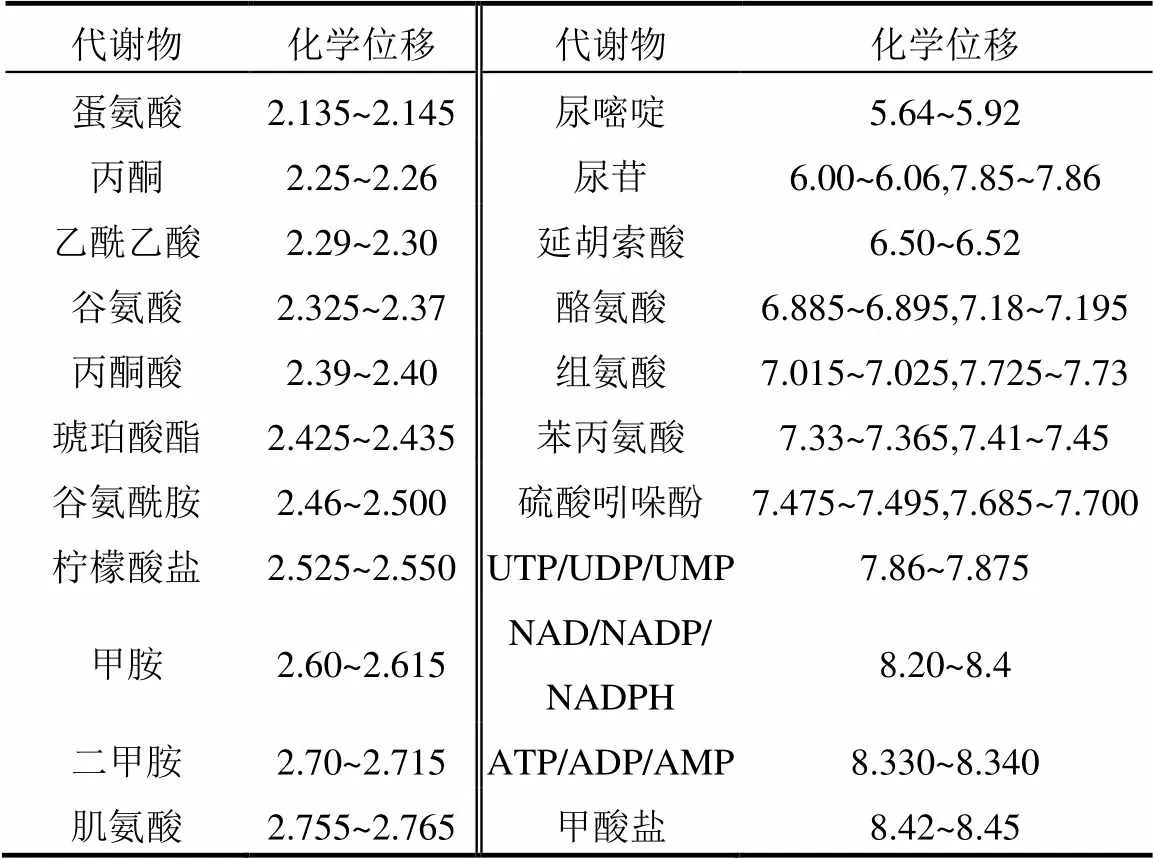
续表2
1.7 统计分析
采用Graphpad Prism 7的单因素方差分析(ANOVA)评估组间差异,以<0.05为标准判断显著性变化.所有试验进行3次重复,除非另有说明,实验结果均以均数±标准差(Mean±SD)表示.
2 实验结果
2.1 PSMPs的表征
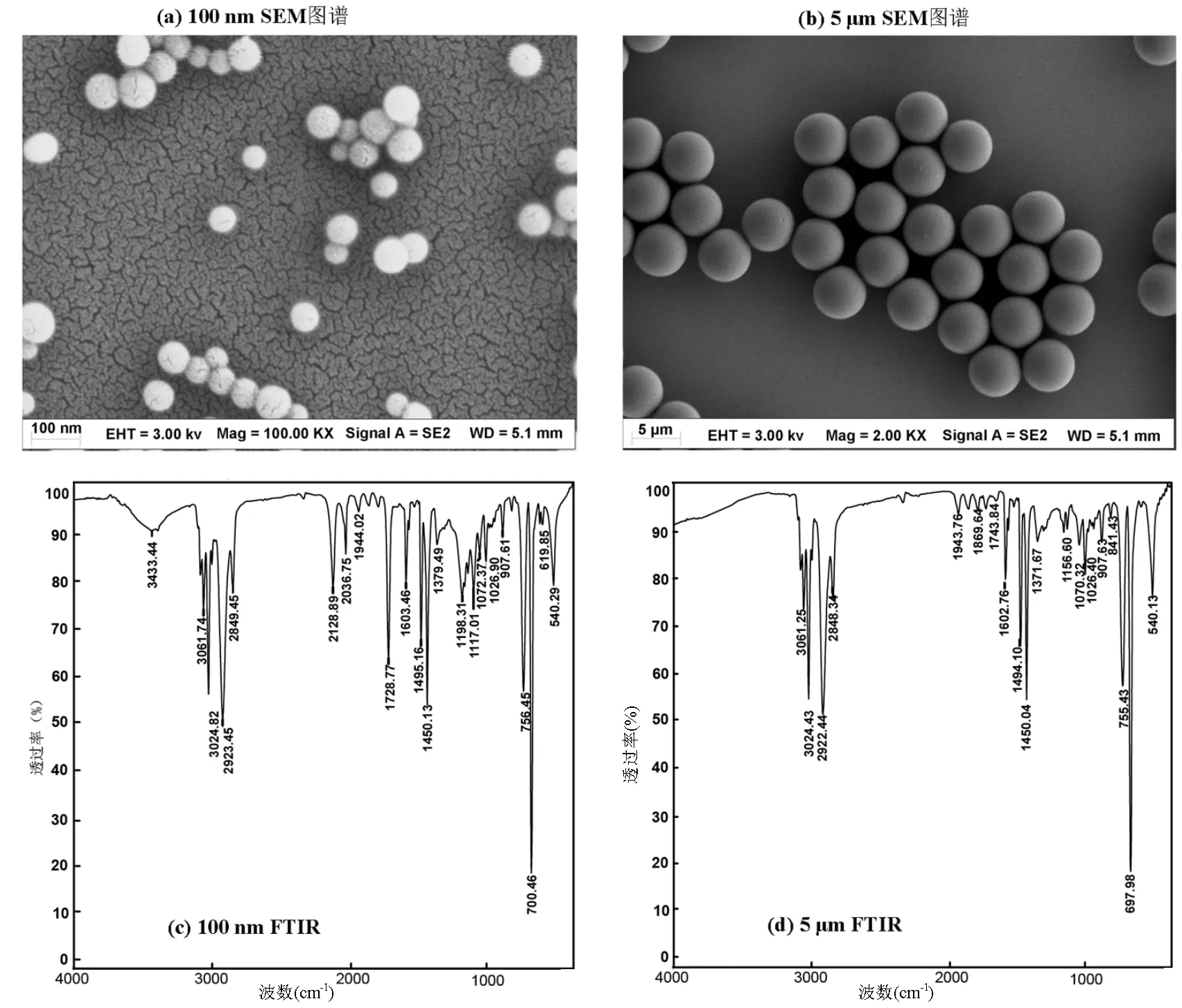
图1 100nm和5 μm PSMPs的SEM及FTIR图像
如图1(a)所示,100nm和5μm PSMPs的颗粒表面光滑,均呈现规则球形结构.如图1(b)所示,在波长为3061和3024cm-1处吸收峰来自苯环C-H键伸缩振动.在波长为2923cm-1处存在特征峰来自亚甲基的C-H键伸缩振动.在1603cm-1处的特征峰可能与双键的伸缩振动有关.1450cm-1处为C-O、C-X(卤素)的伸缩振动峰.756和700cm-1处的特征吸收峰由苯基取代引起.PSMPs的特征峰和组成与前期结果一致[12].
2.2 PSMPs对小鼠肾脏组织的病理损伤
如图2所示,对照组健康小鼠肾脏细胞排列较为紧密,细胞结构完整.Norm-100nm和Norm-5μm组小鼠的肾脏细胞的紧密排列被破坏,细胞间隙变大,出现炎症细胞浸润以及淤血现象,且100nm PSMPs造成的炎症和淤血现象更为严重.与健康小鼠相比,糖尿病小鼠的肾脏组织细胞出现一定程度的炎症细胞浸润现象.100nm和5μm PSMPs暴露均加剧了糖尿病小鼠肾脏组织的炎症细胞浸润,且100nm PSMPs暴露导致糖尿病小鼠肾脏组织淤血现象更加明显.此外,与Norm-100nm组相比,db/db- 100nm组小鼠肾脏组织的炎症细胞浸润与淤血现象更为严重.组织病理学结果表明,糖尿病小鼠的肾脏对PSMPs的暴露更为敏感.

图2 小鼠肾脏H&E染色切片
图中组织病理学变化包炎症细胞浸润(黑色箭头),淤血(黄色圆圈)
2.3 PSMPs对小鼠血清肌酐水平的影响
血清肌酐浓度变化反映肾小球的滤过能力,肌酐浓度升高,则表明肾小球滤过能力下降,肾脏功能受损.如图3所示,与对照组相比,100nm和5μm PSMPs暴露显著增加了小鼠血清中肌酐水平(< 0.05).与健康小鼠相比,糖尿病小鼠血清中肌酐浓度显著增加,达到(3653.58±156.86)μmoL/L,提示糖尿病小鼠的肾脏存在一定的损伤.相较于db/db-5μm组,小鼠血清肌酐浓度在db/db-100nm组中也显著增加(<0.05),达到(4069.63±98.88)μmoL/L.100nm PSMPs暴露对糖尿病小鼠肾脏功能造成了严重的损伤.
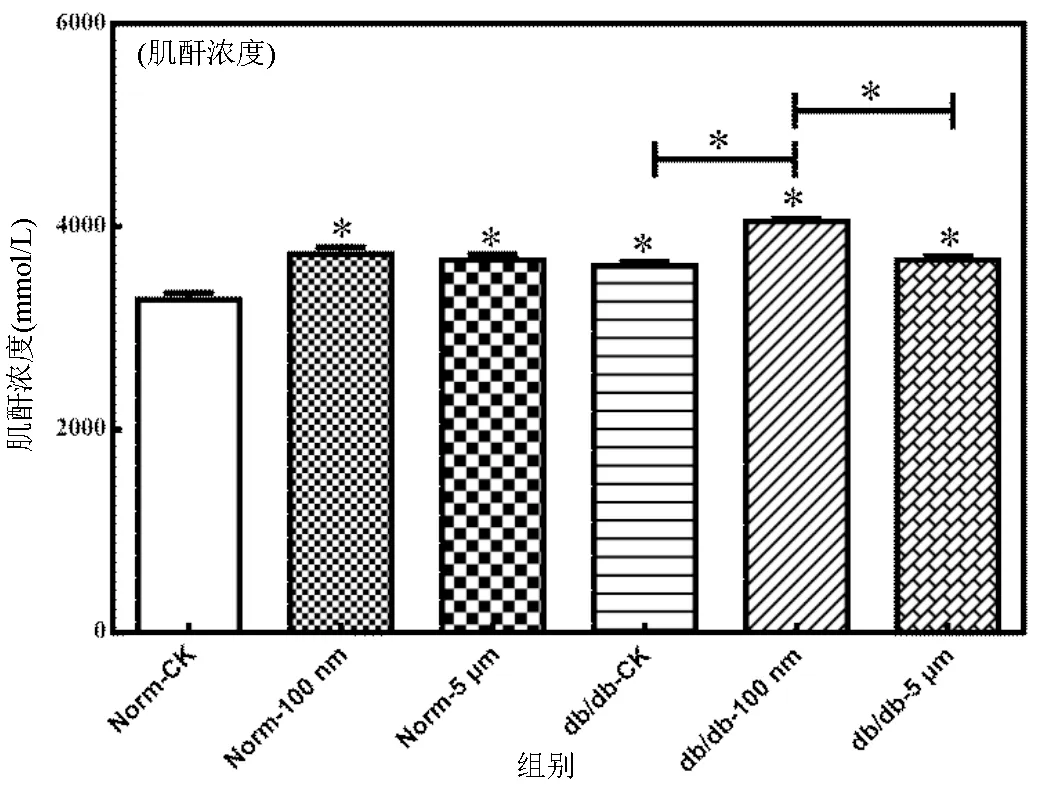
图3 小鼠血清肌酐水平的变化
2.4 PSMPs对小鼠肾脏炎症因子水平的影响
如图4(a)所示,与对照组中健康小鼠相比, 100nm PSMPs的暴露显著增加了小鼠肾脏中TNF-α的表达水平(<0.05).而Norm-5μm组中小鼠肾脏的TNF-α表达水平无明显变化,表明100nm PSMPs对小鼠肾脏造成了严重的炎症损伤.与健康小鼠相比,糖尿病小鼠肾脏中TNF-α表达量达到(92.49±11.71) ng/g,显著高于健康小鼠(<0.05),表明糖尿病小鼠肾脏存在一定程度的损伤.此外,100nm PSMPs的暴露导致糖尿病小鼠TNF-α表达量较对照组明显增加(<0.05),说明100nm PSMPs的暴露进一步加重了糖尿病小鼠肾脏的损伤.
IL-6的表达水平如图4(b)所示,与对照组中健康小鼠相比,100nm和5μm PSMPs的暴露均显著增加了小鼠肾脏中IL-6的表达水平(<0.05).与Norm-5μm组相比,IL-6的表达水平在Norm-100nm组中显著增加,达到(21.90±1.06) pg/mg.表明100nm PSMPs对小鼠的肾脏造成更为严重的损伤.与健康小鼠相比,糖尿病小肾脏中IL-6的表达水平无明显变化(0.05).与糖尿病小鼠相比,IL-6的表达水平在db/db-100nm和db/db-5μm组中均显著增加且db/db-100nm组中IL-6的表达水平要显著高于db/db-5μm组,表明100nm和5μm PSMPs的暴露均能够对糖尿病小鼠肾脏造成损伤且100nm PSMPs对糖尿病小鼠肾脏的损伤更为严重.
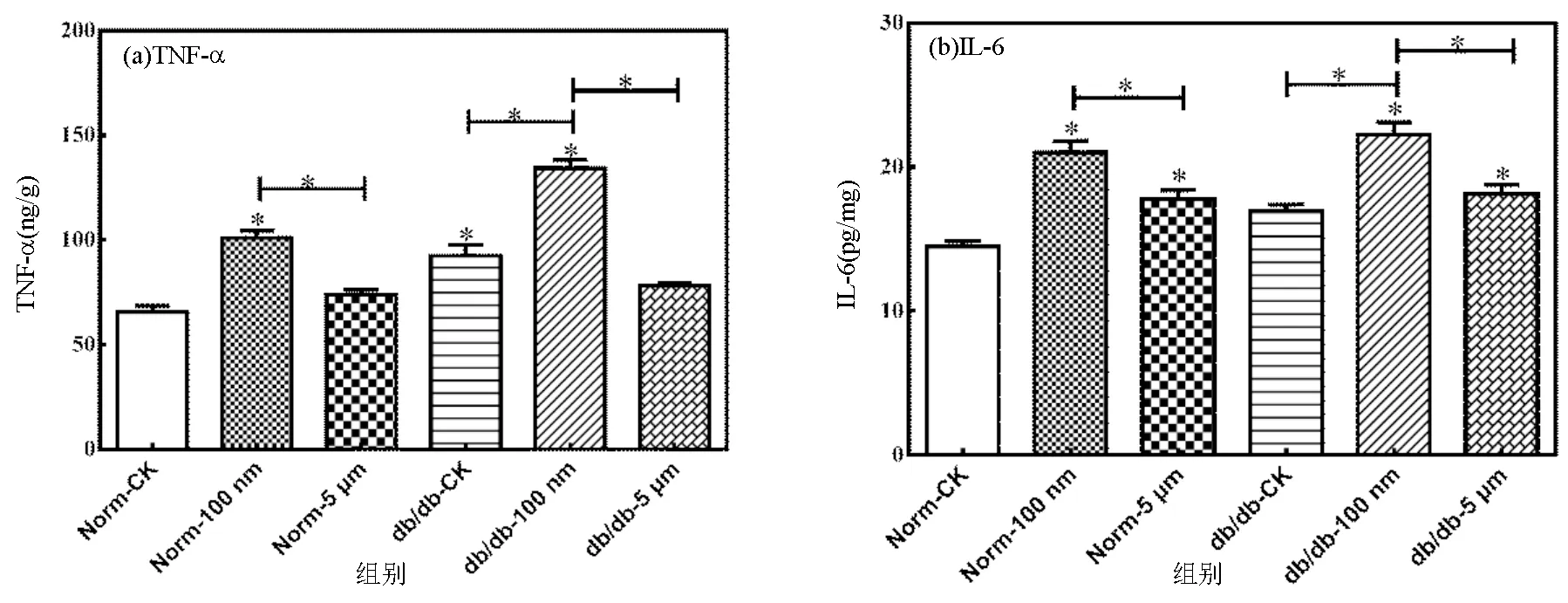
图4 小鼠肾脏炎症因子水平的表达
2.5 PSMPs对小鼠肾脏SOD和GSH表达的影响
SOD是重要的抗氧化酶,广泛分布于生物体内,可以清除体内过多的自由基,SOD水平升高表明自由基含量升高诱导机体氧化应激.如图5(a)所示,100nm PSMPs暴露显著增加了小鼠肾脏中SOD的表达(<0.05),达到(96.64±3.23) U/mgprot,而Norm-5μm组小鼠肾脏SOD的表达水平无明显变化.与健康小鼠相比,糖尿病小肾脏中SOD表达量达到(116.65±10.56) U/mgprot,显著高于健康小鼠肾脏中SOD表达水平(<0.05),提示糖尿病小鼠肾脏存在一定程度的氧化损伤.在db/db-100nm和db/db- 5μm组中,SOD表达量均显著增加(<0.05),且在db/db-100nm组中表达最为显著,达到(132.25±8.20) U/mgprot.小鼠肾脏SOD表达水平的结果说明100nm PSMPs对糖尿病小鼠肾脏的氧化损伤更为显著.
GSH是生物体内重要的抗氧化剂和自由基清除剂,可与自由基结合排出体外,GSH含量降低意味着体内自由基增多,细胞变性和坏死.如图5(b)所示,与对照组中健康小鼠相比,100nm和5μm PSMPs的暴露均显著减少了小鼠肾脏中GSH的表达水平(<0.05).与健康小鼠相比,糖尿病小肾脏中GSH表达量达到(39.72±6.52) U/mgprot,显著高于健康小鼠肾脏中GSH表达水平(<0.05).100nm和5μm PSMPs暴露后,糖尿病小鼠肾脏GSH的表达水平均显著下降,且db/db-100nm组中GSH的表达水平显著低于db/db-5μm组,进一步证明了100nm PSMPs对糖尿病小鼠肾脏的损伤显著高于5μm PSMPs.此外,100nm PSMPs的暴露导致健康小鼠肾脏GSH的表达水平相对于对照组下调了(1.38±1.13)倍,而糖尿病小鼠肾脏GSH水平相对于对照组下调了(1.73±1.15)倍.小鼠肾脏GSH表达水平的结果也进一步表明糖尿病小鼠的肾脏对100nm PSMPs的暴露更加敏感.
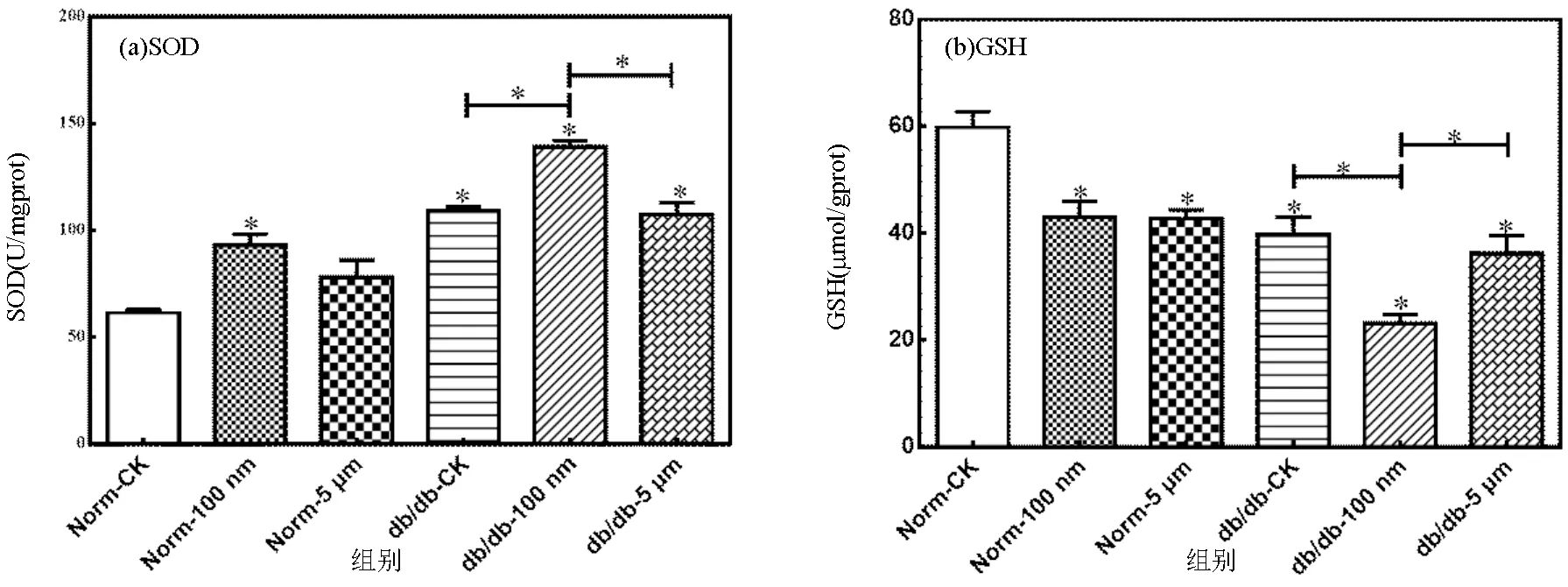
图5 小鼠肾脏SOD和GSH的表达
2.6 PSMPs暴露对小鼠肾脏代谢组学的影响
采用偏最小二乘判别分析(PLS-DA)比较不同处理组间代谢产物的差异,如图6(a)所示,各实验组均能与对照组产生明显区分与清晰聚类,表明100nm和5μm PSMPs的暴露对健康小鼠和糖尿病小鼠肾脏的代谢均有明显影响.此外Norm-5μm组、db/db-5μm组聚类结果与对照组相距较近,而Norm-100nm和db/db-100nm组聚类结果与对照组较远,聚类结果说明PSMPs暴露对肾脏代谢的影响具有一定的粒径依赖性,且100nm PSMPs暴露对小鼠肾脏的代谢影响最为严重.通过比较各对照组和实验组,筛选出各组中显著差异性代谢物(SCMs), SCMs筛选标准为<0.05.如图6(b)所示,Norm- 100nm组、Norm-5μm组、db/db-100nm组和db/db- 5μm组中分别鉴定出13、11、21和12个SCMs.根据组间差异筛选的SCMs可以看出两种粒径PSMPs的暴露共计导致26种代谢物较对照组发生显著变化,不同实验组间具有一定的差异性且db/db-100nm组小鼠肾脏代谢紊乱更为显著.
进一步对SCMs涉及的代谢通路进行分析,结果如图7所示.与Norm-CK组相比,Norm-100nm组涉及甘氨酸、丝氨酸、苏氨酸、丙氨酸、天冬氨酸、谷氨酸代谢以及酮体的合成和分解等相关代谢通路的改变(图7a).Norm-5μm组涉及苯丙氨酸、酪氨酸和色氨酸生物合成,丙氨酸、谷氨酸、甘氨酸、丝氨酸和苏氨酸等相关代谢通路的改变(图7b). db/db-100nm组涉及苯丙氨酸、酪氨酸和色氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢以及柠檬酸循环等相关代谢通路的改变(图7c).db/db-5μm组涉及苯丙氨酸、酪氨酸和色氨酸的生物合成,甘氨酸、丝氨酸、苏氨酸和苯丙氨酸代谢,柠檬酸循环等相关代谢通路的改变(图7d).对代谢通路进行分析发现这些代谢途径主要参与氨基酸代谢、能量代谢、脂肪酸代谢和氧化应激等过程.

图6 小鼠肾脏1H NMR图谱的PLS-DA得分图和SCMs的Venn图
图中每一个点表示一个小鼠肾脏样本,相同颜色的点表示来自同一个处理组,两点之间距离越近表明两样品间的代谢差异越小
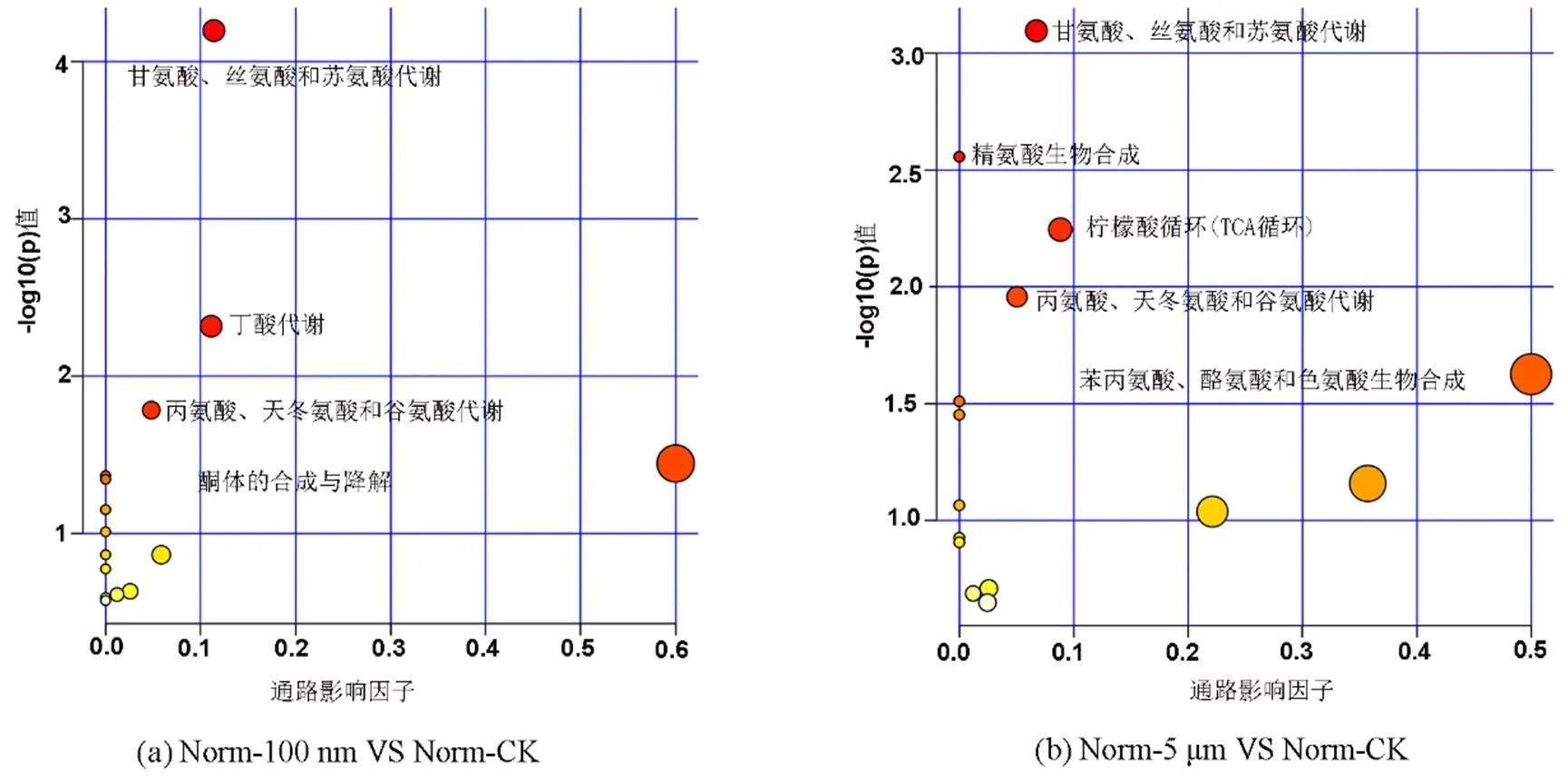
图中气泡的大小及颜色深浅代表不同代谢通路的值和影响值大小
对参与能量代谢和氧化应激通路的SCMs丰度变化情况进行分析,结果如表3所示.在参与能量代谢如柠檬酸循环、糖酵解/糖异生、氮代谢和丙酮酸代谢通路的SCMs中,Norm-100nm组、Norm-5μm组、db/db-100nm组和db/db-5μm组中分别共有1、2、5和3种不同的SCMs表达倍数较对照组发生显著变化.其中在db/db- 100nm组中有4种SCMs丰度下调,1种SCMs丰度上调.参与能量代谢的SCMs数量和表达倍数变化的结果表明db/db-100nm组中小鼠肾脏能量代谢紊乱最为严重.在氧化应激方面,与对照组相比,Norm-100nm组和db/db-100nm组小鼠肾脏中对氧化应激和炎症反应具有保护作用的牛磺酸丰度均显著降低(<0.05),且牛磺酸丰度在db/db-100nm组下调最为明显,说明100nm PSMPs暴露对小鼠肾脏造成了严重的氧化损伤,且对糖尿病小鼠更为明显,进一步验证了肾脏的生化结果.
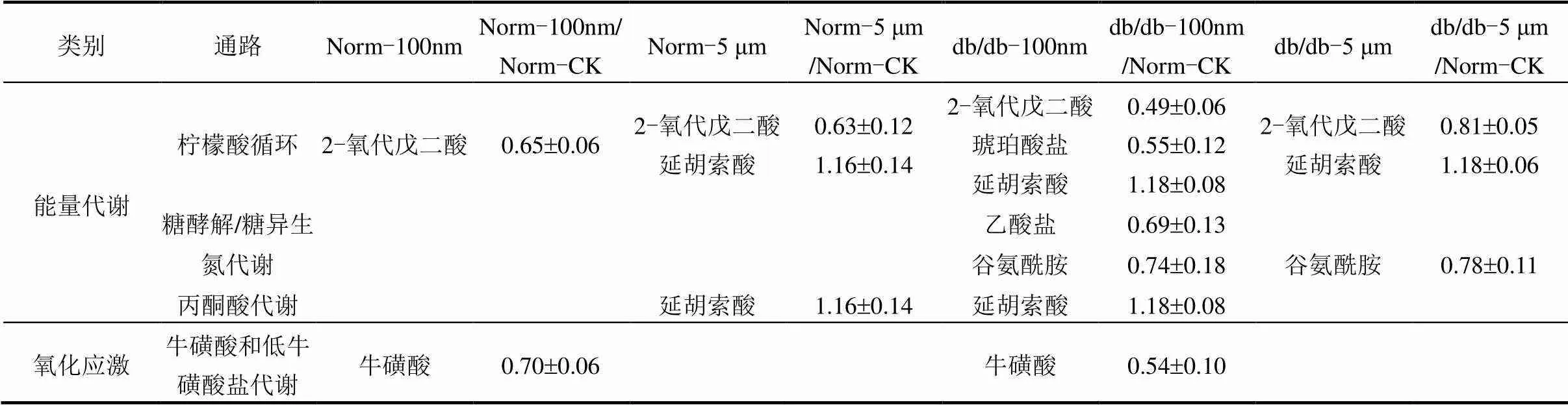
表3 能量代谢和氧化损伤相关SCMs的丰度变化
3 讨论
本研究以糖尿病小鼠为模式生物,研究了PSMPs对糖尿病小鼠肾脏的影响.结果发现,糖尿病小鼠肾脏对PSMPs暴露更加敏感.100nm和5μm PSMPs暴露诱导糖尿病小鼠肾脏组织出现严重的炎症细胞浸润和淤血等病理损伤,100nm PSMPs暴露导致糖尿病小鼠肾脏出现更为严重的氧化损伤和代谢紊乱,表现出明显的粒径毒性效应.这可能与小粒径PSMPs易透过肠道屏障在肾脏中累积有关.此外,代谢组学结果显示肾脏代谢通路紊乱引起的糖酵解能力受损和能量代谢水平降低也增加了PSMPs对糖尿病小鼠肾脏的损伤.
前期研究证明MPs可以在生物体内累积并对肝、肾等器官造成严重损伤,如炎症、氧化损伤等[13].本研究中,100nm和5μm PSMPs的暴露显著增加了糖尿病小鼠肾脏促炎性细胞因子TNF-α和IL-6的表达水平.TNF-α和IL-6作为免疫和炎症反应的生物标志物其表达上调是炎症反应的重要特征[14].与健康小鼠相比,TNF-α和IL-6的表达水平在db/db- 100nm和db/db-5μm组中显著上调表明PSMPs的暴露显著加重了糖尿病小鼠肾脏的炎症效应.前期研究中也有类似结果,例如Deng等[15]研究发现MPs能够聚集在小鼠肾脏及肠道部位引起小鼠炎症、氧化应激和代谢紊乱等.王英雪等[16]证实,富集在哺乳动物肾脏的MPs可诱发氧化应激和炎症反应.氧化应激被认为是PSMPs诱导损伤的主要毒性机制[17].机体的正常生理功能有赖于氧化与抗氧化系统的相互拮抗平衡[18],PSMPs的暴露促进了生物体内ROS(活性氧)的产生,而抗氧化物质如GSH的含量下降,抗氧化能力降低,不能有效地清除ROS,多余的ROS进一步导致肾脏的炎症效应[19].本研究的结果发现PSMPs的暴露能够显著上调糖尿病小鼠肾脏SOD水平并下调GSH浓度,进一步证实了PSMPs的暴露诱导了糖尿病小鼠肾脏出现严重的炎症和氧化应激效应.
MPs的生物毒性受到其在体内吸收转运过程的影响,而MPs的尺寸和形状是决定其体内吸收转运的重要因素[20].一般来说,尺寸越小的MPs具有更好的穿透力,对机体的损伤也越大.例如Lu等[21]发现5μm的MPs可以透过斑马鱼肠道屏障进入循环系统,并在肝脏和脾脏中积累,诱导斑马鱼组织学变化和肝脏的氧化应激,而20μm的MPs仅在鱼鳃和肠道中积累.Jin等[22]研究结果表明500nm PSMPs的暴露对斑马鱼的毒性效应要明显高于5μm PSMPs对斑马鱼的损伤.本研究中,100nm PSMPs的暴露诱导小鼠肾脏出现严重的炎症效应和氧化损伤,这可能与较小粒径的PSMPs易突破机体肠道屏障进入血液循环在肾脏中累积有关.
前期研究表明,大多数环境污染物进入体内可通过诱发氧化应激破坏肾脏组织细胞,导致肾组织纤维化,促进糖尿病肾病的发展[23].此外,糖尿病小鼠肾脏炎症效应导致的肾小球滤过屏障破坏也增加了糖尿病小鼠肾脏对污染物的易感性[24].对于肾脏功能不全的糖尿病机体,可能使更多的污染物在肾脏中累积,从而导致肾脏出现严重的损伤[25].Jin等[26]证实镉在糖尿病大鼠肾脏组织的累积量比非糖尿病大鼠高2倍,并进一步加重了糖尿病小鼠肾小球和肾小管的损伤.Wei等[27]研究指出,与健康小鼠相比,砷更易在糖尿病小鼠肾脏中累积,从而诱导糖尿病小鼠肾脏出现严重的损伤和代谢紊乱.综上,糖尿病小鼠肾小球滤过屏障的破坏可能导致PSMPs在肾脏中累积增加,对肾脏造成更严重的损伤.
代谢组学作为系统生物学的重要组成部分,已经被广泛应用于环境毒理学等方面的研究,用于揭示环境污染物影响机体代谢的分子机制疾病[28].本研究结果发现,2种粒径PSMPs的暴露显著扰乱了小鼠肾脏的氨基酸代谢、脂质代谢以及能量代谢通路,且100nm PSMPs对糖尿小鼠肾脏的代谢影响更为严重.已有研究证实氨基酸代谢异常可诱导糖代谢紊乱,促进慢性肾脏疾病的发生[29].脂质代谢紊乱会诱发机体的氧化应激,从而导致胰腺β细胞功能受损,引发能量代谢障碍[30].肾脏细胞需要利用能量重吸收各种代谢废物,而能量代谢障碍使得肾功能无法正常发挥,增加肾脏组织的负荷,诱发肾脏氧化应激损伤[31].肾脏代谢组学数据显示与能量代谢如柠檬酸循环、糖酵解/糖异生和氮代谢等有关的代谢物丰度在db/db-100nm组中显著下调.因此推测, 100nm PSMPs的暴露导致糖尿病小鼠肾脏代谢功能异常,细胞糖酵解能力受损以及能量代谢水平降低,进而诱导肾脏出现严重的氧化损伤.此外,本研究中与氧化应激有关的代谢结果表明PSMPs暴露导致牛磺酸等相关代谢产物丰度显著降低.Ghosh等[32]研究结果证实了牛磺酸具有强抗氧化特性,可以通过减少氧化应激来预防大鼠的糖尿病并发症.与对照组相比,牛磺酸丰度在db/db-100nm组下调最为明显,进一步解释了本研究中糖尿病小鼠肾脏的生化结果和100nm PSMPs表现出的粒径毒性效应.
现有环境污染物的毒理学研究多基于健康模型开展,忽略了慢性病人群对污染物的毒性响应.以糖尿病为代表的慢性病人群在药物调节的作用下其寿命与健康人群可能没有明显的差别,对于环境污染物具有相同的暴露风险.流行病学研究表明,环境污染物是慢性病人群的重要危险因素,然而环境污染物与自身机能缺陷的慢性病人群间是否会产生交互作用尚缺乏基础数据.本文研究结果提示糖尿病等慢性病人群很有可能对环境污染物更加敏感,在今后的健康风险研究中应予以重视.
4 结论
4.1 糖尿病小鼠肾脏对PSMPs暴露更加敏感.与健康小鼠相比,100nm和5μm PSMPs暴露导致糖尿病小鼠肾脏出现严重的病理学损伤(炎性细胞浸润和淤血)、炎症因子(TNF-α和IL-6)和SOD的表达水平显著上调,并诱导GSH的表达水平下调和代谢紊乱.
4.2 100nm PSMPs对糖尿病小鼠肾脏造成的损伤更为显著.100nm PSMPs诱导糖尿病小鼠肾脏TNF- α、IL-6和SOD的表达水平显著增加至(130.49±12.33) ng/g、(23.50±1.45) pg/mg和(132.25±8.20) U/mgprot,表现出明显的粒径毒性效应.这可能与小粒径的PSMPs更易突破肠道屏障在肾脏中累积有关.
4.3 肾脏代谢通路紊乱引起的糖酵解能力受损和能量代谢水平降低可能是PSMPs加剧糖尿病小鼠肾脏损伤的重要机制.
[1] Mattsson K, Hansson L A, Cedervall T. Nano-plastics in the aquatic environment [J]. Environmental Science Processes & Impacts, 2015, 17(10):1712-1271.
[2] 韩丽花,李巧玲,徐 笠,等.大辽河沉积物中微塑料的污染特征 [J]. 中国环境科学, 2020,40(4):1649-1658.
Han L H, Li Q L, Xu L, et al. The pollution characteristics of microplastics in Daliao River sediments [J]. Chinese Environmental Science, 2020,40(9):4058-4064.
[3] Qiao J, Zhu Y, Jia X, et al. Distributions of arsenic and other heavy metals, and health risk assessments for groundwater in the Guanzhong plain region of China [J]. Environmental Research, 2019,181:108957.
[4] Lei L, Wu S, Lu S, et al. Microplastic particles cause intestinal damage and other adverse effects in zebrafishand nematode[J]. Science of The Total Environment, 2018,619-620:1-8.
[5] Lu L, Wan Z Q, Luo T, et al. Polystyrene microplastics induce gut microbiota dysbiosis and hepatic lipid metabolism disorder in mice [J]. Science of The Total Environment, 2018,631-632:449-458.
[6] Deng Y, Zhang Y, Lemos B, et al. Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure [J]. Scientific Reports, 2017,7(1):46687.
[7] Xi Z, Fang L, Xu J, et al. Exposure to Aroclor 1254persistently suppresses the functions of pancreatic β-cells and deteriorates glucose homeostasis in male mice [J]. Environmental Pollution, 2019,249: 822-830.
[8] Deng T, Zhang Y, Wu Y, et al. Dibutyl phthalate exposure aggravates type 2diabetes by disrupting the insulin-mediated PI3K/AKT signaling pathway [J]. Toxicology Letters, 2018,290:1-9.
[9] Bodin J, Kocbach B A, Wendt A, et al. Exposure to bisphenol A, but not phthalates, increases spontaneous diabetes type 1development in NOD mice [J]. Toxicology Reports, 2015,2:99-110.
[10] 郭凯锋,陈海冰,贾伟平.糖尿病肾脏疾病的流行病学进展 [J]. 医学研究杂志, 2015,44(3):162-166.
Guo K F, Chen H B, Jia W P. Epidemiological progress of diabetic kidney disease [J]. Journal of Medical Research, 2015,44(3):162-166.
[11] 周士飞,林 川,李 多.芪贞银翘汤对2型糖尿病肾脏疾病患者肾脏功能的影响 [J]. 中药药理与临床, 2020,36(5):194-198.
Zhou S F, Lin C, Li D. Effect of Qizhen Yinqiao decoction on the renal function in patients with diabetic kidney disease (DKD) [J]. Pharmacology and Clinics of Chinese Materia Medica, 2020,36(5): 194-198.
[12] Olmos D, Martín E V, González-Benito J. New molecular-scale information on polystyrene dynamics in PS and PS-BaTiO3composites from FTIR spectroscopy [J]. Physical Chemistry Chemical Physic, 2014,16(44):24339-24349.
[13] Jin Y, Lu L, Tu W, et al. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice [J]. Science of The Total Environment, 2019,649(1):308-317.
[14] Zhao H H, Cheng N, Zhou W Q, et al. Honey polyphenols ameliorate DSS-induced ulcerative colitis via modulating gut microbiota in rats [J]. Molecular Nutrition & Food Research, 2019,63(23):22.930-941.
[15] Deng Y, Zhang Y, Lemos B, et al. Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure [J]. Scientific Reports, 2017,7(1):46687.
[16] 王英雪,徐 熳,王立新,等.微塑料在哺乳动物的暴露途径,毒性效应和毒性机制浅述 [J]. 环境化学, 2021,40(1):41-54.
Wang Y X, Xu M, Wang L X, et al. The exposure routes, organ damage and related mechanism of the microplastics on the mammal [J]. Environmental Chemistry, 2021,40(1):41-54.
[17] Deng Y F, Zhang Y, Qiao R X, et al. Evidence that microplastics aggravate the toxicity of organophosphorus flame retardants in mice () [J]. Journal of Hazardous Materials, 2018,357:348- 354.
[18] 李 欢,张静丽,张诗雨,等.四环素和砷对斑马鱼的联合毒性及机制 [J]. 中国环境科学, 2021,41(7):3371-3380.
Li H, Zhang J L, Zhang S Y, et al. Combined toxicity and underlying mechanism of tetracycline and arsenic on zebrafish[J]. Chinese Environmental Science, 2021,41(7):3371-3380.
[19] Li H, Tian S, Chen T, et al. Newly diagnosed diabetes is associated with a higher risk of mortality than known diabetes in hospitalized patients with COVID [J]. Diabetes Obesity and Metabolism, 2020, 22(10):1897-1906.
[20] Jeong C B, Won E J, Kang H M, et al. Microplastic size-dependent toxicity, oxidative stress induction, and p-jnk and p-p38activation in the monogonont rotifer () [J]. Environmental Science & Technology, 2016,50(16):8849.
[21] Lu Y, Yan Z, Deng Y, et al. Uptake and accumulation of polystyrene microplastics in zebrafish () and toxic effects in liver [J]. Environmental Science & Technology, 2016,50(7):4054-4060.
[22] Jin Y X, Xia J Z, Pan Z H, et al. Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish [J]. Environmental Pollution, 2018,235(4):322-329.
[23] Xu X, Wang G, Chen N, et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China [J]. Journal of the American Society of Nephrology, 2016:3739-3746.
[24] Wang S, Fang F, Jin W B, et al. Investigation into the association between NLRP3gene polymorphisms and susceptibility to type 2diabetes mellitus [J]. Genetics & Molecular Research Gmr, 2015, 14(4):17447.
[25] 饶毅峰,杨 林,杜京涛,等.糖尿病肾病患者尿白蛋白排泄率与肾功能、炎症反应、氧化应激反应的相关性 [J]. 海南医学院学报, 2017,23(6):769-772.
Rao Y F, Yang L, Du J T, et al. Correlation of urinary albumin excretion rate with renal function, inflammatory response and oxidative stress response in patients with diabetic nephropathy [J]. Journal of Hainan Medical University, 2017,23(6):769-772.
[26] Jin T, Nordberg G, Sehlin J, et al. The susceptibility to nephrotoxicity of streptozotocin-induced diabetic rats subchronically exposed to cadmium chloride in drinking water [J]. Toxicology, 1999,142(1):69- 75.
[27] Wei H, Hu Q, Wu J, et al. Molecular mechanism of the increased tissue uptake of trivalent inorganic arsenic in mice with type 1diabetes mellitus [J]. Biochemical & Biophysical Research Communications, 2018,504(2):393-399.
[28] 段鑫越,关文玲,程昊东,等.胚胎绒毛膜对微塑料颗粒与镉联合作用的影响 [J]. 中国环境科学, 2021,41(3):1422-1428.
Duan X Y, Guan W L, Cheng H D, et al. Effect of chorionic villi on the combination action of microplastic particles and cadmium[J]. Chinese Environmental Science, 2021,41(3):1422-1428.
[29] Jin Y, Lu L, Tu W, et al. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice [J]. Science of The Total Environment, 2019,649:308-317.
[30] Abudawood M, Tabassum H, Ali M N, et al. Interrelationship between oxidative stress, DNA damage and cancer risk in Diabetes (Type 2) in Riyadh, KSA [J]. Saudi Journal of Biological Sciences, 2019,27(1): 177-183.
[31] Jiang H, Shao X, Jia S, et al. The mitochondria-targeted metabolic tubular injury in diabetic kidney disease [J]. Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology, 2019,52(2):156-171.
[32] Ghosh S, Chowdhury S, Sarkar P, et al. Ameliorative role of ferulic acid against diabetes associated oxidative stress induced spleen damage [J]. Food & Chemical Toxicology, 2018,118:272-286.
Effects of polystyrene microplastics on kidney of diabetic mice.
LI Huan, LIU Su, ZHANG Jing-li, CHEN Jian-qiu*
(Department of Environmental Science, School of Engineering, China Pharmaceutical University, Nanjing 211198, China)., 2022,42(3):1369~1378
Diabetic mice were used as model organisms to investigate the toxicity of 100nm and 5μm polystyrene microplastics (PSMPs) (200μg/L) after exposure to drinking water for 28days. The results of the study indicated that diabetic mice were more sensitive to the exposure of PSMPs. Exposure to 100nm and 5μm PSMPs led to obvious pathological damage such as inflammatory cell infiltration and congestion in the kidneys of diabetic mice, and 100nm PSMP caused more severe pathological damage to the kidney. In addition, exposure to 100nm PSMPs significantly aggravated the expression levels of renal inflammatory factors (TNF-α and IL-6), superoxide dismutase (SOD) and serum creatinine in diabetic mice, and caused renal metabolic disorders. Compared with 5μm PSMPs, the small particle size toxicity exhibited by microplastics may be related to the easier accumulation of nano-level PSMPs in the kidneys through the intestinal barrier. Moreover, the impaired glycolysis and reduced energy metabolism levels caused by disorders of renal metabolic pathways also increased the burden of PSMPs on kidneys of diabetic mice.
polystyrene microplastics;diabetic mice;kidney;inflammation;oxidative stress
X174
A
1000-6923(2022)03-1369-10
李 欢(1994-),男,安徽阜阳人,中国药科大学硕士研究生,主要从事环境毒理学方向研究.发表论文2篇.
2021-08-18
国家自然科学基金面上项目(21876207)
*责任作者, 教授, cjqer@163.com
