基于固液分离预处理的餐厨垃圾厌氧发酵
2022-03-29张靖雪李盼盼杨广平
张靖雪,李盼盼,于 洋,曾 苏,余 冉*,杨广平
基于固液分离预处理的餐厨垃圾厌氧发酵
张靖雪1,2,李盼盼1,于 洋1,曾 苏1,余 冉1*,杨广平3
(1.东南大学能源与环境学院,江苏 南京 210096;2.南京环境集团有限公司,江苏 南京 210046;3.南京清元景和环境科技有限公司,江苏 南京 210019)
研究不同预处理方法所获餐厨垃圾浆料的半连续式厌氧发酵效果,评价该类餐厨垃圾的产甲烷资源化潜能.结果表明,固液油三相分离预处理后的液相餐厨垃圾作为进料较固液混合相餐厨垃圾在厌氧发酵时具有更高的VS去除率,实际产甲烷潜能和甲烷转化率,分别为91.2%, 531.5mLCH4/gVS和54.3%,表明液相餐厨垃圾半连续中温湿式厌氧发酵具有良好的减量化和资源化效能.微生物群落分析表明,不同预处理方式影响了餐厨垃圾厌氧发酵系统的微生物群落演替,氨氮浓度是导致古菌群落转移和丰度变化的关键因素.液相餐厨垃圾厌氧发酵时是以氢营养型产甲烷菌为主,而在固液混合相餐厨垃圾厌氧发酵时则以耐高浓度氨氮的多功能产甲烷菌为主.
餐厨垃圾;厌氧发酵;预处理;微生物群落
餐厨垃圾包括餐厅垃圾,菜市场垃圾和家庭厨房垃圾等,是城市生活垃圾的重要组成部分[1].由于餐厨垃圾具有高产量(占城市生活垃圾的37%~ 62%[2]),高含水率,高含油率,高盐和高有机质占比(约占干重的95%~98%)的特点,易腐烂发臭,滋生蚊蝇,传播疾病,如不及时处理,将对周围环境造成严重影响.在中国,厌氧发酵和好氧堆肥技术被广泛应用于餐厨垃圾的资源化处理[3].与堆肥相比,厌氧发酵具有碳排放量低,二次污染少,运营成本低,适合集中大规模处理等优点[4],且因其可产生清洁能源沼气逐渐成为我国固废资源化利用方式之一.
为了提高餐厨垃圾厌氧发酵的产沼气性能,采用预处理可以提高底物的生物可降解性.预处理方法主要包括物理处理,化学处理,生物处理及多种处理方法的结合.目前国内在实际工程运用上对餐厨垃圾厌氧发酵的主要的预处理方式为机械破碎,加热制浆和固液油三相分离组合方法以获得固相,液相餐厨垃圾和油脂[5].其中油脂可回收制作生物柴油,而固相和液相垃圾则有两种不同的处理方法,一种是将固相和液相垃圾混合均质化后作为底物加入厌氧发酵系统,另一种是仅把液相垃圾加入厌氧发酵系统,固相垃圾则干化后外运焚烧发电.已有研究[6]通过餐厨垃圾分选系统获得了5种不同类型的餐厨垃圾并进行了厌氧发酵,结果表明餐厨垃圾浆液具有更高的甲烷产率.已知单位体积的液相餐厨垃圾底物相比固液混合相具有更多的可溶性有机物,而单位体积的固液混合相垃圾比液相垃圾具有更多的有机质.但二者对厌氧发酵的运行及有机质去除率,产甲烷潜能的影响尚缺乏相关研究.
本文以南京市某餐厨垃圾处置中心预处理环节所获餐厨垃圾底物为研究对象,参考其厌氧发酵运行参数,进行半连续中温湿式厌氧发酵试验,探究不同预处理方式对餐厨垃圾厌氧发酵产甲烷的影响,并通过分析微生物群落变化解析了影响厌氧发酵产甲烷的主要因素,研究结果旨在为国内餐厨垃圾厌氧发酵的实际工程应用提供借鉴.
1 材料与方法
1.1 预处理样品采集
厌氧发酵试验餐厨垃圾取自南京市某餐厨垃圾处置中心固液油三相分离预处理后的液相垃圾和固液混合相垃圾,采集密封后在4℃下冷藏保存作为后续厌氧发酵底物.厌氧污泥取自该处置中心厌氧发酵罐.
1.2 挥发性固体含量去除率
挥发性固体含量(VS)去除率可以表征厌氧发酵的有机质去除效果,其计算方法可按照式(1)计算:
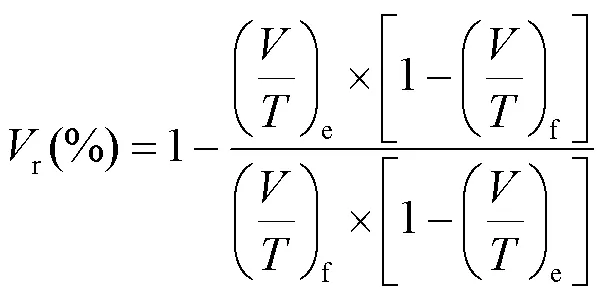
式中:r表示VS去除率,%;表示VS,%;表示总固体含量(TS),%;下标e表示出料,f表示进料[7].
1.3 实际产甲烷潜能
实际产甲烷潜能(EMP)计算公式见式(2):

式中:表示EMP,mLCH4/gVS;CH4为标准状态下产生CH4的体积,mL;d为反应器内实际消耗的VS量,g[7].
1.4 餐厨垃圾半连续式中温湿式厌氧发酵
启动驯化阶段,记为S0,将5L厌氧污泥置于反应罐中(图1).氮吹密封后每日定时进出样.当系统运行稳定后,首先每天定时进液相餐厨垃圾,连续运行30d,该阶段记为S1阶段;后将固液混合相混合垃圾底物以相同有机负荷加入厌氧发酵系统,连续运行30d,该阶段记为S2阶段,餐厨垃圾及厌氧污泥理化特性见表1,餐厨垃圾半连续式中温湿式厌氧发酵运行参数见表2.每日记录产气量,每两日收集气体进行气体成分分析,每日留样做指标分析.

图1 半连续厌氧发酵试验装置示意
1.补碱口; 2.补酸口; 3.机械搅拌器; 4.出气口; 5.进样口; 6.温度监测探头; 7.pH值监测探头; 8.取样口; 9.出料口; 10.控温隔层; 11.循环水浴加热器; 12.控制系统
1.5 微生物群落分析
试验选取S1和S2厌氧发酵阶段始末的污泥作样品,编号分别为S1-1, S1-2, S2-2,其中因S1体系结束即为S2体系的开始,故S2体系的起始污泥样品等同样品S1-2.样品DNA提取采用快速DNA提取法(FastDNA Spin Kit for Soil, MP土壤DNA提取试剂盒).将DNA样品送至上海生工生物工程股份有限公司进行微生物高通量测序,使用16s V4引物515F和806R进行细菌群落分析,使用巢式PCR引物V3-V4进行两轮扩增,第1轮引物340F和1000R,第2轮引物349F和806R进行古菌群落分析[8].
1.6 分析指标及测定方法
TS参考《生活垃圾采样和物理分析方法》[9][CJ/T313-2009]的相关方法测定;VS参考《生活垃圾化学特性通用检测方法》[10][CJ/T 96-2013]的灼烧法测定;含盐量参考《食品中氯化物的测定》[11][GB 5009.44-2016]的直接滴定法测定;pH值采用pH计(Testo, 206pH2)测定;餐厨垃圾中C, N等有机元素采用元素分析仪测定(德国艾力蒙塔公司, Vario EL cube);甲烷浓度采用气相色谱仪(普分科技有限公司,C3900)测定;挥发性脂肪酸(VFA)采用气相色谱分析仪(Agilent, 7890B)测定;氨氮参考《水质氨氮的测定纳氏试剂分光光度计法》[12][HJ 535-2009]测定;厌氧发酵产气量采用排水法测定.分析指标测定每次设置3个平行样,结果取平均值.

表1 餐厨垃圾及厌氧污泥理化特性

表2 厌氧发酵运行条件
2 结果与讨论
2.1 沼气成分和CH4日产量
从图2可知,有机负荷从驯化期(S0)0.6gVS/(L·d)升至液相厌氧发酵阶段(S1) 2.0gVS/(L·d)后,S1的CH4浓度在初始有小范围上升,最高至63.5%,之后稳定在60.1%,固液混合相厌氧发酵阶段(S2)的CH4浓度上升至61.3%.在产气方面,S1稳定后的 CH4日产气量为4859.3mL; S2的CH4日产气量整体高于S1,其平均值为5276.0mL.固液混合相餐厨垃圾厌氧发酵S2段产生的CH4浓度和液相餐厨垃圾厌氧发酵S1段无显著性差异,但CH4日产量在S2段高于S1段,而S2的CH4日产量波动较大,这可能与固液混合相餐厨垃圾的不均质有关.
2.2 VFA和氨氮
根据图2可以看出,厌氧发酵正式运行后,由于有机负荷的提升,系统受到了冲击负荷, VFA迅速积累后逐渐降低最后稳定的过程.这是因为驯化期转液相餐厨垃圾厌氧发酵时有机负荷上调,餐厨垃圾被产酸菌快速降解,后产甲烷菌活性增强将VFA降解转化.在厌氧发酵进行12d后丙酸含量已低出检测限,VFA主要以乙酸的形态存在,S1和S2两个阶段并无明显差异.VFA趋于稳定后在2.0gVS/(L·d)有机负荷下浓度低于200mg/L,可知该半连续式中温湿式厌氧发酵系统可以在较高浓度的有机负荷下正常运行.氨氮积累方面,S1阶段氨氮积累较缓慢,经过30d半连续厌氧发酵后氨氮增长了16.9%,而S2阶段氨氮积累较快,氨氮增长了29.0%.发酵液中的氨氮主要来自于微生物对蛋白质等有机物的降解,以游离氨和铵根离子的形式存在,其中游离氨被认为是抑制厌氧微生物的主要原因.餐厨垃圾经过固液油三相分离后的固液混合相垃圾在单位体积下比液相垃圾具有更多的蛋白质,更多的有机氮可转化为无机氮,导致分解蛋白质产生的氨氮大于微生物消耗氨氮的量,从而氨氮浓度呈上升趋势,长期运行会导致厌氧微生物尤其是产甲烷菌生长受到抑制[13].结合EMP可知S2氨氮的快速积累抑制了厌氧发酵的有机质转化效率.结合表1可知,厌氧发酵所用餐厨垃圾的C/N偏低,即氮元素太多造成氨氮不能被微生物及时转化利用,导致系统的氨氮浓度升高,故提高厌氧发酵底物碳源,调节C/N至20~30可缓解氨氮积累.
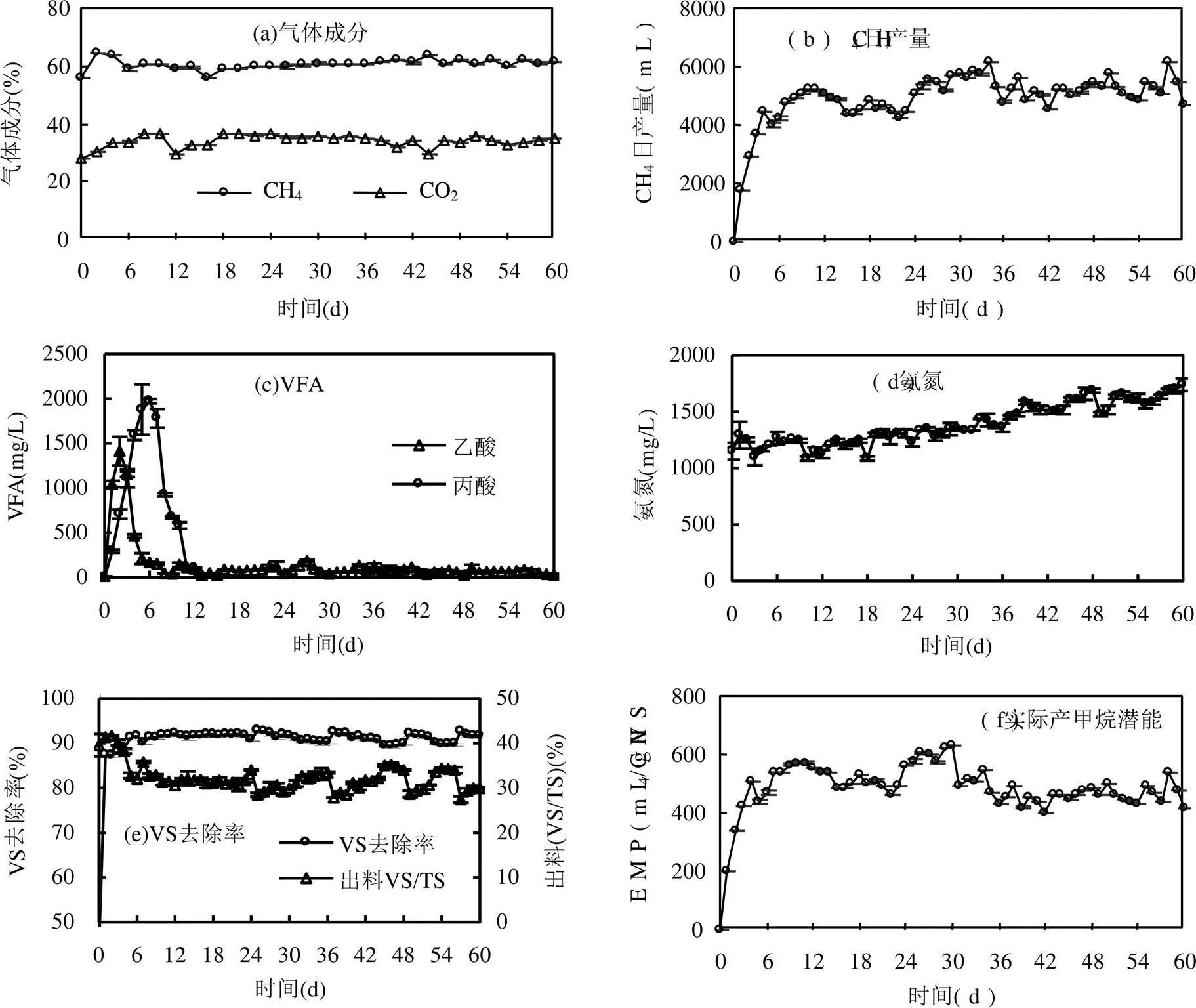
图2 餐厨垃圾半连续式厌氧发酵运行性能
2.3 VS去除率和EMP
从图2可知,虽然S1和S2阶段VS去除率平均值相近,分别为91.2%和91.0%,但S1的VS去除率是逐渐上升的趋势,VS去除率维持在87.3%~92.9%,而在S2阶段整体呈下降趋势,VS去除率维持在89.4%~92.6%.对比已有文献[7,14]报道的中温半连续餐厨垃圾厌氧发酵VS去除率在85%~94%,本实验S1和S2两阶段VS去除率均处于较高水平.而液相垃圾厌氧发酵相较固液混合相垃圾厌氧发酵具有更高的VS去除率,一方面是因为氨氮快速积累抑制固液混合相垃圾厌氧发酵,另一方面因为液相垃圾的小分子和可溶性有机质占比一般高于粒径不一的固液混合相垃圾,生物可降解性更高.从图2可以看出,EMP在S1阶段逐渐上升,最高时可达到633.0mLCH4/gVS,平均值为531.5mLCH4/gVS;与之对比在S2阶段,EMP值整体下降,最高时仅达到545.8mLCH4/gVS,平均值为465.8mLCH4/gVS,且数值较为波动.对比Tampio等[15]进行中温半连续餐厨垃圾厌氧发酵实验,在3gVS/(L·d)的有机负荷下得到最高483mLCH4/gVS的甲烷产率,本厌氧发酵试验在2gVS/(L·d)有机负荷下具有更高EMP. Zhang等[6]对5种不同类型的餐厨垃圾进行先中温35℃后高温55℃的厌氧发酵结果表明,餐厨和蔬菜残渣混合物压滤后的浆液厌氧发酵表现出最高的比甲烷产率,而植物残渣经过压滤的浆液厌氧发酵最低.故液相餐厨垃圾因为其具有大量的可溶性有机质从而具有更高的EMP,在半连续式中温湿式厌氧发酵工艺中液相餐厨垃圾比固液混合相餐厨垃圾产甲烷效率更高.
2.4 厌氧发酵系统物料平衡
纯液相和固液混合相餐厨垃圾厌氧发酵2个阶段每日进料150mL,纯液相餐厨垃圾VS为6.6%,固液混合相餐厨垃圾的VS为8.3%.2个阶段各选择稳定时即反应第15d和16d的数据进行碳平衡计算,根据质量守恒可得式(3):

式中:为反应器每天进料的总碳质量,g;为反应器每天出料的总碳质量,g;为每天产生的沼气总碳质量,g.已知两个阶段选取的第15d和16d数据见表3.其中总碳TC≈VS×47%[16].
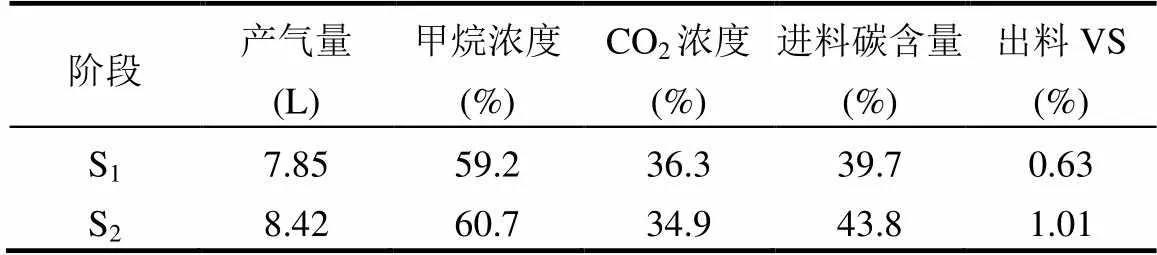
表3 碳平衡计算选取参数
注:进料碳含量以干基计算.
可计算出S1阶段和S2阶段,,和TC利用率及甲烷转化率(表4).由碳平衡计算可知S1阶段的TC利用率和甲烷转化率比S2阶段分别高4.3%和1.4%,即液相餐厨垃圾进行半连续式中温湿式厌氧发酵时可以将更多的有机质转化为沼气和甲烷.
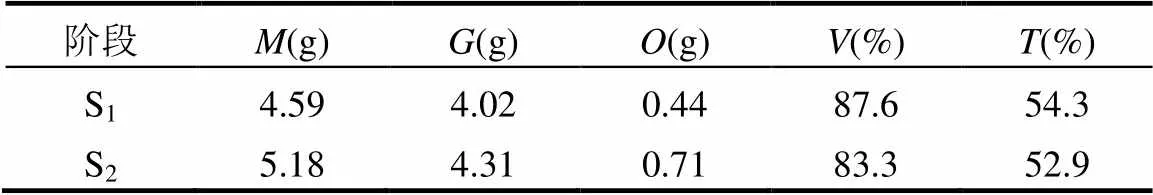
表4 餐厨垃圾厌氧发酵碳平衡计算
2.5 厌氧发酵微生物群落分析
如表5所示,S1阶段随着厌氧发酵的进行,细菌群落分布丰富度(Chao1和ACE指数)呈增大的趋势而S2阶段在降低.用来估算群落分布多样性的Shannon指数值越大,说明群落多样性越高,而Simpson指数数值越大说明群落多样性越低.S1阶段Shannon指数和Simpson指数分别降低和增加,表示细菌群落多样性在降低.与之对比S2阶段细菌群落多样性则表现出增大的趋势.
S1阶段随着发酵的进行古菌群落丰富度(Chao1和ACE指数)无显著变化,而古菌群落多样性(Shannon和Simpson指数)在增大.在S2阶段随着厌氧发酵的进行,古菌群落丰富度和多样性均在减小.
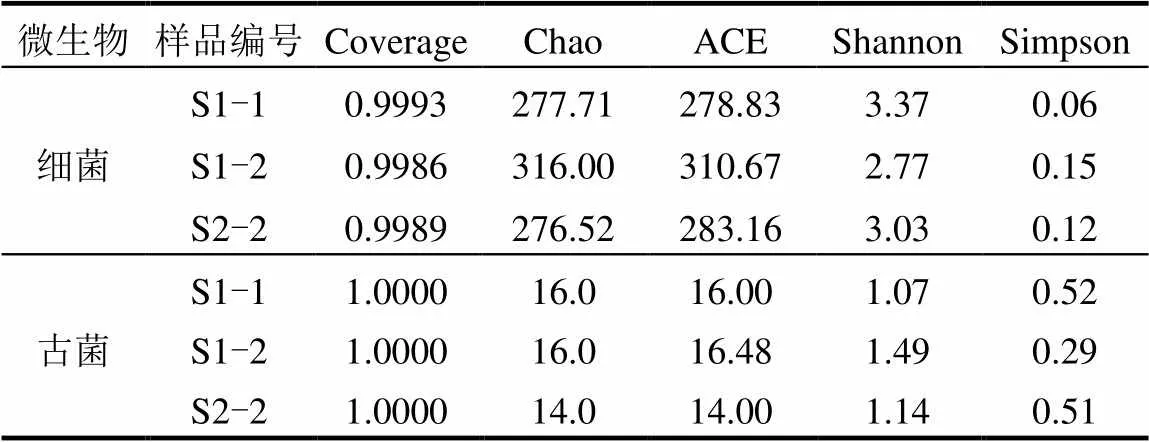
表5 不同预处理进料条件下的厌氧发酵反应器中细菌和古菌群落分析
如图3所示,因为两个厌氧发酵阶段的古菌在门水平上均属于Euryarchaeota,故在属水平上进行群落结构分析.图中横坐标为样品编号,纵坐标为相对丰度比例.颜色对应了此分类水平各物种的名称,颜色宽度表示不同物种相对丰度比例.
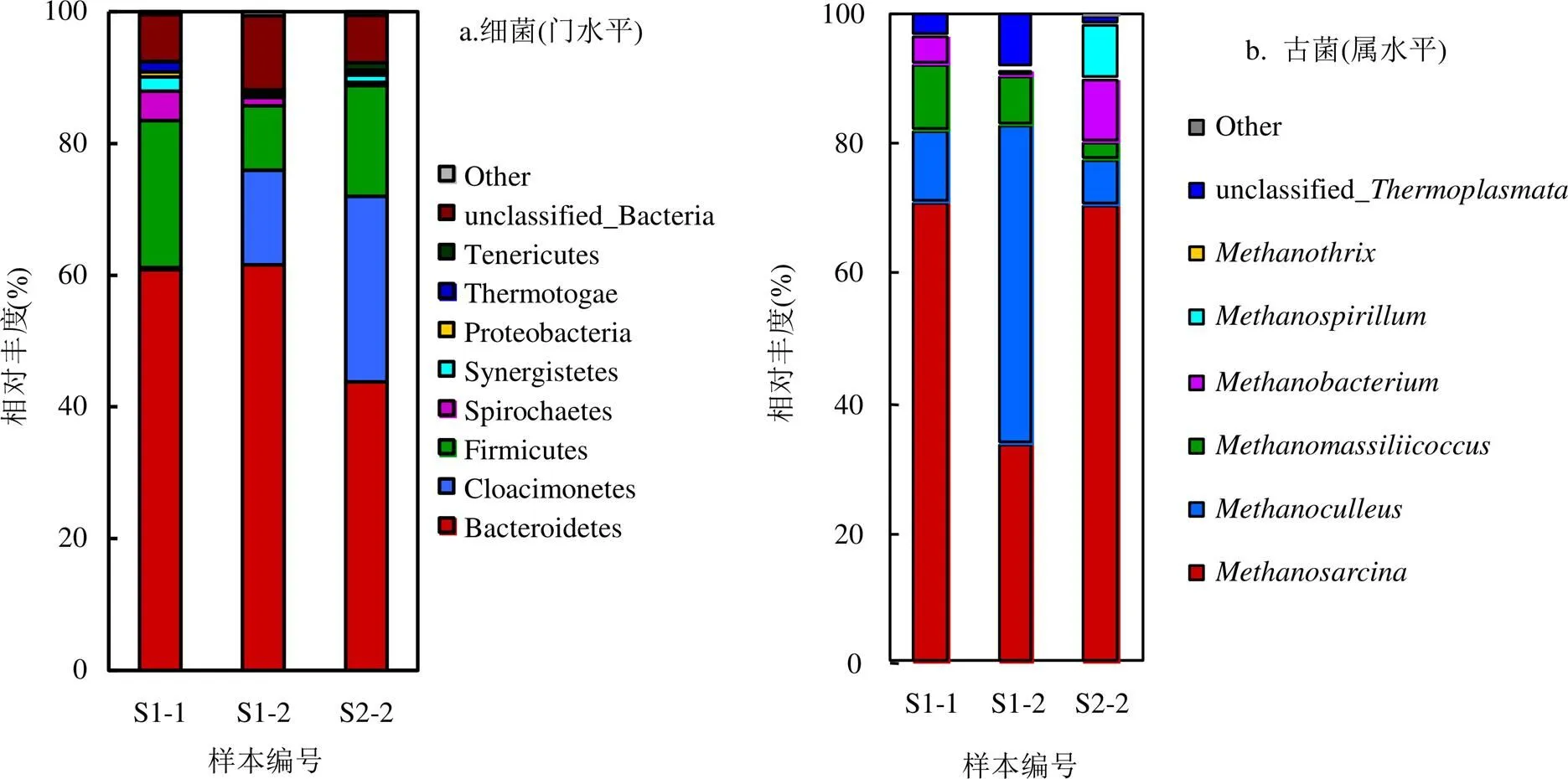
图3 餐厨垃圾厌氧发酵反应器中细菌群落在门水平和古菌群落在属水平上的相对丰度
如图3所示,Bacteroidetes, Cloacimonetes和Firmicutes是两个厌氧发酵阶段中最主要的细菌门类.其中Bacteroidetes的微生物菌群被报道存于在碳水化合物发酵,生理稳态和类固醇代谢中,可以生产各种分解酶,包括降解复杂的有机化合物的水解酶,蛋白酶和脂肪酶[17-19]. Cloacimonetes被报道与其他耗氢和利用乙酸盐的细菌共同作用时,可以在低氨氮条件下降解纤维素,参与丙酸的共氧氧化和氨基酸降解为乙酸盐,CO2和H2[20]. Firmicutes由大量分泌裂解酶包括纤维素酶,脂肪酶,蛋白酶和其它胞外酶的细菌组成,由于可以形成孢子,这些细菌可以在极端环境条件下存活[21-22].在S1体系开始时Bacteroidetes(60.8%)和Firmicutes(22.4%)占优势,在厌氧发酵结束时Bacteroidetes(61.6%)无明显变化,而Cloacimonetes(14.4%)成为优势门之一, Firmicutes(9.8%)降低了12.6%成为第3优势门.在S2阶段Bacteroidetes(43.8%)相对丰度相比起始降低了17.8%,Cloacimonetes(28.1%)和Firmicutes(16.85%)分别增长了13.8%和7.1%. Cloacimonetes的出现并在S2体系内作为优势门,说明固液混合相餐厨垃圾的复杂成分使体系内的功能菌群发生了变化,固液混合相餐厨垃圾厌氧发酵体系除了需要Bacteroidetes和Firmicutes分泌大量水解酶来降解大分子有机物,还需要Cloacimonetes的协同降解纤维素、氨基酸等.
由图3可以看出,和是2个厌氧发酵阶段中产甲烷古菌的主要优势属.可以利用甲醇,甲胺,乙酸盐以及H2和CO2生产甲烷,能够利用不少于9种的产甲烷基质,且具有较快的生长速率可以快速适应周围环境变化[23-24].是氢营养型产甲烷菌,可以利用H2和甲酸盐作为主要的电子供体将CO2还原为CH4[25]. S2阶段中相对丰度较高的和同为氢营养型产甲烷菌,都是利用H2作为电子供体将CO2还原为CH4[25-26].在S1阶段可以看出随着厌氧发酵的进行相对丰度下降37%,与之对应相对丰度升高至49.0%,成为主要优势属.在S2阶段回到了最高相对丰度(70.1%),下降至7.2%,其相对丰度下降了41.8%. S1反应体系内主要为氢营养型产甲烷菌,占据了相对丰度的57.9%, S2反应体系内主要为多功能的为主,占据了相对丰度的70.1%,其可以在甲基营养型,乙酸营养型和氢营养型三种模式下产甲烷[27].S2阶段的大量富集,是因为对高浓度的氨氮具有更强的抵抗力[28-29],结合两个厌氧发酵阶段的氨氮浓度变化,可以解释该富集现象.与之相反因为S1阶段的氨氮浓度相对较低,适宜更多种类的产甲烷菌生长,所以氢营养型和乙酸营养型产甲烷菌开始富集.结合表5的2个厌氧发酵阶段中古菌多样性分析,与S2相比S1具有更高的群落分布丰富度和多样性,证明了氨氮浓度是导致古菌种群转移的关键因素[30].
3 结论
3.1 固液油三相分离预处理后,液相餐厨垃圾比固液混合相餐厨垃圾在厌氧发酵过程中具有更高的VS去除率(91.2%),实际产甲烷潜能(531.5mLCH4/ gVS)和甲烷转化率(54.3%),且氨氮积累较慢.
3.2 微生物群落分析表明氨氮浓度是导致古菌群落转移和丰度变化的关键因素,在液相餐厨垃圾厌氧发酵时因其氨氮浓度较低,致使古菌群落具有更高的丰富度和多样性,古菌群落向氢营养型和乙酸营养型产甲烷模式进化;而在固液混合相餐厨垃圾厌氧发酵时因其氨氮浓度较高使古菌群落以耐高浓度氨氮的多功能产甲烷菌为主.
[1] Jin C, Sun S, Yang D, et al. Anaerobic digestion: An alternative resource treatment option for food waste in China [J]. Science of The Total Environment, 2021,779:146397.
[2] 汤 晴.餐厨垃圾厌氧制沼及沼气异位生物提纯技术研究 [D]. 无锡:江南大学, 2019.
Tang Q. The biogas generation from food waste by anaerobic digestion and its ex-situ biological upgrading technology [D]. Wuxi: Jiangnan University, 2019.
[3] Lin L, Xu F, Ge X, et al. Improving the sustainability of organic waste management practices in the food-energy-water nexus: A comparative review of anaerobic digestion and composting [J]. Renewable and Sustainable Energy Reviews, 2018,89:151-167.
[4] Li Y, Jin Y, Borrion A, et al. Current status of food waste generation and management in China [J]. Bioresource Technology, 2019,273: 654-665.
[5] 文 斐.我国餐厨垃圾处理工艺技术路线选择与分析 [J]. 环境与发展, 2020,32(9):107+109.
Wen F. Selection and analysis of food waste treatment process in China [J]. Environment and Development, 2020,32(9):107+109.
[6] Zhang J, Hu Q, Qu Y, et al. Integrating food waste sorting system with anaerobic digestion and gasification for hydrogen and methane co-production [J]. Applied Energy, 2020,257:113988.
[7] 何 琴,李 蕾,何清明,等.重庆主城餐厨垃圾理化性质及产甲烷潜能分析 [J]. 环境化学, 2014,33(12):2191-2197.
He Q, Li L, He Q M, et al. Physical and chemical properties and methane production potential of food waste in Chongqing City [J]. Environmental Chemistry, 2014,33(12):2191−2197.
[8] 王 丽.厨余-污泥混合干式厌氧发酵及其微生物学机制研究 [D]. 西安:西安工程大学, 2019.
Wang L. Study on dry anaerobic fermentation of kitchen waste-sludge and its microbiological mechanism [D]. Xi'an: Xi'an Polytechnic University, 2019.
[9] CJ/T313-2009 生活垃圾采样和物理分析方法 [S].
CJ/T313-2009 Sampling and physical analysis methods of domestic waste [S].
[10] CJ/T 96-2013 生活垃圾化学特性通用检测方法 [S].
CJ/T 96-2013 General test method for chemical characteristics of domestic waste [S].
[11] GB 5009.44-2016 食品中氯化物的测定 [S].
GB 5009.44-2016 Determination of chloride in food [S].
[12] HJ 535-2009 水质氨氮的测定纳氏试剂分光光度计法 [S].
HJ 535-2009 Water quality determination of ammonia nitrogen nessler reagent spectrophotometric method [S].
[13] 张达飞.餐厨垃圾厌氧消化运行实验研究 [D]. 北京:北京建筑大学, 2017.
Zhang D F. Experimental research on the anaerobic digestion of food waste [D]. Beijing: Beijing University of Civil Engineering and Architecture, 2017.
[14] 李荣平,葛亚军,王奎升,等.餐厨垃圾特性及其厌氧消化性能研究 [J]. 可再生能源, 2010,28(1):76-80.
Li R P, Ge Y J, Wang K S, et al. Characteristics and anaerobic digestion performances of kitchen wastes [J]. Renewable Energy Resources, 2010,28(1):76−80.
[15] Tampio E, Ervasti S, Paavola T, et al. Anaerobic digestion of autoclaved and untreated food waste [J]. Waste Management, 2014, 34(2):370-377.
[16] 钱小青.泔脚废物厌氧两相发酵工艺及其矿化垃圾协同生物产氢过程研究 [D]. 上海:同济大学, 2006.
Qian X Q. Anaerobic digetion and biological hydrogen production from food origin wastes in the presence of aged refuse [D]. Shanghai: Tongji University, 2006.
[17] Alalawy A I, Guo Z, Almutairi F M, et al. Explication of structural variations in the bacterial and archaeal community of anaerobic digestion sludges: An insight through metagenomics [J]. Journal of Environmental Chemical Engineering, 2021,9(5):105910.
[18] Marchesi J R, Adams D H, Fava F, et al. The gut microbiota and host health: A new clinical frontier [J]. Gut, 2016,65(2):330-339.
[19] Rivière D, Desvignes V, Pelletier E, et al. Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge [J]. ISME Journal, 2009,3(6):700-714.
[20] Stolze Y, Bremges A, Maus I, et al. Targeted in situ metatranscriptomics for selected taxa from mesophilic and thermophilic biogas plants [J]. Microbial Biotechnology, 2018,11(4): 667-679.
[21] Pasalari H, Gholami M, Rezaee A, et al. Perspectives on microbial community in anaerobic digestion with emphasis on environmental parameters: A systematic review [J]. Chemosphere, 2020,270:128618.
[22] Lim J W, Chiam J A, Wang J-Y. Microbial community structure reveals how microaeration improves fermentation during anaerobic co-digestion of brown water and food waste [J]. Bioresource Technology, 2014,171:132-138.
[23] Jenney F E, Adams M W W. Hydrogenases of the model hyperthermophiles [J]. Annals of the New York Academy of Sciences, 2008,1125(1):252-266.
[24] Goberna M, Gadermaier M, Franke-Whittle I H, et al. Start-up strategies in manure-fed biogas reactors: Process parameters and methanogenic communities [J]. Biomass and Bioenergy, 2015,75:46- 56.
[25] Guo J H, Peng Y Z, Ni B J, et al. Dissecting microbial community structure and methane-producing pathways of a full-scale anaerobic reactor digesting activated sludge from wastewater treatment by metagenomic sequencing [J]. Microb. Cell. Fact., 2015,14:11.
[26] Cadillo-Quiroz H, Brauer S L, Goodson N, et al. Methanobacterium paludis sp nov and a novel strain of Methanobacterium lacus isolated from northern peatlands [J]. International Journal of Systematic and Evolutionary Microbiology, 2014,64:1473-1480.
[27] Mehta P, Deshmukh K, Dagar S S, et al. Genome sequencing and analysis of a psychrotrophic methanogen Methanosarcina sp. nov. MSH10X1cultured from methane hydrate deposits of Krishna Godavari Basin of India [J]. Marine Genomics, 2021:100864.
[28] Zhang J, Lv C, Tong J, et al. Optimization and microbial community analysis of anaerobic co-digestion of food waste and sewage sludge based on microwave pretreatment [J]. Bioresource Technology, 2016, 200:253-261.
[29] Poirier S, Desmond-Le Quéméner E, Madigou C, et al. Anaerobic digestion of biowaste under extreme ammonia concentration: Identification of key microbial phylotypes [J]. Bioresource Technology, 2016,207:92-101.
[30] Zamanzadeh M, Hagen L H, Svensson K, et al. Anaerobic digestion of food waste – Effect of recirculation and temperature on performance and microbiology [J]. Water Research, 2016,96:246-254.
Study on anaerobic digestion of kitchen waste based on solid-liquid separation pretreatment.
ZHANG Jing-xue1,2, LI Pan-pan1, YU Yang1, ZENG Su1, YU Ran1*, YANG Guang-ping3
(1.Department of Energy and Environment, Southeast University, Nanjing 210096, China;2.Nanjing Environment Group Co.LTD, Nanjing 210046, China;3.Chinair Environmental Science and Technology Co. LTD, Nanjing 210019, China)., 2022,42(3):1252~1258
A semi-continuous anaerobic digestion (AD) experiment was set up to evaluate the methanogenesis potential of kitchen waste (KW) after different pretreatment modes. After the solid, liquid and oil three-phase separation pretreatment, the liquid-phase KW achieved a higher volatile solid (VS) removal rate, experimental methane potential (EMP) and methane conversion rate than the mixed one of solid-liquid phases, which were 91.2%, 531.5mLCH4/gVS, and 54.3%, respectively. The results indicated that the medium-temperature wet AD displayed a satisfying effect on KW reduction and resource utilization when using the liquid-phase KW as the feedstock. The microbial community analysis showed that the microbial community succession in the AD system was affected by the KW pretreatment method. The ammonia concentration was the key factor to induce the variation and abundance shifts of the archaeal community. The hydrogenotrophic methanogen,was the dominant methanogens in the AD system with the KW liquid phase as the feedstock. The, which was reported to be able to resist high concentrations of ammonia nitrogen was the dominant methanogens in the AD system with the feedstock of the KW solid-liquid phase mixture.
kitchen waste;anaerobic digestion;pretreatment;microbial community
X705
A
1000-6923(2022)03-1252-07
张靖雪(1995-),女,河南平顶山人,东南大学博士研究生,主要从事固体废弃物处理与处置研究.
2021-08-01
2020年度江苏省建设系统科技项目(指导类)(2020ZD61)
*责任作者, 教授, yuran@seu.edu.cn
