悬移质泥沙影响下水体中DBP的降解
2022-03-29何艺欣刘孟子胡学斌
黄 维,冉 艳,何艺欣,刘孟子,何 强,胡学斌,李 宏
悬移质泥沙影响下水体中DBP的降解
黄 维,冉 艳,何艺欣,刘孟子,何 强,胡学斌,李 宏*
(重庆大学三峡库区生态环境教育部重点实验室,重庆 400045)
为探究含悬移质泥沙(SPM)影响下水体中邻苯二甲酸二正丁酯(DBP)的去除过程,采集了三峡库区一级支流御临河中的原位水样和SPM,以DBP为供试试剂,在室内构建实验体系,设置4组实验:原水(对照)、原水-NaN3、原水-SPM-NaN3和原水-SPM,研究了扰动水体中DBP的光解、吸附和生物降解过程.研究发现:水相中的DBP可通过直接吸收光电子诱导有机分子降解或在有色溶解性腐殖质(包括富里酸和类胡敏酸等)中的发色团(苯环、羧基等)吸收电子产生活性中间体而诱导DBP发生光催化降解;在原水-NaN3实验组中,在2种光解反应的作用下,24d后水相中DBP浓度降低了82.86%;SPM的吸附作用对DBP的去除效果不佳(0.63%),可能是由于DBP光降解产物及原位水中的溶解性有机质会与DBP竞争SPM上的表面吸附位点;SPM附着生物膜对DBP的吸附-生物降解,导致水相中89.81%的DBP被去除.虽然24d内,各处理组DBP的去除率接近(82%~89%),但原水-SPM组中总溶解性有机碳去除率显著高于(<0.05)其他组,表明在原水-SPM组中实现了DBP的降解.
邻苯二甲酸二正丁酯;悬移质泥沙;光降解;生物降解;吸附
邻苯二甲酸酯 (PAEs)广泛应用在食品包装袋、汽车、儿童玩具、服装、假牙以及建筑材料等生产生活中[1-3].PAEs作为一种常见的环境内分泌干扰物,在许多生物体内可引起免疫毒性、代谢毒性、内分泌毒性、神经毒性、遗传毒性、发育毒性等不良反应[4-5]. PAEs不易降解,容易在生物体内的各个组织中积累,并以生物放大的方式在食物链中进行累积和传递[6].
我国长江重庆段水体、沉积物和消落带土壤中都有不同浓度水平的PAEs检出,且三峡库区中的PAEs污染物单体中DBP的浓度最高[7-9].目前DBP的潜在去除途径有:水解、光解、吸附和生物降解.但PAEs的水解作用极小,其中DBP水解的半衰期长达22a(pH=7.0,25℃)[10].Lertsirisopon等[11]进一步在遮光条件下模拟DBP的水解作用(pH=7.0),发现DBP水解率约为10%(140d).
在天然河流中,水体和泥沙是各类污染物的主要载体.悬移质泥沙(SPM)因具有颗粒小、比表面积大、组分复杂和易受水动力条件影响等特性,会对PAEs的迁移转化过程产生影响.目前,针对水环境中PAEs环境行为的研究主要关注吸附过程[12],但对水环境中PAEs的上述复杂环境行为的耦合过程解析的研究涉及尚少.为了探究水体中SPM对PAEs去除过程的影响,本研究选择DBP为PAEs的模式污染物,研究了SPM介导下DBP的生物和非生物降解途径,旨在揭示SPM影响DBP去除的关键过程,为多沙河流中PAEs污染的防治提供依据.
1 材料与方法
1.1 材料
供试水样和SPM采自三峡库区库尾一级支流御临河(重庆市渝北区境内,29°34¢45²N~30°07¢22²N, 106°27¢30²E~106°57¢58²E).采集的原位水样静置3d,取上层水样经400目的标准筛过滤,去除水样中浮游动植物和陆源输入的动植物残体等.接着将沉于圆筒底部的SPM混匀,通过蠕动泵经0.45µm玻璃纤维过滤器过滤水样,滤膜上截留的SPM经风干后储存在棕色试剂瓶中,直至后续实验与分析.
1.2 实验方法
分别向12个锥形瓶中各加入2L过滤后的原位水样,随后加入DBP标液,使各锥形瓶中DBP浓度约为5mg/L.将12个锥形瓶分成4组,第1组为含有5mg/L DBP的原位水(对照);第2组为含有5mg/L DBP + 200mg/L NaN3的原位水(原水- NaN3);第3组为含有5mg/L DBP + 200mg/L NaN3+ 0.4g SPM的原位水(原水-SPM- NaN3);第4组为含有5mg/L DBP + 0.4g SPM的原位水(原水-SPM).将以上实验组置于25℃的光照培养箱中, 通过磁力搅拌器以300r/min的转速不间断搅拌,每天交替进行各12h的光照和黑暗培养.
每隔3d从锥形瓶中取3mL的水样,以6000r/min的转速下离心20min后取上清液,测定水样中DBP的浓度及其降解产物.
1.3 分析方法
1.4 数据处理
采用Origin 2021b及IBM SPSS Statistics 26对数据进行分析处理及显著性检验.
2 结果与分析
2.1 水相中DBP的降解特征
2.1.1 DBP浓度 各实验体系中DBP的初始浓度为4.90~4.96mg/L,24d后,对照组、原水-NaN3组、原水-SPM-NaN3组和原水-SPM组水相中DBP浓度分别降低了87.57%、82.86%、83.49%和89.81%(图1).

图1 不同实验组中DBP浓度变化
2.1.2 溶解性总有机碳去除率 原水-NaN3组、原水-SPM-NaN3组中溶解性总有机碳去除率相对较小.对照组和原水-SPM组中溶解性总有机碳去除率较高,分别为10.03%和59.85%.
2.1.3 溶解性有机质组成特征 使用荧光区域积分法(FRI)将三维荧光光谱图分为5个激发波长/发射波长区域来分析水体中5类溶解性有机质,包括芳香类蛋白(Ⅰ区,激发波长/发射波长为200~250/ 200~330nm)、芳香类蛋白(Ⅱ区,激发波长/发射波长为200~250/330~380nm)、类富里酸(Ⅲ区,激发波长/发射波长为200~250/380~500nm)、溶解性微生物代谢产物(Ⅳ区,激发波长/发射波长为250~280/200~ 380nm)、类胡敏酸(Ⅴ区,激发波长/发射波长为250~ 400/380~500nm)[13].
如图2所示,在未添加DBP标准品前,各实验组原位水的三维荧光光谱的出峰位置和峰形基本一致,仅荧光峰的强度存在一定的差异,主要为类富里酸(Ⅲ区)和类胡敏酸(Ⅴ区)等天然有机质.实验结束后,各实验组之间的三维荧光特征差异较为明显.添加了生物抑制剂的原水-NaN3和原水-SPM-NaN3两组仅存在相似的类胡敏酸的荧光峰,且两者荧光峰强度无明显差异.而在均存在微生物作用的对照组和原水-SPM两组中呈现更为丰富的荧光峰信息.在对照组和原水-SPM组中出现了不同荧光强度的芳香类蛋白(Ⅰ区)、类富里酸、溶解性微生物代谢产物和类胡敏酸的荧光峰,其中对照组在Ⅰ和Ⅳ区的荧光强度稍强,这表明其水相中存在更多的溶解性微生物代谢产物和芳香类蛋白(Ⅰ区),而原水-SPM组在Ⅲ和Ⅴ区的荧光强度稍强,表明其类富里酸和类胡敏酸的含量可能高于前者.

图2 实验前后不同实验组中溶解性有机质组成
a、b、c和d分别为对照、原水-NaN3、原水-SPM-NaN3和原水-SPM,1和2分别为初始和结束
2.2 悬移质泥沙中DBP降解特征
2.2.1 泥沙形态 如图3所示,原始SPM的颗粒形状不规则,颗粒的细部特征明显;泥沙表面也存在相对平坦的区域,这可能是矿物的节理形成的,此外还有大量小颗粒泥沙贴附在颗粒表面凹陷或平坦区域.在实验结束时,原水-SPM-NaN3组中的SPM相较于原始SPM,颗粒表面附着的物质较少,泥沙自身形状得以呈现出来.原水-SPM组中的SPM表面出现了不规则的微团聚体.在微聚合体中泥沙颗粒表面裹覆着一层类似薄膜的物质,使得泥沙颗粒边缘轮廓变得圆滑,且SPM颗粒之间由类似胶质的生物质黏结起来,这可能是由于生物的生长活动,例如细菌在泥沙颗粒上的定植、生长和增殖等[14]所分泌的胞外物质引起的.
2.2.2 泥沙理化性质 (1)细菌及多糖的分布:实验前后,添加生物抑制剂的原水-SPM-NaN3组中的SPM表面并无细菌的活动迹象(图4A和a组).在实验第1d,原水-SPM实验组应处于生物膜形成初期,细菌仅在SPM表面进行粘附,因此在原水-SPM组中的SPM上仅观察到少量活细菌分布,多糖分布不明显(图4B组);在实验结束时,观察到SPM颗粒间出现明显的聚集现象,且大量活细菌非均匀的分布在SPM表面,并能观察到明显的多糖信号(图4b组).这是由于在SPM表面形成微菌落的细菌继续繁殖并分泌胞外聚合物,如多糖、蛋白和胞外DNA等,最终形成具有三维结构的成熟生物膜,同时也使SPM颗粒“胶结”在一起,形成细菌-SPM聚集体,该现象与环境扫描显微镜观察到的结果一致.此外,在实验前期,水中游离的细菌还处于初始粘附阶段,因此SPM表面并无明显的死细菌分布;实验后期的SPM表面也并未观察到明显的死细菌分布,这可能是两方面的原因导致的:一是当生物膜中的细菌死亡或者裂解时,它们的残体会进一步被分解作为其他活细菌的养分;二是在磁力搅拌器的不断搅拌下,SPM之间发生碰撞,死细菌可能从SPM表面脱落下来,两者综合作用导致实验后期死细菌的分布并不明显.

图3 SPM的表面形态
a、b和c分别为原始SPM,原水-SPM-NaN3(结束)和原水-SPM(结束)

A和a分别为原水-SPM-NaN3初始和结束;B和b分别为原水-SPM初始和结束;序号1、2、3、4分别表示活菌染色呈现的绿色荧光、死菌染色呈现的红色荧光、多糖染色呈现的蓝色荧光和Syto 9、PI、Con-A三重染色呈现的荧光效果
(2)表面官能团:如图5所示,实验前后,在原水-SPM-NaN3组SPM的光谱图无明显的吸收区域和吸收强度的变化,在3400cm-1左右出现的宽峰,可能是由于黏土矿物表面本身存在-OH[15];在1640cm-1左右出现的弯曲振动峰为黏土矿物吸附水而产生的H-O-H[16],1030cm-1处出现的峰对应C-O-C的伸缩振动峰或Si-O不对称拉伸振动峰.微生物及其代谢产物可显著改变黏土矿物表面性质[16-18],因此在实验结束时,原水-SPM组中的SPM虽然在吸收波数和吸收区域没有较大差异,但是在3400cm-1的吸收强度增强且峰宽明显增加,2936和1640cm-1处的吸收强度明显增大.其中细菌分泌的胞外聚合物中的蛋白质聚合物增加,导致3400cm-1处的吸收峰增强,而粘土矿物本身存在的-OH、羧酸化合物的O-H拉伸振动以及酰胺中N-H的叠加效应导致吸收峰变宽;在2936cm-1处-CH拉伸振动峰增强,这表明SPM表面的-CH和-CH2增加,其中-CH是有机化合物中常见的结构单位;1640cm-1处的酰胺(蛋白质肽键)中的C = O拉伸振动峰的存在,也会导致该处的吸收强度增加.此外,如图4b组所示,结束时原水-SPM实验组中SPM表面存在着大量的多糖,但傅立叶红外光谱图在1030cm-1处的C-O-C伸缩振动峰(多糖(糖原)的主要成分)的吸收强度并没有明显增加,这可能与黏土矿物中大量Si-O不对称拉伸振动峰产生的屏蔽效应有关.
⑤采用多级导航模板定义。通过改变模板方案调整页面整体布局,使网站页面布局设计方便灵活,随意组合,所见即所得。
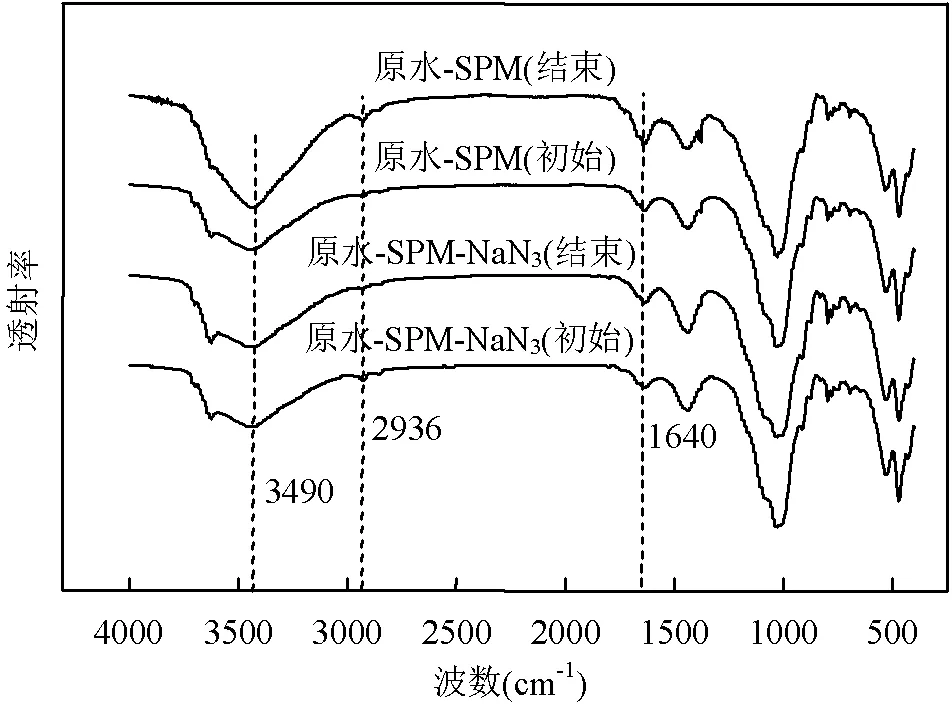
图5 SPM傅立叶红外光谱图
(3)有机元素含量:对原始SPM以及结束时SPM进行有机元素分析,用于SPM和细菌-SPM复合物中有机元素的半定量分析(表1).与原始SPM相比,实验结束时原水-SPM-NaN3组中SPM的C含量显著降低,H和S元素含量无明显变化,而N和O元素含量分别增加1.94和1.15倍;与原始SPM相比,原水-SPM组SPM的有机元素含量都存在不同程度地增加,其中C、H、N和O含量分别增加了3.91、1.50、2.81和1.97倍.S元素含量在实验结束时较初始增加了11.00倍,这是因为天然有机化合物的蛋白质中常含S元素,上述结果与SPM的傅立叶红外光谱图中3400cm-1处吸收峰(蛋白质聚合物)增强的结果相吻合(图5).
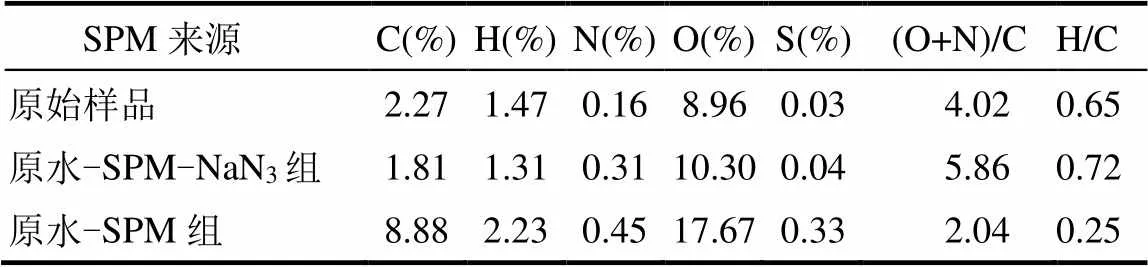
表1 SPM的有机元素分析

图6 实验初始与结束时SPM的级配曲线
2.2.3 泥沙粒径变化 如图6所示,实验初始时,原水-SPM组和原水-SPM-NaN3组中的SPM颗粒粒径分布相似,呈正态分布且半峰宽较小的特点,两实验组的中值粒径0.5为3.98μm.实验结束时,原水-SPM-NaN3组中的SPM粒径与实验初始时的粒径分布相比略微减小,其中值粒径0.5为3.27μm(0.1= 1.38μm,0.9=9.25μm);而原水-SPM组中SPM的粒径分布与初始差异显著(<0.05),整体粒径中值和峰宽明显增大,中值粒径0.5为15.56μm(0.1=3.27μm,0.9=52.33μm),这主要与细菌及其代谢产物的“胶结”作用促使SPM出现聚合现象有关,使得单个泥沙颗粒粒径增大(图3和图4),最终导致粒径普遍增加,其级配曲线呈现整体粒径分布向右偏移的趋势.
3 讨论
天然水环境中的SPM是由腐殖质及金属水和氧化物粘附架桥聚集在一起的有机质和矿物质的复合体,能吸附大量无机或有机污染物;SPM可为水体中游离细菌提供附着定植的基底,并在SPM表面形成生物膜,进而间接影响水相和SPM基质中无机或有机污染物的生物降解过程[36].研究表明,生物降解过程是PAEs最为高效的去除过程,PAEs能作为碳源被单一细菌或菌群利用转化,从而实现PAEs 完全矿化[42],且自然水体中的天然物质会直接或间接影响PAEs的降解过程.
本研究中,对照组中涉及的DBP去除过程主要包括光解及原水中微生物的生物降解作用;原水-NaN3组中DBP的去除过程只包括光解过程;原水-SPM-NaN3组中DBP的去除过程包括光解作用及SPM对DBP的吸附去除;原水-SPM组中DBP的去除过程包括光解、吸附和生物降解作用.实验24d内(图1),体系中水相DBP主要通过光解作用去除,去除率高达82.86%;通过吸附作用去除的DBP百分比为0.63%;在未添加SPM的实验组中,DBP通过生物降解去除百分比为4.71%,而添加SPM后,实验体系中通过生物降解去除的DBP的量所占百分比为6.32%,添加SPM使得水相中DBP的生物降解效率提高了1.61%.
3.1 光解作用
光解是DBP非生物降解的主要过程[11],在偏酸或偏碱性的条件下较有利于DBP的光解作用.在天然水体且pH值偏中性的环境中,经太阳光照射直接光解PAEs的降解效率较低,其中DBP光解的半衰期为50~360d[11].DBP的光解主要与水体中存在的有色溶解性有机质密切相关.水体中的有色溶解性有机质能够吸收光能跃迁为激发态、产生活性自由基或单线态氧等活性中间体与DBP发生反应而促发光解作用.如图2(a1,b1,c1和d1)所示,由于御临河原位水引入使各实验体系中均含有一定量的有色溶解性腐殖质(CDOM),主要包括类富里酸和类胡敏酸.CDOM中的苯环、羧基、羰基等发色团能吸收光电子后产生活性中间体,如•OH、CO3−•,1O2等[19-20],进而诱导DBP的光催化降解,在直接光解和间接光解的共同作用下,24d内原水-NaN3实验组中DBP浓度降低了82.86%(图1).目前关于水体中PAEs间接光解的研究极少,而对于CDOM作用下抗生素的间接光解研究相对较多.李聪鹤等[20]研究显示:2,5,10mg/L CDOM(2S101H,国际腐殖酸协会)存在下磺胺甲噁唑的光降解率分别为18.25%、20.39%和30.94%(24h),CDOM产生的不同活性中间体对磺胺甲噁唑的光降解率贡献度也所有不同,其中•OH在磺胺甲噁唑间接光降解中处于主导地位.
如图1所示,原水-NaN3实验组中DBP浓度降低了82.86%(24d),但水相中溶解性总有机碳含量并无明显变化.此外,该实验组中几乎无微生物的增殖作用(图4),因此可推测原水-NaN3实验组中DBP降低浓度均是光解过程驱动的.同时,对原水-NaN3实验组中DBP及其光解中间产物的测定结果表明,虽然水体中DBP发生了转化,但并未从系统中去除.表2中,DBP的母体化合物DBP-P0(9.44min)以及4种主要光解产物,DBP-P1(6.67min)、DBP-P2 (6.15min)、DBP-P3(8.02min)和DBP-P4(3.62min).
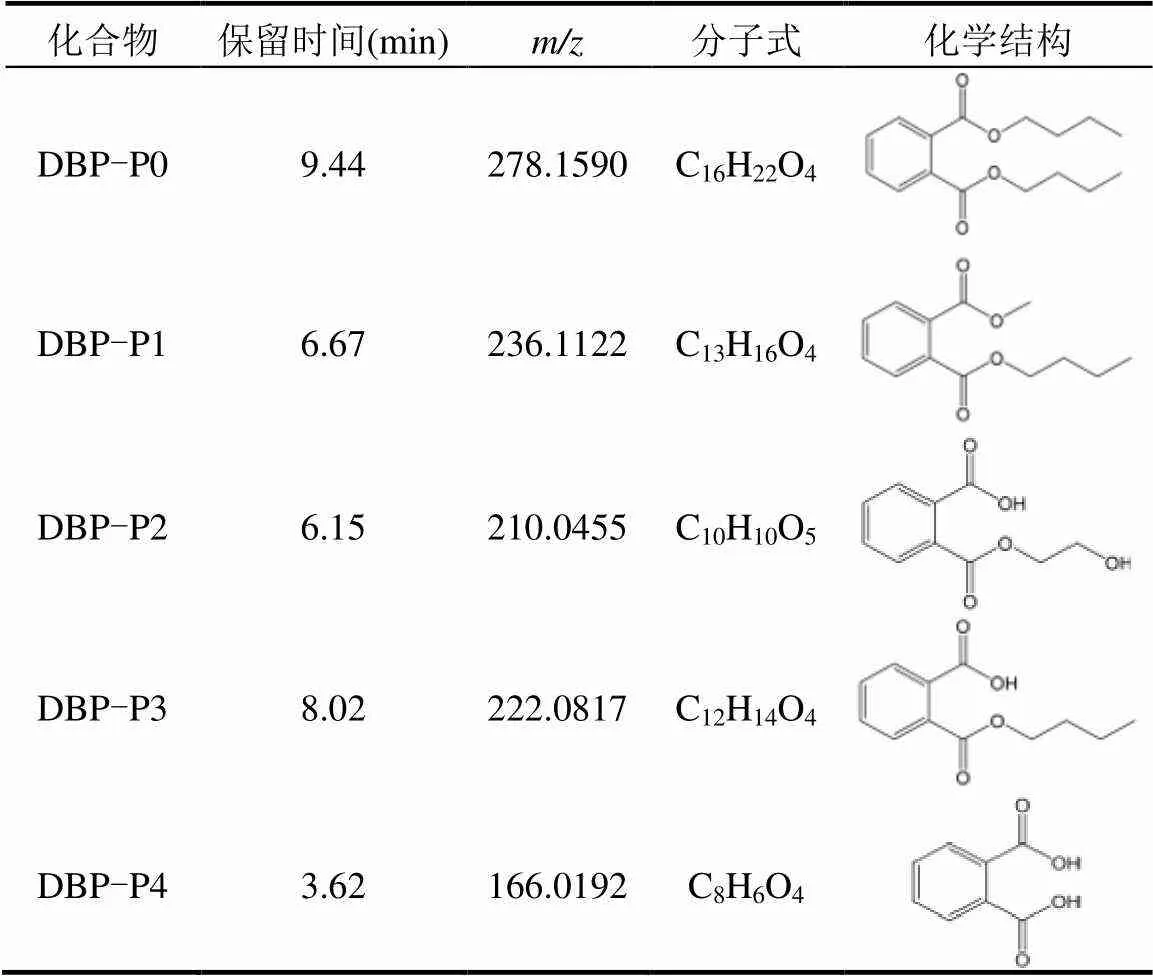
表2 DBP及其主要光解产物
结合文献[10,21-23]分析并推测DBP光解途径:CDOM诱导产生•OH[19,24],产生的•OH首先攻击DBP支链上的酯键,并通过脱烷基化形成2-羧基苯甲酸乙醇(DBP-P2);同时,也可以进一步形成邻苯二甲酸单丁基酯(DBP-P3)和邻苯二甲酸(DBP-P4). DBP主要光解途径包括脱烷基化和羟基加成.
3.2 SPM的吸附作用
SPM具有粒径小、比表面积大等特点,其对有机质的吸附起主要作用的是黏土矿物和附在泥沙表面的金属离子,主要通过氢键作用力、阳离子交换和配体交换等作用将DBP 固定在泥沙表面[25-26].本研究后期,SPM表面形成了一层致密的生物膜(图3),进而构建了SPM-微生物复合体系,这可能会强化SPM对水相的DBP的吸附作用.本研究中,原水-NaN3实验组水相中DBP仅能通过光解作用去除,原水-SPM-NaN3实验组中DBP能通过吸附作用和光解作用两种途径去除.在实验结束时,两实验组水相中DBP浓度分别降低了82.86%和83.49%(图1),这表明吸附作用对去除DBP的贡献率仅为0.63%.可能原因为:1)由于水相中DBP主要通过分配作用迁移至SPM表面,而在水体扰动下,SPM颗粒间不断碰撞,表面附着物质剥落(图3b组); 2)DBP光降解产物以及由御临河原位水引入的溶解性有机质(图2c1)可能会与DBP存在竞争吸附关系,两个影响因素共同作用下使得SPM对DBP的吸附能力降低.
3.3 DBP的生物降解
当外界环境发生变化时,细菌会改变自身生理状态,启动与游离细菌不同的基因调控系统形成生物膜以适应环境的变化[27].如图4所示,初始时原水-SPM实验组水相中游离的细菌在SPM表面发生粘附,且为可逆过程[28-29],粘附的细菌通过分泌胞外聚合物(蛋白、多糖和脂质等)与SPM表面发生紧密结合[30],细菌进一步增殖形成微菌落,SPM表面菌群内的细菌不断分泌胞外聚合物(图5),最终形成成熟的生物膜[31].
附着生物膜成膜过程会影响SPM表面特性,主要体现在1)改变SPM的表面形态.生物膜的形成使得泥沙颗粒边缘轮廓变得圆滑,且细菌分泌的胞外聚合物使颗粒“胶结”在一起,最终形成细菌-SPM聚集体(图3、图4),从而有效抵抗机械压力,避免细菌从生物膜中脱落[27]; 2)影响SPM的表面理化性质.有研究表明C和N元素含量与有机物质含量成显著正相关[32],结束时原水-SPM实验组中细菌-SPM聚集体的各有机元素含量均存在不同程度的增加,其中S、C和N元素分别增加了11.00、3.91和2.81倍(表1).由此推测与原始SPM相比,附着生物膜成膜过程中细菌-SPM聚集体中有机质含量也不断增加.结束时原水-SPM实验组中细菌-SPM聚集体的傅立叶红外光谱显示蛋白和酰胺对应的特征峰明显增强也印证了该推测(图5).与原始SPM相比,结束时原水-SPM实验组中细菌-SPM聚集体的(O+N)/C(极性)和H/C(亲水性)分别降低了2.60和1.97倍[33](表1),即细菌-SPM聚集体的极性和亲水性都所有降低,这可能与其表面致密的生物膜有关.细菌表面的疏水性以及生物膜基质中脂类物质增加导致SPM亲水性的降低,同时使极性也减小[33]; 3)改变SPM的粒径和沉降特性. SPM的粒径大小显著影响SPM自身迁移运输能力及SPM携带相关污染物的迁移转化过程[34],且随着SPM粒径的增大,其孔隙度和密度也会随之改变,最终影响SPM的沉降和起动特性[35].与初始时原水-SPM实验组中SPM粒径相比,结束时细菌-SPM聚集体的形成使SPM粒径增加,其中位粒径增大了3.91倍,且大粒径颗粒普遍增多(图6).
3.4 SPM影响下DBP的光解-吸附-生物降解耦合过程
生物膜是PAEs的重要吸附基质[36],生物膜中细菌也能对PAEs进行生物降解.在自然环境中,生物膜往往通过吸附-生物降解复合作用去除水相中的PAEs.相比水相中游离细菌的生物降解,SPM附着生物膜的吸附-生物降解作用强化了对DBP的去除.Andrew Loh等[37]通过柱实验研究也发现,油-悬浮颗粒复合体系比非分散油的生物降解效果提高了5倍,这是因为油-悬浮颗粒复合体的形成促进了细菌的生长,富含有机质的SPM是烃类碎屑细菌的重要支撑.与未添加SPM的实验组(对照)相比,原水-SPM实验组水相中DBP生物降解去除率为6.32%,增加了1.61%,可能原因是SPM为微生物的增殖提供了良好的载体,使得微生物能够在泥沙表面快速增殖,从而增加了微生物与DBP的接触频率;此外,在SPM表面进行增殖的微生物需要外界碳源作为营养物质,两者共同作用使得生物降解效率得以提高.但同时,SPM对生物降解的强化作用并不明显,可能原因是在持续扰动环境中,SPM颗粒间的不断碰撞及其产生的剪切作用使得SPM表面的生物膜脱落,从而形成了脱落-覆膜的循环过程,使得生物膜稳定性降低.
对照组水相中游离细菌生物降解作用仅去除了10.03%的溶解性总有机碳,而在原水-SPM实验组水相中,游离细菌和SPM附着生物膜中固着细菌导致溶解性总有机碳去除率高达59.85%,表明原水-SPM体系中DBP降解更彻底,主要原因为:1)生物膜的生长增加附着基质的异质性,进而影响疏水性有机物在其有机质中的分配[38].随着SPM表面基质及其颗粒间有机物质含量的增加,更多DBP通过分配作用迁移到SPM相中,增加了DBP与水相中微生物的接触频率.如图3(c)所示,在实验结束时原水-SPM实验组中细菌-SPM聚集体含有大量细菌分泌的多糖物质(图4b),同时有研究表明细菌分泌的多糖或胞外聚合物-多糖复合物能强化PAEs的黏附和累积[36]; 2)生物膜建立了比游离细菌更有效的养分摄取策略.生物膜中保持相对稳态的细菌将高效摄取包括水相和生物膜附着基质的营养物质[39].例如,有研究表明DBP可作为碳源被细菌转化利用,为细菌等微生物的生长提供养分,从而使得微生物的整体酶活性提高,DBP的生物降解率提高[40-41].
但另一方面,相较于原位水中各溶解性有机物的荧光强度,结束时原水-SPM实验组中溶解性微生物代谢产物和类胡敏酸的特征荧光峰显著增强(图2),这可能与生物膜中胞外聚合物的可溶解性微生物产物溶解到水相中有关[42].水相中CDOM(主要为类胡敏酸)含量的增加可能会进一步促进DBP的光解效率,进而影响原水-SPM体系中DBP的降解过程.
采用HPLC-MS进一步测定了潜在中间产物,由表3可见,其中结束时原水-SPM实验组中存在DBP的母体化合物DBP-P0(9.44min)以及6种主要降解产物,DBP-P1(6.67min)、DBP-P2(6.15min)、DBP-P3(8.02min)、DBP-P4(3.62min)、DBP-P5 (6.68min)和DBP-P6(1.02min).
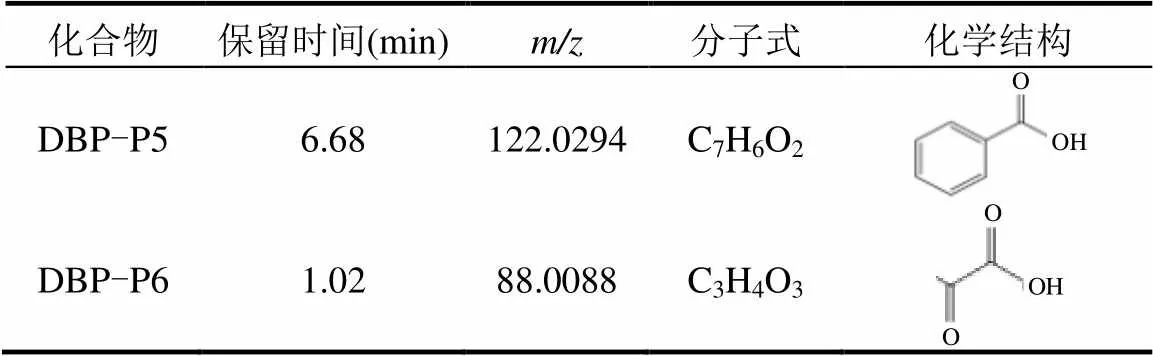
表3 含SPM体系中DBP降解产物
注:DBP-P1、DBP-P2、DBP-P3、DBP-P4相关信息见表2.
结合文献[43-47]分析并得出了SPM及其附着生物膜对DBP降解途径(图7):①DBP经CDOM诱导间接光解为邻苯二甲酸(DBP-P4);②在细菌及其酶的作用下,通过脱羧反应生成苯甲酸(DBP-P5),苯甲酸(DBP-P5)通过苯环裂解并进一步反应代谢生成2-羟基粘康酸半醛(预测代谢产物),然后在一系列反应代谢成丙酮酸(DBP-P6)和乙醛(预测代谢产物),进一步经细菌代谢最后生成CO2和H2O,实现DBP的有效去除.DBP生物降解途径主要包括脱羧化和苯环裂解.

图7 含SPM体系中DBP的潜在降解途径
4 结论
4.1 抑制微生物条件下,水相DBP浓度降低了82.86%(24d),且实验前后水相中溶解性总有机碳含量无显著差异(<0.05),表明DBP在水相中可能发生了光降解.
4.2 在含SPM且微生物抑制条件下,水相中DBP在吸附和光解的共同作用下,浓度降低了83.49%,该实验组中光解作用大于吸附作用.
4.3 在对照组和含SPM组,水相DBP含量分别降低了87.57%和89.81%.且含SPM组水相中溶解性总有机碳去除率达59.85%,显著高于对照组(10.03%,<0.05).
[1] 吴 琼,刘 慧,张 丹,等.邻苯二甲酸酯对浅层含水层沉积物微生物多样性的影响 [J]. 中国环境科学, 2010,30(5):671-676.
Wu Q, Liu H, Zhang D, et al. Effect of di-n-butyl phthalate (DBP) on the microbial diversity in shallow aquifer sediment [J]. China Environmental Science, 2010,30(5):671-676.
[2] Heudorf U, Mersch-Sundermann V, Angerer J. Phthalates: toxicology and exposure [J]International Journal of Hygiene and Environmental Health, 2007,210(5):623-634.
[3] 张小红,王亚娟,陶 红,等.宁夏土壤中PAEs污染特征及健康风险评价 [J]. 中国环境科学, 2020,40(9):3930-3941.
Zhang X H, Wang Y J, Tao H, et al. Study on pollution characteristics and health risk assessment of phthalates in soil of Ningxia [J]. China Environmental Science, 2020,40(9):3930-3941.
[4] Zhang Y, Jiao Y, Li Z, et al. Hazards of phthalates (PAEs) exposure: A review of aquatic animal toxicology studies [J]Science of the Total Environment, 2021,771:145418.
[5] 孙天杭,沈晓芳,张占恩,等.邻苯二甲酸酯及邻苯二甲酸在碳管上的吸附 [J]. 中国环境科学, 2021,41(6):2717-2724.
Sun T H, Shen X F, Zhang Z E, et al. Sorption of phthalic acid esters and low-molecular weight acid on carbon nanotubes [J]. China Environmental Science, 2021,41(6):2717-2724.
[6] Chatterjee S, Karlovsky P. Removal of the endocrine disrupter butyl benzyl phthalate from the environment [J]Applied Microbiology and Biotechnology, 2010,87(1):61-73.
[7] He M J, Yang T, Yang Z H, et al. Current state, distribution, and sources of phthalate esters and organophosphate esters in soils of the Three Gorges Reservoir Region, China [J]. Archives of Environmental Contamination and Toxicology, 2018,74(3):502-513.
[8] 林 莉,董 磊,李青云,等.三峡库区水体和底泥中多环芳烃和邻苯二甲酸酯类分布和来源 [J]. 湖泊科学, 2018,30:660-667.
Lin L, Dong L, Li Q Y, et al. Distribution and sources of polycyclic aromatic hydrocarbons and phthalic acid esters in water and surface sediment from the Three Gorges Reservoir [J]. Journal of Lake Sciences, 2018,30:660-667.
[9] 杨 婷,何明靖,杨志豪,等.邻苯二甲酸酯在三峡库区消落带非淹水期土壤中污染特征及健康风险 [J]. 环境科学, 2017,38(8):4187- 4193.
Yang T, He M J, Yang Z H, et al. Occurrence, Distribution and Health Risk of the Phthalate Esters in Riparian Soil in the Fluctuating Zone of the Three Gorges Reservoir [J]. Environmental Science, 2017,38(8): 4187-4193.
[10] Wolfe N L, Burns L A, and Steen W C. Use of Linear Free-Energy Relationships and an Evaluative Model to Assess the Fate and Transport of Phthal Ate-Esters in the Aquatic Environment [J]. Chemosphere, 1980,9(7/8):393-402.
[11] Lertsirisopon R, Soda S, Sei K, et al. Abiotic degradation of four phthalic acid esters in aqueous phase under natural sunlight irradiation [J]. Journal of Environmental Sciences, 2009,21(3):285-290.
[12] 冉 艳,何 强,袁若愚,等.不同粒径悬移质泥沙对邻苯二甲酸二正丁酯的吸附特性 [J]. 土木与环境工程学报(中英文), 2021,43(5): 178-186.
Ran Y, He Q, Yuan R Y, et al. Adsorption characters of dibutyl phthalate in different grain-size suspended particulate matter [J]. Journal of Civil Environmental Engineering, 2021,43(5):178-186.
[13] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation− emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003,37: 5701-5710.
[14] Billings N, Birjiniuk A, Samad T S, et al. Material properties of biofilms-a review of methods for understanding permeability and mechanics [J]. Reports on Progress in Physics, 2015,78(3):036601.
[15] Madejova J. FTIR techniques in clay mineral studies [J]. Vibrational Spectroscopy, 2003,31(1):1-10.
[16] Gao Q, Tang D, Song P, et al. Bio-adsorption and Bio-transformation of Arsenic by Acidithiobacillus ferrooxidans BY3 [J]. International Microbiology, 2018,21(4):207-214.
[17] Kang L, He Y X, Dai L C, et al. Interactions between suspended particulate matter and algal cells contributed to the reconstruction of phytoplankton communities in turbulent waters [J]. Water Research, 2019,149:251-262.
[18] Zhang Z T, Liu S T, Miyoshi T, et al. Mitigated membrane fouling of anammox membrane bioreactor by microbiological immobilization [J]. Bioresource Technology, 2016,201:312-318.
[19] Vione D, Minella M, Maurino V, et al. Indirect photochemistry in sunlit surface waters: Photoinduced production of reactive transient species [J]. Chemistry-a European Journal, 2014,20(34):10590- 10606.
[20] 李聪鹤,车潇炜,白 莹,等.水体中磺胺甲噁唑间接光降解作用 [J]. 环境科学, 2019,40(1):273-280.
Li C H, Che X W, Bai Y, et al. Indirect Photodegradation of Sulfamethoxazole in Water [J]. Environmental Science, 2019,40(1): 273-280.
[21] Pang X Z, Skillen N, Gunaratne N, et al. Removal of phthalates from aqueous solution by semiconductor photocatalysis: A review [J]. Journal of Hazardous Materials, 2021,402:123461.
[22] Ryan C C, Tan D T, Arnold W A. Direct and indirect photolysis of sulfamethoxazole and trimethoprim in wastewater treatment plant effluent [J]. Water Research, 2011,45(3):1280-1286.
[23] Zhang H G, Zhao C J, and Na H. Theoretical design of biodegradable phthalic acid ester derivatives in marine and freshwater environments [J]. Chemistryopen, 2020,9(10):1033-1045.
[24] 李恭臣,夏星辉,周 追,等.富里酸在水体多环芳烃光化学降解中的作用 [J]. 环境科学学报, 2008,28(8):1604-1611.
Li G C,Xia X H,Zhou Z, et al.Effect of fulvic acid on photolysis of polycyclic aromatic hydrocarbons in aqueous solution [J]. Acta Scientiae Circumstantiae, 2008,28(8):1604-1611.
[25] 马晓军.邻苯二甲酸二丁酯在土壤中的吸附机制研究. [D]. 天津:天津工业大学, 2015.
Ma X J. Study on the adsorption mechanism of dibutyl phthalate in soil [D]. Tianjin:TianGong University, 2015.
[26] 王 磊,应蓉蓉,石佳奇,等.土壤矿物对有机质的吸附与固定机制研究进展 [J]. 土壤学报, 2017,54(4):805-818.
Wang L, Ying R R, Shi J Q, et al. Research progress on the adsorption and fixation mechanism of soil minerals to organic matter [J]. Acta Pedologica Sinica, 2017,54(4):805-818.
[27] 马文婷,土壤矿物介导下细菌生物膜形成过程及机制 [D]. 武汉:华中农业大学, 2017.
Ma W T. The processes and mechanisms of bacteria biofilm formation in the presence of soil minerals [D]. Wuhan: Huazhong Agricultural University, 2017.
[28] Bullitt E, Makowski L. Structual Polymorphism of Bacterial Adhesion Pili [J]. Nature, 1995,373(6510):164-167.
[29] Thomas W E, Nilsson L M, Forero M, et al. Shear-dependent 'stick-and-roll' adhesion of type 1fimbriated Escherichia coli [J]. Molecular Microbiology, 2004,53(5):1545-1557.
[30] Flemming H C, Wingender J. The biofilm matrix [J]. Nature Reviews Microbiology, 2010,8(9):623-633.
[31] Borlee B R, Goldman A D, Murakami K, et al. Pseudomonas aeruginosa uses a cyclic-di-GMP-regulated adhesin to reinforce the biofilm extracellular matrix [J]. Molecular Microbiology, 2010,75(4): 827-842.
[32] Tang X, Zhang J, Liu Y, et al. Geochemistry of organic matter and elements of black shale during weathering in Northern Guizhou, Southwestern China: Their mobilization and inter-connection [J]. Chemie Der Erde-Geochemistry, 2018,78(1):140-151.
[33] Spokas K A. Review of the stability of biochar in soils: predictability of O: C molar ratios [J]. Carbon Management, 2010,1(2):289-303.
[34] Plach J M, Elliott A V, Droppo I G, et al. Physical and ecological controls on freshwater floc trace metal dynamics [J]. Environmental Science & Technology, 2011,45(6):2157-2164.
[35] Droppo I G. Rethinking what constitutes suspended sediment [J]. Hydrological Processes, 2001,15(9):1551-1564.
[36] Wang L, Li Y, Zhang P, et al. Sorption removal of phthalate esters and bisphenols to biofilms from urban river: From macroscopic to microcosmic investigation [J]. Water Research, 2019,150:261-270.
[37] Loh A, Shankar R, Ha S Y, et al. Suspended particles enhance biodegradation of oil in sea [J]. Sci. Total. Environ., 2019,685:324- 331.
[38] Daniel W, Uta B, Reemtsma T. Environmental influences on the partitioning and diffusion of hydrophobic organic contaminants in microbial Biofilms [J]. Environmental Science & Technology, 2008, 42:1990-1996.
[39] Flemming H C, Wingender J, Szewzyk U, et al. Biofilms: an emergent form of bacterial life [J]. Nature Reviews Microbiology, 2016,14(9): 563-575.
[40] Xu W J, Wan Q, Wang W F, et al. Biodegradation of dibutyl phthalate by a novel endophytic Bacillus subtilis strain HB-T2 under in-vitro and in-vivo conditions [J]. Environmental Technology, 2020,DOI 10.1080/09593330.2020.1858181.
[41] Tang J P, Rong X, Jin D C, et al. Biodegradation of phthalate esters in four agricultural soils: Main influencing factors and mechanisms [J]. International Biodeterioration & Biodegradation, 2020,147:104867.
[42] Rummel C D, Jahnke A, Gorokhova E, et al. Impacts of biofilm formation on the fate and potential effects of microplastic in the aquatic environment [J]. Environmental Science & Technology Letters, 2017,4(7):258-267.
[43] Cao B, Geng A, Loh K C. Induction of ortho- and meta-cleavage pathways in Pseudomonas in biodegradation of high benzoate concentration: MS identification of catabolic enzymes [J]. Applied Microbiology and Biotechnology, 2008,81(1):99-107.
[44] Reiner A M, Hegeman G D. Metabolism of benzoic acid by bacterial-accumulation of (-)-3,5-cyclohexadiene-1,2-diol-1- carboxylic acid by a mutant strain of alcaligenes-eutrophus [J]. Biochemistry,1971,10(13):2530-2536.
[45] Ren L, Lin Z, Liu H, et al. Bacteria-mediated phthalic acid esters degradation and related molecular mechanisms [J]. Applied Microbiology and Biotechnology, 2018,102(3):1085-1096.
[46] 沈 思,王晓瑜,王海霞,等.细菌降解邻苯二甲酸酯的研究进展 [J]. 生物工程学报, 2019,35:2104-2120.
Shen S, Wang X Y, Wang H X, et al. Advances in biodegradation of phthalates esters [J]. Chinese Journal of Biotechnology, 2019,35: 2104-2120.
[47] 张晓云,盖忠辉,台 萃,等.微生物降解苯甲酸的研究进展 [J]. 微生物学通报, 2012,39:1808-1816.
Zhang X Y, Gai Z H, Tai C, et al. Advances in benzoic acid degradation by microorganism [J]. Microbiology China, 2012,39: 1808-1816.
The degradation of di-n-butyl phthalate in suspended particulate matter contained waters.
HUANG Wei, RAN Yan, HE Yi-xin, LIU Meng-zi, HE Qiang, HU Xue-bin, LI Hong*
(Key Laboratory of the Three Gorges Reservoir Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China)., 2022,42(3):1230~1239
A microcosm scale study was established to explore the adsorption, photodegradation and biodegradation of di-n-butyl phthalate (DBP) in suspended particulate matter (SPM) contained waters. The water and SPM samples were collected from the Yulin River, a tributary of the Three Gorges Reservoir.Twelve columns containing the same amount of water were prepared, and were divided into 4 treatments. 1) containing water and 5mg/L DBP, which were used as controls; 2) containing water, 5mg/L DBP, and NaN3; 3) containing water, 5mg/L DBP, and SPM; 4) containing water, 5mg/L DBP, SPM and NaN3. The water volume, SPM and NaN3concentration was equivalent for the 4treatments. The results showed that the DBP in the water phase can directly absorb photoelectrons or the chromophore (benzene ring, carboxyl group, etc.) in the colored soluble humus (including fulvic acid and humic acid-like, etc.) could absorb electrons to generate active intermediates, which induced the photocatalytic degradation of DBP. In the raw water-NaN3experimental group, photocatalytic degradation was responsible for 82.86% degradation of DBP in the water after 24 days. The adsorption of DBP by the SPM was insignificant and triggered 0.63% reduction of DBP in the water, this may be due to the competition of adsorption sites between DBP photodegradation products, soluble organic matter and DBP. The joint effect of adsorption and biofilm degradation by the SPM attached biofilm effectively degraded 89.81% DBP in the water. Although the overall removal efficiency of DBP in the four treatments displayed slight difference (in the range of 82%~89%), the concentration of dissolved organic carbon in the SPM added group but without the addition of NaN3was significantly higher (<0.05) than others, indicating the degradation of DBP from the water.
DBP;suspended particulate matter;photodegradation;biodegradation;adsorption
黄 维(1995-),女,重庆奉节人,重庆大学环境与生态学院硕士研究生,主要从事污染物环境行为研究.
2021-08-17
国家自然科学基金资助项目(51609024,41877472)
*责任作者, 副教授, hongli@cqu.edu.cn
A
1000-6923(2022)03-1230-10
X524
