替吉奥联合阿帕替尼治疗晚期胰腺癌患者的效果及对其无进展生存率的影响
2022-03-29周丹枫
周丹枫
(辽宁省北票市中心医院肿瘤血液科,辽宁 北票 122100)
在多因素的联合作用下,胰腺癌成为临床常见且多发的肿瘤。医疗技术的发展和完善致使外科手术成为现阶段临床治疗胰腺癌的主要技术,通过手术可切除病变部位,继而防止肿瘤病灶的扩散和转移。随着临床研究的不断深入,发现手术治疗并不能完全清除病灶,且部分患者术后极易出现复发,因此单纯手术治疗的效果较差,患者后期痛苦不堪。新辅助化疗方案是指术后辅以药物治疗,提高手术成功率的同时减少术后并发症的发生[1-2]。在全球恶性肿瘤排位中,胰腺癌居第4位。近年来,在各种内外源因素的共同作用下,致使我国胰腺癌发病率逐年攀升。胰腺癌早期隐匿性较高,极易漏诊、误诊,因此多数患者在被确诊时,就已处于中晚期,仅有约15%的患者会获得手术切除的机会。阿帕替尼是目前临床治疗期胰腺癌的一线化疗药物,可控制癌细胞扩散、缓解临床症状,但阿帕替尼单药治疗的效果欠佳,因此需结合其他药物治疗[3]。替吉奥联合阿帕替尼治疗晚期胰腺癌患者的效果显著,可抑制胰腺癌细胞,明显延长患者的生存周期,并改善患者的机体耐受性[4]。本研究旨在分析替吉奥联合阿帕替尼治疗晚期胰腺癌患者的临床效果。
1 资料与方法
1.1 一般资料 将62例本院于2015年6月至2017年 12月收治的晚期胰腺癌患者分为两组。对照组31例,男性患者15例,女性患者16例;年龄65~83岁,平均(74.56±8.00)岁。观察组31例,男性患者16例,女性患者15例;年龄64~83岁,平均(74.22±8.22)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),可比性较高。纳入标准:①符合临床中胰腺癌的诊断标准。②经活检、肿块穿刺等实验室检查确诊。③胰腺癌分期在Ⅲ~Ⅳ期。④血常规、生化指标各项结果处于正常。⑤临床资料完整。⑥患者、家属知情且同意。⑦预计生存时间超过90~120 d。排除标准:①心、肝、肾等重要脏器存在重大病变或衰竭者。②存在血液疾病者。③近30 d接受过化疗、放射治疗者。④艾滋病、精神病者。⑤凝血功能严重异常者。⑥沟通、认知、语言障碍者。⑦出血倾向严重者[3]。
1.2 方法 对照组给予阿帕替尼(Apatinib Mesylate Tablets,国药准字H20140103)单药治疗,指导患者午餐30 min后温水口服500 mg阿帕替尼,每日1次,每次850 mg。观察组在对照组基础上联合替吉奥(Tegafur,Gimeracil and Oteracil Potassium Tablets,国药准字H2014001)治疗,指导患者口服80 mg替吉奥,早晚各1次,每次80 mg。两组坚持用药2周后停药1周。
1.3 观察指标 观察不同时段(3、6、9、12个月)两组患者的无进展生存率;无进展生存期从患者初始治疗日开始算,直至死亡日。观察治疗前后肿瘤标志物水平[5],包括CA-199、CA242、CEA、CA50。治疗前后于空腹状态下抽取静脉血3~5 mL,离心处理,转速3000 r/min,时间10 min,通过电化学发光法检测肿瘤标志物各指标水平。观察治疗前后两组患者的生活质量,采用简明健康状况量表(36-item Short-form Health Survey,SF-36)评价,分值和生活质量成正比[6]。
1.4 统计学方法 采用SPSS 22.0统计学软件对数据进行分析。计量资料采用(±s)表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 不同时段无进展生存率 观察组3、6、9个月时的无进展生存率明显较对照组高(P<0.05)。在第12个月时,两组无进展生存率比较差异无统计学意义(P>0.05)。见表1。
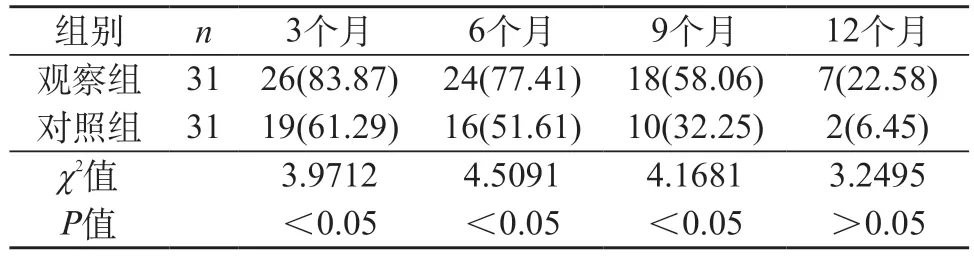
表1 两组不同时段无进展生存率比较[n(%)]
2.2 治疗前后肿瘤标志物水平 治疗前后观察组CA-199、CA242、CEA以及CA50均出现明显下降,P<0.05。治疗前后对照组CA-199、CA242、CEA以及CA50均出现明显下降,P<0.05。经治疗后,观察组CA-199、CA242、CEA以及CA50明显较对照组低,但差异无统计学意义,P>0.05。见表2。
表2 两组治疗前后肿瘤标志物水平比较(±s)
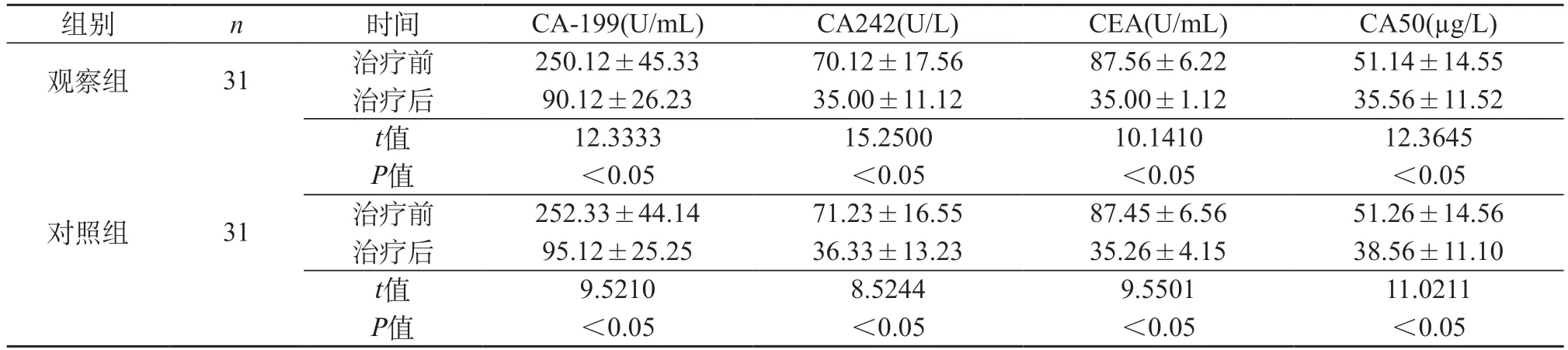
表2 两组治疗前后肿瘤标志物水平比较(±s)
2.3 治疗前后生活质量 观察组治疗前后生活质量各项评分均有所升高,P<0.05。对照组治疗前后生活质量各项评分均有所升高,P<0.05。治疗后,观察组各项生活质量评分较对照组高,P<0.05。见表3。
表3 两组治疗前后生活质量比较(分,±s)
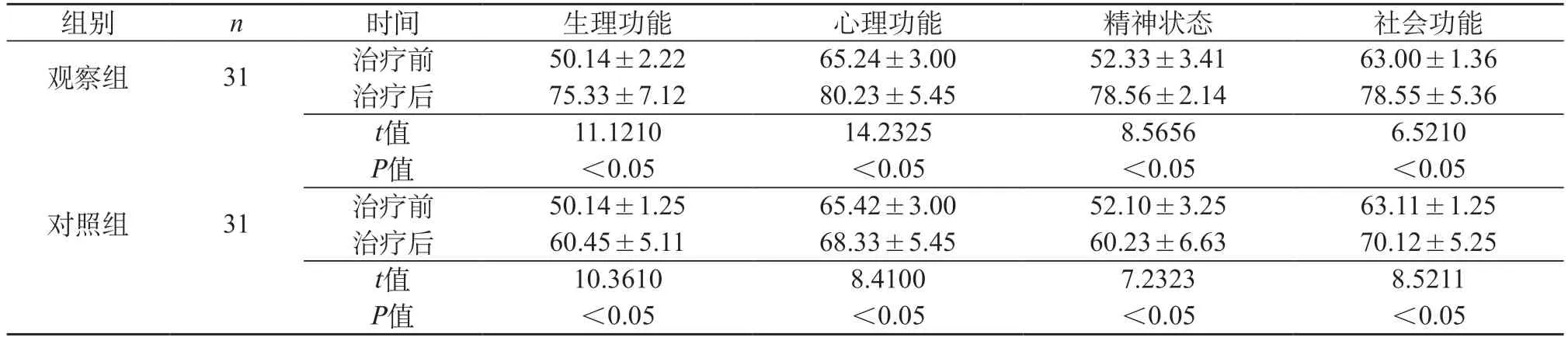
表3 两组治疗前后生活质量比较(分,±s)
3 讨 论
近年来,在各种内外源因素的共同作用下,致使胰腺癌的发病率、病死率逐年攀升。若早期发现并给予手术切除,可提高患者的生存期和生活质量。但胰腺癌发病隐匿,多数患者在确诊时就已经处于中晚期,错失了手术治疗的最佳时机[7]。即便胰腺癌的直径较小,也会伴随淋巴结转移等现象。若胰头为主要癌变部位,则会导致患者局部大血管出现浸润,对周围肠膜、腹腔动脉等组织产生损伤,因此不适合接受切除治疗,只能通过化疗等措施进行治疗。由此可见,手术切除治疗方案仅适用于无血管浸润、无淋巴结转移的胰腺癌患者[8]。
在多因素联合作用下,我国成为胰腺癌高发国家。目前,临床治疗该病推荐以手术为主,且在长期治疗中可获得显著的成效。临床数据显示,约有50%的患者在就诊时会有手术治疗的机会,但术后5年内患者仍有复发或转移风险[9]。而随着临床研究的深入,证实了对手术治疗的胰腺癌患者术后联合化疗方案干预,可大幅延长患者的生存期,并改善其生活质量。部分胰腺癌患者术前身体功能欠佳,术后对化疗药物的耐受力下降,所以治疗效果欠佳。可见,对手术治疗的胃癌患者,术后化疗药物的选择至关重要[10]。现阶段,我国临床医疗技术不断发展、化疗药物不断完善,致使越来越多的化疗药物适用于胰腺癌患者。通过药物治疗可减轻胰腺癌患者的症状、控制病灶转移,从而改善患者的生存期[7]。
借助血清肿瘤标志物可有效诊断相关肿瘤疾病,并明确病情分期。CEA属于酸性糖蛋白,在胚胎、肿瘤组织呈高发状态。CEA在胰腺癌疾病的诊断评估中具有重要价值,CA-199水平与胰腺癌分期呈正相关,与疾病预后呈负相关[11]。CA242是现阶段临床诊断胰腺癌的敏感标志物,诊断胰腺癌具有较高的特异度。血清肿瘤标志物可直接对体内肿瘤活跃程度进行有效反映,因此可通过血清肿瘤标志物的检测结果来评估患者病情发展情况和预后情况[12]。此研究亦发现,观察组患者经治疗后肿瘤标志物CA-199、CA242、CEA、CA50水平明显下降。
顺铂、5-氟尿嘧啶(5-FU)等是治疗胰腺癌有效的药物,其中5-FU在恶性肿瘤的治疗中有不可替代的作用。但该药物在使用后患者的药物不良反应较多。随着研究的不断深入,诸多新型的抗肿瘤药物相继问世,其中以替吉奥最为典型。替吉奥是优质的5-FU衍生物口服制剂,替加氟、吉美嘧啶是其主要成分[13]。其中替加氟生物利用度良好,也是是代谢前身,经过人体代谢可转变为5-FU。吉美嘧啶可对二氢嘧啶脱氢酶进行抑制,而奥替拉西组织分布具有一定分差异性,但在胃肠道的分布中具有较高浓度,可阻断5-FU化学反应并降低患者用药后的不良反应[14]。替吉奥属于典型的抗肿瘤制剂,为口服复方制剂,主要由吉美嘧啶等药物调节剂而成。其中吉美嘧啶对氟尿嘧啶降解具有抑制作用,且抗肿瘤作用较稳定,患者耐药风险较低。替加氟经肝微粒体P450代谢,从而活化为5-FU,抗肿瘤作用显著。奥替拉西钾对加氟磷酸化作用进行阻断,降低、减少磷酸脱氧尿苷生成和降解,因此患者在服药后胃肠道不良反应可明显减轻[15]。甲磺酸阿帕替尼属于抑制剂,于我国2014年被批准上市,主要用于治疗晚期肿瘤患者。阿帕替尼对血管瘤生成具有明显的抑制作用,因此被临床广泛用于治疗胰腺癌、胃癌等疾病。
此研究结果示:观察组患者3、6、9、12个月无进展生存率分别为83.8%、77.4%、58.0%、22.5%,且经治疗后CA-199、CA242、CEA以及CA50水平明显较低。可见替吉奥联合阿帕替尼治疗晚期胰腺癌可行性较高。由此提示:①替吉奥药物不良反应较少,且口服方式更方便,联合阿帕替尼可有效抑制肿瘤血管生成,并阻断肿瘤血管供应。②替吉奥联合阿帕替尼可抑制肿瘤细胞增殖、迁移、蛋白质合成,降低肿瘤微循环的同时加速其凋亡。
