不同氧浓度作用下煤氧化自燃热动力学特性*
2022-03-28钟凯琪
范 宁,钟凯琪,苏 龙
(1.中煤华晋集团有限公司,山西 运城 043300;2.西安科技大学 安全科学与工程学院,陕西 西安 710054)
0 引言
受限于煤层赋存条件、开采技术以及煤炭自身属性的影响,煤火灾害在全球主要产煤国家(中国[1-3]、美国[4-5]、印度[6]等)十分普遍。煤火灾害由于燃烧面积大、燃烧煤量多、漏风供氧条件有限,使得其大部分煤层的燃烧处于贫氧状态[7]。氧作为煤氧复合反应的参与物质之一,其浓度大小对于煤层的氧化燃烧状态有重要影响[8]。
周福宝等[9]开展了不同氧浓度下煤自燃试验,分析了氧化产物的生成规律,发现氧化产物的生成随氧浓度降低总体呈现“滞后效应”。金永飞等[10]利用自制高温程序升温装置,分析了高温贫氧氧化燃烧过程中的气体变化规律。XIAO Y等[11]研究了氧浓度对临界温度的影响,发现临界温度随氧浓度的增大呈“M”型变化。PERDOCHOVA M等[12]研究了煤变氧浓度条件下的低温氧化气体产物,分析了氧浓度对气体产物的影响。氧浓度对煤的燃烧特性也有影响,MUTO M等[13]研究了烟煤煤粉的燃烧特性,发现氧浓度对烟煤煤粉燃烧有显著的影响。王海燕等[14]研究了煤自热升温的升温速率、表观活化能和特征温度与氧浓度的关系。李振钢等[15]发现了氧气分压的增大会导致煤粉燃烧反应速率呈幂函数形式增长,且煤氧静置燃烧反应速率受氧气分压的影响更加显著。QI G等[16]研究了煤的低温贫氧氧化过程,划分了缓慢氧化和快速氧化2个阶段,同时发现低氧浓度时2个阶段的动力学参数差异很小。QI X等[17]划分了煤自燃过程中的各个特征温度,并计算了活化能,分析了氧浓度的影响。
煤自燃由于燃烧面积大、燃烧煤量多、地下煤层裂隙发育不够、与空气的渗流作用较小,使得大部分煤层的燃烧处于贫氧状态。随着燃烧进行,高温区域煤层消耗,邻近煤体氧化升温,高温区域不断迁移变化,贫氧环境中煤的燃烧热效应受到影响,进一步影响到煤火高温区域的燃烧半径和燃烧速率。目前主要集中在低温氧化条件下煤的自燃特性研究,而对贫氧条件下煤的氧化放热特性研究较匮乏。因此,探究贫氧对煤样低温氧化过程的影响规律,可对煤自燃有更深刻的认识,有利于煤火灾害的防治。
1 试验
1.1 煤样
试验选用煤样来自山西某矿业公司,在实验室将煤样破碎,进行工业分析试验,结果见表1。
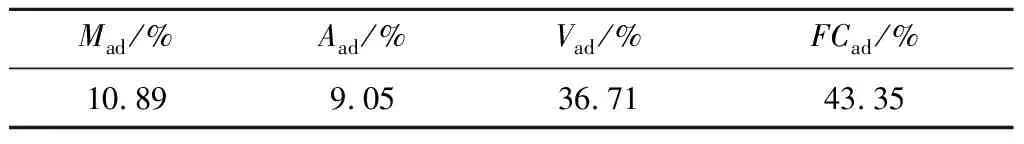
表1 煤样的工业分析结果Table 1 Industrial analysis results of coal samples
1.2 试验仪器及过程
测试仪器是法国凯璞科技集团生产的Setline DSC差示扫描量热仪,如图1所示。其操作简便,维护简单,传感器灵敏度高,能够提供高质量的数据以及保证热反应和转变过程中样品温度的精确测量。

图1 DSC差示扫描量热仪Fig.1 DSC differential scanning calorimeter
将煤样破碎研磨至0.075 0 mm以下,称量10 mg样品放置于氧化铝坩埚中压实。然后,通入不同氧浓度的氮氧混合气(3%、5%、7%、10%、13%、17%、21%),气体流量恒定为100 mL/min,从30 ℃升温至450 ℃,升温速率为2 ℃/min。所得数据用于确定不同氧浓度对煤热效应的影响。
2 试验结果与分析
2.1 煤样贫氧氧化热流变化规律
以3%氧浓度下的升温的热流与时间(dHF)导数为例,如图2所示。将初始试验温度定义为T0,热流曲线最低点(吸热速率最大点)所对应的温度定义为T1,热流为0时的温度定义为初始放热温度(热平衡温度)T2,热流曲线最高点(放热速率最大点)所对应的温度定义为T3。

图2 热流和dHF曲线Fig.2 Heat flow and dHF curve
在氧化升温初始阶段,煤样存在一个较短的吸热过程(T0~T2阶段),该阶段为煤样的水分蒸发与气体脱附失重过程[18]。在T0~T1阶段,由于煤样初始温度滞后于炉体温度,煤样吸热升温,附着在煤体上的气体出现吸热脱附现象,活性官能团与氧发生缓慢反应,释放出少量热量,但在这个过程中煤温较低,反应较弱,导致吸热量远大于放热量,在温度T1时达到吸热最大值。在T1~T2阶段,煤样进入缓慢的吸热阶段,随着反应温度的升高,煤氧相互作用逐渐增加,由于前期部分水蒸发,吸热与放热之间差异减小,直到达到温度T2时,煤氧反应速率与水分蒸发、气体脱附速率达到一个短暂的动态平衡。
T2~T3为快速放热阶段,当温度升高超过T2时,煤样氧化热效应从吸热转变为放热,随着温度升高,煤氧之间发生剧烈的复合反应,释放出大量的热量,热流曲线持续增大在温度T3时达到峰值,此时T3为最大放热速率温度。
从图3中可以看出,不同氧浓度下煤样的热流曲线趋势总体一致,只是由于氧浓度的变化使得特征温度有些许不同,不同氧浓度下的特征温度如图4所示。初始温度T0存在些许差异,这是由于做试验当天室外温度不同。吸热速率最大点对应的温度T1几乎不受氧浓度的影响,这是由于在初始阶段,温度较低,煤样主要发生脱水、脱气、吸附等物理性反应,受氧气浓度影响较小,因此使得不同氧浓度下吸热速率最大点对应的温度几乎一致。随后,热平衡温度T2随着氧浓度的增加反而降低,这是由于随着温度的升高,活性基团需氧量越大,反应过程对氧气的依赖性加大,使得氧浓度对放热量的影响也增大。放热速率最大点所对应的温度T3是煤样的着火温度点,在这个温度点以后,煤样进入到燃烧阶段,随着氧浓度的增加,T3在逐渐前移。在氧浓度为3%时,T3为448.05 ℃,而在氧浓度为21%时,T3降低了38.39 ℃,此时T3仅为409.66 ℃。这说明氧浓度对于煤样的燃烧温度起着至关重要的作用,且氧浓度越大,煤样燃点越低,更易发生自燃。
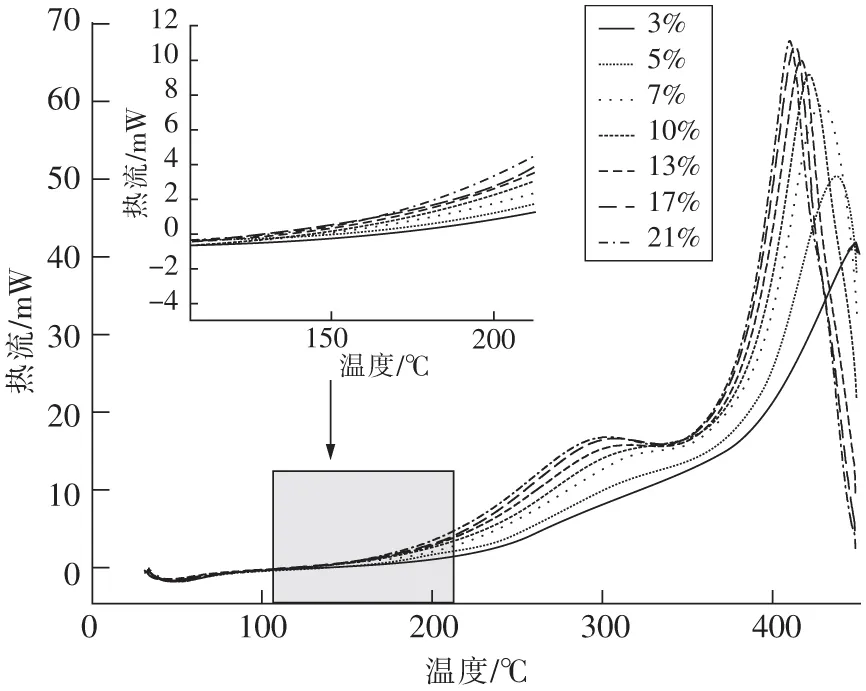
图3 不同氧浓度下煤样的热流曲线Fig.3 Heat flow curves of coal samples under different oxygen concentration
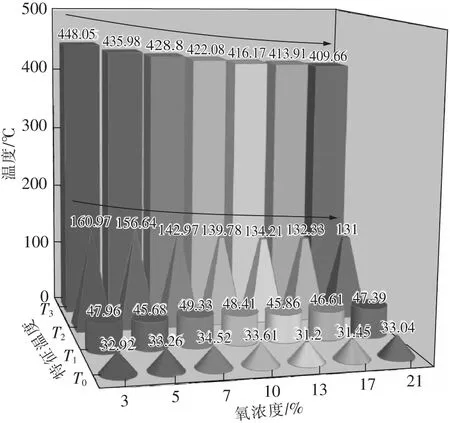
图4 不同氧浓度下的特征温度Fig.4 Characteristic temperature under different oxygen concentration
2.2 煤样贫氧条件下放热量变化规律
在煤样氧化反应的过程中,反应放出或吸收的热量为热流曲线下的面积,如图5所示。蓝色区域面积代表吸热量,红色区域面积代表放热量,对图5进行积分,可精确计算出吸热量与放热量,7个氧浓度下的吸热量与放热量如图6所示(图中负值代表吸热量)。可以发现在吸热阶段也就是在T0~T2阶段,此时煤体的吸热量与氧浓度相关性较小,这是由于该阶段主要发生气体解析和水分散失,此时煤的反应性也较弱,对氧气的需求量也较小。而在放热阶段,即热平衡温度T2以后的阶段,煤体的放热量与氧浓度呈正相关,21%氧浓度下的放热量是3%氧浓度下放热量的1.6倍。氧浓度在3%~10%的范围时,氧浓度的增长会极大地增加煤体放热量。这是由于在热平衡温度以后,随着温度的上升,煤中活性官能团大量与氧气发生物化反应,产生的热量使得煤体进一步升温,高氧浓度下煤分子中的活性官能团被进一步激活参与反应,从而释放出大量的热量。而氧浓度在10%~21%时,放热量随着氧浓度增加而增大的趋势变缓,这是由于煤中活性官能团大多已被激活,氧浓度的增加对放热量仍旧有影响,但影响较小。说明氧浓度的降低能够有效抑制煤体的氧化放热,从而为煤火防治奠定基础。
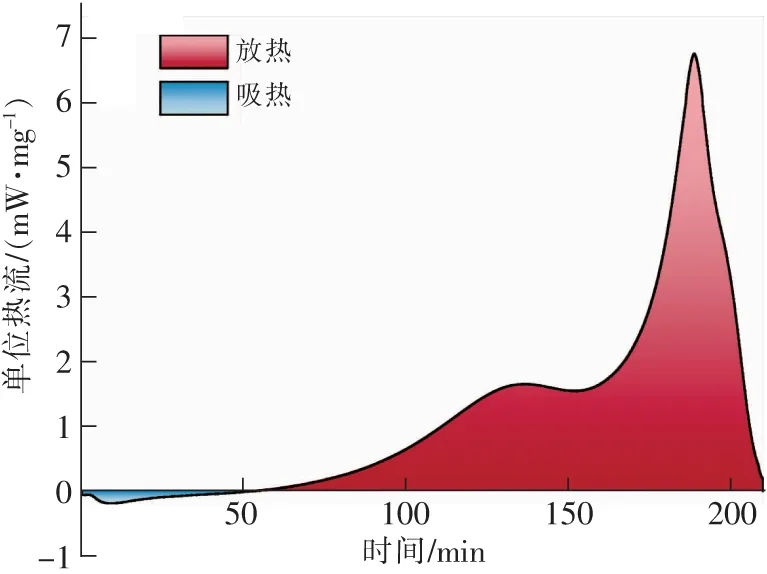
图5 煤样的放热与吸热Fig.5 Exothermic and endothermic of coal samples
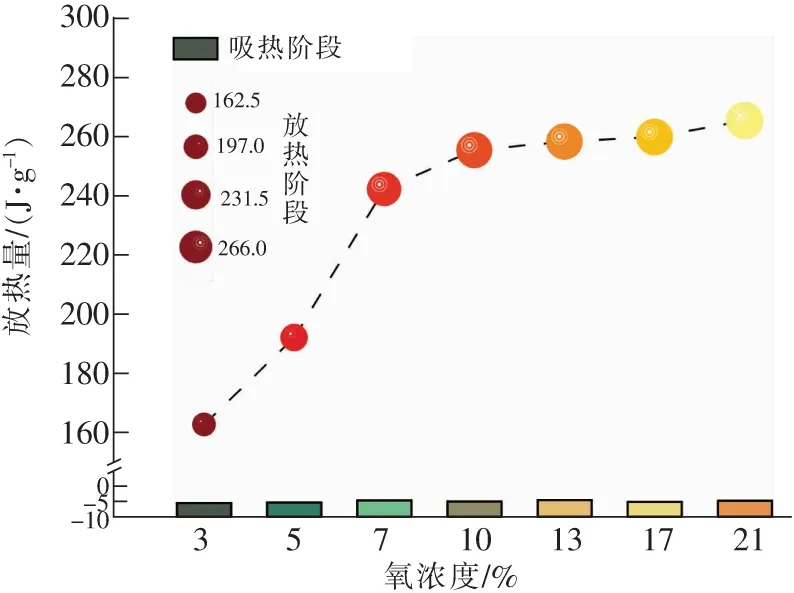
图6 不同氧浓度下煤样放热量Fig.6 Heat release of coal samples under different oxygen concentration
2.3 煤样贫氧条件下活化能计算
活化能代表反应物的分子由初始稳定状态变为活化分子所需吸收的能量[19]。活化能的计算可分为微分法和积分法,由于微分法需要使用试样在反应过程中的值,但值的精度一般较低,因此采用Coats-Redfern积分法计算煤样在快速放热阶段的活化能[20-21],见式(1)。
(1)
式中,A为指前因子,min-1;E为表观活化能,kJ/mol;R为摩尔气体常量,8.314 J/(mol·K)-1;β为恒定升温速率,K/min;α为T时刻煤的转化率,α=(H0-HT)/(H0-H∞);其中,H0为初始的放热量,J/g;HT为T时刻的煤的放热量,J/g;H∞为结束时煤的放热量,J/g。
煤与氧气反应可近似看作一级反应,此时反应机理积分函数为G(α)=-ln(1-α),将其带入式(1),绘制出ln[G(α)/T2]与1/T的图像,根据其斜率可以求解出活化能E。对不同氧浓度的煤样进行动力学计算,根据图7所示可计算出不同氧浓度下煤样的活化能,见表2。可看到活化能随着氧浓度的增加而降低,说明随着氧浓度增大,煤氧反应所需要吸收的能量也越低,煤氧复合反应更加容易进行。此外,在氧浓度为3%~10%时,每降低1%,活化能增加1.77 kJ/mol,而当氧浓度在10%~21%范围时,每降低1%,活化能增加0.22 kJ/mol。说明活化能也和放热量一样呈现阶段性的变化,氧浓度较低时,对煤样活化能的影响较大,而氧浓度较高时,对煤样活化能有较小的影响。
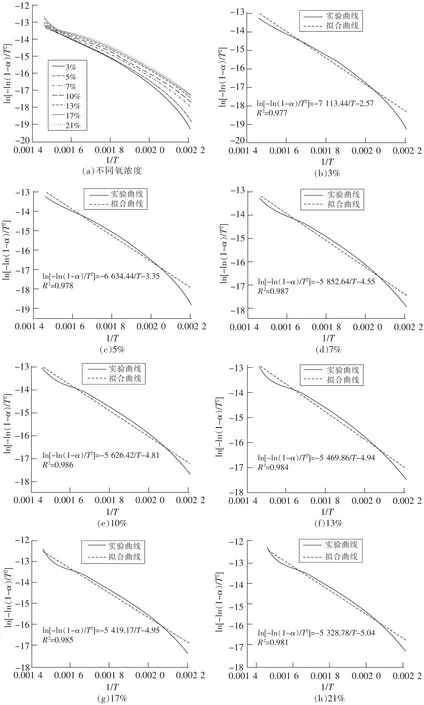
图7 不同氧浓度下煤样的ln[-ln(1-α)/T2]与1/T的拟合Fig.7 Fitting graph of ln[-ln(1-α)/T2] and 1/T of coal samples under different oxygen concentration
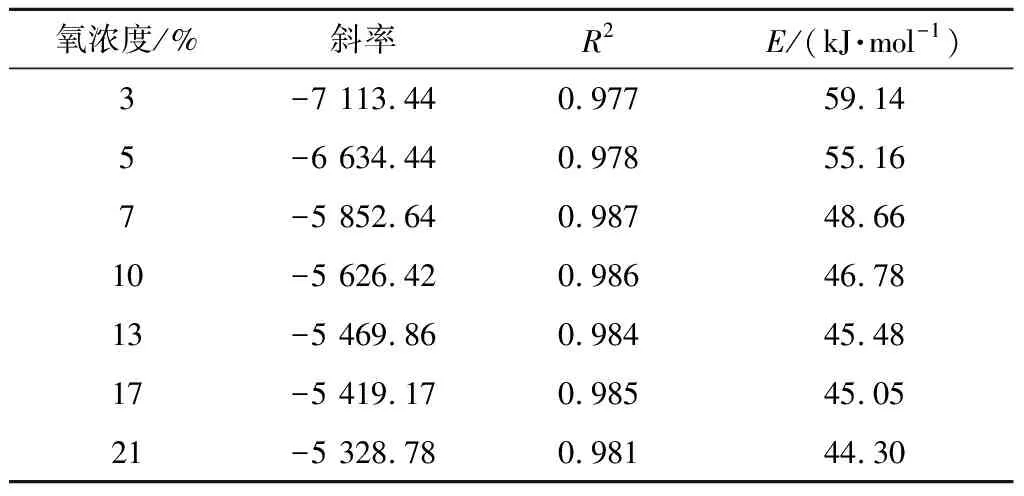
表2 不同氧浓度下煤样的活化能Table 2 Activation energy of coal samples under different oxygen concentration
3 结论
(1)在对煤样进行差示扫描量热分析时发现煤样的热流曲线先降低后升高,前期的吸热过程中煤样进行了水分蒸发与气体脱附,后期随着温度升高,煤氧之间发生剧烈的复合反应,放出大量热量,热流曲线又开始升高。
(2)不同氧浓度下的热流值在试验初期差异较小,而在后期随着温度的升高,差异越发明显。并且煤样的热平衡温度T2及放热速率最大点所对应的温度T3均随着氧浓度的升高而前移,当氧浓度为3%时,T2为160.97 ℃,T3为448.05 ℃;氧浓度为21%时,T2为131 ℃,T3为409.66 ℃。
(3)煤样的放热量和活化能都呈现阶段性变化,放热量随着氧浓度的增加而增大,活化能则是随着氧浓度的增加而减小,氧浓度越高,煤氧复合反应越容易发生。当氧浓度范围为3%~10%时,放热量和活化能在这个阶段的变化幅度都较大,当氧浓度范围为10%~21%时,放热量和活化能在这个阶段的变化幅度较小。并且氧浓度为3%时活化能为59.14 kJ/mol,氧浓度升高至21%时活化能降低到44.30 kJ/mol,更容易发生煤氧复合反应,因此可以考虑通过降低氧浓度来实现煤自燃的防治。
