电针对骨癌痛大鼠脊髓星形胶质细胞活化及炎性因子的影响
2022-03-28王凤娇具紫勇范神栋陈灏施舍王功命梁嘉仪王珂夏勇
王凤娇,具紫勇,范神栋,陈灏,施舍,王功命,梁嘉仪,王珂,夏勇
(1.上海中医药大学,上海 201203;2.复旦大学附属肿瘤医院,上海 200032;3.上海中医药大学附属岳阳中西医结合医院,上海 200437)
癌症的发病率正在逐年上升[1],骨组织是乳腺癌和其他癌症(包括前列腺癌、肺癌、肾癌、甲状腺癌和肉瘤等)患者最常见的远处转移之一[2]。高达75%的患者忍受严重癌症引起的骨痛(cancer-induced bone pain, CIBP)[3]。癌性骨痛是导致患者活动受限、情绪低落、呼吸系统感染、栓塞、压疮等风险增加的主要原因,严重影响患者的生活质量。根据世界卫生组织的三阶梯止痛方案进行姑息放疗和药物治疗是降低CIBP的首选治疗方法,但这些方法并不总是有效且伴有严重的副作用[4]。中重度癌痛患者需使用阿片类药物,存在明显的不良反应[5]。近年来,针灸治疗癌症疼痛日益受到关注和重视,多篇系统综述和meta分析显示针灸可能是一种癌症疼痛有效的镇痛辅助方法[6-8]。且针灸控制癌痛应用方便,不良反应很少,无成瘾性;但针灸治疗癌症相关疼痛的机理研究尚处于初步阶段,其镇痛机制仍不明确。研究发现,癌症疼痛不仅与脊髓痛觉传递神经元的兴奋性有关,而且与脊髓中激活的星形胶质细胞有密切联系。基于此,本研究通过动物实验,建立大鼠骨癌痛模型,观察并阐明针灸对骨癌痛的镇痛效应及机制,以期为临床治疗提供借鉴和思路。
1 材料与方法
1.1 实验动物与分组
雌性 SD大鼠 48只,清洁级,体质量(190±10)g,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2013-0016],饲养于上海中医药大学动物实验中心。动物饲养在温度21℃左右,相对湿度40%~60%的环境中,每天光照12 h,自由摄食饮水,按需更换垫料。动物实验伦理委员会批转编号为PZSHUTCM190315002。所有大鼠适应性饲养1周后按随机数字表法分为空白组、假手术组、模型组、电针组,每组12只。
1.2 主要试剂与仪器
异氟烷(MGB-15533,深圳市瑞沃德生命科技有限公司);GFAP抗体(ab7260,艾博抗-上海贸易有限公司);大鼠 TNF-α、IL-1β、IL-6 ELISA 试剂盒(ZC-37624,ZC-36391,ZC-36404,上海博鼎生物科技有限公司);肿瘤细胞LLC-WRC 256(Walker256,日本RCB细胞库);电子Von-Frey(ITTC-1443,ITTC生命科学有限公司);透射电子显微镜(JEM-1230,日本电子株式会社广州事务所);韩氏穴位神经刺激仪(HANS-200E,南京济生医疗科技有限公司);微量注射泵(1600528,深圳市瑞沃德生命科技有限公司)。
1.3 细胞制备
取成年雌性 SD大鼠腹腔注射 Walker 256细胞 0.5 mL (2.5×107/mL),6~7 d 后抽取 5 mL 大鼠腹水,加入等量磷酸盐缓冲液(PBS)充分混匀后 1 300 rpm离心3 min, PBS溶液重悬,计数并离心收集细胞,调整细胞浓度为5×107/mL,置于冰盒上待用。
1.4 模型制备
大鼠用麻醉机(内含异氟烷)麻醉后,将右膝关节用7%的碘酒和75%的乙醇溶液消毒。从右侧膝关节处切开皮肤,左手指固定膝关节,然后用5 mL针筒针头在膝关节髌韧带外侧缘,沿胫骨纵轴走向往胫骨远端钻孔,深约 1 cm,用微量注射器向胫骨骨髓腔内注射Walker 256 肿瘤细胞(5×107/mL)10 μL,假手术组大鼠注射 10 μL磷酸盐缓冲液。注射后留针片刻,出针后针孔处放置明胶海绵,皮肤缝合[9]。
1.5 干预方法
大鼠在造模后第 11天开始电针干预,隔日 1次,共 3次。选取双侧L3~L5夹脊穴(EX-B2),电针时大鼠以俯卧位安置于固定器内,用乙醇棉球消毒背部皮肤,将针灸针在L5棘突下旁开后正中线3 mm处直刺进针,针尖抵到椎板时,转换方向朝向头部,沿棘突旁透刺至L3水平位置,毫针连接韩式穴位神经刺激仪,电针参数选择频率 2/100 Hz,疏密波,电流强度 2 mA,时间30 min。电针干预前3 d,所有大鼠均于固定器内进行适应。
1.6 指标检测
1.6.1 机械痛阈测定
4组大鼠均于造模前和造模后9 d、11 d、13 d、15 d进行机械痛阈测定。将大鼠放置在测试架上的透明有机玻璃罩内,底部是金属网,适应周围环境 15~30 min。在电子Von-Frey手持式测力传感器上安装聚丙烯尖端,尖端垂直于后爪的中心区域,并逐渐增加压力,以大鼠爪子出现退缩动作为准,收爪后记录压力的强度,以3次测量的平均值为最终结果[10]。
1.6.2 胫骨组织学观察
大鼠安乐死后,剪断并分离大鼠胫骨与股骨、跖骨连接的韧带、皮肤与肌肉,生理盐水冲洗后放入 4%多聚甲醛溶液内固定24 h,按1:10的比例浸泡在脱钙液36 h,取出上端(近股骨侧)三分之一,蒸馏水冲洗,用50%的乙醇溶液冲洗 2次,分别使用 70%、80%、95%、100%的乙醇溶液进行梯度脱水,再用二甲苯透明处理,依次使用石蜡进行包埋,用切片机切成4 μm的石蜡带,将组织石蜡块在 50 ℃水中展开,将切好的组织片放入63 ℃恒温箱中烤片2 h,然后二甲苯、乙醇梯度脱水后苏木精染色5 min,流水冲洗10 min,1%盐酸乙醇溶液分化5 s,流水冲洗2 min,伊红染色 2 min,流水冲洗后,70%、80%、95%、100%梯度乙醇脱水各 10 s,二甲苯透明,中性树胶封片,光学显微镜下观察并拍照。
1.6.3 脊髓背角组织GFAP蛋白检测
大鼠安乐死后,纵向剪断腰椎与骶椎及胸椎的组织连接,分离脊柱与肋骨及周围组织以充分暴露各节段脊神经;台盼蓝标记 L3~L5脊神经,根据标记的脊神经定位并分离相应的脊髓节段,于光学显微镜下分离脊髓背角组织。脊髓背角组织放入蛋白裂解液中,按BCA法测定蛋白浓度。用10%的分离胶和5%的浓缩胶提取等量的蛋白液,随后转PVDF膜,取膜后放入5%脱脂奶粉封闭液过夜。将封闭后的膜剪成小块后滴加一抗(1:2 000)。PBST冲洗后滴加 HRP偶联的二抗(1:3 000)轻摇孵育。Alpha软件处理系统分析目标带的光密度值。
1.6.4 脊髓背角TNF-α、IL-1β、IL-6炎性因子含量检测
脊髓背角组织用预冷的PBS溶液冲洗、称重后将其剪碎,与对应体积的PBS加入玻璃匀浆器中,于冰上充分研磨。对匀浆液进行超声破碎或反复冻融以进一步裂解组织细胞。最后将匀浆液以5 000 r/min离心5~10 min,取上清液。按照ELISA试剂盒说明书操作,并在波长为450 nm处,用酶标仪测定光密度,根据标准曲线算出TNF-α、IL-1β、1L-6浓度。
1.7 统计学方法
应用SPSS26.0统计软件对数据进行统计分析。符合正态分布的计量资料采用均数±标准差表示,重复测量资料采用重复测量法比较同一组不同时间点测量数据,组间差异比较采用单因素方差分析;方差齐时,采用LSD法;方差不齐时,采用Games-Howell法进行两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 4组大鼠机械痛阈比较
4组大鼠造模前(0 d)的机械痛阈差异无统计学意义(P>0.05),空白组及假手术组造模前、后各时间点的机械痛阈差异无统计学意义(P>0.05)。与空白组和假手术组比较,模型组各时间点的机械痛阈明显下降,差异有统计学意义(P<0.05)。与模型组比较,电针组第 11天、13天和 15天的机械痛阈均显著上升(P<0.05)。详见表 1。
表1 4组大鼠右后爪机械痛阈比较 (±s, g)
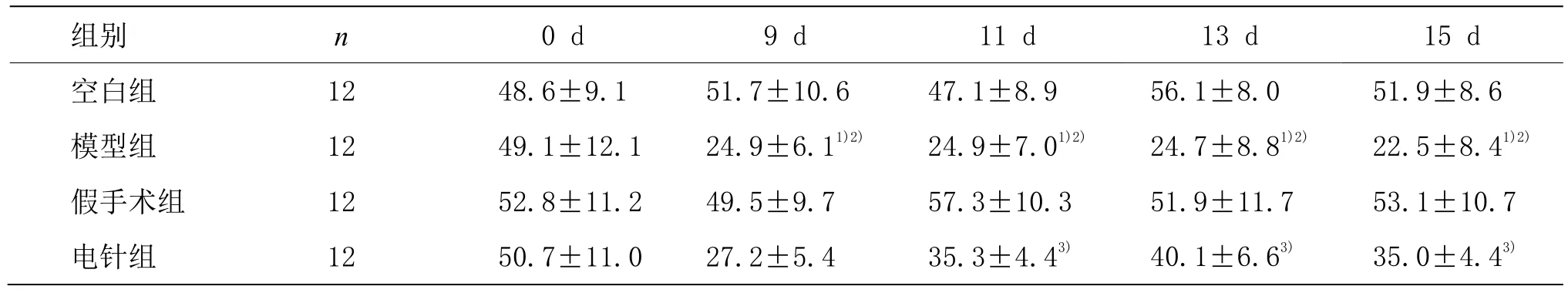
表1 4组大鼠右后爪机械痛阈比较 (±s, g)
注:与空白组比较 1)P<0.05;与假手术组比较 2)P<0.05;与模型组比较 3)P<0.05
组别 n 0 d 9 d 11 d 13 d 15 d空白组 12 48.6±9.1 51.7±10.6 47.1±8.9 56.1±8.0 51.9±8.6模型组 12 49.1±12.1 24.9±6.11)2) 24.9±7.01)2) 24.7±8.81)2) 22.5±8.41)2)假手术组 12 52.8±11.2 49.5±9.7 57.3±10.3 51.9±11.7 53.1±10.7电针组 12 50.7±11.0 27.2±5.4 35.3±4.43) 40.1±6.63) 35.0±4.43)
2.2 4组大鼠胫骨组织学观察
空白组新生骨组织内结构清晰,软骨细胞柱排列有序,胫骨髓腔内未见癌细胞;假手术组过渡性骨小梁间未见癌细胞浸润;模型组新生骨组织纹理模糊不清,软骨细胞柱遭到破坏,髓腔内癌细胞大量侵入;电针组过渡性骨小梁间可见大量癌细胞浸润。详见图1。
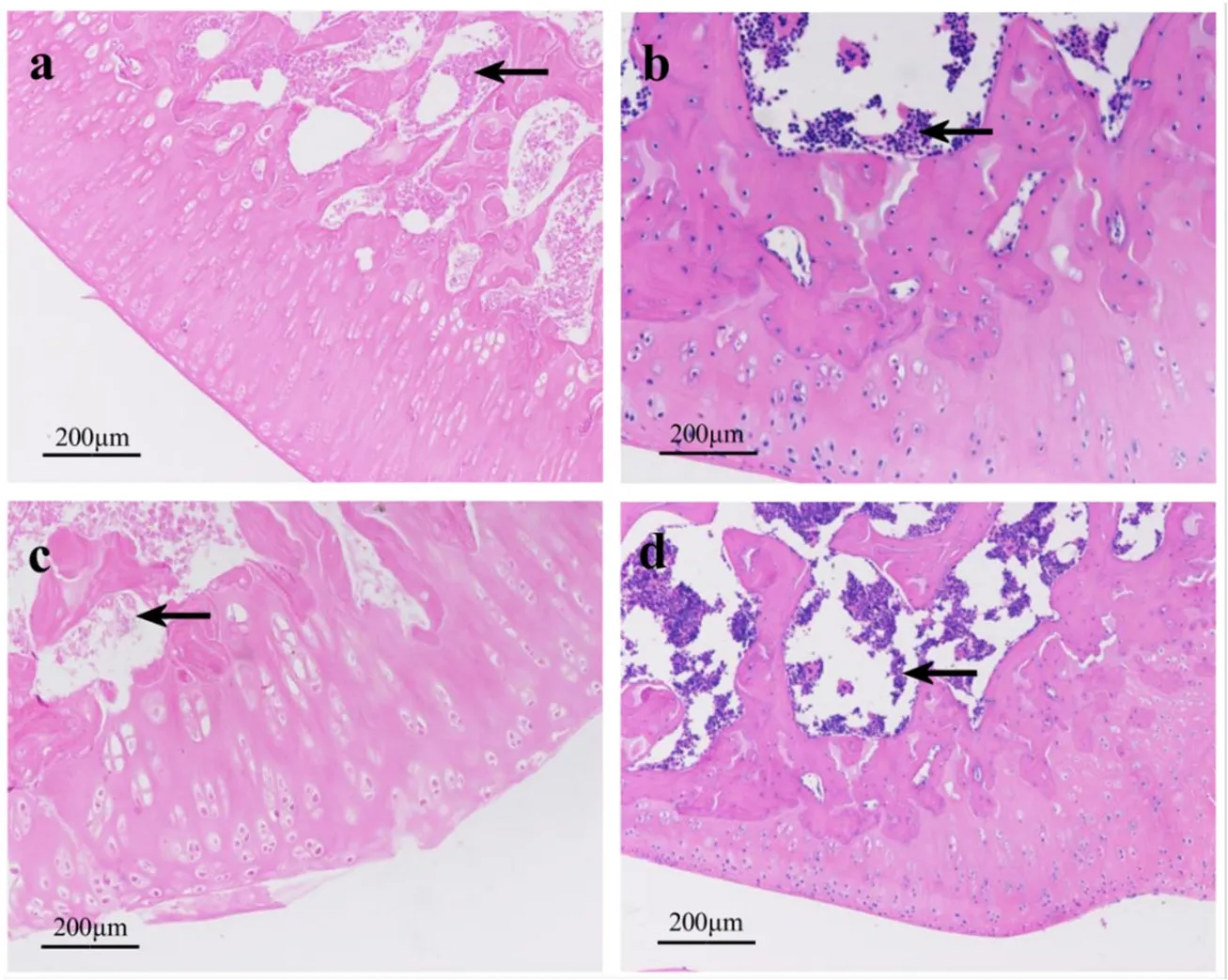
图1 各组大鼠胫骨组织病理学观察(HE染色,×100倍)
2.3 4组大鼠脊髓背角TNF-α、IL-1β、IL-6含量比较
与空白组和假手术组比较,模型组大鼠脊髓背角IL-1β、IL-6的含量均明显升高,差异有统计学意义(P<0.05),电针组 IL-1β、IL-6的含量低于模型组,差异有统计学意义(P<0.05)。各组大鼠脊髓背角TNF-α的含量比较,差异无统计学意义(P>0.05)。详见表2。
表2 4组大鼠脊髓背角TNF-α、IL-1β、IL-6含量比较 (±s, pg/mL)

表2 4组大鼠脊髓背角TNF-α、IL-1β、IL-6含量比较 (±s, pg/mL)
注:与空白组比较 1)P<0.05;与假手术组比较 2)P<0.05;与模型组比较 3)P<0.05
组别 n TNF-α IL-1β IL-6空白组 6 199.65±46.27 14.18±3.76 91.81±9.68模型组 6 176.21±32.39 28.50±1.581)2) 134.78±10.411)2)假手术组 6 196.21±50.51 13.53±4.01 91.33±21.40电针组 6 189.18±54.55 20.81±5.443) 97.79±17.203)
2.4 4组大鼠脊髓背角GFAP蛋白表达水平比较
与空白组和假手术组比较,模型组大鼠脊髓背角星形胶质细胞标记蛋白GFAP的表达明显增加,差异有统计学意义(P<0.05)。与模型组相比,电针组 GFAP的蛋白表达则显著降低,差异有统计学意义(P<0.05)。详见图2。

图2 4组大鼠脊髓背角GFAP蛋白表达水平比较
3 讨论
骨癌痛属中医学“骨瘤”范畴[11],可从躯体、心理、社会和精神等方面影响患者的生活质量[12-13]。田建辉等[12]认为骨癌痛的发生,责之于正虚邪实,正虚为根本,邪实是表象,正虚主要表现于肾虚,邪实主要表现为伏毒,提出“伏毒蚀骨扰神”为骨癌痛核心病机。此外,有医家认为癌痛是瘤毒侵犯经络或瘤块阻滞经络气血所致[14-15]。《千金翼方》:“凡病皆由气血壅滞,不得宣通,针以开导之。”[16]本实验选取的穴位为双侧 L3~L5夹脊穴,夹脊穴可通过督脉和膀胱经发挥效应,疏通经络、调节气血以治痛;又与心、脑、髓关系密切,来影响神气而治痛。另一方面,下肢与 L3~L5夹脊穴属于同神经节段。
现代医学认为骨癌痛是一种区别于炎性痛和神经病理性痛的持续性、突破性疼痛[17-18],不仅与脊髓痛觉传递神经元的兴奋性有关,而且与脊髓中激活的星形胶质细胞有密切联系。骨癌痛模型中最具特征的改变是脊髓背角星形胶质细胞肥大及增生,星形胶质细胞特异性标记物胶质原纤维酸性蛋白(GFAP)大量表达[19-20]。GFAP表达的增加,引起转录后修饰,导致脊髓促炎物质增加神经的兴奋性,加重疼痛反应[21]。抑制CIBP大鼠脊髓星形胶质细胞的激活,可有效逆转促炎细胞因子TNF-α、IL-1β和IL-6 mRNA表达的上调,减轻大鼠的机械痛敏[22-23]。提示星形胶质细胞激活依赖的脊髓神经炎在CIBP中发挥关键作用[20]。研究证实针灸可缓解骨癌痛[24-25]。ZHANG R X等[26]发现,与无电刺激对照组比较,10 Hz/2 mA电针环跳能缓解骨癌痛大鼠热痛觉超敏,抑制脊髓 IL-1β mRNA的表达;杜俊英等[27]报道电针双侧后三里和跟端穴对骨癌痛具有良好的镇痛作用,且治疗效果与频率、频次无关。基于上述事实,本文观察了电针对骨癌痛大鼠脊髓背角星形胶质细胞活化及炎性因子表达的影响。
本实验通过大鼠胫骨注射 Walker 256细胞建立CIBP模型,造模后第9天胫骨切片显示,模型组新生骨组织纹理模糊不清,软骨细胞柱遭到破坏,髓腔内癌细胞大量侵入,空白组、假手术组均未见异常,说明CIBP造模成功;电针组过渡性骨小梁间可见大量癌细胞浸润,表明电针干预并未改变胫骨局部组织的病理状态。行为学检测结果表明电针可明显缓解 CIBP诱发的机械痛敏。进一步研究显示,骨癌显著增加了脊髓背角星形胶质细胞标志物GFAP的水平,表明星形胶质细胞处于激活状态,这与之前的报告一致[20];而后的实验结果显示,电针干预可显著下调脊髓背角 GFAP的表达,减少促炎细胞因子IL-1β、IL-6的释放;4组大鼠脊髓背角TNF-α的表达比较,差异无统计学意义。以上结果表明,电针对骨癌痛大鼠有较好的镇痛效应,其可能通过抑制脊髓背角星形胶质细胞活化诱导的炎症反应发挥作用。