基于代谢组学研究噻虫嗪和戊唑醇农药对蔬菜生理代谢的影响
2022-03-26张希平木其尔余向阳李拖平
张希平,田 菊,木其尔,余向阳,李拖平,李 勇
(1.沈阳农业大学食品学院,沈阳 110161;2.省部共建国家重点实验室培育基地/江苏省食品质量安全重点实验室,南京 210014;3.江苏省农业科学院农产品质量安全与营养研究所,南京 210014)
随着全球人口的增长和人均食品消费量的增加,全球对食物中青菜的需求也在增加[1],而农药的使用可以提高粮食作物的产量。目前在我国使用的农药种类多种多样,如杀虫剂、杀菌剂和除草剂等,由于其独特的性质,如广谱活性、低使用率、系统活性和灵活的施用方法等,已在世界范围内广泛的使用。但它们的使用往往与环境污染和害虫抗药性有关,甚至对青菜本身造成一定的影响。每年到达目标生物体的农药施用量通常不到1%,其他大部分由于偏离目标而沉积在土壤中,或者通过叶面吸收和土壤-根迁移在作物中积累;而环境中的残留物可能会被非目标生物(包括脊椎动物和无脊椎动物)吸收,从而增加对食品和环境安全的风险[2-3]。
近年来,农药暴露对青菜生理代谢及品质的影响已成为研究热点,代谢组学可用于研究农药对青菜代谢的影响。LI等[4]发现低浓度吡虫啉在长期暴露下可以促进上海青茎叶部分生物量累积,即存在毒物兴奋效应,利用基于LC-QTOF/MS 的非靶向代谢组学技术分析不同暴露时期上海青茎叶样品,发现吡虫啉暴露初期对上海青产生一定氧化应激反应,而吡虫啉暴露后期对上海青的氧化应激反应得到一定缓解,基于代谢通路分析发现,吡虫啉可能通过调控上海青的氮代谢通路来促进植物生长。LIU 等[5]基于代谢组学结合转录组学分析3种不同农药对水稻植株的胁迫响应,发现丁草胺可以影响碳水化合物代谢途径,干扰淀粉-蔗糖的分布,毒死蜱显著影响了氨基酸代谢途径,导致游离氨基酸含量增加和可溶性蛋白质降解,三环唑显著影响脂肪酸代谢途径,主要编码油体膜蛋白的DEGs 显著上调,导致饱和脂肪酸(棕榈酸和硬脂酸)减少,不饱和脂肪酸(亚麻酸和十八碳二烯酸)增加。ZHANG等[6]发现有机氯杀虫剂林丹和十氯酮施用可以影响玉米根中淀粉和糖代谢,造成蔗糖含量下降。CHEN等[7]发现杀菌剂代森锰锌可以调控莴苣中抗坏血酸盐、糖、脂质和核苷酸以及氨基酸含量。
本研究基于代谢组学研究不同类型杀虫剂噻虫嗪、杀菌剂戊唑醇农药对上海青叶片的胁迫响应。通过土培方式种植青菜,并向青菜喷施推荐剂量的两种不同类别的杀虫剂噻虫嗪和杀菌剂戊唑醇农药,基于LCQTOF/MS 的非靶向代谢组学分析青菜茎叶样品,分析不同农药对青菜的代谢影响。本研究结果有助于农药生态环境风险评价,并对农药安全使用提供理论支撑。
1 材料与方法
1.1 材料
上海青(Brassica rapavar.chinensis)的种子购自江苏省农业科学院;噻虫嗪和戊唑醇标准品购买自上海源叶生物科技有限公司。乙腈(MeCN)和甲醇(MeOH)均为色谱(HPLC)级,购自上海安培科学仪器有限公司(上海)。过氧化物酶(POD)、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒由南京建城生物工程研究所有限公司(南京)提供。
1.2 盆栽试验
将上海青种子移到育苗盘中催芽生长,培养4周后,选择大小相似的植物,用无菌水冲洗蔬菜幼苗的根部,将这些蔬菜幼苗转移到装有农田土的育苗盒培养。将噻虫嗪和戊唑醇标准品分别溶于甲醇中,参照商品农药标签规定使用剂量农药推荐剂量,噻虫嗪为2g 有效成分/0.0667hm2,戊唑醇为15g 有效成分/0.0667hm2,计算蔬菜盆栽面积,配置相应体积农药溶液,并进行喷施,对照组喷施含有10μL甲醇的水溶液。培养1周后,采集5株上海青茎叶组织,剪碎混成1个样品,每个处理组共收集5组样品,并用于生理指标测定以及代谢组学测定,其中代谢组学样品进行液氮速冻,研钵粉碎后,保存于-80℃冰箱。
1.3 生理指标测定
使用试剂盒分析蔬菜茎叶的生理活性指标,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)。首先将新鲜蔬菜茎叶样品(0.5g)切碎后与生理盐水以1∶9(W/V)的比例混合。样品在低温条件下提取,并以3500r·min-1的速度离心10min。根据试剂盒使用说明,取上清液用于检测超氧化物歧化酶、过氧化物酶和丙二醛的含量[8]。
1.4 代谢组学分析
1.4.1 样品提取 称取0.05g茎叶样品于10mL离心管中,加入3mL甲醇水溶液(V/V=80∶20),振荡提取20min,5000r·min-1离心15min 后,移取1mL 上清液过0.22μm 滤膜于进样小瓶。然后每个样品各取20μL 混成质量控制(QC)样品,待上机检测。
1.4.2 代谢图谱测定 使用配备Shimadzu HPLC(LC-20A)和Sciex QTOF/MS(Triple TOF 5600+)的LC-QTOF/MS 检测植物叶片样品的代谢谱图。每个样品均以正电离和负电离模式进行分析。梯度流动相由水(A)和乙腈(B)组成,其中正电离模式流动相A 为0.1%的甲酸,负电离模式流动相A 为5mmol·L-1的醋酸铵,色谱条件:0~3.0min,10%B;3.0~21.0min,10%B线性增加至95%B;28.0~34.0min,10%B。色谱柱为LC HSS T3色谱柱,规格为:150mm×2.1 mm×3.5μm。所有代谢样品均在信息依赖采集(IDA)模式下采集,质量扫描范围均为50~1000m/z,正电离和负电离模式下的离子源电压分别为5500V 和4500V,正模式和负模式下的碰撞能量(CE)分别设置为-30V 和30V。在数据采集之前,将QC 样品运行5次以确保质谱仪在相关实验条件下达到平衡,随后每5个样品进行1次检测。
1.4.3 代谢组学数据分析 利用MS-DIAL 软件对LC-QTOF/MS 数据进行分析,获得质谱峰的信息,包括保留时间、精确质量数、二级质谱及一级质谱峰面积。通过主成分分析(PCA)方法分析不同样品指纹图谱代谢差异。通过PLS-DA(VIP>1)、t检验(p<0.05)筛选差异质谱峰,利用开源数据库(HMDB、METLIN 等)差异质谱峰进行鉴定,比对保留时间、一级质谱和二级质谱准确度,利用Metaboanalyst 软件(https://www.metaboanalyst.ca)进行差异代谢物代谢通路富集分析。
2 结果与分析
2.1 农药喷施对青菜生理指标影响
植物受胁迫下会产生活性氧,破坏细胞脂质、蛋白质和DNA,并诱导植物调节复杂的抗氧化防御系统,以消除活性氧的毒性作用,保护植物细胞免受氧化损伤[8-9]。SOD 和POD 是抗氧化酶,SOD 首先通过歧化作用将超氧阴离子转化为H2O2,POD 继续将H2O2转化为H2O 和O2[10]。图1为农药喷施后青菜叶片中SOD、POD 活性水平变化。与对照组相比,两种农药喷施均增加了青菜的SOD 和POD 活性,说明喷施农药对青菜造成了氧化应激。此外,噻虫嗪处理组POD活性比戊唑醇处理组高,两种农药的SOD活性和MDA含量无显著差异。MDA是在自由基引起的脂质过氧化过程中产生的,是脂质过氧化的指标[11]。两种农药胁迫均造成青菜叶片MDA 含量增多,表明膜脂过氧化作用增加[12]。基于以上数据表明,两种农药在推荐剂量下均对青菜生理造成一定的影响,且不同类型农药的影响程度不同。
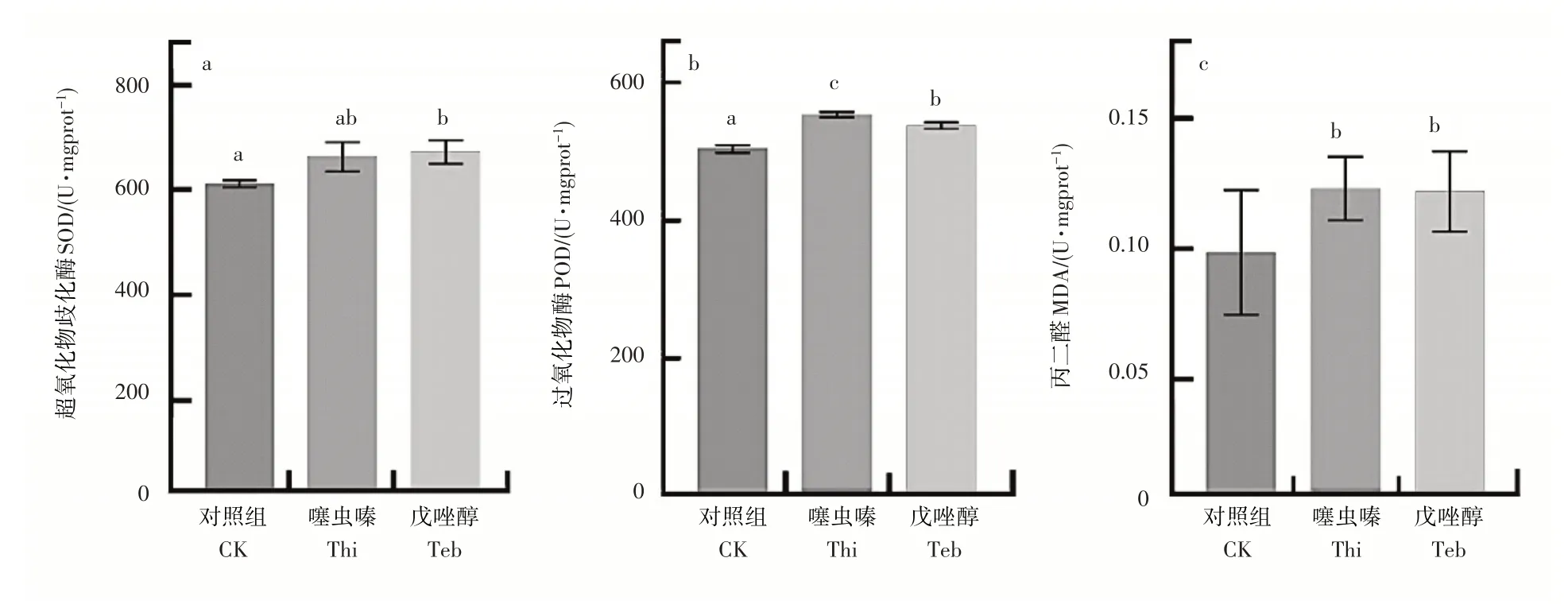
图1 两种农药对上海青茎叶生理指标影响Figure 1 Effect of two pesticides on physiological activities in vegetables tissues
2.2 代谢组学分析
主成分分析(PCA)是一种常用的数据降维方法,它对数据中的原始变量进行线性组合,得到几个正交的成分(即主成分)对原数据的协方差阵进行解释,其属于无监督模式识别,在主成分分析投影图中,相近的样品会聚到一起,不相似样品的空间距离较远。本试验利用奇异值分解方法对代谢组学数据进行主成分分析。主成分分析结果(图2)可以看出,3 组青菜样品代谢图谱存在明显差异,说明两种农药可以显著影响青菜指纹代谢图谱。基于方差分析及质谱数据库比对,共鉴定出98 个显著变化代谢物(p<0.05),包括21 个类黄酮、13 个有机酸、9 个氨基酸、10 个核苷、2 个生物碱、7 个酚酸、9 个脂类、4 个糖磷酸、3 个维生素、2 个生物碱、7个其他(图3)。噻虫嗪处理组中,显著上调代谢物40种,其中变化最多的代谢物为腺嘌呤、异鼠李素-3-O-葡萄糖苷、异鼠李素、喜树醇-3-O-葡萄糖、烟酸、甘油酸、木犀草素4'-O-葡萄糖、鸟苷、杨梅苷;显著下调代谢物28种,其中变化最多的代谢物为苄基硫代葡萄糖苷、吲哚甲基硫代葡萄糖苷、阿魏酰腐胺等、(2S)-2-羟基-3-丁烯基硫代葡萄糖苷、新芸薹素、甲氨蝶呤、4-吡哆醇酸、β-烟酰胺腺嘌呤二核苷酸、丁香脂素吲哚-3-甲醛等。戊唑醇处理组中,显著上调代谢物24 种,其中变化最多的代谢物为黄腐酚、二氢辣椒素、海生菊甙、谷胱甘肽、3-羟基黄酮、苯乙酸、亚油酸、N2-甲基鸟苷、甘油酸、龙胆苦苷等;显著下调代谢物47 种,其中变化最多的代谢物为苄基硫代葡萄糖苷、阿魏酰腐胺、二裂酸、棉子糖、吲哚-3-甲醛、N、N-二甲基精氨酸、烟酰胺、精氨酸、松三糖、脯氨酸等。
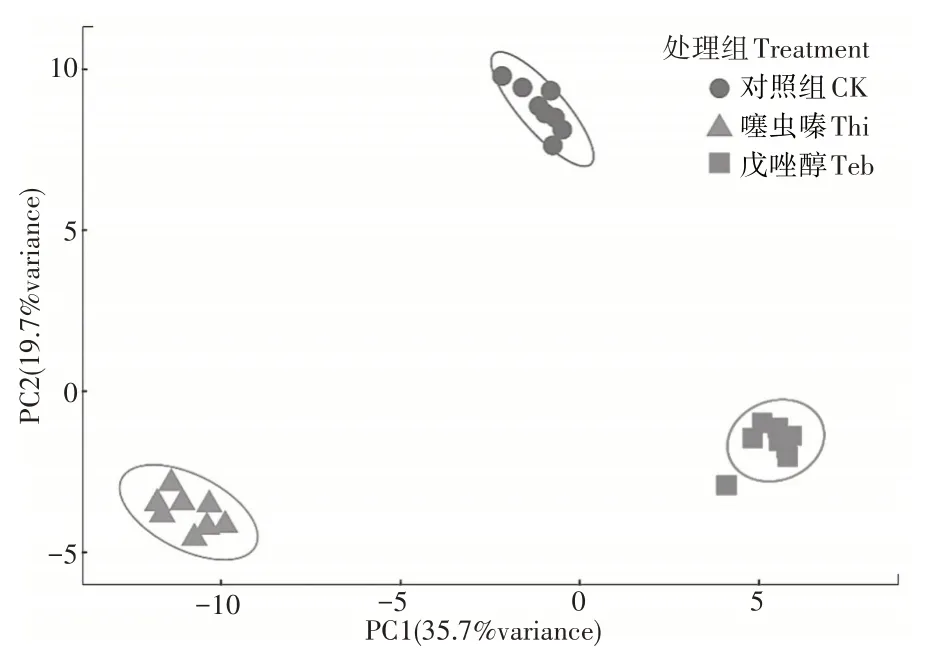
图2 主成分分析(PCA)不同处理组代谢图谱差异Figure 2 PCA analysis the metabolic profiling of vegetable samples in different groups
利用MetaboAnalyst软件进行代谢通路富集分析,具体结果如图4,两种不同农药处理均显著影响了上海青叶片中的黄酮和黄酮醇的生物合成、烟酸酯和烟酰胺代谢和三羧酸循环(TCA循环)。此外,噻虫嗪处理显著影响了亚油酸代谢、苯丙烷生物合成和C5-分支二元酸代谢;戊唑醇处理影响了丙氨酸,天冬氨酸和谷氨酸代谢、次级代谢产物生物合成和亚油酸代谢。
氨基酸是植物初级代谢的必需成分,在植物的生理过程中起着重要作用,可作为渗透调节物质,调节气孔开度,并作为合成防御相关代谢物和信号代谢物的前体[13-15]。本试验中共检测到9个差异变化的氨基酸。与对照组相比,噻虫嗪处理组中差异氨基酸有4个,且均显著增多,而戊唑醇处理组中显著增多的氨基酸有1个,显著降低的氨基酸有8 个。噻虫嗪胁迫下,上海青中脯氨酸显著积累,有助于稳定酶和膜结构,从而提高植物耐受胁迫的能力[16];而在戊唑醇胁迫下,脯氨酸显著减少。谷胱甘肽是一种非酶抗氧化剂,是植物抗氧化防御系统的组成部分,可防止活性氧对重要细胞成分的损伤[17-18]。在戊唑醇处理时,叶片中谷胱甘肽显著积累,有利于植物清除过剩的自由基从而保护植物免受农药胁迫引起的氧化损伤[19-20];而在噻虫嗪处理组没有显著变化。在不同农药处理下,两种防御型氨基酸变化趋势不一致,可能说明植物响应两种农药胁迫响应不一致。谷氨酰胺和精氨酸、N,N-二甲基精氨酸是叶片中主要的富含氮的氨基酸,主要参与无机氮的固定[21]。噻虫嗪胁迫造成青菜叶片中谷氨酰胺和N,N-二甲基精氨酸显著累积,表明固定无机氮的过程可能得到加强,有利于核酸和蛋白质的合成[22]。在戊唑醇处理组,这三种氨基酸显著降低,表明固定无机氮的过程可能受到影响。此外,相比噻虫嗪,戊唑醇处理后的叶片其他氨基酸含量也显著降低,包括异亮氨酸、缬氨酸、酪氨酸、色氨酸等。以上结果表明,两种农药均可以影响青菜氨基酸代谢,但两种农药处理后叶片中氨基酸含量差异很大。
糖和有机酸不仅被认为是植物构建碳骨架和提供能量所需的代谢资源,也是影响青菜风味的重要因素[23]。本实验中共检测到13个差异变化有机酸和4个差异变化糖磷酸。与对照组相比,噻虫嗪处理组中显著增多的有机酸有4 个、糖磷酸1 个,显著降低的有机酸有4 个;而戊唑醇处理组中显著增多的有机酸有3 个,显著降低的有机酸有6个、糖磷酸均显著降低。糖酵解和三羧酸循环途径可以产生大量能量物质及各种中间代谢产物,是碳代谢和氮代谢联系的枢纽[24]。苹果酸、柠檬酸和丁二酸是三羧酸(TCA)循环的中间体,6-磷酸葡萄糖是糖酵解和三羧酸循环反应初期的产物,磷酸烯醇丙酮酸是糖酵解作用与糖质新生作用的中间产物[25]。两种农药处理后4个有机酸和糖磷酸的累积趋势不一致,噻虫嗪喷施后,柠檬酸和6-磷酸葡萄糖显著上调,苹果酸显著下调,而丁二酸没有显著变化;戊唑醇喷施后,丁二酸显著上调,柠檬酸和6-磷酸葡萄糖显著下调,而苹果酸没有显著变化;而两种农药处理差磷酸烯醇丙酮酸含量均减少。6-磷酸甘露糖、棉子糖和松三糖不仅是可溶性糖,还可作为渗透保护剂、前体和细胞对某些胁迫效应的反应的能量来源[26]。戊唑醇处理组中6-磷酸甘露糖、棉子糖和松三糖均显著下调,由此可以说明,两种农药对植物糖酵解和三羧酸循产生一定影响,但中间产物累积不一致。甘油酸是甘油氧化形成的三碳醇酸,是丝氨酸降解的中间产物,磷酸化后生成甘油酸3-磷酸,可进一步异生成糖或进一步参与糖酵解。两种农药处理后甘油酸含量均显著增多,甘油酸增多后会影响植物糖酵解过程。此外,噻虫嗪还促进叶片中柠康酸、喹啉酸含量增多,而丙酸、马来酸含量减少;戊唑醇还促进叶片中2-羟基苯乙酸增多,而哌啶酸、莽草酸、葡萄糖酸、柠康酸显著减少。由此可以发现两种农药均可以影响青菜糖酸代谢,影响青菜品质。
核苷类物质是核酸的结构单元,与细胞能量代谢有关[27]。本试验中共检测到10 个差异变化核苷类物质。与对照组相比,噻虫嗪处理组中显著增多的核苷类有5 个,显著降低的核苷类有5 个;而戊唑醇处理组中显著增多的核苷类有1 个,显著降低的核苷类有4个。腺嘌呤、鸟嘌呤和鸟苷是核酸RNA 和DNA 有关的前体物质[28],噻虫嗪处理组中,腺嘌呤、鸟嘌呤和鸟苷显著上升。5'-单磷酸腺苷和β-烟酰胺腺嘌呤二核苷酸均与能量代谢有关,而在两种农药处理下,两种物质均显著降低,其可能与植物响应农药胁迫有关。
脂质不仅是提供细胞膜结构完整性和能量来源的必不可少的生物分子,而且对于细胞信号传导也至关重要[29-30]。本试验中共检测到9 个差异变化脂质,与对照组比,噻虫嗪处理组亚油酸显著增加,戊唑醇处理组叶片中棕榈酸、亚麻酸、亚油酸均显著增加。亚麻酸、亚油酸为不饱和脂肪酸,自由基会影响细胞膜中的不饱和脂肪酸,导致脂质过氧化等一系列连锁反应并使细胞膜产生损伤[29]。亚麻酸和亚油酸具有显著的抗氧化活性,并且可以调节细胞膜的流动性,植物细胞可以使用亚麻酸来合成信号分子茉莉酸,从而激活植物抵抗昆虫伤害和许多病原体的防御能力并调节植物的生长[31]。以上结果表明,青菜响应农药胁迫产生不饱和脂肪酸,提高植物对农药的防御能力。
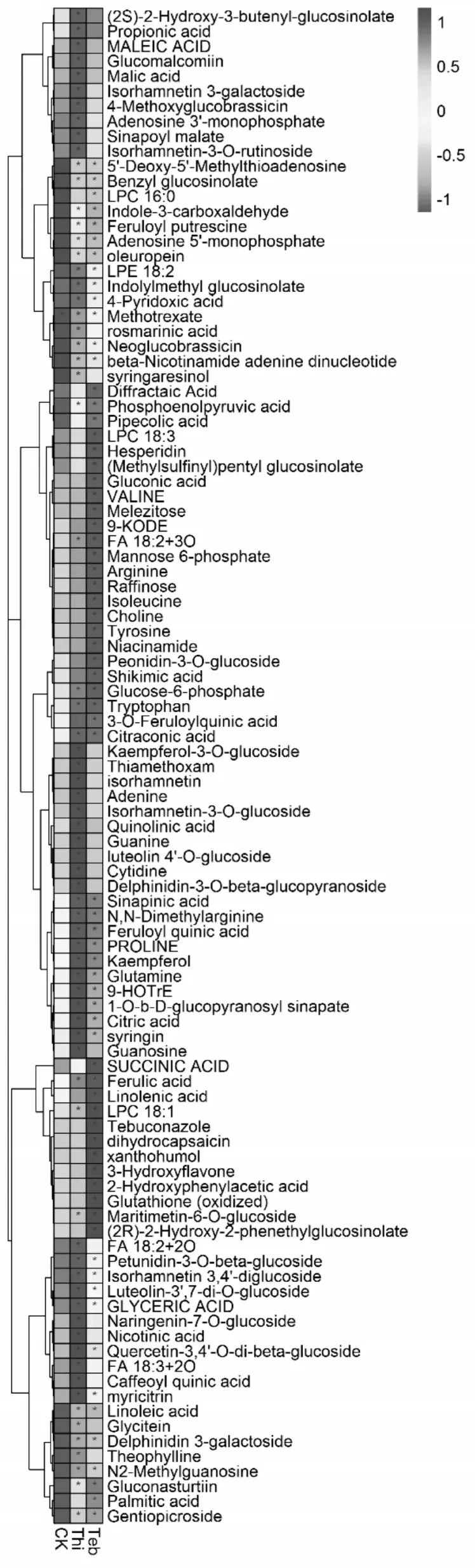
图3 热图分析不同处理组显著变化的差异代谢物Figure 3 Heatmap analysis of metabolites with significant differences vegetable shoots
植物会产生大量多样的次级代谢产物,这些代谢产物介导了植物与其生物和非生物环境的相互作用。植物次生代谢途径主要有苯丙烷代谢途径、异戊二烯代谢途径和生物碱合成途径等[32]。酚酸和类黄酮是苯基丙酸途径的重要合成物质。本试验中共检测到28个差异变化次级代谢产物。与对照组相比,噻虫嗪处理组中显著增多的次级代谢产物有17 个,显著降低的次级代谢产物有5 个;而戊唑醇处理组中显著增多的次级代谢产物有10 个,显著降低的次级代谢产物有7 个。在噻虫嗪的胁迫下,黄酮类物质显著积累,其中异鼠李素、山奈酚、杨梅苷和异鼠李素3,4'-二葡萄糖分别显著上调2.35,1.47,1.82,1.67 倍;在戊唑醇胁迫下,异鼠李素、杨梅苷和异鼠李素3,4'-二葡萄糖苷分别上调1.12,1.24,1.34 倍,而山奈酚显著下调0.68 倍。黄酮类化合物的变化,表明两种农药胁迫对青菜产生了氧化应激。此外,在叶片中也检测到了苯丙烷生物合成途径中的衍生物(酚类物质)发生了显著变化(图3)。酚类化合物是强大的抗氧化剂,可作为自由基清除剂和还原剂[33]。在噻虫嗪胁迫下,奎宁酸、阿魏基奎宁酸和芥子酸上调1.29,1.16,1.23 倍,有利于清除自由基,增强植物防御能力;在戊唑醇胁迫下,芥子酸和阿魏基奎宁酸显著下调(0.77倍和0.85倍),对青菜造成了一定的氧化损伤。
硫代葡萄糖苷是植物中一类富含氮、硫元素的次生代谢产物,当植物受到胁迫时,会分配物质用于生产更多的次生代谢产物来应对胁迫[34]。非生物胁迫如缺磷胁迫、杀虫剂污染以及CO2胁迫会通过促进甲硫氨酸等氨基酸的代谢促进硫代葡萄糖苷的合成[35-37]。本试验中共检测到11 个硫代葡萄糖苷。与对照组相比,噻虫嗪处理组中显著增多的硫代葡萄糖苷有3个,显著降低的硫代葡萄糖苷有6个;而戊唑醇处理组中显著增多的硫代葡萄糖苷有3 个,显著降低的硫代葡萄糖苷有5 个。其中吲哚甲基硫代葡萄糖苷在两种农药处理下均显著减少,有文献报道重度胁迫会导致植物中硫代葡萄糖苷分解来合成生长必需物质以抵御胁迫伤害或造成植物死亡[38]。吲哚类硫代葡萄糖苷在酶的水解下会产生吲哚3-甲醇、吲哚-3-乙酰睛等化合物,这些化合物具有一定的生物活性,能够抑制微生物的生长并对某些昆虫和草食动物具有威慑作用。通过以上分析可以发现,农药喷施可以显著影响植物硫代葡萄糖苷代谢[39]。
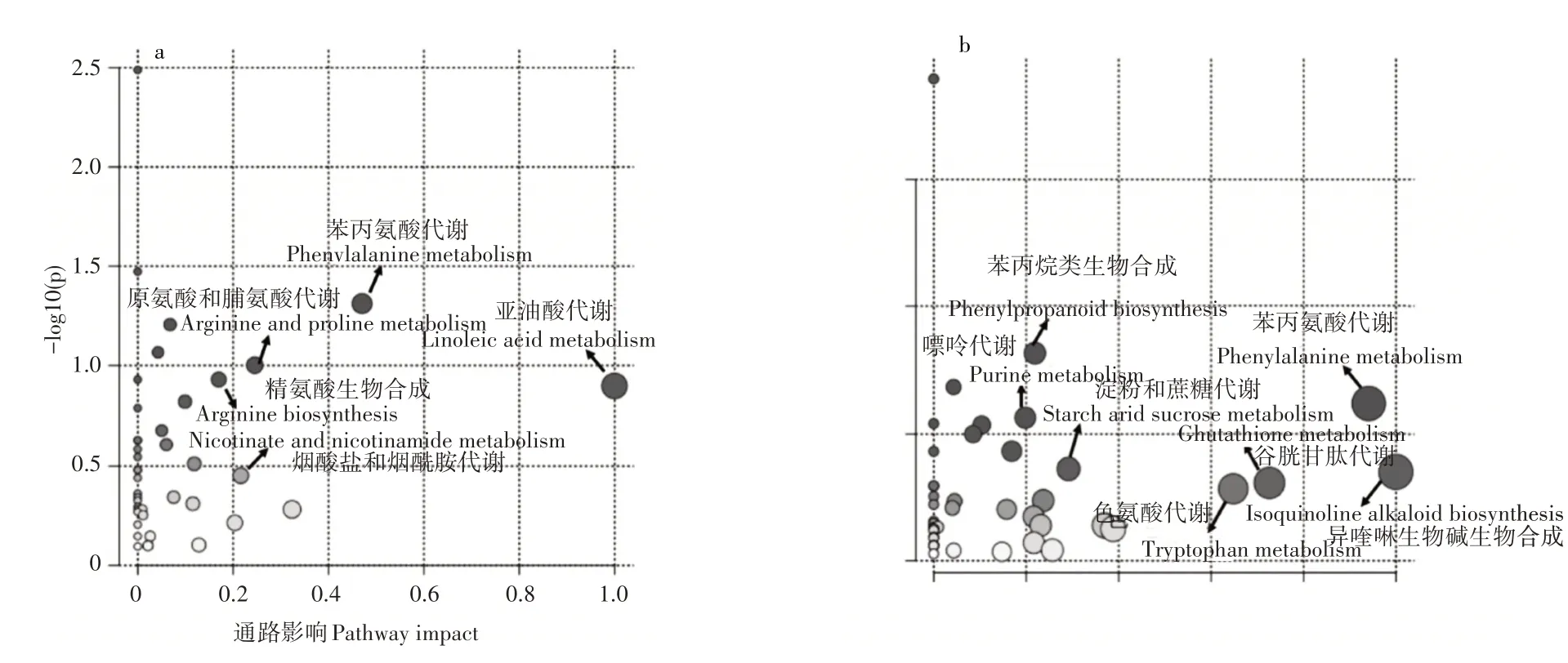
图4 差异代谢富集的代谢通路Figure 4 Metabolic pathway analysis based on the metabolites with significnat difference
3 结论
本研究以杀虫剂噻虫嗪和杀菌剂戊唑醇为例,研究农药喷施对上海青生理代谢影响。试验结果表明,两种农药喷施均对青菜造成一定胁迫响应,致使抗氧化酶活性水平及膜脂过氧化提高。基于代谢组学分析,发现两种农药均可以影响青菜指纹代谢图谱,共鉴定出98个差异代谢物,其中类黄酮、硫代糖苷、有机酸、氨基酸等物质种类最多,其中两种农药均可以促进叶片中类黄酮含量增加,其可能与青菜抵御农药胁迫有关;噻虫嗪导致大部分氨基酸、酚酸含量累积,而戊唑醇处理组则相反;戊唑醇可以增加叶片中不饱和脂肪酸(亚麻酸和亚油酸)含量增多,而降低糖类组分(松三糖和棉子糖)含量。此外,两种农药还影响青菜叶片中有机酸、核苷、硫代糖苷等组分代谢。
