草莓FveRPM1基因的鉴定及功能分析
2022-03-26关宇涵王雨沙李晓明
关宇涵,王雨沙,李晓明,李 贺
(沈阳农业大学园艺学院/辽宁省草莓育种及优质栽培重点实验室,沈阳 110161)
草莓属于蔷薇科草莓属,是经济价值较高的小浆果。近年来,草莓在我国发展迅速,栽培面积和产量均居世界第一[1],随着草莓设施栽培的发展,许多病害带来了严重的危害,其中灰霉病是草莓生产的主要病害之一[2]。草莓灰霉病主要发生在草莓开花期和结果期,严重影响草莓果实的产量,其病原菌是由半知菌亚门丝孢纲中的灰葡萄孢侵染所致,适宜在温暖潮湿的环境生长,最适生长温度为20~23℃[3]。目前,草莓灰霉病的防治主要依靠嘧菌环胺、环酰菌胺等化学药剂,而关于抗灰霉病草莓品种(系)筛选和抗病机理的研究相对较少[4]。
随着分子生物学在植物研究中的广泛利用,研究者们已经克隆出多种植物抗病基因,并发现这些抗病基因存在许多保守结构域[5],根据结构域的不同,可以将已经克隆出的抗病基因分为几大类:LRR-TM-STK 类、LRR-TM 类、NBS-LRR 类、STK 类以及不属于这4 种的其他类[6]。NBS-LRR 是植物中数量最多,并且拥有极其保守结构域的一类[7],其中NBS 是最为保守的结构域,还可以进一步分成P-loop、MHDV 等8 种保守基序[8]。NBS 具有ATP 或GTP 的结合活性,能够识别病原菌,是激活植物发生防御反应的重要区域[9];而LRR 结构域能参与蛋白间的相互作用,也能够与多种配体特异性结合,在防卫反应中参与信号传导[10]。根据N 端结构的不同,NBS-LRR基因主要分为两类,一类为包含Toll蛋白和哺乳动物白细胞介素-1受体的TIR-NBS-LRR,另一个类为含有卷曲螺旋结构的CC-NBS-LRR[11]。
RPM1(resistance to pseudomonas maculicola 1)是一种质膜相关蛋白,不具有跨膜结构域[12],属于CC-NBSLRR 类抗病蛋白,是植物细胞内的非特异性免疫性受体[13]。拟南芥中敲除与RPM1 相互作用的蛋白激酶(RIPK)后,发现对RPM1 具有稳定作用的质膜定位蛋白RIN4 的磷酸化水平降低,进而RPM1 介导的防御反应减弱[14,15];过表达水稻RPM1的同源基因OsRLR1(Oryza sativa RPM1-like resistance gene 1)可导致水稻叶片出现超敏反应,并对稻瘟病菌和白叶枯病菌具有广谱抗性[16];茭白中2 个ZlRPM1基因均参与菰黑粉菌菌丝侵染诱导的茎部膨大发育调节[17]。目前,关于草莓RPM1基因的研究还鲜有报道。本研究克隆草莓FveRPM1基因的编码区序列,分析该基因启动子的核心作用元件,明确其表达特性,并通过构建过表达载体和沉默载体,利用农杆菌介导的草莓果实瞬时转化方法详细研究了该基因对草莓灰霉病的抗性,旨在为草莓生产和草莓抗病育种奠定基础,研究结果具有丰富植物RPM1基因功能研究的科学意义。
1 材料与方法
1.1 材料
二倍体森林草莓Ruegen 保存在沈阳农业大学果树分子生物学实验室,其幼嫩叶片用于基因克隆,根、茎、叶、花、果用于基因表达特性分析;八倍体栽培草莓艳丽和月华种植在沈阳农业大学草莓试验园,生长期选取大小、发育状态基本一致的第三片完全展开叶用于灰霉病菌接种试验,果实生长期采集大小及发育状态基本一致的白果期果实用于瞬时转化试验;本氏烟草(Nicotiana tabacumL.)植株培养在沈阳农业大学果树分子生物学实验室,其幼嫩叶片用于亚细胞定位研究。
1.2 方法
1.2.1 激素处理 Ruegen 草莓苗在固体继代培养基(MS 粉4.43g·L-1,蔗糖30g·L-1,琼脂7g·L-1)中培养30d后,选取生长势一致的植株,将其分别放入不同浓度(0,0.1,1,10,25μmol·L-1)的SA 和MeJA 固体继代培养基中培养12h后采样用来检测基因的相对表达量,每个浓度处理5株,生物学重复3次。
1.2.2 病菌处理及酶活检测 收集带有灰霉病的草莓果实,用无菌水将菌丝从果实上冲洗下来,用已灭菌的牙签,从无菌水中挑出菌丝,在PDA培养基上培养,每隔7d进行菌株分离,共进行3次,室温保存。
在PDA 培养基上培养的灰霉病菌,使用前检查灰霉病菌的孢子量,配成105个·mL-1的孢子悬浮液。在进行灰霉病菌的叶片接种试验中,将清洗干净的叶片放在含有滤纸的培养皿中,叶背朝上,将状态一致的灰霉菌菌柄放在叶片上,每次处理20 片叶,生物学重复3 次,第2 天去除菌柄,每24h 拍照、取样。将染病后的草莓叶片放入三角瓶中,加入适量的含0.02%台盼蓝染色液,在水中煮沸2min,随后放到浓度为2.5g·mL-1的饱和水合氯醛溶液中进行脱色,再用100%的酒精漂洗3~4 次,观察叶片的细胞坏死情况。在进行灰霉病菌的果实接种试验中,将大小、发育状态基本一致的转熟期艳丽和月华转基因草莓果实和非转基因果实浸泡到孢子悬浮液中,约30s后观察果实的发病状态,各处理30个果实,生物学重复3次。
叶片和果实中的超氧化物歧化酶(SOD)活性测定采用氮蓝四唑比色法[18];过氧化物酶(POD)活性测定采用愈创木酚比色法[19],过氧化氢酶(CAT)活性测定采用李仕飞等方法[20]。利用SPSS 软件对数据进行差异显著性分析。
1.2.3 草莓RNA提取及基因克隆 通过蔷薇科基因组(genome database for rosaceae,GDR)网站(https://www.rosaceae.org/)查找森林草莓(F.vesca)FveRPM1基因编码区(CDS)序列和启动子序列,并设计CDS 序列扩增引物(表1)。采用改良的CTAB 法[21]提取Ruegen 草莓的根、茎、叶、花、果及艳丽和月华草莓叶片、果实中的RNA,利用反转录试剂盒(TaKaRa)将提取的总RNA 反转成cDNA。PCR 扩增反应体系如下:上下游引物各1μL,dNTP 1.6μL,ddH2O 12μL,10×LA Buffer 2μL,cDNA 模板2μL,LA Taq 0.4μL,总体积20μL。反应程序:95℃5min;95℃30s,57℃30s,72℃2min40s,35个循环;72℃10min;16℃保存。

表1 本试验所用引物Table 1 Primers used in this study
1.2.4FveRPM1基因序列分析 通过NCBI 网站(https://www.ncbi.nlm.nih.gov/)分析克隆的FveRPM1基因的结构域。结合NCBI网站查找不同物种中RPM1的同源蛋白,利用MEGA7.0软件分析保守结构域并构建系统进化树,分析FveRPM1 蛋白的亲缘关系。从GDR 网站下载启动子序列,通过Plant CARE 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析顺式作用元件。
1.2.5FveRPM1基因表达分析 依据FveRPM1基因序列设计荧光定量PCR引物(表1),以草莓26S rRNA作为内参基因,使用7500 荧光定量PCR 仪(Applied Biosystems,USA)采用SYBR Green 法进行RT-qPCR 反应,体系为cDNA 1μL,上下游引物各1μL,SYBR Green Mix 10μL,RNase-free H2O 7μL,总体积20μL。程序为95℃30s;95℃15s 和60℃1min,共40 个循环;95℃15s;60℃1min;95℃30s;60℃15s。每个反应重复3 次,采用2-△△Ct法计算基因的相对表达量。
1.2.6 亚细胞定位 基于pRI101-GFP 载体,构建草莓RPM1-GFP 融合基因,通过冻融法将构建好的重组载体转入农杆菌EHA105 菌株,YEP 液体培养基培养后,用重悬液(含1mL MES-KOH 溶液,1mL MgCl2溶液,0.04mL乙酰丁香酮,197.96mL 蒸馏水)均匀打散菌块调OD600在1.0,静置2h,选取6~8 片本氏烟草叶片,将菌液注入烟草叶背,暗培养24~48h;用激光共聚焦显微镜观察绿色荧光蛋白(GFP)信号。
1.2.7 草莓果实瞬时转化 将FveRPM1基因切胶回收后的扩增片段与pMD18-T载体连接,经转化、鉴定、测序后获得新的重组质粒,基于pRI101-An和pRI101-RNAi载体,利用双酶切及T4DNA连接酶进行连接反应,分别获得草莓RPM1基因的过表达载体和沉默载体。通过冻融法将构建好的重组载体转入农杆菌EHA105 菌株,用YEP 培养基培养,过夜摇菌至OD600值为0.8,离心后用MMA 悬浮液重悬菌体,吸取1mL 菌悬液,均匀的注射到艳丽草莓和月华草莓白果中,待白果转红时,将果实泡在灰霉病菌悬液中,之后观察其染病情况,同时检测接菌前后FveRPM1基因的表达量及接菌后草莓果实CAT和SOD酶的活性。
2 结果与分析
2.1 草莓RPM1基因的克隆鉴定
2.1.1 草莓RPM1基因编码区的克隆及结构分析 利用二倍体森林草莓数据库信息设计草莓RPM1基因的引物,以Ruegen草莓叶片cDNA为模板进行PCR扩增,得到FveRPM1基因的全长序列(图1A),克隆测序结果表明该基因全长为2748bp,编码915 个氨基酸。基因结构分析发现(图1B):FveRPM1基因编码的氨基酸序列主要包含N端的Rx-CC 结构域、C端不同的LRR 结构域,中间为1个保守的NB-ARC 结构域。为了研究不同物种中RPM1蛋白的亲缘关系,从NCBI数据库中下载了23种RPM1蛋白序列,利用MEGA7.0软件进行分析,结果表明草莓FveRPM1 与苹果(Malus domestica)的MdRPM1 蛋白同源性最近,而与乌拉尔图小麦(Triticum urartu)的同源性较远(图1C)。
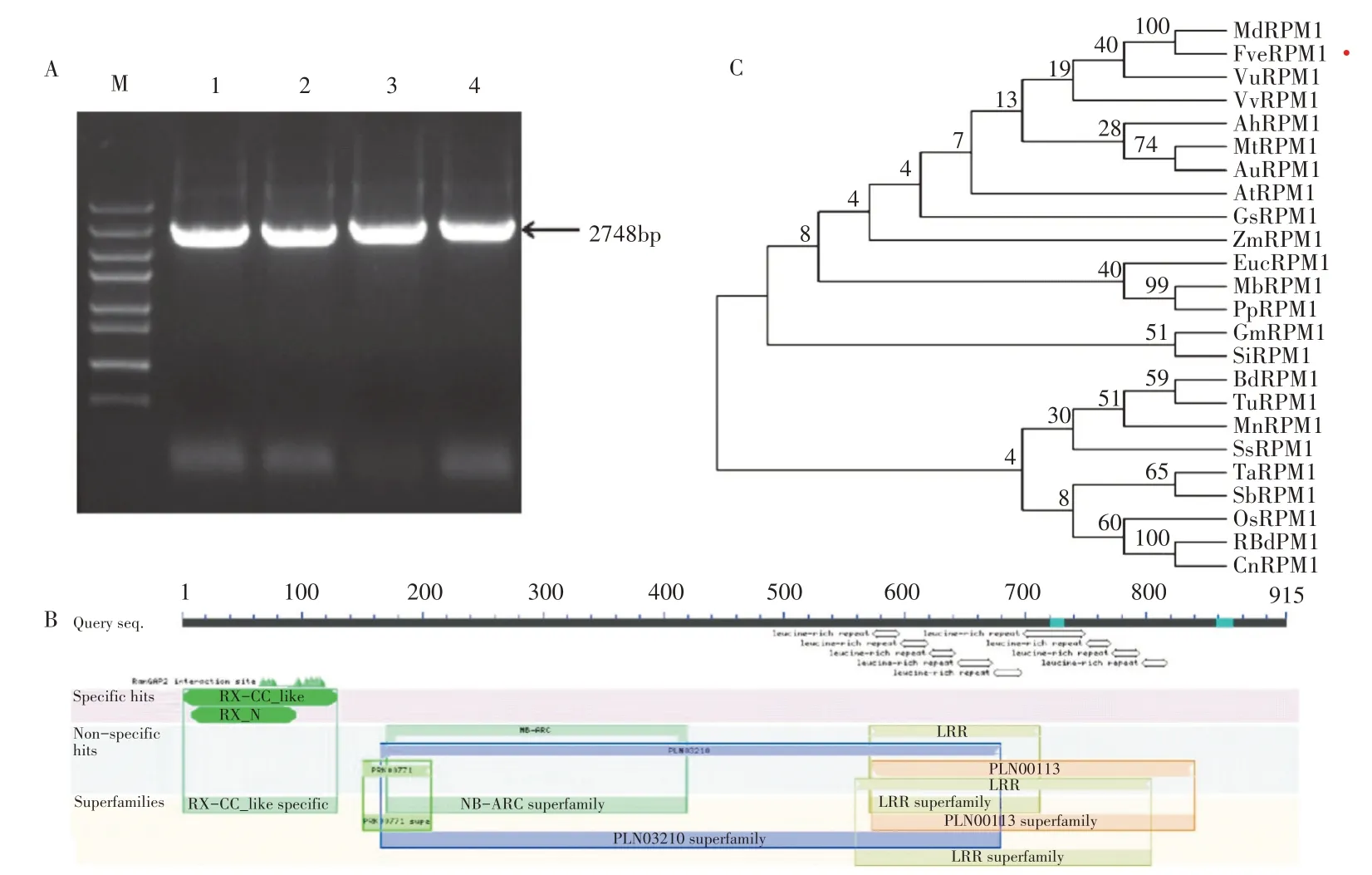
图1 草莓RPM1基因的扩增片段、蛋白结构及进化关系分析Figure 1 The amplified fragment, protein structure and evolutionary relationship of strawberry RPM1
2.1.2 草莓FveRPM1基因启动子的鉴定分析 从GDR 网站下载FveRPM1基因的启动子序列,利用生物信息学在线软件Plant CARE 对获得的草莓FveRPM1基因启动子序列进行分析发现(表2),除核心作用元件TATABox 和CAAT-Box 外,还包括参与植物激素响应的作用元件,如参与脱落酸反应的序列为AACCCGG 的ABRE元件,参与茉莉酸甲酯反应的序列为TGACG 的TGACG-motif 元件和序列为CGTCA 的CGTCA-motif 元件,还有参与光响应的ACE、GT1-motif、I-box等元件;参与玉米素代谢调节的O2-site元件等。
2.2 草莓FveRPM1基因的特性分析
2.2.1 草莓FveRPM1基因的时空表达特性 利用RT-qPCR 技术检测了Ruegen 草莓不同器官中FveRPM1基因的表达量。结果表明(图2A):FveRPM1基因主要在根中表达,在新叶中表达较少。以成熟叶片为对照,根中该基因的相对表达量是成熟叶片中表达量的165.48 倍,花苞中的表达量是成熟叶片的117.10 倍,红果中表达量为成熟叶片的2.69倍;茎中表达量是成熟叶片的9.67倍,可见FveRPM1基因在草莓不同器官中表达差异显著。
2.2.2 激素处理后FveRPM1基因的表达特性 有研究表明,一些基因的表达受激素、病菌等诱导[22]。为了进一步明确草莓FveRPM1基因的表达特性,选取生长势一致的Ruegen 草莓组培苗,分别培养在不同浓度的茉莉酸甲酯(MeJA)、水杨酸(SA)的液体培养基中,处理12h后分析FveRPM1基因的表达水平。与0μmol·L-1的对照相比(图2B,C),不同浓度的MeJA和SA均诱导了FveRPM1基因的表达。1μmol·L-1的MeJA处理12h后,FveRPM1基因的表达量最高,为对照的13.2 倍;0.1μmol·L-1的SA 处理12h 后,FveRPM1基因的表达量最高,为对照的14倍,说明MeJA和SA均能诱导FveRPM1基因的表达。
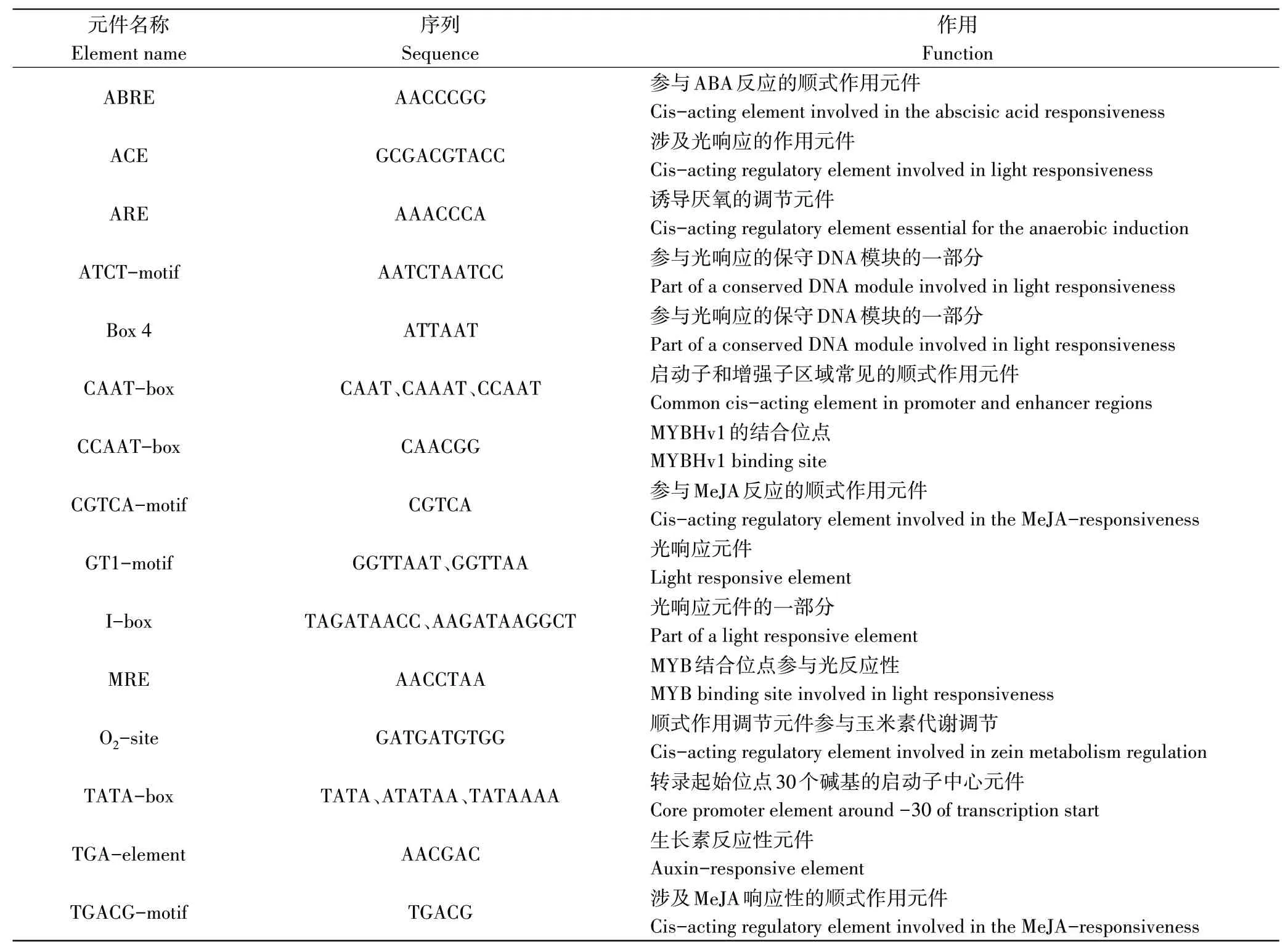
表2 FveRPM1基因启动子顺式作用元件分析Table 2 Analysis of cis-acting elements of FveRPM1 promoter

图2 FveRPM1在草莓不同器官及激素处理后的表达特性分析Figure 2 Expression characteristics of FveRPM1 in different organs of strawberry and after hormone treatment
2.2.3 病菌处理后FveRPM1基因的表达特性 为了明确病菌侵染对FveRPM1基因表达的影响,在田间摘取艳丽草莓和月华草莓的第3 片完全展开叶接种灰霉病菌,观察发病情况,发现艳丽草莓在第3 天开始发病(图3A),而月华草莓在第2天开始发病(图3G);通过台盼蓝染色,观察接菌处理后的细胞死亡情况,同样可以看出从第3 天开始,两品种叶片中死亡细胞的数量均大幅度上升(图3B,H)。通过RT-qPCR 检测发现艳丽草莓叶片在接菌第4 天时,FveRPM1基因的表达量最高(图3C),而月华草莓叶片在接菌第3 天时,FveRPM1基因的表达量最高(图3I)。
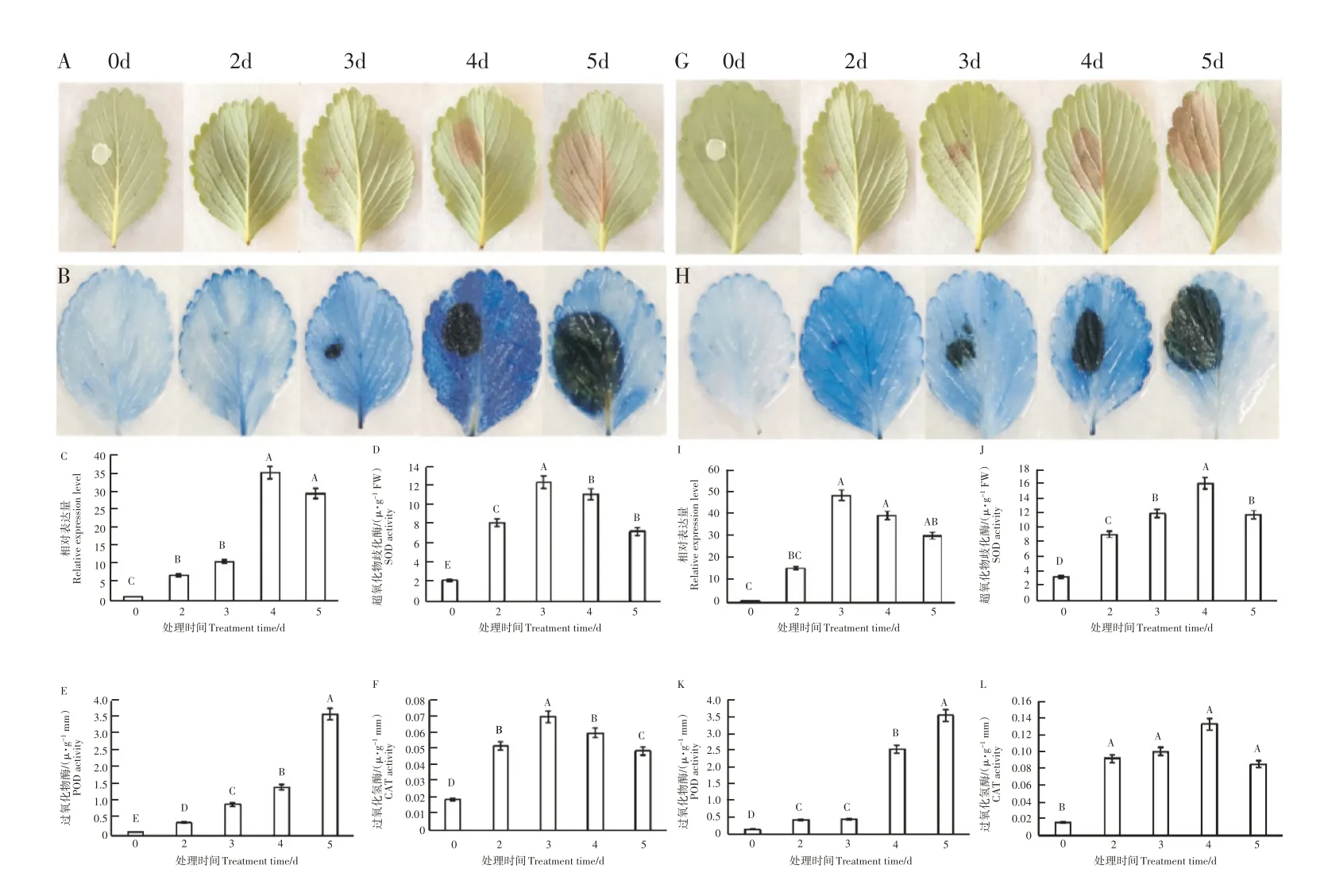
图3 草莓灰霉病菌接种情况及酶活性变化分析Figure 3 Botrytis cinerea treatment and changes in enzyme activity in strawberry
分析艳丽和月华两个品种叶片在接种灰霉病菌后的酶活性变化,发现艳丽草莓叶片SOD 酶的活性在接种灰霉病菌后3d 达到最高,然后逐渐下降(图3D),POD 酶的活性整体上呈逐渐上升趋势(图3E),CAT 酶的活性也是在接种3d达到最高,然后逐渐下降(图3F);月华草莓叶片SOD 酶的活性在接种灰霉病菌后4d 时达最高,然后下降(图3J),POD 酶的活性也是整体呈逐渐上升趋势(图3K),CAT 酶的活性在接种2d 时就显著高于对照,4d时达最高(图3L)。

图4 FveRPM1蛋白的亚细胞定位Figure 4 Subcellular localization of FveRPM1 protein
2.2.4 草莓FveRPM1蛋白的亚细胞定位 为了研究FveRPM1 蛋白在细胞中的表达情况,我们成功构建了FveRPM1基因与GFP 基因融合的表达载体。将空载体和融合载体分别导入烟草叶片后,利用激光共聚焦显微镜观察发现GFP 空载体的荧光信号分布在细胞膜和细胞核中,而FveRPM1 蛋白的荧光信号只分布在细胞膜上(图4),说明FveRPM1 蛋白定位在细胞膜上,是一种膜表达蛋白。
2.3 草莓FveRPM1基因的功能分析

图5 草莓果实瞬时转化情况及酶活性变化Figure 5 Transient expression of strawberry fruit and changes in enzyme activity
为了研究FveRPM1基因对草莓灰霉病的抗性,利用克隆的FveRPM1基因编码区全长序列,分别构建过量表达载体(pRI101-FveRPM1)和干扰载体(pRNAi-FveRPM1)。借助农杆菌介导的草莓果实瞬时转化方法,分别选取30个艳丽和月华草莓白果期果实进行注射,待白果转红时,用灰霉病菌进行处理,之后观察果实感病情况。发现与对照(CK)相比,含FveRPM1沉默基因的果实感病情况更为严重,而含FveRPM1过表达基因的果实感病较轻(图5A,B)。由此推测,FveRPM1基因可能参与草莓果实对灰霉病的防御响应。接菌前后过表达果实中FveRPM1基因的表达量均高于对照,沉默果实中基因表达量均低于对照(图5C,D)。同时我们也检测了接菌后草莓果实SOD 和CAT 酶的活性。发现含FveRPM1过表达基因的果实SOD 酶的活性也最强,对照次之,FveRPM1基因沉默的果实SOD酶的活性最弱,CAT酶活性表现相同的规律(图5E~H)。
3 讨论与结论
NBS-LRR 通常被称为NLR 免疫受体蛋白,在植物抗病反应过程中起着重要的作用,其中TIR-NBS-LRR蛋白介导的抗病反应需要EDS1 和SAG101 蛋白的参与,而CC-NBS-LRR 能够识别病原物的效应因子,传给下游信号系统激活植物抗病反应[23]。已有研究报道从草莓中克隆出FaNBS1[24]和FaNBS20[25],这两个基因都属于TIR-NBS-LRR 家族,主要包含TIR、NBS、LRR 结构域。本研究克隆了草莓FvePRM1基因,其属于CC-NBSLRR 家族,主要包含CC、NBS、LRR 结构域,与小麦抗白粉病菌蛋白CNL PM 的保守结构域相同[26]。通过序列比对发现樟树的CcRNL 蛋白与油棕的亲缘关系最近[27],而本研究中草莓FveRPM1 蛋白与苹果的亲缘关系较近。顺式作用元件能够参与基因表达的调控,启动子上典型的顺式作用元件主要包括GC-box、CAAT-box、TATAbox[28],本研究分析FveRPM1基因的启动子序列,发现除了核心元件TATA-Box、CAAT-Box 外,还包括参与植物激素响应元件,如脱落酸反应元件ABRE、茉莉酸甲酯反应元件TGACG-motif、生长素反应元件TGA-element,参与环境响应的元件,如诱导厌氧的ARE元件、参与光响应的ACE元件等,说明草莓FveRPM1基因可能参与激素应答响应和环境胁迫应答等。
植物激素能够参与控制防御基因表达,其中MeJA 是与植物逆境相关的信号分子,当植物受到病原菌侵染时,MeJA 能够迅速并大量积累,激活MeJA 介导的防御基因表达[29]。MeJA 的积累能够促进拟南芥防御素基因PDF1.2和Thi2.1的表达量升高[30]。SA 是植物产生系统获得性抗性必不可少的条件,外源SA 能诱导植物防卫基因的表达,而内源SA 水平的提高也能够提高植物的抗病能力[31]。研究表明用SA 处理后的芒果能够增强对炭疽病的抗性[32]。本研究用MeJA、SA两种激素处理Ruegen草莓植株发现FveRPM1基因的表达水平显著上升,表明这些防御信号分子能够诱导FveRPM1基因表达,在草莓抗病防御信号转导途径中可能起到了潜在的调节作用。当受到病原菌侵染时,植物会引发一系列生理生化变化来抵御病原物的侵染,而这些特殊的生理生化变化对于进一步揭示植物抗病遗传机制,了解抗病基因的表现方式和过程具有重要意义[33]。本研究通过灰霉病菌的接菌试验,测定了CAT、SOD 和POD 酶的活性。发现接菌处理后草莓叶片的酶活性明显增强,同时FveRPM1基因的表达量上升,由此推测FveRPM1基因参与了草莓的抗病反应。
农杆菌介导的瞬时转化是一种操作简单,快速有效分析基因功能的方法,可以在不得到转基因植株的情况下有效检测外源基因的表达水平[34]。通过农杆菌介导的方法将外源基因CrBKT注射到不同时期的南瓜果实中,发现外源基因表达能够导致南瓜的类胡萝卜素含量发生变化[35]。本研究通过农杆菌介导的方法将携带FveRPM1基因的过表达载体和沉默载体注射到艳丽和月华草莓果实中,然后用灰霉病菌处理果实,观察其表型发现注射过表达载体后的草莓果实抗病性明显提升,说明FveRPM1基因的高表达提升了草莓果实的抗病性。
