益气活血化痰方作用于巨噬细胞外泌体miRNA-let-7-5p/TAB2信号通路抗动脉粥样硬化的实验研究
2022-03-26赵汉君苏立杰阮小芬姚轶立王肖龙薛金贵
黄 宇,赵汉君,苏立杰,陈 婕,阮小芬,姚轶立,王肖龙,薛金贵
近年来,随着人口高龄化和经济的发展,动脉粥样硬化(AS)所致的心血管疾病(atherosclerotic cardiovasculardisease,ASCVD)死亡率及发病率逐步升高[1],亟须深入阐明其发病机制进而优化治疗措施。AS产生机制复杂,但目前普遍认为与内皮细胞损伤、炎症反应等相关[2-5]。中医药具有作用多靶点、多途径且安全有效的优势,越来越被临床重视。益气活血化痰方(黄连9 g,生黄芪30 g,丹参20 g,水蛭12 g,全瓜蒌15 g)为本院治疗冠状动脉粥样硬化性心脏病的经验方,经过15年的临床应用,疗效显著。近年来课题组研究发现,益气活血化痰方抗AS作用可能与其改善内皮功能、减轻炎症反应等机制有关,但其具体机制需要进一步研究。本研究通过细胞实验和生物信息学方法,验证巨噬细胞外泌体miRNA-let-7-5p/TAB2信号通路,探寻益气活血化痰方抗AS可能的分子机制。
1 材料与方法
1.1 材料 无血清培养基(GIBCO,31800022),磷酸缓冲盐溶液(PBS)、胎牛血清(FBS)购自南京拜睿生物科技有限公司,培养板、培养皿(Corning),氧化型低密度脂蛋白(ox-LDL)由北京协和医科大学提供,CD63、CD81、β-actin、TAB2(ABcam),台盼蓝、结晶紫、胰酶、钨磷酸(Sigma),96孔板、6孔板(AXYgen),转染试剂盒、2,2-联喹啉-4,4-二甲酸二钠(BCA)蛋白浓度测定试剂盒、免疫沉淀(IP)细胞裂解液均购自上海碧云天生物技术有限公司,miR-28-3p mimic、miR-28-3p NC购自吉凯基因,Luria-Bertani(LB)固体培养基(Solarbio,L1015),LB液体培养基(Solarbio,L1010),甲醇(MP),十二烷基硫酸钠(SDS,Bio-Rad,161-0302),凝胶前体(AP,Bio-Rad,161-0700),甘氨酸(Tris,Bio-Rad,161-0719),聚偏二氟乙烯(PVDF)膜(Millipore),脱脂奶粉(伊利),ECL化学发光试剂盒(生物工程有限公司),无水乙醇、氯仿、异丙醇购自国药集团化学试剂有限公司,胎牛血清(GIBCO,10270-106),焦碳酸二乙酯(Sigma),实验无特定病原体(SPF)级雄性ApoE-/-小鼠(8周龄,体重20~25 g,所有小鼠提前饲养7 d以适应)。
1.2 仪器 超净工作台(苏州净化,SW-CJ-1FD),高速冷冻离心机(德国,Eppendorf),小型离心机(长沙湘瑞),2.5 μL、10 μL、200 μL、1 000 μL移液器(德国,Eppendorf),振荡器(上海沪西分析仪器,WH-2),立式压力锅(上海博讯,YXQ-LS-50),电热鼓风干燥箱(上海圣欣,101AS-3),酶标仪(Rayto,RT-6000),显微镜(日本,OLYMPUS,CX23),二氧化碳(CO2)培养箱(日本,SANYO,XD-101),脱水机(Leica,ASP 200),凝胶成像分析仪(Biorad),纳米孔板(Corning)。
1.3 实验方法
1.3.1 细胞培养与构建AS模型细胞 小鼠巨噬细胞RAW 264.7(ATCC公司)于50 mL培养瓶内接种。无血清培养饥饿12 h后分为两组,A组只加入PBS观察24 h;B组加入ox-LDL 60 μg/mL诱导24 h。
1.3.2 外泌体的提取 取对数生长期RAW 264.7细胞接种,培养并去除FBS 中外泌体后再次培养48 h,试剂盒提取外泌体。测定外泌体的大小和浓度(qNano法)。通过免疫印迹实验检测外泌体标记表达。
1.3.3 蛋白免疫印迹(Western Blot)实验
1.3.3.1 蛋白样品制备 根据细胞量加入IP裂解液200 μL、重悬细胞后离心,转移上清转液至1.5 mL离心管中放置于-80 ℃保存。
1.3.3.2 BCA法测定蛋白浓度 将标准胎牛血清蛋白稀释后配制BCA工作液,于37 ℃放置半小时,测定吸光度值计算得出蛋白浓度。
1.3.3.3 聚丙烯酰胺凝胶电泳(SDS-PAGE) 采取去离子水封闭所配制的10%分离胶表面,待胶凝结后加入上样缓冲液混匀,煮沸后冰浴中冷却。分次在80 V恒压、分离胶电泳电压120 V条件下电泳。取预先配置的1 L转移缓冲液冷却至4 ℃,PVDF膜于甲醇内浸泡,置于转移缓冲液浸泡10 min,夹心法排列于电泳槽中200 mA恒流转移。
1.3.3.4 免疫印迹 封闭及抗原抗体反应:将PVDF膜置于平皿中,放入5%脱脂奶粉的封闭液,摇床振荡封闭;用TBST洗膜10 min×3次;将膜置于含一抗稀释液CD63(稀释比例1∶1 500)、CD81(稀释比例1∶1 000)、β-actin(稀释比例1∶5 000)的平皿中,4 ℃摇床振荡孵育12 h;取出置于室温振荡,弃置一抗,TBST洗10 min×3次;用TBST稀释二抗(稀释比例1∶10 000),室温摇床振荡反应;等二抗反应结束,回收二抗。再次TBST洗膜3次。
显色:采用ECL化学发光试剂盒内A、B两种液体,等体积混合;取出TBST中PVDF膜,加合适工作液后保鲜膜覆盖;然后将其移入凝胶成像分析仪中曝光显影。
1.4 实时荧光定量聚合酶链式反应(RT-qPCR)
1.4.1 总RNA提取 于样本中加入1 mL的Trizol放于冰上。在超净台中温育5 min,12 000 r/min离心10 min。吸取上清液置于新离心管中并加入200 μL的氯仿,摇匀,室温静置2 min,4 ℃,12 000 r/min离心10 min。再次采吸上清液置于新1.5 mL离心管中并加入600 μL异丙醇混合,室温静置15 min,4 ℃,12 000 r/min,离心15 min,弃上清。加入1 mL 75 %的无水乙醇(750 μL无水乙醇和250 μL焦碳酸二乙酯水)漂洗沉淀,4 ℃,12 000 r/min,离心5 min,弃上清。加入1 mL无水乙醇,漂洗沉淀,4 ℃,12 000 r/min离心5 min,弃上清,室温干燥10 min。融入40 μL的焦碳酸二乙酯水,放在-80 ℃冰箱留存。
1.4.2 反转录 反转录以总RNA为模板,以随机引物为反转录引物,进行第一链cDNA合成,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因(采用Takara公司M-MLV反转录试剂盒)。所有操作遵循厂商提供的说明书进行,所有样本总RNA同一批反转录。
1.4.3 RT-qPCR检测 RT-qPCR在Stepone Plus system (Applied Biosystems,Foster city,CA)上进行,定量所用试剂为2×SYBR Green real-time PCR master mix。以GAPDH为内参基因,均采用反转录后产物作为模板进行RT-qPCR反应来检测其表达量改变,反应体系参考说明书。
1.5 双荧光素酶报告基因检测 取下游TAB2 3′-UTR插入pGL3双荧光素酶miRNA靶表达载体,采用聚合酶链式反应(PCR)扩增miRNA-let-7-5p的3′-UTR及其突变的3′-UTR,形成目标突变体。人主动脉内皮细胞(HAEC,2×104cells/well)分3份接种于12孔板,静置至细胞密度达80%左右时,转染荧光素酶报告质粒。使用Lipofectamine 2000转染试剂盒将miRNA-let-7-5p模拟物或对照组(50 nmol/L)和报告质粒(100 ng/mL)共转染至HAEC中。转染36 h后测定荧光素酶活性。
1.6 AS动物模型的构建 实验组以高脂饲料(脂肪21.8%、胆固醇1.25%、标准饲料76.95%)喂养,对照组采用普通饲料喂养,每只小鼠5 g/d,早晚各饲养1次,小鼠喂养1周后随机取1只处死,取小鼠主动脉根部至主动脉弓部的血管,常规脱水,石蜡包埋并切片,通过苏木精-伊红(HE)染色观察AS程度(镜下可见血管内膜增生与明显的脂质条纹突起为成功标记)。
1.7 动物分组和给药方法 将小鼠随机分为正常对照组、AS模型组、AS模型+益气活血化痰方组。建模成功后第1周,AS模型+益气活血化痰方组开始给予益气活血化痰方干预,按照动物与人体间的等效剂量换算[6],以等效剂量为标准,按照每20 g小鼠给予1 mL,给予益气活血化痰方浸膏水溶剂生药量为14.14 g/kg。正常对照组和AS模型组给予等量蒸馏水。小鼠每日定时灌胃1次(3周为1个疗程),每疗程干预后停止给药1周,共干预3个疗程。
1.8 基因芯片筛选 小鼠大动脉组织基因芯片筛选:按上述方法,从正常对照组、AS模型组、AS模型+益气活血化痰方组中每组随机抽取3只小鼠的大动脉组织切片,筛选后续基因芯片。
基因芯片筛选方法:提取总RNA,用变性琼脂糖凝胶电泳检测RNA的完整性,按照顺序依次标记合格RNA后,再结合miRNA芯片杂交,经过洗脱和离心,得到干燥芯片。应用高分辨率芯片扫描仪采集图像,Genepix Pro 6.0分析数据输出至Excel中,使用局部回归方法扣除背景值,LOWESS方法进行数据归一化处理,采用平均连接和欧氏距离的层级法进行聚类分析,后进行靶基因预测及基因本体(GO)和Pathway富集分析。

2 结 果
2.1 外泌体的鉴定 用SBI抽提试剂盒提取巨噬细胞RAW 264.7与AS模型细胞培养基中外泌体,后用Western Blot法检测外泌体表面标记物CD63及CD81的蛋白表达水平鉴定外泌体(见图1),对照组(RAW264.7+PBS)与AS模型组细胞上清液中CD61与CD81几乎没有表达,而对照组(RAW264.7+PBS)与AS模型组提取的外泌体中CD61与CD81均高表达。表明外泌体提取成功。

图1 Western Blot法检测外泌体表面蛋白标记物CD61与CD81的表达情况
2.2 外泌体 miRNA qPCR Array与生物信息学分析 外泌体内含miRNA,通过检索3个与AS相关的数据库,发现有12个miRNA共存在于这3个数据库(见图2)。通过芯片分析这12个miRNA在外泌体中的表达(见图3),与对照组相比,外泌体组有4个miRNA(miRNA-885、miRNA-21、miRNA-451与miRNA-let-7-5p)表达异常。外泌体与HAEC共培育后,RT-qPCR检测miRNA表达(见表1),与HAEC组相比,在外泌体与HAEC共培养组仅有miRNA-let-7-5p显著表达。因此,选择miRNA-let-7-5p作为后续的调控机制进行研究。

图2 生物信息学分析AS相关的miRNA
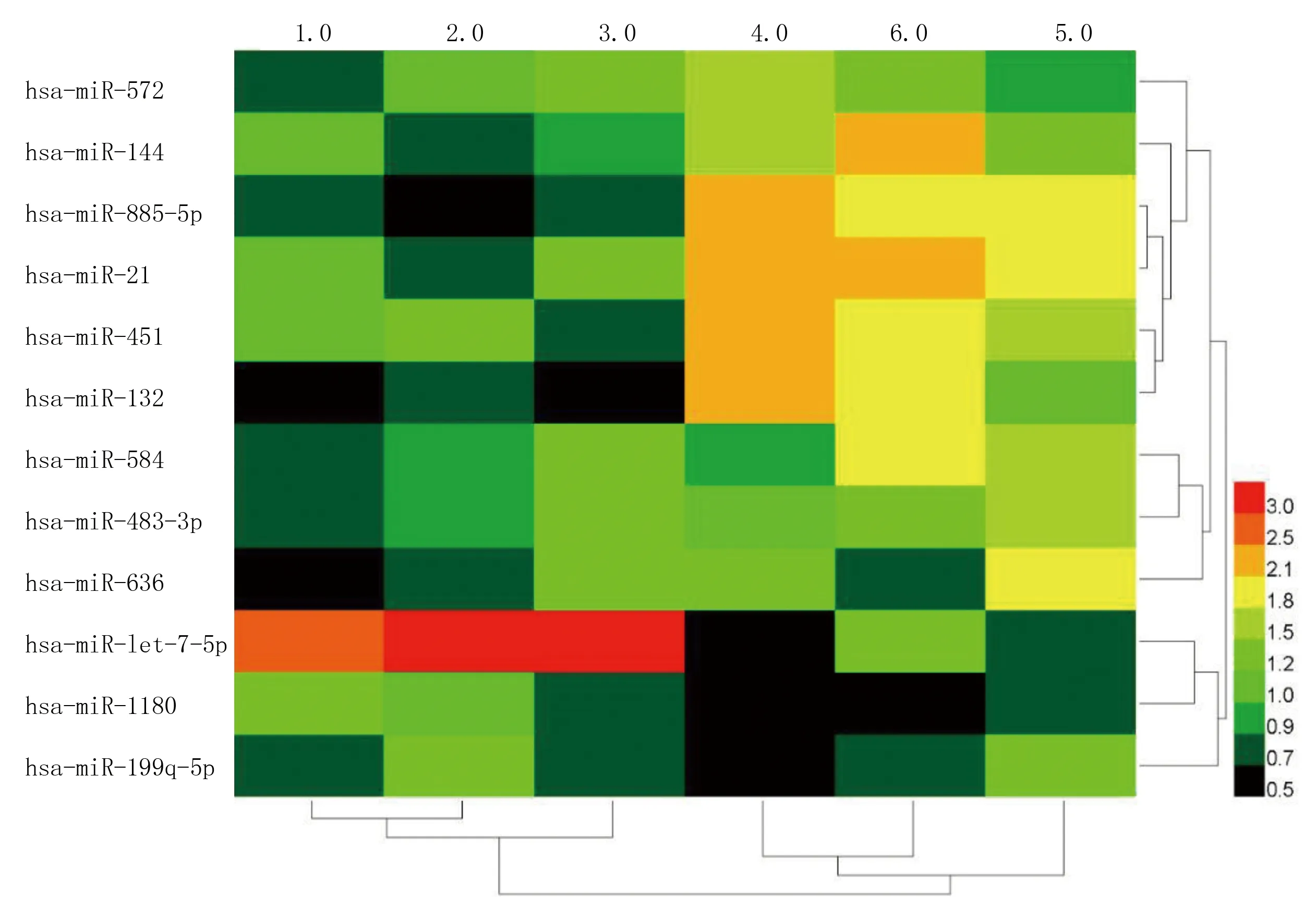
图3 芯片分析miRNA的表达差异(图中miR即miRNA)

表1 miRNA在HAEC和外泌体+HAEC中的表达差异(±s)
2.3 明确外泌体中差异表达的miRNA-let-7-5p对靶基因TAB2的调控机制 采用生物信息学剖析差异miRNA调控的靶向基因。运用双荧光素酶报告基因方案验证差异miRNA与预测的靶向基因之间联系(见表2),TAB2为miRNA-let-7-5p的靶基因。进而探究miRNA-let-7-5p对TAB2的调控关系,过表达miRNA-let-7-5p后采用Western Blot法验证TAB2在HAEC中表达(见图4),HAEC内过表达的miRNA-let-7-5p抑制了TAB2的表达。
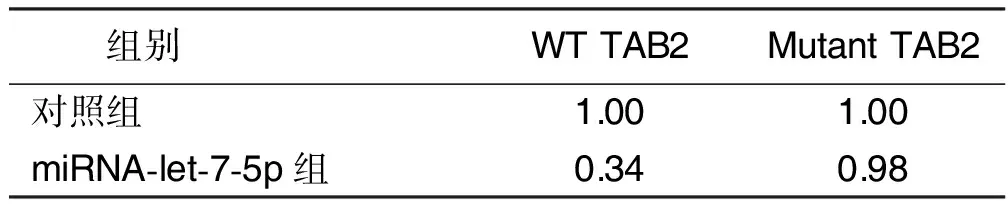
表2 双荧光素酶基因报告检测miRNA-let-7-5p的靶基因(Rluc/Luc比值)
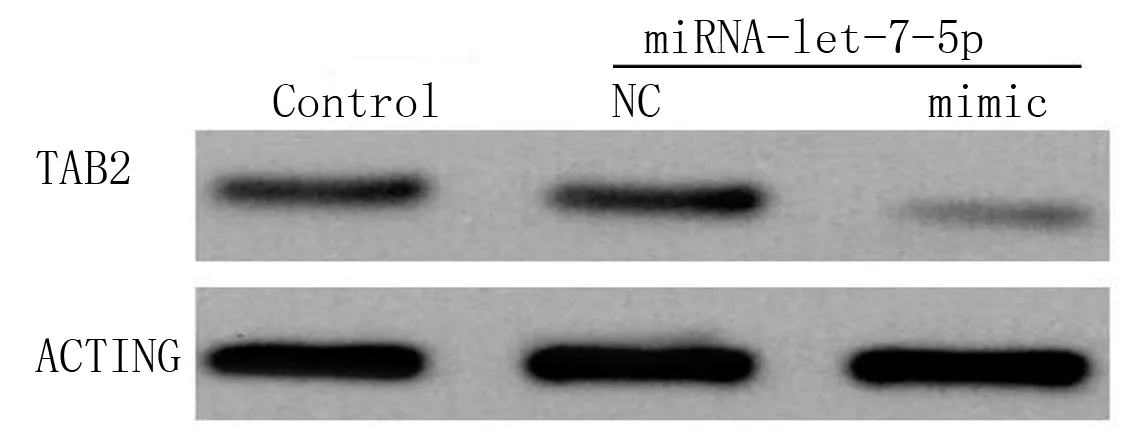
图4 Western Blot法检测miRNA-let-7-5p对TAB2的调控作用(Control为主动脉内皮细胞+miRNA等量安慰剂组;NC为主动脉内皮细胞组;mimic为miRNA-let-7-5p模拟组)
2.4 动物模型大动脉组织基因芯片筛选 通过筛选AS模型组、AS模型+益气活血化痰方组大动脉组织基因芯片,寻找差异性基因,发现miRNA-let-7-5p为具有差异性miRNA(见图5)。其中差异基因mRNA的Pathway分析结果显示,差异mRNA参与的通路中存在与炎症反应相关的核转录因子-κB(NF-κB)通路,并且NF-κB通路中TAB2是主要的目标mRNA(见图6)。

图5 AS模型+益气活血化痰方组与AS模型组差异miRNA筛选
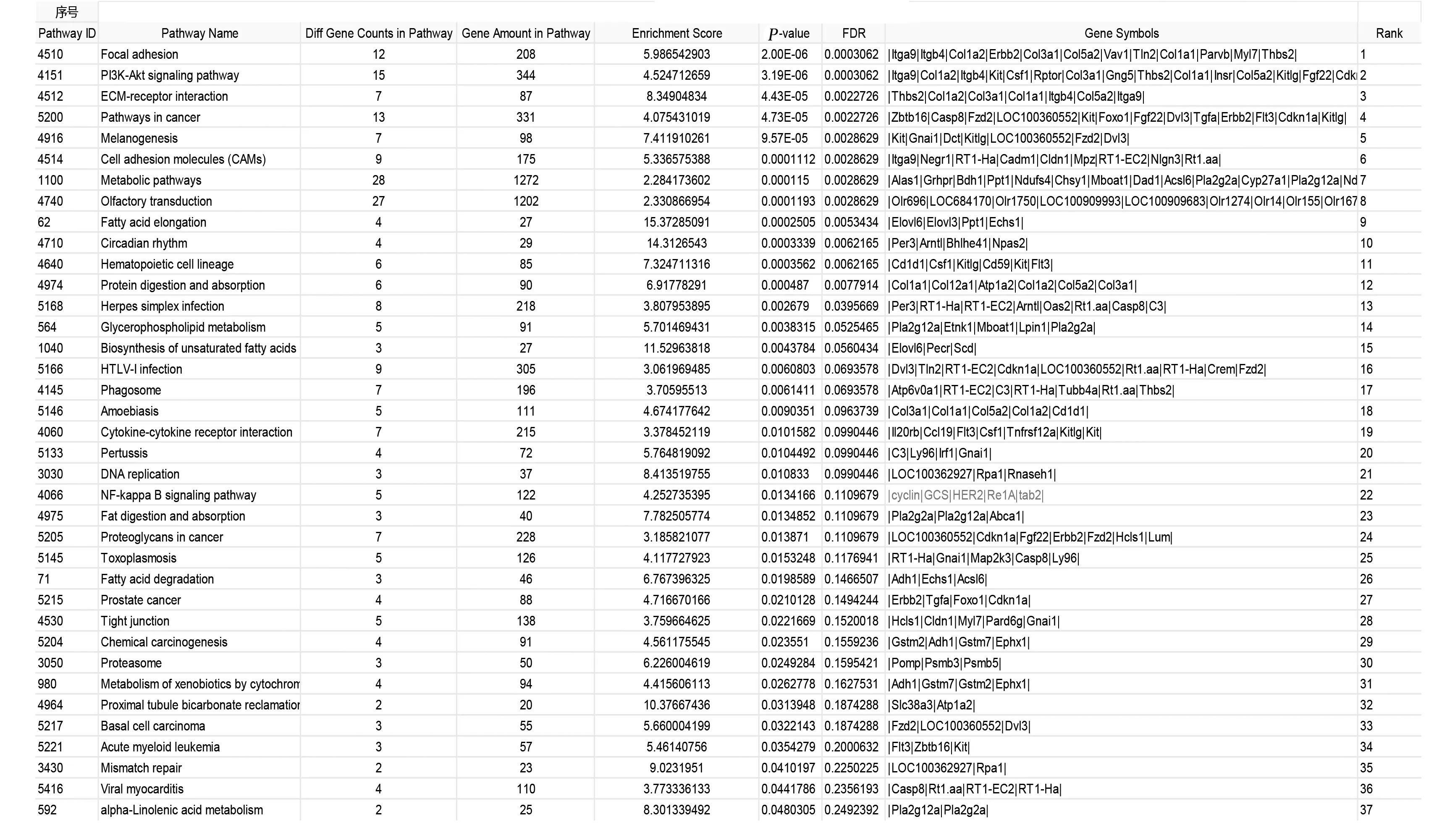
图6 AS模型+益气活血化痰方组与AS模型组差异mRNA参与的通路
3 讨 论
据以往统计,缺血性疾病名列全世界死亡原因前茅[7],其最主要的病理基础为AS。众多研究结果认为AS的形成和发展进程本质上是一种血管内皮慢性炎症反应,其中包括:①血管内皮细胞(endothelial cell,ECs)在一些损伤因素的影响下活化,释放多种炎性因子进入外周血循环;②经过各种细胞因子的刺激诱导,外周血中单核细胞向巨噬细胞转化、增殖,从而引导ox-LDL聚积形成泡沫细胞;③而平滑肌细胞(vascular smooth muscle cell,VSMCs)刺激后逐步生成纤维帽,随泡沫细胞的汇集而坏死崩解构成粥样斑块[8-12]。由此可见,在AS的进展过程中,巨噬细胞和内皮细胞作用关键。
研究显示,体内的大多数细胞均能分泌直径为50~150 nm的微囊泡即外泌体,其携带mRNA、miRNA、lncRNA和蛋白质等内容物,在细胞间起通讯介质的作用,进而介入绝大部分生理和病理过程[13],被认为是除接触依赖信号传导和可溶性分子介导传导外,最新发现的第3种细胞间信息传递形式[14]。有文献报道,在AS发生过程中,巨噬细胞来源的外泌体携带大量促炎miRNA(miR-19、miR-21、miR-133、miR-155)等[15]。另有文献报道,巨噬细胞遭刺激后,其外泌体中miR-150的分泌增加,从而调控C-Myb蛋白表达,加强内皮细胞迁移。与此同时,AS病人血中分泌的外泌体中亦富含miR-150,这些外泌体与健康人外泌体对比,更能够增进内皮细胞的迁移[16]。通过外泌体的形式进入内皮细胞促进细胞凋亡和迁移,证实miRNA可以诱发AS发生[17]。
本研究首先通过细胞实验成功提取巨噬细胞外泌体。然后通过检索3个与AS相关的数据库,获得12个miRNA共存在于这3个数据库。然后通过芯片分析这12个miRNA在外泌体中的表达,发现外泌体组有4个miRNA(miRNA-885、miRNA-21、miRNA-451与miRNA-let-7-5p)表达异常。进一步将外泌体与HAEC共培育后,发现只有miRNA-let-7-5p在外泌体与HAEC共培育组中显著表达。这充分表明miRNA-let-7-5p可能参与AS中外泌体与内皮细胞的调控过程。随后,运用双荧光素酶报告基因实验,进一步验证TAB2为miRNA-let-7-5p的靶基因,且在HAEC中过表达miRNA-let-7-5p抑制了TAB2的表达。
Dai等[18-19]在体外细胞试验中证实miR-199a-3p可以抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)。在AS过程中,血管内皮生长因子可由巨噬细胞等多种血管壁细胞产生并释放,作为重要的细胞因子刺激巨噬细胞吞噬功能的激活、血管内皮细胞的翻转、血管平滑肌细胞的转型和迁移等过程。研究发现,miRNA-let-7-5p能够大幅度下调经γ-干扰素(IFN-γ)激活的巨噬细胞中促炎症细胞因子,以及中度下调经白细胞介素-4(IL-4)激活的巨噬细胞中部分抗炎细胞因子的产生,这也可能是其发挥抗AS作用的一种新机制。而多项研究发现,TAB2能通过阻断NF-κB激活和血管炎症延缓AS进展[20-21]。这些均提示miRNA-let-7-5p可能通过靶向调控TAB2发挥抗AS作用。
本研究通过与前期预实验益气活血化痰方干预过的小鼠大动脉组织芯片进行比对,寻找差异性基因结果发现,miRNA-let-7-5p和TAB2均为差异性基因。提示益气活血化痰方可能通过巨噬细胞外泌体miRNA-let-7-5p/TAB2的信号通路发挥抗AS作用,但其具体调节机制尚需更深入的研究来证实。
