CYP2C19基因多态性与脑梗死患者氯吡格雷反应性的关系
2022-03-25董露露凌静胡楠杨旭萍邹素兰蒋艳
董露露,凌静,胡楠,杨旭萍,邹素兰,蒋艳
脑梗死又称为缺血性脑卒中,是指由于各种原因导致的脑部血液供应障碍而导致机体出现的相应神经功能缺损的临床综合征,一般多发于50岁以上人群,研究[1]证实抗血小板治疗可有效降低缺血性卒中患者的复发风险。氯吡格雷是一种血小板二磷酸腺苷(Adenosine diphosphate,ADP)受体拮抗剂,它可以有效减少血小板的黏附和聚集[2]。作为最常用的抗血小板药物之一,无论是在脑梗死急性期、预防早期复发还是二级预防以及支架植入后预防支架内血栓形成等方面均发挥着重要作用。然而,在临床实践中,部分患者虽然规范服用氯吡格雷,但临床疗效却并不十分理想。由于氯吡格雷是一种无活性的前体药物,需经肝脏P450系列酶代谢后才能转化为活性成分,而CYP2C19基因编码的蛋白酶是影响氯吡格雷代谢的关键酶,因此部分学者[3]认为CYP2C19基因多态性与氯吡格雷的反应性关系密切,CYP2C19基因多态性可能是导致氯吡格雷临床反应变异性的重要原因,目前对于CYP2C19基因多态性与氯吡格雷的反应性关系尚存在争议[4-5]。本研究以江苏省常州市第一人民医院232例急性脑梗死患者为研究对象,验证CYP2C19基因多态性与急性脑梗死患者氯吡格雷反应性的关系,为临床通过基因检测与血栓弹力图检测指导脑梗死患者氯吡格雷的个体化用药治疗提供依据,现报告如下。
1 资料与方法
1.1 一般资料 经医院伦理委员会批准同意,选取2018年7月—2019年7月常州市第一人民医院神经内科收治的急性脑梗死患者232例为研究对象。232例患者根据CYP2C19基因代谢型分成EM组(90例,38.8%)、IM组(95例,40.9%)和PM组(47例,20.3%)。3组患者的在性别、年龄、体质量、吸烟饮酒史、合并基础疾病、临床用药及生化指标等一般资料方面差异均无统计学意义(P>0.05),具有可比性。见表1。
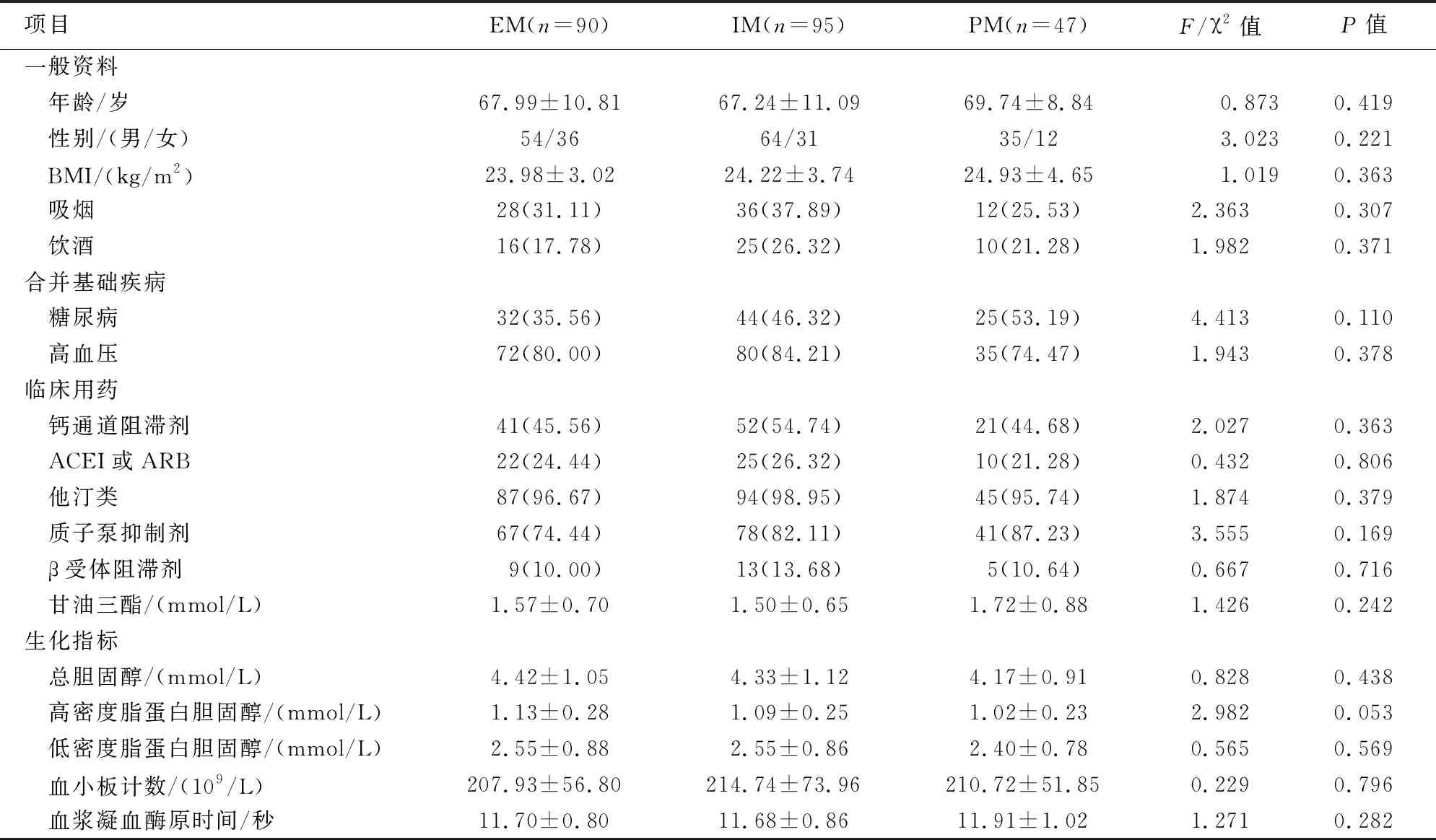
表1 3组不同基因型分组脑梗死患者一般资料比较
1.2 纳入标准 (1)汉族,首次发病,经头颅CT或MRI证实为脑梗死,诊断标准参照《中国急性缺血性脑卒中诊治指南》[6](2014版);(2)发病3 d内入院治疗,既往无氯吡格雷服用史,美国国立卫生研究院卒中量表(NIHSS)评分在4~20分[7]。
1.3 排除标准 (1)存在氯吡格雷应用禁忌证,凝血功能异常或其他出血性疾病;(2)短暂性脑缺血发作,严重心功能不全,肝肾功能不全;(3)入院前1月内应用其他抗血小板聚集药;(4)合并肿瘤、免疫系统疾病、严重贫血、感染性疾病等。
1.4 方法 所有患者入院后,均予硫酸氢氯吡格雷片(赛诺菲圣徳拉堡民生制药有限公司,国药准字J20180029)治疗,首次给予负荷剂量300 mg,随后给予维持剂量75 mg/d,连续服用时间需超过7 d,收集患者年龄、性别、饮酒史、吸烟史、用药史等病史资料及血脂等数据。
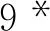
1.6 血栓弹力图检测血小板抑制率 患者口服氯吡格雷7 d后,晨起空腹,采集外周静脉血2~3 mL,利用血栓弹力图凝血分析仪5000(TEG5000,Haemoscope,美国)及其配套试剂,采用TEG软件以ADP为激活剂计算氯吡格雷的血小板抑制率。本研究中血小板抑制率的参考范围为30%~90%,将血小板抑制率小于30%定义为氯吡格雷低反应性,30%~90%为正常反应性,大于90%为高反应性[8]。
2 结果
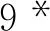

表2 232例脑梗死患者CYP2C19基因型及等位基因的频率分布
2.2 CYP2C19基因型与血小板抑制率的关系 3组氯吡格雷血小板抑制率中位值EM组显著高于IM组和PM组,差异有统计学意义(P<0.05),IM组和PM组比较,差异无统计学意义(P>0.05)。见表3。

表3 不同CYP2C19基因型血小板抑制率的比较
2.3 不同CYP2C19基因型患者氯吡格雷反应性达标情况比较 以血小板抑制率在30%~90%内即氯吡格雷正常反应性为氯吡格雷反应性达标,达标率情况为EM组高于IM组和PM组,差异具有统计学意义(P<0.05)。IM组和PM组比较,差异无统计学意义(P>0.05)。见表4。
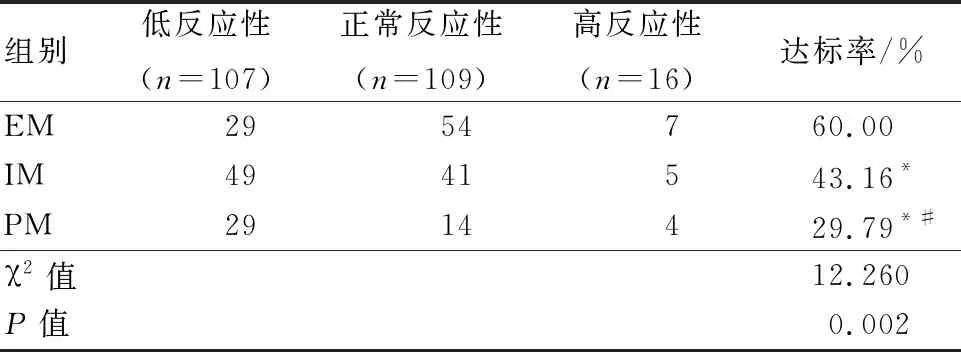
表4 CYP2C19基因多态性与氯吡格雷反应性的关系
3 讨论
综上,本研究认为脑梗死患者氯吡格雷反应性可能与CYP2C19基因多态性有关,CYP2C19基因多态性可能会对氯吡格雷抗血小板效果产生影响,提示临床医生在实践中可根据CYP2C19基因型为脑梗死患者制定个体化用药方案,对于CYP2C19基因型为慢代谢型的患者,可考虑增加氯吡格雷剂量或更换其他抗血小板药物,以最大程度确保疗效并规避不良事件的发生。本研究同时具有一定的局限性,有待于今后多中心、大样本及前瞻性的实验研究进一步验证。
