免疫衰老影响牙周炎细胞免疫的研究进展
2022-03-25姚燕子刘建国周学东
姚燕子,胡 欢,王 倩,刘建国,周学东,4∗
(1.遵义医科大学口腔医学院,贵州 遵义 563000;2.贵州省普通高等学校口腔疾病研究特色重点实验室暨遵义市口腔疾病研究重点实验室,贵州 遵义 563000;3.贵州省普通高等学校微生物资源与药物开发特色重点实验室,贵州 遵义 563000;4.口腔疾病研究国家重点实验室,国家口腔疾病临床医学研究中心,四川大学华西口腔医院牙体牙髓病科,成都 610041)
牙周炎(periodontitis)是最常见的口腔感染性疾病,以牙龈炎症、牙周袋形成、牙槽骨吸收和牙齿松动为特征,是加重或诱发全身系统性疾病的主要口腔疾病,严重危害患者的口腔和全身健康[1]。在2009至2012年的美国健康与营养调查资料中显示,成年人(≥30岁)的牙周炎患病率为46%,且患病可能性随年龄增长而稳步增加[2]。最新研究发现牙周炎易感性随衰老而变化,同时牙周组织破坏程度也与年龄相关[3]。“与年龄相关的易感性(agerelated susceptibility)”学说认为,随年龄增长免疫系统失调或免疫衰老会引起牙周炎的易感性增加[4]。本文在查阅相关文献的基础上,从免疫细胞如何进行免疫应答来讨论免疫衰老对牙周炎易感性和组织破坏程度的影响。
1 衰老和免疫衰老
衰老(aging or senescence)又称为老化,是生命过程中整个机体的形态、结构和功能逐渐衰退现象的总称,其中胸腺、脾等免疫器官衰退和免疫细胞重塑而造成的先天性免疫和适应性免疫的改变被称为“免疫衰老(immunosenescence)”,表现为胸腺退化,循环单核细胞和树突状细胞数量的改变,吞噬活性降低,外周血幼稚细胞数量减少,而记忆细胞数量相对增加,T、B细胞库多样性受限,T细胞亚群失衡,抗体产生减少等特征[5-9]。这些变化最终导致对新抗原反应能力减弱,而自身抗原应答亢进,以及免疫监视失调,表现出个体对许多自身免疫性、感染性和炎症性疾病的易感性增加,导致老年人患感染的敏感性增加,接种疫苗的效力降低等[10-11]。目前多种生理现象已被提出来解释免疫衰老的发生机制,包括长期暴露于抗原、端粒酶活性受损、线粒体功能障碍、自噬缺陷、内质网应激、表观遗传学改变、年龄相关的肠道菌群变化等[12-16]。同时,大量研究表明遗传、营养、生活方式(如体育锻炼、饮食习惯)、慢性病毒感染等多因素也会影响着免疫系统的衰老水平[17-20]。
近年来,免疫衰老促进年龄相关疾病的发展和临床进展的研究备受关注,如肿瘤、阿尔兹海默症、类风湿性关节炎、心血管疾病、代谢疾病等,探讨免疫衰老及其在发病机理中的作用和机制可能是治疗此类疾病和药物开发前景的依据[21-23]。牙周炎作为一种慢性炎症性疾病,流行性调查和临床检查都表现出其患病率和组织损伤随年龄增长而增加。同时对年轻人和老年人进行临床牙龈炎评估与活检样本测定来看,两者之间存在大量的免疫学差异[24]。由此推测牙周炎年龄相关性的变化可能与免疫衰老有关。
2 免疫衰老与牙周炎
牙周组织长期暴露于口腔微生物中,免疫系统不断地识别、监视入侵者,并与其共存以维护牙周稳定,包括多种免疫细胞参与(见图1)[25]。当病原菌及其代谢产物逃避免疫防御,引起一系列免疫反应,则会造成牙周组织的直接损伤;另外由病原因子持续性破坏引起的变态反应,亦可导致牙周组织的继发性损伤[26]。牙菌斑生物膜是牙周炎的始动因子,但宿主的免疫反应影响疾病的进展和组织损伤程度。然而随着机体老化,宿主先天性免疫和适应性免疫都经历着变化,其抵御感染的能力受损,先天免疫介导的炎症反应程度和持续时间增强,细胞介导的免疫功能和抗体介导的免疫应答下降[27-28]。这一变化影响牙周炎的易感性和牙周组织的破坏程度。显而易见,老年人先天性免疫和适应性免疫的免疫衰老变化可能影响着牙周炎的发生和发展。
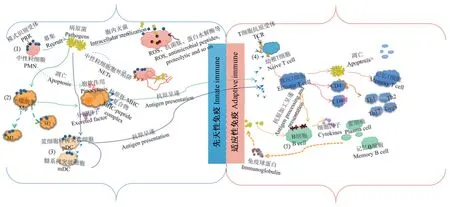
图1 免疫细胞对病原菌的防御作用Figure1 Mechanisms of immune cells defense against pathogens
2.1 先天性免疫
先天性免疫又称固有免疫,由不同的细胞和因子组成,是抗感染的第一道防线,机体通过识别病原菌直接抵御微生物对宿主的侵袭。固有免疫细胞,包括中性粒细胞、巨噬细胞、树突状细胞等,其效应功能的许多方面都随年龄增长而变化。
2.1.1 中性粒细胞
伴随微生物的入侵,循环中性粒细胞通过白细胞黏附级联反应迁移到血管外,随后迅速募集到牙周感染部位形成屏障,阻止细菌侵入更深的组织。白细胞黏附缺陷综合征-I型(leukocyte adhesion deficiency-I,LAD-I)相关的牙周炎是由白细胞粘附和迁移障碍引起的侵袭性发展的牙周炎症,对抗生素和/或机械刮除牙菌斑治疗均无效,这证明牙周组织中性粒细胞的成功募集对于牙周组织防御病原菌入侵有重要作用[29-31]。中性粒细胞的迁移取决于协调良好的黏附级联反应,包括β2整合素如淋巴细胞功能相关抗原1(lymphocyte functionassociated antigen1,LFA-1)与内皮拮抗受体如细胞间粘附因子(intercellular adhesion molecule,ICAM)的相互作用[32]。内皮发育调节基因1(developmental endothelial locus-1,Del-1)是由内皮细胞分泌的胞外基质,通过与整合素LFA-1的结合,阻止依赖于LFA-1的白细胞与内皮细胞表面的相互作用,从而负性调节中性粒细胞外渗到炎症部位[33]。Eskan等[34]对老龄小鼠(≥18个月)牙周组织分析发现Del-1mRNA及其蛋白质表达量较年轻小鼠低,这会引起中性粒细胞过多募集和炎性骨吸收。中性粒细胞通过细胞粘附分子与内皮细胞接触和黏附,而后向内皮细胞中迁移的过程称为趋化性,可导致大量中性粒细胞从外周血液主动转移到被攻击部位。有学者提出老年人群血液中中性粒细胞的趋化性明显减弱,可能是年龄相关的膜流动性改变影响脂筏,进而可能导致信号转导和趋化性改变[35];Sapey等[36]的研究发现老年宿主的磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)活性过度或失调,导致中性粒细胞迁移的准确性显著降低。衰老影响中性粒细胞的募集,使牙周组织中性粒细胞稳态失衡,继而造成牙周组织损伤[33]。
当中性粒细胞成功募集到病原菌感染部位后,通过有效地识别、吞入并杀伤和降解病原菌。吞噬作用是一个由中性粒细胞表面模式识别受体如toll样受体(toll-like receptors,TLRs),和/或IgG Fc受体(即FcγR,如FcγRⅡ和FcγR III)介导,诱导微生物主动进入吞噬小体的过程[37]。吞噬小体的形成涉及肌动蛋白细胞骨架的调节。在衰老过程中肌动蛋白聚合反应改变和关键吞噬作用受体FCγ受体(CD16)显著减少,都是可能造成中性粒细胞吞噬能力及效率降低的重要原因[38]。细菌一旦被吞噬至胞内,中性粒细胞将迅速释放蛋白水解酶、抗菌肽和活性氧杀菌[39]。而老年人较年轻人具有更高的活性氧(reactive oxygen species,ROS),过多的ROS释放会产生氧化应激,氧化应激伴随着牙槽骨附近细胞因子水平的升高可以激活叉头框蛋白O3(forkhead box protein O3,FOXO3)和Wnt信号通路,进而触发RANKL介导的骨吸收[37,40-41]。
除了胞内灭菌,中性粒细胞还通过脱颗粒,在胞外形成中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs),这是一个由含组蛋白的DNA骨架、髓过氧化酶、嗜中性粒细胞弹性蛋白酶和乳铁蛋白等颗粒衍生的肽和酶组成的胞外纤维网[42]。NETs捕获胞外病原体并固定,通过局部高浓度抗菌物质清除龈沟内病原菌及其代谢产物来保护牙龈;也可作为阻止细菌继续扩散的物理屏障[42-43]。牙周病原菌通过胞外核酸酶降解NETs,导致致病性增加;慢性肉芽肿疾病不依赖NADPH途径产生NETs使这些患者不易患牙周炎;ELANE基因突变的患者可能因为不能形成NETs,而多数患有侵袭性牙周炎,这些均提示我们NETs对于维持牙周健康必不可少[44-45]。Xu等[46]研究发现老年小鼠的中性粒细胞发生自噬相关蛋白ATG5缺陷相关的自噬水平降低,导致释放NETs能力受损。Hazeldine等[47]通过白细胞介素-8(interleukin-8,IL-8)或脂多糖(LPS)体外刺激中性粒细胞,可见健康老人NETs的形成明显减少,并且将老年和年轻两组牙周炎患者的中性粒细胞暴露于次氯酸,同样发现老年组的中性粒细胞释放的NETs显著减少,可见老年人中性粒细胞的NETs形成受损。
中性粒细胞是牙周炎免疫反应的主要细胞,是清除病原菌及其代谢产物的基础。衰老可能导致中性粒细胞功能失调,造成清除细菌障碍,使宿主反应与菌群失衡,增加炎症的易感性,使牙周炎发生易感、病程发展易加重。
2.1.2 巨噬细胞
巨噬细胞是单核细胞移行到组织后分化成熟的吞噬细胞,通过胞饮作用、吞噬作用和受体介导的胞吞作用摄取抗原呈递给淋巴细胞。巨噬细胞的胞饮作用可吞噬凋亡中性粒细胞,维持机体内中性粒细胞稳态。Aprahamian等[48]发现老年小鼠的巨噬细胞对于凋亡细胞的胞饮作用受损,造成凋亡细胞的积累,可影响宿主的自身免疫反应,这一现象与随年龄增长而积累的免疫复合物、细胞因子和氧化低密度脂蛋白有关。巨噬细胞强大的吞噬作用是通过表面特异受体如TLRs识别病原体,引起局部肌动蛋白细胞骨架聚合形成伪足来包裹颗粒。多项研究表明增龄造成巨噬细胞TLRs功能改变,内毒素耐受能力降低,可能引起老年人不可控制的牙周炎症[49-50]。Liang等[51]在高龄小鼠的巨噬细胞表面发现放大炎症的受体(C5aR和TREM-1)的表达增加,这可能是衰老相关的高炎症状态的原因之一。在病原体诱导下,巨噬细胞分泌一系列细胞因子和趋化因子参与免疫反应。Shaik-Dasthagirisaheb等[52]的研究发现衰老造成巨噬细胞产生中性粒细胞趋化蛋白KC、巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)等趋化因子和NO等细胞因子的能力显著降低,以及白介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)等先天免疫介质的表达也呈减弱趋势,而前列腺素E2(prostaglandin E2,PGE2)等细胞因子则无变化,表明衰老可减弱骨髓巨噬细胞对牙龈卟啉单胞菌的免疫反应。
巨噬细胞摄入病原体、外毒素或胞内蛋白分子等抗原,通过去折叠和蛋白酶水解等过程将其降解为多肽片段,合成抗原肽-MHC复合物。该复合物表达于细胞表面,然后被递呈给淋巴细胞,诱导免疫反应和调节免疫应答。Gonzalez等[53]通过对不同年龄牙龈组织中发生抗原处理和提呈的基因进行转录组测序分析,发现老化的健康牙龈组织中MHC-Ⅱ途径(外源性抗原途径)的基因表达显著增加,包括IFI30、CD74、CTSS等;相反,MHC-Ⅰ途径(内源性抗原途径)基因表达下调;此外,胞浆抗原的蛋白质加工相关的热休克蛋白HSP90表达量也减少,这些变化提示我们老化的健康牙龈组织主要通过MHC-Ⅱ途径进行抗原呈递。
在微生物和微环境的刺激下,诱导巨噬细胞表型极化为M1型和M2型,M1型为经典活化巨噬细胞参与促炎反应,在防御病原体感染中发挥核心作用;M2型巨噬细胞即替代性活化的巨噬细胞,主要促进Th2型免疫应答,参与组织重构、促进机体的抗炎反应[54]。巨噬细胞表型极化可能是监测牙周炎活动性、调节高危患者对龈下生物膜的免疫反应和减少牙槽骨丢失的关键指标[55]。Yang等[56]发现巨噬细胞亚群的相对失衡可能会影响并加剧牙周炎症,而M2亚群的倾斜将有利于炎症的缓解,并认为M1/M2比值可帮助我们了解牙周组织健康状况。Gonzalez等[50]发现在健康老年牙周组织中,巨噬细胞浸润/分化/成熟的模式倾向于增加炎症和组织破坏性巨噬细胞M1,当受到微生物刺激时,可能会增强牙槽骨吸收的易感性和破坏程度。
2.1.3 树突状细胞
树突状细胞(dendritic cells,DC)是一组异质细胞群,根据功能和表型外周血树突状细胞分为浆细胞样树突状细胞(plasmacytoid DC,pDC)和髓系树突状细胞(myeloid dendritic cell,mDC)。mDC在外周捕获抗原,然后迁移到淋巴器官以启动免疫应答;pDC在胸腺髓质和淋巴结T细胞区域协助抗病毒反应[57]。Pérez-Cabezas等[58]通过检测18~65岁健康人群的血液样本,发现外周血中树突状细胞的绝对数量伴随衰老发生变化,pDC功能受损和数量减少,这可能是老年人感染易感性增加的原因之一。
树突状细胞是口腔黏膜的哨兵,外周未成熟树突状细胞通过表达各种模式识别受体(pattern recognition receptor,PRR)捕获、加工牙周组织微生物、凋亡细胞等刺激淋巴细胞活化增殖。其中TLRs是关键受体家族,通过识别不同的病原体相关分子模式(pathogen associated molecular pattern,PAMP)产生细胞因子调节T细胞亚群的分化[59]。有效的抗原捕获是树突状细胞免疫反应的关键,Agrawal等[60]研究发现PI3k激酶信号通路中AKT激酶的激活减少可能削弱树突状细胞的吞噬能力。衰老削弱了TLRs的功能和表达,影响细胞因子的分泌,使活化T细胞能力受损,影响T细胞亚群的分化[61-62]。DC功能的改变共同导致了老年人的免疫功能障碍和慢性炎症的发展。
朗格汉斯细胞(Langerhans cell,LC)是口腔黏膜上皮中树突状细胞家族的一员,在牙周病的发生和维持中可能起重要作用。Zavala等[63]在健康牙龈中发现上皮内LC的密度随年龄增长而下降,树突状结构的数量和长度均减少,这些形态学改变可能导致树突状细胞功能的丧失和/或反映了免疫功能的异常,这提示我们口腔组织的免疫防御可能在老年时受到损害。Bodineau等[64]研究发现慢性牙周炎老年患者上皮LC数量减少,树突状结构也更短(即表面积减少),在抵御病原菌时,表现出较早的成熟以平衡其较低的上皮内密度和改变的形态。这一变化是否会影响牙周健康需要进一步探索。
树突状细胞是先天性免疫和适应性免疫的桥梁。衰老可能在功能上损害了树突状细胞对抗原的摄取,对凋亡细胞的吞噬,以及T细胞介导的适应性免疫的激活,增加了宿主疾病的易感性和组织破坏程度。
2.2 适应性免疫
当固有免疫应答无法消灭牙周病原菌及其毒力因子时,在抗原呈递和细胞因子作用下机体启动适应性免疫应答。适应性免疫又称获得性免疫或特异性免疫,包括T细胞介导的细胞免疫和B细胞介导的体液免疫。
2.2.1 T淋巴细胞
牙周炎病变早期,牙周结缔组织出现大量T淋巴细胞浸润,提示T细胞介导的细胞免疫在牙周病发病机制中的重要作用。T淋巴细胞来源于骨髓祖细胞,迁移到胸腺成熟后,输出到外周[65]。外周幼稚T细胞表面T细胞抗原受体(T cell receptor,TCR)与抗原相互作用,增殖分化为介导清除感染的效应性T细胞,效应细胞迁移到感染部位清除病原菌。大多数效应T细胞清除病原菌后凋亡,一部分作为长期记忆T细胞持续存在,免受后续感染。随年龄增长,胸腺退化导致TCR多样性降低,幼稚T细胞输出减少,并且经历的抗原刺激增加和已发生的感染有助于幼稚T细胞分化为记忆T细胞,记忆T细胞的比例增加,这直接导致对新抗原反应差的发生率增加,细胞介导的免疫力降低,增加牙周炎复发的风险[65-67]。
T细胞成熟后根据CD分子分为CD4+T细胞和CD8+T细胞。其中在抗原呈递细胞的引导下,CD4+T细胞分化为Th1、Th2、Th17、调节性T细胞(Tregs)等细胞亚群,这些细胞亚群通过形成复杂的细胞因子网络作用于靶细胞,随后介导牙周免疫[68]。有学者提出CD4+T细胞亚群功能分化及相关炎症因子动态平衡在牙周炎的发生及发展过程中发挥重要作用,其平衡和极化状态影响着牙周炎的进展和预后[69]。随年龄增长,以Th1细胞主导的破坏性应答和以Th2细胞主导的保护性应答平衡受到破坏,Th1/Th2平衡向Th1倾斜,可能导致机体疾病的发生和疾病进程的改变[69-71]。Schmitt等[72]发现在衰老过程中健康人群外周血中TH17/Treg比例失衡和细胞因子表达改变都可能导致促炎和抗炎免疫反应之间的失衡,即患炎症性疾病的易感性增加。Su等[73]研究发现在慢性牙周炎的发病过程中,年轻患者的Th17/Treg比值不同于老年患者,这一现象与DC中CD40的差异表达水平相符。Th17/Treg比例失衡会引起RANKL过度表达,导致牙槽骨吸收,并且通过调节Th17/Treg失衡可抑制实验性牙周炎的牙槽骨吸收[74-75]。
CD8+T细胞即细胞毒性T淋巴细胞,在稳态条件下可下调炎症,并在组织损伤情况下启动修复机制维持牙龈组织的完整性,抑制骨破坏细胞因子和修复牙槽骨[76]。Han等[77]发现调节CD8+T细胞通过抑制破骨细胞生成和促进成骨细胞生成可保护牙槽骨免受炎症损伤。Kayar等[78]发现与牙周健康的产妇相比,患有牙周炎的产妇CD8+T细胞增加,并提出CD4+/CD8+比率是宿主防御系统改变的重要指标。Demir等[79]通过比较不同年龄组的健康小鼠,发现较成年小鼠而言,衰老小鼠牙龈组织CD4+T细胞数量随年龄增加没有变化,但CD8+T细胞相对数量增加,CD4+/CD8+比例降低;同时外周血中CD8+T淋巴细胞伴随着年龄的增加而减少,CD4+T淋巴细胞的相对数量增加,CD4+/CD8+比率增加。衰老伴随的这一变化对牙周免疫防御的影响需要进一步的研究。
2.2.2 B淋巴细胞
作为体液免疫的一部分,B淋巴细胞在免疫反应的早期阶段发挥抗原呈递功效。Clark等[80]发现与年轻人相比,老年人B细胞表现出较差的抗原呈递功能。Crawford等[81]提出B细胞抗原呈递功能的缺乏损害效应T细胞分泌细胞因子功能。此外,B淋巴细胞通过产生抗体和细胞因子使宿主对牙周病原菌进行防御[82-83]。
随年龄增长,骨髓中微环境改变,幼稚B细胞生成减少,并且外周成熟B细胞的关键存活因子如B细胞活化因子(B cell activating factor,BAFF)和增殖诱导配体(A proliferation-inducing ligand,APRIL)在血浆中表达水平降低,引起B细胞祖细胞和不成熟B细胞的增殖能力下降,而外周B细胞寿命延长,使B细胞数量几乎没有变化,但B细胞多样性急剧减少,对外来抗原的反应减弱,多样性的丧失直接影响老年人的免疫健康,破坏免疫平衡[84-87]。记忆B细胞具有高度特异性的抗原记忆能力,当同种抗原再次入侵牙周组织时,记忆B细胞迅速转化为效应B细胞并产生更强烈的二次免疫应答。随年龄增长,记忆B细胞尤其是IgD+IgM+CD27+IgM记忆B细胞明显减少,并伴有浆细胞分化能力和Ig合成能力的降低[88]。Ebersole等[89]发现在健康老年牙龈组织和老年牙周炎组织中,B细胞和浆细胞的基因模式发生了改变,大多数变化与细胞的分化/成熟功能有关,特别是与免疫球蛋白多样性有关。
B细胞通过产生抗体分子(也称为免疫球蛋白)来启动体液免疫保护,在生发中心(germinal centers,GC)通过体细胞高频突变(somatic hypermutation,SHM)和类别转换重组(class switch recombination,CSR)机制促进抗体多样化。体细胞高频突变在免疫球蛋白(Ig)重链基因的可变区(variable,V)、变异区(diversity,D)和连接区(joining,J)内引入点突变,编码免疫球蛋白的抗原结合可变区,为抗原筛选高亲和力抗体突变体;同时类别转换重组通过将编码IgM和IgD的Cμ和Cδ基因分别替换为编码IgG、IgA和IgE的Cγ、Cα和Cε基因,在不改变抗原特异性的情况下产生具有新效应功能的抗体[90]。受转录因子E47(由E2A基因编码的碱性螺旋环螺旋蛋白)调控的胞苷脱氨酶(activation-induced cytidine deaminase,AID)在这两个免疫球蛋白基因多样化机制过程必不可少,老年人表现出B细胞E47mRNA的表达量降低,这可能影响了抗体的多样性,使B细胞体液免疫的特异性受损[28]。Ebersole等[91]认为牙周炎患者口腔病原菌的抗体反应的强度与年龄无关,但口腔病原体抗体水平与临床疾病程度之间的关系随年龄而变化,提出老年人群口腔疾病发病率和病情严重程度增加的主要原因可能是抗体质量的改变。这一现象是否与衰老影响抗体多样性有关,需要我们进一步研究。
3 小结及展望
牙周炎是牙菌斑与宿主免疫防御系统间相互作用的结果。免疫衰老引起免疫细胞的一系列复杂的变化(见表1),可能导致免疫细胞无法有效地防御病原菌,从而导致牙周病原菌长期存在,并增加牙周组织中防御细胞的积累,进而造成老年群体牙周炎症易感性和组织损伤程度增加。随着全球老龄化和口腔存留牙数增加,针对老年群体牙周疾病治疗和保健的需求将不断增长。已有大量研究表明牙周炎与冠心病、类风湿关节炎等年龄相关的系统性疾病有关,其可能机制是牙周病原菌及其毒力因子躲过宿主的防御机制进入体循环发生远处传播,同时细菌及其代谢产物引起机体系统性炎性反应的慢性升高,从而影响疾病的发生发展,在这些病程发展中免疫衰老的作用仍需要更多进一步的研究[92-93]。加强对免疫衰老及其在牙周炎中作用的进一步研究有利于我们更全面的认识牙周炎,可能为防治老年人牙周疾病提供潜在的新策略,并为研究年龄相关性系统性疾病提供新思路。

表1 衰老对牙周组织免疫细胞功能的影响Table1 Effects of aging on cellular functions in periodontal tissue
