基于磁共振影像的乳腺癌计算机辅助检测方法综述
2022-03-25聂生东魏传令张小兵
聂生东,魏传令,张小兵
(上海理工大学 健康科学与工程学院,上海 200093)
目前,乳腺癌已超越肺癌,成为全球第一大癌症,其发病率和死亡率在女性中均为首位[1]。从八十年代至今,乳腺癌发病率在中国持续快速上升,同时患病群体表现出年轻化的趋势。乳腺癌严重危害女性健康,早诊断、早治疗能够提高乳腺癌患者生存率。动态对比增强磁共振成像
(dynamic contrast enhancement magnetic resonance imaging,DCE-MRI)可生成多序列、高分辨率影像,能够清晰地分辨乳腺腺体、脂肪、病灶组织,对乳腺癌的诊断具有较高的准确性,可以为乳腺癌检出、分子分型、预测和预后评估等提供参考依据,因此在乳腺癌影像检查方面得到了广泛的应用[2]。
在DCE-MRI 检查中,每病例总计生成图片近千张,各序列示例见图1。如此巨量的图片只靠医生的专业技术和主观经验进行判断,不仅速度慢,还容易产生误诊和漏诊。因此,计算机辅助检测(computer aided detection,CADe)系统正逐渐应用到乳腺癌检测任务中,协助医生进行快速诊断。乳腺癌的准确检测是CADe 系统中至关重要的一步,不仅可以标记影像中的乳腺癌区域,有效减轻医生的工作负担,提升医疗服务质量,还可以为后续的乳腺癌分子分型、预后评估等提供数据基础。此外,CADe 系统还可以对经验不足的医生起到提示参考的作用,在一定程度上能解决偏远地区医疗资源匮乏的问题。
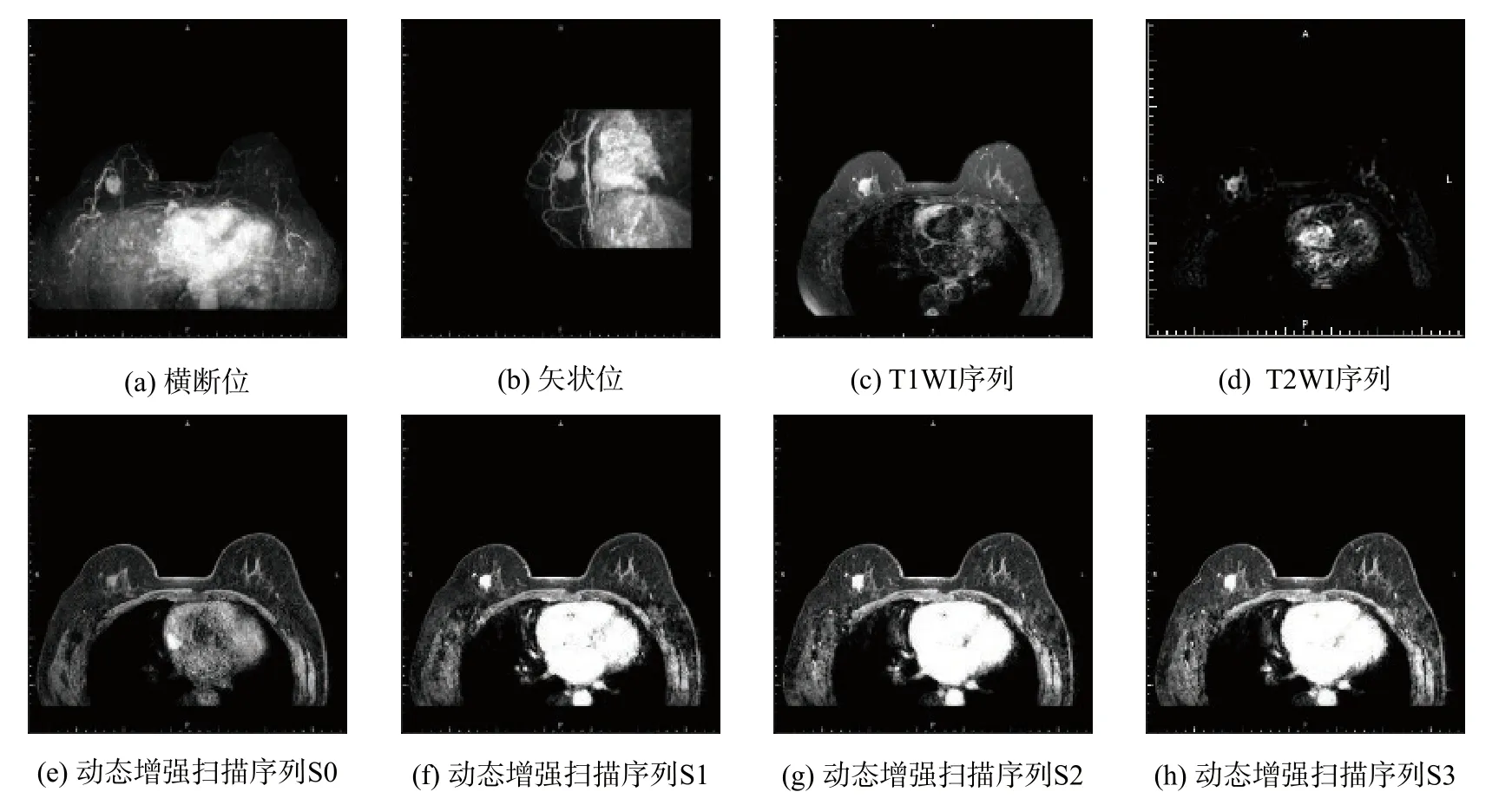
图1 每病例包含的部分MRIFig.1 Part of MR images included in each case
为了高效准确的检测乳腺癌,研究者们提出了许多检测方法,基本流程如图2 所示:首先对原始图像进行预处理,分割出图像中的乳腺区域;再利用传统图像处理方法或深度学习方法检测出可疑的乳腺癌区域;最后得出检测结果。传统图像处理及深度学习方法均取得了较好的效果,也有研究将两者组合应用[3-4]。Rezaei[5]对所有乳腺成像方式的乳腺癌检测分割、分类方法进行概括总结,但是没有详细介绍MRI 计算机辅助检测方法。Chan[2]综述了基于人工智能的计算机辅助诊断(computer-aided diagnosis,CADx)系统在乳腺癌方面的最新成果,但是对乳腺MRI 方面的介绍主要集中在良恶性分类及乳腺分割等,依然没有对乳腺癌检测方法进行总结。因此,本文通过研读大量相关文献,总结了近年来国内外基于MRI 的乳腺癌计算机辅助检测方法,分别从传统方法及深度学习方法两个方面进行综述;最后对乳腺癌检测技术的现有问题和未来发展方向进行总结与展望,为正在探索乳腺癌检测领域的研究者们提供一定的参考。
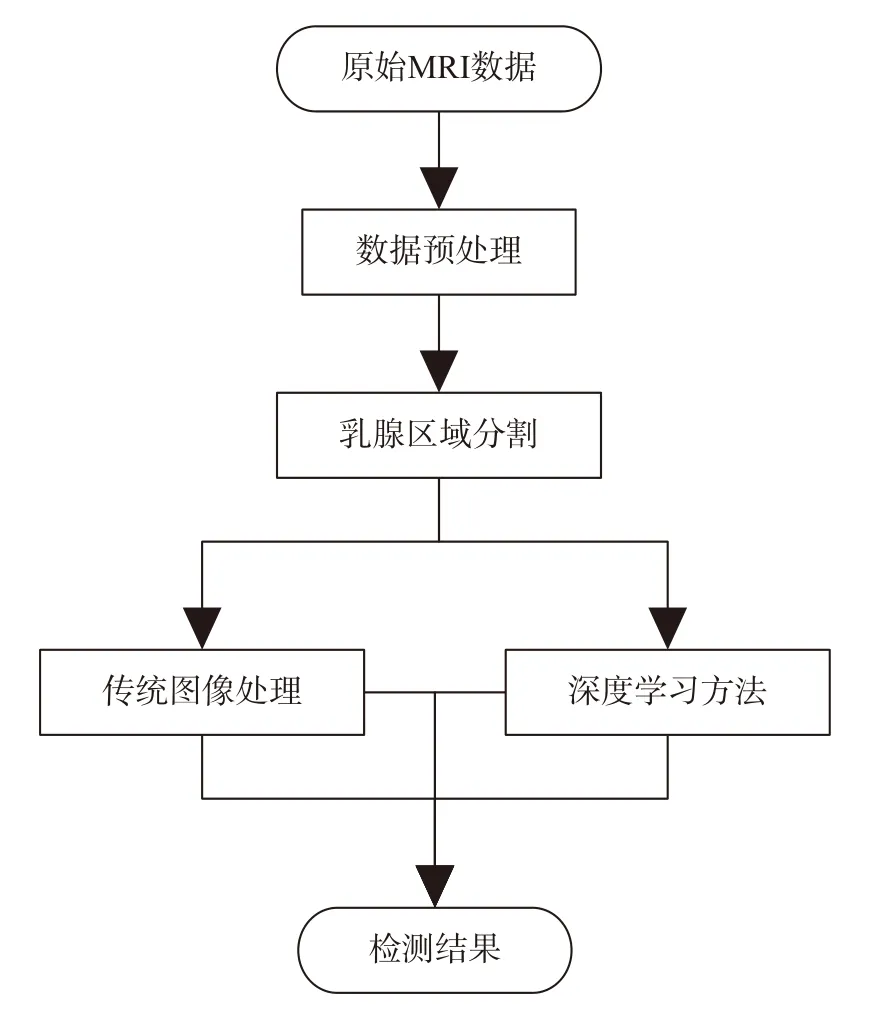
图2 乳腺癌检测流程Fig.2 Breast cancer detection process
1 传统乳腺癌检测方法
在磁共振图像中,乳腺癌常表现为类圆形、分叶状或不规则形的区域,区域边缘特点为光滑、不规则或星芒状。在磁共振的不同序列中,乳腺癌区域的信号特点也不同:在T1WI 中多表现为等或低信号(图像中相应区域灰度值较低),在T2WI 抑脂序列及动态增强序列中则表现为高信号(图像中相应区域灰度值较高)。传统乳腺癌检测步骤如图3 所示,通常包含图像预处理、乳腺区域分割、可疑肿瘤区域提取、特征提取和分类判断等部分。图像预处理的目的是去除噪声及伪影[6-7]、增强肿瘤特征以及标准化不同数据源图像。乳腺区域分割的目的是提取乳腺区域,去除其他区域的组织、器官等,可以极大提升检测结果的可靠性。传统乳腺癌检测方法应用于肿瘤区域、特征的提取和分类判断等步骤,主要包括阈值法、活动轮廓模型、聚类法、概率图模型以及其他机器学习方法等,接下来将逐步进行阐述。
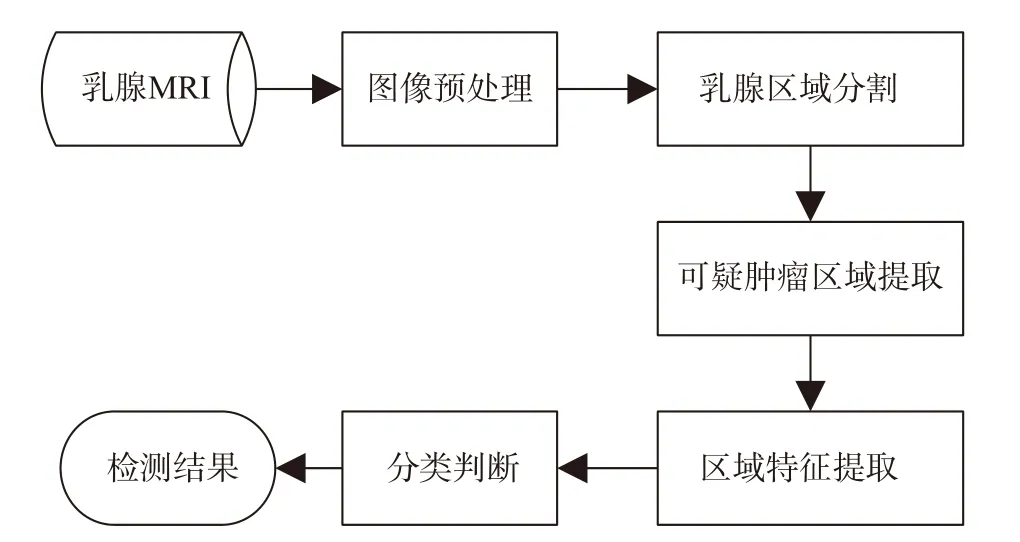
图3 传统乳腺癌检测方法流程Fig.3 Detection of breast cancer by traditional method
可疑肿瘤区域提取最常见方法是阈值法。阈值法主要通过比较肿瘤与背景像素灰度值的差异来提取目标区域,为了获得更好的分割效果,后续常使用形态学处理或区域生长法优化目标区域的边缘[8]。早期的研究大多依赖于手动设置阈值大小及种子点位置,效率较低。因此,研究者开始寻求自动化阈值选取及种子点确定方法[9]。例如,大津法不受图像亮度和对比度的影响,被广泛应用到可疑肿瘤区域提取任务中[10]。由于肿瘤形状通常呈类圆形,血管等组织呈线条形,通过判断几何特征来删除线条形区域,可以减少部分假阳性[11]。需要注意的是,形态学算子半径过大可能导致过分割。此外,基于数学形态学的分水岭算法与自适应阈值法相结合可以有效抑制图像过分割现象[12],但是该算法对噪声点或者其他干扰因素非常敏感。阈值法的优点是分割速度快,计算效率高,但这些方法仅考虑像素点的灰度特征,很少考虑空间特征。若肿瘤区域灰度级与其他组织差异性不大,常会出现错分割的情况。因此,阈值法常与其他方法组合使用,以获得更好的可疑肿瘤区域提取效果。
活动轮廓模型作为一种重要的图像分割方法,也常被应用于乳腺癌检测任务中。该方法通过最小化能量泛函,使图像中的初始曲线逐步运动到目标对象的边界,获得可疑肿瘤区域轮廓[13]。相较于阈值法,该方法的优势是边缘分割精度更高,还可以结合先验知识,如形状、灰度分布,方便的构造合适的能量最小化框架,对后续的目标分析及识别有重要意义。水平集方法属于几何活动轮廓模型,可对3D 图像进行分割,根据肿瘤体积变化在迭代过程中添加3D 形状加权值,可以加快收敛速度,还能消除背景噪声,使分割轮廓更接近实际肿瘤边缘[14]。但是当图像的模糊程度和噪声密度较大时,该方法的特异性显著降低。
聚类方法也可用于乳腺癌检测任务中。与阈值法不同,基于聚类的方法更多的是针对每个像素与其相邻像素的关系而运行的。在乳腺癌检测任务中,常见的聚类方法有均值漂移[15]、K 均值聚类[16]、模糊C 均值聚类(fuzzy C-means,FCM)等。均值漂移和K 均值聚类方法计算开销较大,不能快速地对整个MRI 序列进行检测。模糊C 均值聚类检测速度稍快,但是得到的结果常常包含多个假阳性区域。因此,Huang 等[17]基于FCM 的结果和形态学特征,利用Hessian 滤波器进一步从可疑区域中提取肿瘤组织,去除大部分假阳性区域。接下来Shokouhi 等[18]在此基础上结合区域生长,获得更准确的肿瘤区域。Sun 等[19]则提出了一种基于简单线性迭代聚类和DBSCAN 聚类的半监督乳腺肿瘤分割方法,对较大的肿瘤拥有较好的检测效果,但是提取微小肿瘤的效果不佳。
此外,还有一些基于概率图模型及其他方法的研究。如Gubern-Mérida 等[6]利用基于概率地图集提供的空间信息对乳腺进行分割,再根据体素相对增强特征对病变进一步区分。Cetinel 等[20]使用马尔可夫随机场(Markov random field,MRF)来提高大津法的分割效果。此类方法计算过程复杂,且先验知识的准确性对分割结果有着很大的影响。冯宝等[21]结合MRF 和活动轮廓模型方法,综合考虑灰度区域、边缘以及乳腺癌的空间聚类特性,在肿块型和非肿块型乳腺癌的检测中均得到较好的结果。
为了去除假阳性区域,需要对候选区域的图像特征进行提取和分类。理想的特征组合应该可以准确表现出肿瘤及非肿瘤区域之间的差异,特征维数尽可能少。在DCE-MRI 中,常见的图像特征可分为四类:形态学特征、纹理特征、血流动力学特征和药代动力学特征。其中,最为常用的是形态学特征和纹理特征,这两种特征可以较好地表征出肿瘤的形状、大小、灰度分布等特点,对肿瘤的良恶性判断具有重大指导作用。动力学特征是DCE-MRI 专有的特征,表现的是图像序列间的变化特性。血流动力学特征一般是从每个体素的时间-强度曲线中提取的最大增强(ME)、达峰时间(TP)、吸收率(UR)、清除率(WR)和曲线下面积等特征。因为肿瘤的血流动力学特征与正常腺体有很大不同,所以此类特征对肿瘤的分类效果最好。药代动力学特征与血流动力学类似,更多体现的是造影剂在肿瘤血管中的变化过程,对肿瘤分类的效果也很出色。
虽然分类效果主要与特征的选择和所用数据集的质量有关,但是也不能忽视分类器的选择。常用的分类器有支持向量机、K-最近邻、Adaboost、人工神经网络、贝叶斯算法、决策树、随机森林等。通常实验中都会对这一系列分类器的效果进行对比,然后选择最合适的分类器进行特征分类。目前没有一种特定的分类器在所有数据集和特征组合中表现均为最佳。
对传统乳腺癌检测方法的总结如表1 所示。上述研究表明,传统乳腺癌检测方法侧重点在于人工设计与乳腺癌最相关的特征,其优势是不需要大量数据进行训练就能实现快速准确的检测,结合临床先验知识,结果可解释性强,运行过程明确。总结传统乳腺癌检测方法性能,如表2 所示。然而,传统乳腺癌检测方法还面临一些难题:第一,在不同设备及医学扫描参数下生成的图像,其图像特征也会有很大的变化,因此传统检测方法在不同数据库之间会表现出很大差距,得到的结果也难以互相比较优劣;第二,使用数据量过少,导致模型的鲁棒性较差,泛化能力弱;第三,人工设计的特征对边界清晰、与周围组织灰度对比明显的病灶具有很好的检测效果,但是对边界模糊不规则的病灶检测效果较差,具有一定的局限性;第四,小体积肿瘤难以被检测,主要原因是小体积肿瘤携带的信息较少,由此导致特征表达能力偏弱。因此,未来在研究DCE-MRI 的传统乳腺癌检测算法时,要权衡各部分方法的利弊,寻找更相关的特征组合,设计出检测精度更高的方法。

表1 基于DCE-MRI 的传统乳腺癌检测方法优缺点总结Tab.1 Advantages and disadvantages of traditional breast cancer detection methods based on DCE-MRI

表2 传统乳腺癌检测方法评价结果Tab.2 Evaluation results of traditional breast cancer detection methods
2 基于深度学习的乳腺癌检测方法
传统检测算法暂时无法满足临床需求。近年来,深度学习技术飞速发展,不仅在图像分类任务中表现优秀,在目标检测和语义分割任务中也发挥出强大的性能。在基于深度学习的乳腺癌检测领域,肿瘤检测和分割几乎融为了一体,是近年来研究的重点之一。与传统方法不同,深度学习使用网络模型对大量数据进行训练,以实现自动提取肿瘤的特征,从而对肿瘤的位置及类别进行判断,基本流程如图4 所示:首先是数据预处理阶段,包括对原始乳腺MRI 的预处理和相应肿瘤区域的标签勾画;然后将数据集划分为训练集、验证集和测试集,划分方法主要有留出法、K 折交叉验证法等。接下来是模型的搭建及训练阶段,训练集用来对模型进行训练,验证集用来调整超参数以及选择更优秀的模型,测试集则是用来测试选定的模型对新样本的检测能力,进而评估模型的泛化能力。根据检测策略的不同,深度学习检测方法可分为三种:基于候选区域的乳腺癌检测、基于全卷积网络的乳腺癌检测、基于弱监督学习的乳腺癌检测。
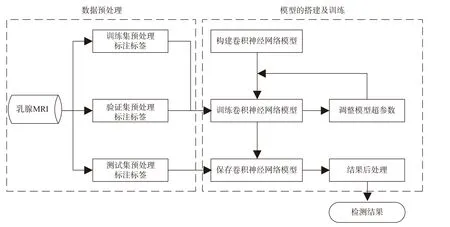
图4 基于深度学习的乳腺癌检测流程Fig.4 Detection of breast cancer by deep learning
2.1 基于候选区域的乳腺癌检测
基于候选区域的乳腺癌检测方法的步骤一般分为三步:首先,利用选择性搜索、区域建议网络(region proposal network,RPN)、ROI 池化层等方法从输入图像中预测乳腺肿瘤可能出现的位置,生成若干个候选区域;然后利用卷积神经网络从候选区域中提取特征;最后利用分类器对特征进行分类。典型代表为R-CNN 系列模型,在乳腺钼靶图像检测任务中应用较多[22-23],在DCEMRI 中较为少见。该模型凭借卷积神经网络强大的分类能力对候选区域进行判断,从而得出最符合目标的边界框。Jiao 等[24]利用Faster R-CNN 对DCE-MRI 的单张图片进行肿瘤检测与分类,如图5所示。该实验检测准确率较高,但不能满足检测实时性的需求。其原因是该模型在提取候选区域的过程中进行大量的重复迭代计算,导致检测速度较慢。同时,候选区域通常比原图像小得多,其尺寸也会限制感知区域的大小,导致模型只能提取到局部特征,降低了检测性能。此外,算法每个阶段需要分别进行训练或者微调,步骤繁琐,不利于取得最优解。
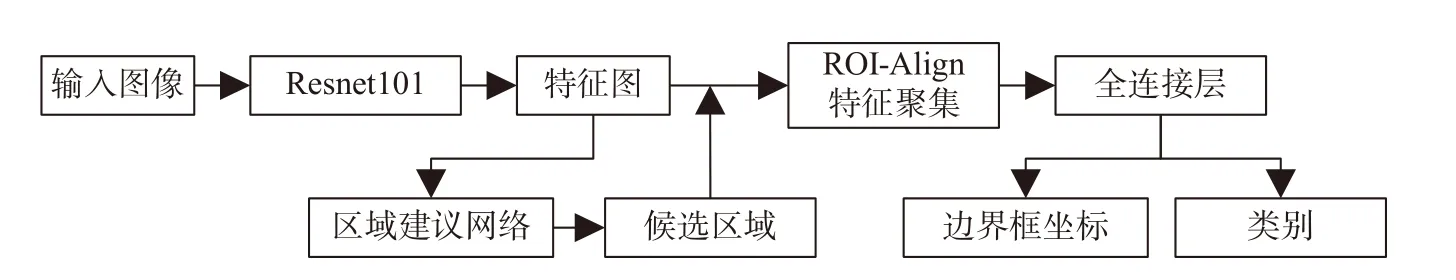
图5 文献[21]所用Faster R-CNN 网络模型Fig.5 Faster R-CNN network model used in reference[21]
针对RCNN 普遍存在的缺乏实时性的问题,YOLO 系列模型[25]删除了区域建议网络,转而采用预定义网格等形式将图片进行区域划分,然后输入到网络中。该方法检测速度较RCNN 算法提升40 倍以上,在乳腺钼靶图像及MRI 中都有较好的表现。如Al-masni 等[26]利用基于Darknet 的YOLO网络对600 张乳腺X 光片进行良恶性肿瘤位置检测,在置信概率设置为0.2 的情况下得到的准确率为96.33%。然而,该模型难以对小体积肿瘤进行检测,其原因是预定义网格代替候选区域生成的方法过于粗糙,导致前期网络训练时很难收敛,对小目标的检测不敏感。马伟等[27]针对乳腺MRI肿瘤区域相对较小、肿块型和非肿块型肿瘤之间形态学差异大的问题,提出了一套粗检测细分割的二阶段深度学习模型。首先运用YOLOv2 网络进行粗检测,得到可疑的肿瘤区域;然后对该区域运用SegNet 网络进行精细分割,从而实现算法最优的性能。与单一模型相比,这种利用不同网络模型的多阶段方法能够更好地发掘影像中的信息,在检测结果上表现得更加优秀。为了增强小体积肿瘤检测性能,Adachi 等[28]第一次将RetinaNet应用到乳腺癌检测任务中,采用特征金字塔结构以及Focal Loss 函数使模型在训练时更关注难分类、面积小的肿瘤区域,极大地提高了检测精度。接下来的研究中,Ayatollahi[29]将RetinaNet 应用到3D 乳腺MRI 序列上,在考虑了三维形态和动态信息后,灵敏度和准确率进一步提升。
2.2 基于全卷积网络的乳腺癌检测
全卷积网络(fully convolutional network,FCN)是一种卷积神经网络,可以在无全连接层的情况下对图像中的每个像素点进行分类及预测,实现对图像的端到端分割[30]。然而,早期的全卷积网络只是简单地使用最后一个反卷积层将特征图上采样到输入图像的大小,损失大量形状和位置信息,无法对肿瘤进行准确的检测。U-net 是由全卷积网络改进而来的一种编码器-解码器结构的语义分割网络[31],在医学图像分割领域取得了优秀的成绩,在样本较少的情况下依然有较好的表现,结构如图6 所示。从结构上看,U-net 在全卷积网络中添加了跳跃连接结构,利用拼接的方法将U 型网络的上下文信息连接起来,保证最后的特征图将底层语义信息和高层边缘位置信息充分融合,因此分割精度较普通全卷积网络更高。Zhang等[32]提出了一个掩膜引导的多阶段学习框架,利用三个U-net 逐步检测并分割乳腺肿瘤。实验中将乳腺区域掩膜与对比后图像、差分图像融合成三通道图像输入到U-net 中,这种软掩膜策略可以避免因乳腺分割不准确而引发的误检。此外,作者提出一种基于Dice 系数和灵敏度的损失函数,使网络高度关注肿瘤像素,较好地缓解了像素类别不平衡的问题。由于训练U-net 模型非常费时费力,Lu 等[33]将迁移学习方法引入到训练过程中,用预训练乳腺图像的分类网络来初始化U-net 分割网络,得到了更准确的乳腺病灶分割结果。迁移学习的应用为分割网络参数初始化提供了便利,使其更容易聚焦于肿瘤区域,提高分割准确率。
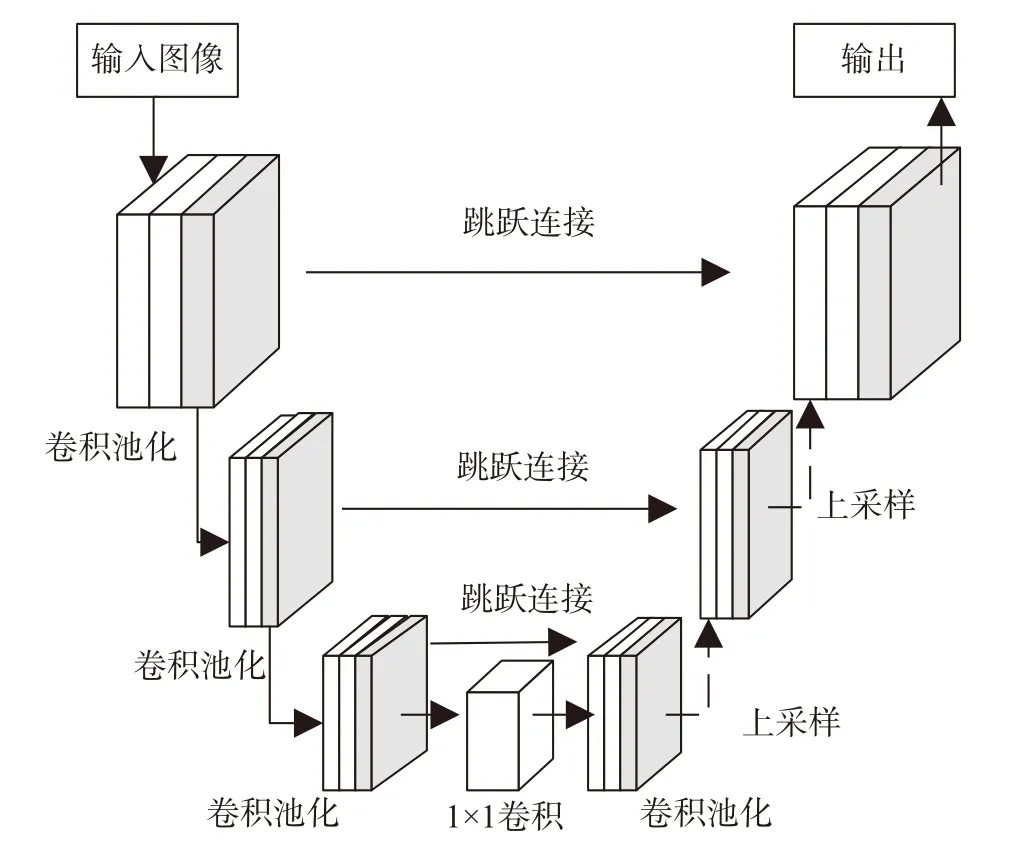
图6 U-net 模型结构Fig.6 U-net model structure
随着深度学习技术的发展,研究者们围绕Unet 的改进做了大量的工作,包括对输入数据的形式及数据流向的改进,如2D 图像输入改为3D 图像、更多的跳跃连接路径;对网络结构进行的改进,如注意力机制、残差模块、特征融合、空洞卷积层等;对损失函数进行的改进,如Dice 损失函数的改进等。在乳腺癌检测任务中,研究者可沿着这些方向继续进行深入的研究。此外,将Unet 与传统图像处理方法结合也是当前研究的热门方向。
2.3 基于弱监督学习的乳腺癌检测
前述的深度学习算法都属于监督学习,极其依赖大型、精确标注的训练数据库,数据库样本越多,检测效果越好。然而在医学图像领域,制作一个高质量数据集是比较耗时费力的,需要消耗大量人工成本。为了克服数据标注成本过大的难题,研究者们开始尝试基于弱监督学习的乳腺癌检测方法。此类方法的主要挑战是如何将弱标签(如图像级标签、边界框标签)与图像中肿瘤区域的像素建立起相关的联系。
基于弱监督学习的检测算法仍可以遵循从可疑区域提取到假阳性检测的流程,Amit 等[34]采用一种无监督的交叉显著性检测方法,结合乳腺的对称性和肿瘤的非对称性来识别图像中的显著性区域,能够较好地检测出成对器官中的肿瘤区域。然而该方法会产生大量假阳性区域,因此需要再将提取的区域输入到卷积神经网络中进行分类,从而完成肿瘤的自动检测定位,训练过程中只需要图像级标签。
在深度学习分类网络模型中,卷积层的输出已经包含了图片中对分类影响最明显特征的位置信息。因此,可以通过网络中间层输出的特征图对肿瘤进行检测。Zhou 等[4]首先搭建了一个基于DenseNet 的3D 乳腺癌分类网络,然后利用类激活图方法(class activation map,CAM)对网络中间层的特征图进行加权融合,得到乳腺肿瘤区域,表现出弱监督学习方法在图像中定位病变的可行性。由实验结果可知,类激活图方法只能检测出乳腺癌的模糊位置,需要结合其他方法进一步约束乳腺癌区域的边缘。Maicas 等[35]提出一种单类显著性检测器结构来提取输出特征图的显著性区域,该检测器在对比实验中效果优于CAM 方法,其相对优势在于该检测器也参与了反向传播,能够捕捉显著性区域的细节。需要注意的是,该算法对损失函数的参数要求较高,需根据不同任务目标修改各部分的权重。Hwang 等[36]基于迁移学习的思想提出了自迁移学习CNN 框架,在分类网络中添加定位器分支。损失函数为分类器与定位器损失函数的加权和,可以防止定位器得到较差的局部最优解。该框架利用分类器分支的训练来指导定位器分支,动态调整损失函数的权重将训练重心逐步转移到定位器分支,从而不需要任何位置信息及预训练模型即可完成肿瘤的检测。
综上所述,基于深度学习的乳腺癌检测方法利用卷积神经网络,对乳腺MRI 中的肿瘤与非肿瘤区域的特征进行自动分析和提取,既减轻了人工特征设计的负担,又可以联合图像序列的上下文信息,得到更丰富的低层和高层语义特征。得益于计算机的性能提升,深度学习方法可以快速有效地检测出恶性及良性乳腺肿瘤,较传统方法具有更强大的鲁棒性。部分算法性能对比如表3所示。然而,深度学习方法存在一些问题:第一,绝大多数研究者没有对乳腺癌的具体类型进行区分,如肿块型乳腺癌和非肿块型乳腺癌,当前研究更多研究的是肿块型乳腺癌。这两种类型的乳腺癌在图像中的分布形式、内部强化等信号特点上有很大差别,非肿块型乳腺癌需要参考功能性成像或增强扫描的强化特征才能进行准确判断;第二,大部分算法都是基于数据驱动的,对于模型的修改仅限于各类网络层的增删组合,很少将领域知识结合到网络中,这样的网络对训练集的质量和数量有更高的要求,更容易出现过拟合问题;第三,由于医院设备、机器扫描参数存在较大差异,医学图像数据的共享是非常复杂且困难的,缺乏统一的标准,因此深度学习方法仍面临小样本数据的限制。
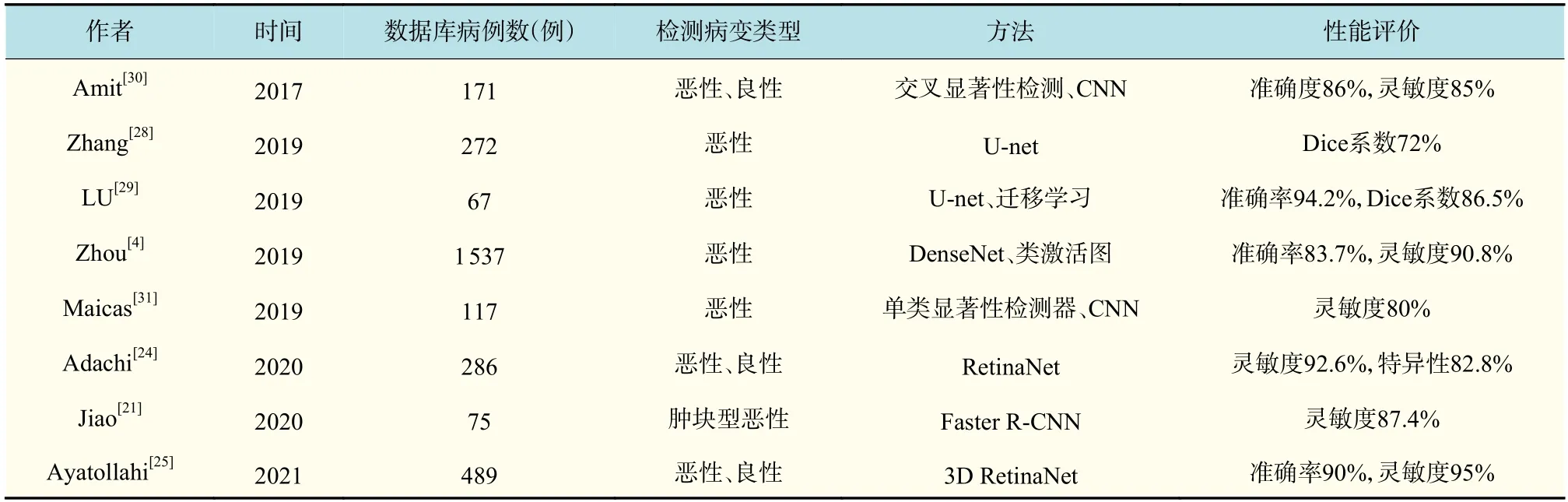
表3 基于深度学习的乳腺癌检测方法评价结果Tab.3 Evaluation results of breast cancer detection methods based on deep learning
根据已有文献可知,基于候选区域的乳腺癌检测方法是最早应用于乳腺MRI 肿瘤检测的深度学习方法,该方法更有针对性地对图像局部进行精确分类,检测灵敏度较高。缺点是候选框提取数量过多,检测速度慢,同时假阳性率也较高。对此,研究者采用YOLO 等模型删除或简化候选框提取步骤,以获得更快的检测速度。然而,这些模型难以检测体积较小的肿瘤,容易出现漏检的情况,存在较大局限性。全卷积网络的深度学习方法对图片的全部区域同时进行检测,对较小的肿瘤检测效果更好,是目前研究最热门的乳腺癌检测方法,但该方法也存在对数据依赖性较大、计算效率低、模型可解释性不强等缺点。弱监督学习的乳腺癌检测方法利用分类网络中的卷积层已经提取到肿瘤位置信息这一特点,为乳腺癌检测任务提供了新的思路,极大减少了人工标注成本。但是如何设计有效的模型结构成为了研究的难点,当前应用此类算法得到的检测准确率较有监督学习算法仍有较大差距,未来还需要进行更多的探索,进一步提升检测性能。基于深度学习的乳腺癌检测方法优缺点总结如表4。

表4 深度学习乳腺癌检测方法优缺点总结Tab.4 Advantages and disadvantages of breast cancer detection methods based on deep learning
3 总结与展望
计算机辅助检测是医学图像处理领域的研究热点之一,在提高放射科医生诊断效率、辅助医生阅片等方面具有非常重要的意义。因此,本文从传统图像处理方法及深度学习技术两方面综述了近年来基于MRI 的乳腺癌计算机辅助检测的相关研究。总的来说,当前检测流程每一部分的方法都有一定程度的优化,检测性能大幅提高,但仍处于探索阶段。通过对现有MRI 乳腺癌检测技术的归纳,提出以下观点并进行展望。
乳腺癌计算机辅助检测方法存在的问题:
a.高质量数据集的紧缺仍是提升检测性能的瓶颈。使用小样本数据集导致传统方法的泛化能力较差,难以进行临床应用;缺乏大数量、高质量的数据集及准确标注的标签,数据集分布不平衡导致深度学习方法的性能难以发挥。此外,现有文献的实验方法缺少在多中心数据库间的性能对比。大部分文献只针对某一个数据库进行实验,且这些数据库大部分为小型、非公开数据库,这导致方法的有效性存疑。
b.特殊类型的肿瘤检出率较低。微小肿瘤占图像的区域较小,特征与血管等组织相似,噪声较多,传统方法无法提取有效信息,常会出现漏检;深度学习方法虽采用多尺度特征等技术对小肿瘤进行检测,精度依然与常见肿瘤的检测精度有显著差距。此外,非肿块型乳腺癌通常需要结合多序列图像进行检测且临床数据样本较少,当前研究该类型肿瘤的工作较少。
随着乳腺癌检测技术越来越成熟,可根据以下方向进一步研究:
a.深度学习技术与传统检测方法相结合。深度学习方法高效准确,具有极强的自动寻找特征的能力,但不能很好地结合人们现有的知识,检测过程比较抽象。而传统检测方法可解释性强,运行过程明确,在边缘检测等特定场景下性能更佳。因此,二者组合应用更能发挥各自的优势,提高检测性能。
b.多模态影像的应用。DCE-MRI 的多序列图像和其他辅助信息可以从多层面提供肿瘤信息,而当前检测方法大多数只针对一张图片进行判断,损失大量有用信息。因此,未来可以结合临床诊断经验,利用多模态数据进行检测。
c.为了克服数据标注成本过大的难题,未来的研究重点可在弱监督目标检测领域开展。弱监督方法可以大大减少人工成本,充分利用医院现存的大量粗糙数据库。同时,未来可以在弱标注样本的基础上结合部分强标注的样本联合训练。此外,自然图像理解领域中存在大量性能优秀的检测方法,如生成式对抗网络、Transformer 模型等,将其迁移到乳腺癌检测任务中可能会有较好的表现。
综上,当前基于MRI 的乳腺癌检测方法准确率较高,但仍有进一步发展的空间。目前,基于深度学习的检测方法是热门研究方向,未来我们应继续研究人工智能的其他方法在乳腺癌检测方面的应用,在临床实践中证明其有效性,与放射科医生相互配合,持续改进所用方法,进一步提高医疗诊治水平,充分利用医疗资源。
