16例消化系统肿瘤围手术期缺血性卒中临床特点分析
2022-03-24刘淑琼杨炼红
刘淑琼 杨炼红
随着医疗水平的提高,越来越多具有心脑血管基础疾病或相关危险因素患者也获得手术机会。对外科手术服务需求增加的同时,围手术期卒中的风险也明显升高。围手术期卒中不仅导致患者住院时间延长、医疗费用增加,还因致残性给社会带来沉重的负担,更是患者围手术期死亡的重要原因,是卒中领域不可忽视的研究点。暂未见对消化系统肿瘤手术围手术期卒中特点总结报道,因此我们分析了我院此类疾病的特点,以提高临床警惕,减少此类疾病的发生、发展。
1 临床资料
1.1 一般资料 入选标准:搜索中山大学孙逸仙纪念医院电子病历信息系统,筛选2015 年1 月至2020 年12 月诊断及病程记录中提及围手术期出现缺血性脑卒中的消化系统恶性肿瘤(包括胃、肠、肝胆、胰腺)患者。其中,缺血性卒中的诊断均由神经科医生会诊确诊,符合中国急性缺血性脑卒中诊治指南2010 制定的标准。排除标准:心源性卒中患者。本研究得到了中山大学孙逸仙纪念医院伦理机构审查委员会的批准。
1.2 方法 回顾性分析入选病人临床资料(包括年龄、性别、既往史、手术情况、肿瘤情况、卒中类型等)、实验室检查(术前糖类抗原-125、术后次日血常规、凝血常规等指标)、头颅影像学资料特点。
1.3 统计学分析 采用SPSS 13.0 统计软件,连续变量以()表示,计数资料采用率表示。
2 结 果
2.1 一般资料 根据电子病历信息搜索记录,我院2015年1 月1 日至2020 年12 年31 日期间诊断为消化系统恶性肿瘤且接受手术切除的患者共有8238 例,其中共有16 例患者围手术期中发生了缺血性卒中。在这16 例病人当中,男女患者各8 例,发病年龄51-93 岁,平均(70.1±2.1)岁;卒中发生时间在术后6-9 小时多见,最长发生时间为术后第9 天,平均(51.4±12.7)小时。按TOAST 分型,有12例卒中类型为大动脉粥样硬化型,4 例为小动脉闭塞型;预后方面,6 例病人病情好转,均为轻型卒中,NIHSS 评分<4 分;7 例死亡,3 例自动放弃治疗出院,该类病例NIHSS 评分均大于4 分,为中重度卒中。术前抽血结果提示糖类抗原125(CA-125)7.6-214 U/ml(参考值≤35 U/ml),平均(57.97±14.07)U/ml;病人术后抽血提示均有贫血,血红蛋白59-113 g/L,平均(92.63±4.720)g/L,其中10 例轻度贫血,5 例中度贫血,1 例重度贫血;D-2 聚体0.48-34 mg/L(参考值0-0.55 mg/L),平均(10.03±2.554)mg/L;纤维蛋白原1.5-3.92 g/L(参考值2-4 g/L),平均(2.874 ±0.1865)g/L。余病例特点见表1,表2。

表1 卒中相关临床特点
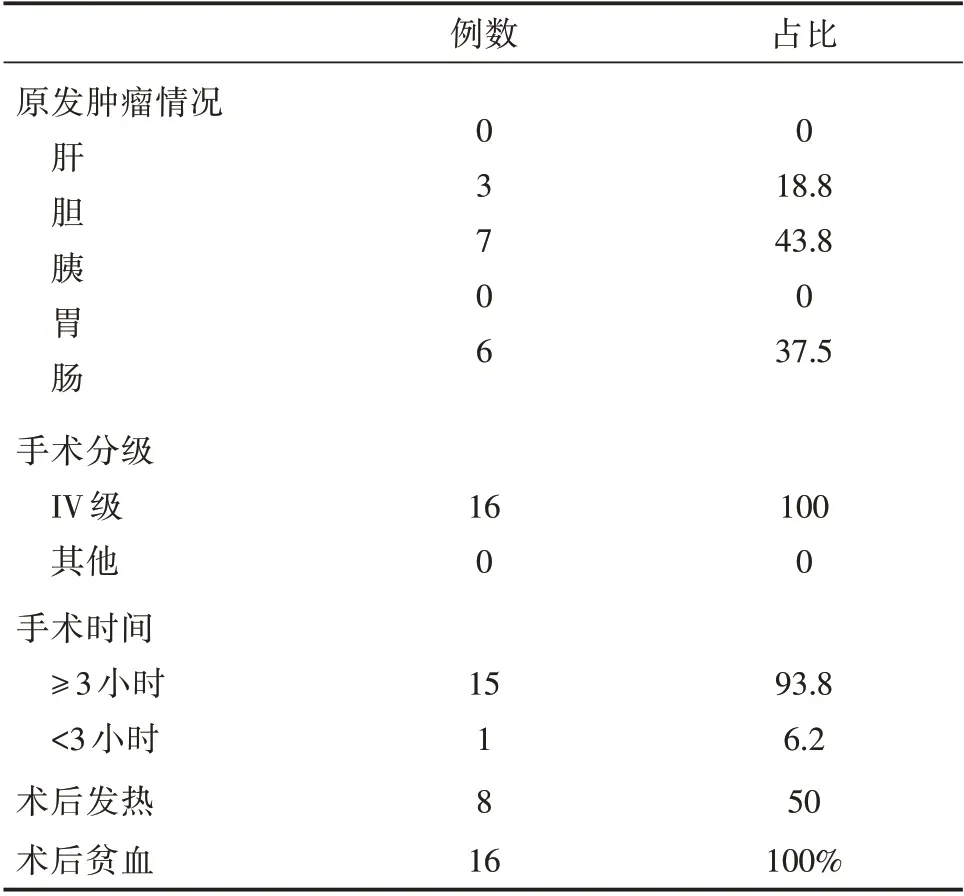
表2 原发肿瘤及手术相关情况
2.2 临床表现 患者均在术后突然出现言语不清、肢体乏力、麻木、昏迷等神经功能缺损症状。
2.3 治疗与转归 所有病例均未接受血管内溶栓或介入治疗,在院期间未接受脑血管病二级预防治疗如抗板、降脂等,仅予营养神经、改善循环及纠正可能潜在的致病因素治疗。7 例患者因并发肺部感染致全身多器官功能衰竭而死亡,3 例患者家属因病情危重放弃治疗自动出院,6例好转后出院。
3 讨 论
围手术期卒中(Perioperative Stroke,PS)[1]指的是术中或术后30 天内出现卒中的临床表现,包括出血性卒中及缺血性卒中。其中,缺血性卒中占了约99%,是PS 的主要类型[2]。该类疾病的致死率高达20-60%,是手术医生、神经科医生需要密切关注的疾病。在本研究中,消化系统肿瘤患者围手术期中缺血性卒中的发病率约0.19%,与文献报道[3]的非心脑血管围手术期发生缺血性卒中的发病率(0.1-1.9%不等)大致相符。
3.1 病因探讨 围手术期缺血性卒中的原因,总的来说分三方面。一方面,围手术期全麻、出血、禁食、利尿、血容量不足等引起血压波动、脑灌注不足,容易导致分水岭性脑梗塞。另一方面,围手术期停用抗板、抗凝药物、血糖控制不良、手术激活凝血相关机制、血管内皮损伤、凝血瀑布反应等可致动脉血栓形成性脑梗塞。最后,恶性肿瘤切除时,可能有癌栓脱落,导致脑栓塞[4]。
有研究表明癌症合并脑梗死患者血清CA-125 水平明显升高[5],进一步分析发现,CA-125 有黏蛋白特性,可导致患者血液凝固性升高。这可能癌症并发脑梗死的高危因素。而CA-125 的升高常见于消化系肿瘤[6],如肠癌、胰腺癌等。在本研究中,50%患者出现CA-125 升高,肿瘤类型以胰腺癌、肠癌为主(分别为43.8%、37.5%)。另有研究表明[3],血红蛋白低于9 g/dl 及大出血、围手术期使用非特异性β-受体阻滞(以美托洛尔为最)的手术患者中风风险明显增加,可能相关的机制包括在贫血的情况下β 受体阻滞剂的使用减少脑血管舒张和CO 调节脑组织氧输送的调节功能受损。当然,目前关于术中β-受体阻滞剂与脑血管疾病结局相关性的数据很少,需要更多的证据确定围手术期使用该类药物的风险及获益。
我们的研究数据表明,除了传统的高血压、糖尿病、冠心病、高凝状态、停用抗板药物等血管危险因素外,复杂的四级手术、手术时间大于3 小时、术后贫血、发热,均可能是围手术期缺血性卒中的高危因素。另,YI 的研究表明,大动脉粥样硬化与PS 相关[7],在我们的研究病例中,大动脉粥样硬化类型的脑梗占多数且预后欠佳。
3.2 治疗方面 虽然PS 多发生在医院内,但治疗方面仍是以营养神经等对症处理为主。围手术期存在较大的出血风险,是静脉溶栓的禁忌;在院期间也较少立即启动抗板、稳定斑块等二级预防治疗;另一方面,因对脑卒中的认识不足,确诊脑梗塞时往往已错过血管内治疗的时间窗。有研究表明,在治疗时间窗内的围手术卒中,动脉溶栓、机械取栓术可能是有效的治疗手段。本组病例中,均采用保守治疗,疗效欠佳,预后差,尤其是中重度卒中,病死率高达90%。
3.3 预防方面 如何避免消化系统肿瘤围手术缺血性卒中?首先,术前应充分识别脑卒中高危患者,必要时完善颈动脉超声、头颅MRA 检查,评估相关危险因素并进行多学科协作,制定个体化的治疗方案。其次,术中应注意稳定血压,避免血压波动超过30%。术后注意维持水电解质平衡,维持血糖、血压平稳,避免感染,对患者进行分层及精细化管理,慎重使用β 类降压药物[3]。近年研究表明他汀类药物除降脂作用外,还改善血管内皮细胞功能、调节炎症及免疫反应,抑制和逆转动脉粥样硬化,并可修复破裂或溃疡的动脉粥样硬化斑块,避免血栓形成。故笔者认为,如无他汀类药物的使用禁忌,存在卒中高风险的患者术后应尽早启动他汀类药物预防治疗[8]。最后,应加强术科医生对卒中临床表现的认识,当神经功能症状缺失发生时,临床医生能及时识别,尽快启动院内卒中绿色通道,争取血管内治疗手段的时间窗,以期改善卒中的预后。
消化系统肿瘤围手术期卒中是多种危险因素综合作用的结果,可在预防为主的基础上,尽早识别、诊断及治疗该病,以提高患者生活质量,降低死亡率。
