病原宏基因组高通量测序中无菌部位临床标本的处理办法
2022-03-24梁志坤孙荣同吴轶兰王琳唐翠燕
梁志坤 孙荣同 吴轶兰 王琳 唐翠燕
感染性疾病作为全球十大死亡原因之一,时刻威胁着患者的生命健康。其根本原因在于现有的病原鉴定技术,包括微生物的培养和分离、特异性病原抗体的检测和微生物核酸[DNA(Deoxyribonucleic acid)或RNA(Ribonucleic Acid)]检测[PCR(Poly⁃merase Chain Reaction)]等无法满足临床需求[1⁃3]。病原宏基因组高通量测序(mNGS,Metagenomics next⁃generation sequencing)技术理论上能“无偏倚”地检出全部潜在病原体,包括病毒、细菌、真菌、寄生虫等[4],尤其适用于病原不明的疑难感染性疾病的诊断[5⁃7]。也正是得益于mNGS 技术,才能在新型冠状病毒疫情初期迅速发现并鉴定出这一新发病原体[8]。
mNGS 技术适用于几乎所有类型的临床样本。主要有静脉血、脑脊液、肺泡灌洗液、痰液、胸水和腹水组织等。不同样本核酸提取前需进行不同的前处理,比如离心、过滤、液化、破壁、去宿主等以提高病原体检出率。
专家共识中也都指出样本前处理和核酸提取为mNGS 技术流程的质量控制的重要节点[9⁃10]。无菌部位的标本(静脉血、脑脊液、胸腔积液、组织等)具有更高的临床价值,应尽量送检无菌部位的标本[10]。因此,本文通过对mNGS 无菌部位临床样本处理方法进行综述,着重阐述常见无菌部位样本的特性及处理方法,以期为医疗工作者及科研人员提供详实的参考信息。
1 病原宏基因组高通量测序技术原理
mNGS 检测过程主要包括实验操作(湿实验)和生信分析(干实验)两个部分,具体是将临床感染患者样本中的全部核酸片段化后进行测序,然后再应用生物信息学分析软件将测序结果与相关病原体数据库中的参考序列进行对比、分析和鉴定,见图1。
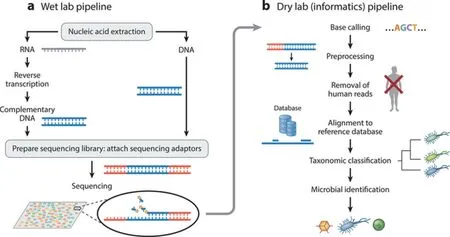
图1 mNGS 技术原理[4]Figure 1 mNGS technology principle[4]
与传统的病原体核酸诊断技术(PCR、基因芯片、核酸杂交技术)相比,mNGS 能在较短的时间内完成对样本的无靶向检测,单次即可检测上千种病原体,检测的病原体种类包括病毒、细菌、真菌和寄生虫等[11⁃12]。
2 无菌部位临床样本处理方法
mNGS 技术相当于是“草垛寻针”,既要考虑草垛的数量,也要考虑针的数量,即草垛和针的比例。测序数据中仅有1%的reads 是非人源的,而这1%又仅有少部分是属于病原的[2]。不同的临床样本中所含的人核酸含量不同。因此,需要根据不同种类的临床样本核酸特点设计样本前处理的具体方法,如痰液液化、组织研磨和切片脱蜡等,来保证检测的可靠性。以下总结了不同实验室针对感染性疾病无菌部位样本的处理方法。
2.1 血液
血浆cfDNA(Circulatingfree DNA)中存在引起机体不同部位感染的病原体基因组DNA 片段。因此,对外周血中微生物cfDNA 进行测序,可以提高对多种感染进行无创检测的可能性[5]。血液样本处理方法如下:
将大于1.2 mL的血浆样本解冻,加入已知浓度的合成的分子质控,16 000 g离心10 min,收集血浆。用改进的Mag⁃Bind cfDNA kit(M3298,Omega Biotek,USA)提取0.25 mL血浆的cfDNA[5],或者用TIANamp Micro DNA Kit(DP316,TIANGEN BIOTECH,Bei⁃jing,China)提取300 μL血浆中的DNA[11]。
对于血液样本,一般是建议采集后立即离心收集血浆来进行长期保存。与血培养不同,mcfDNA检测容易受溶血、乳糜血的影响,与高人源背景的影响相似[5],当标本出现严重的溶血、乳糜血时,微生物检出不足,容易造成假阴性。
2.2 脑脊液
颅内感染会产生脑炎或脑膜炎的症状。脑脊液样本核酸总量有时可能低于测序文库制备所需的最低核酸起始量,需要考虑对样本中的核酸进行富集,使用核酸回收率高的纯化试剂盒。脑脊液样本处理方法如下:
方法1[6]:600 μL CSF 用FastPrep⁃24 磁珠匀浆机(MPFastPrep⁃24 5G,MP biomedicals,USA)以6 m/s 的速度匀浆两次,每次30 s,在4℃孵育5 min。以2 000 rpm 离心3 min 后留取400 μL 上清。将DNA 和RNA 质控,包含DNA 和RNA 噬菌体的内部质控加入上清液中(以3×105和9×103copies/mL浓度),结果大约为1x103RPM,提取400 μL 样本,使用的试剂盒为EZ1 Virus Mini Kit v2.0(955134,Qiagen,Germany),洗脱体积为60 μL。见图2。

图2 脑脊液样本处理方法示意图[6]Figure 2 Schematic diagram of cerebrospinal fluid sample processing method[6]
DNA 的富集:取25 μL 总核酸使用NEBNext Microbiome DNA Enrichment Kit (E2612S/L,New England Biolabs,USA)进行富集。该试剂盒通过选择性抗体介导的甲基化DNA 去除来来富集微生物核酸,甲基化DNA 大部分来自人类宿主。
病毒RNA 的富集:取25 μL 总核酸,用3 μL of Turbo DNAse(AM2238/AM2239,Thermo ⁃fisher,USA)和1 μL Baseline DNase[(DB0715K,Epicentre(Illumina),USA]37℃处理30 min。然后使用RNA Clean & Concentrator Kit(R1013/R1014,Zymo Re⁃search,USA)对DNase进行终止,RNA 进行纯化。
方法2[12]:病毒核酸提取前,100 μL 的脑脊液样本先用Turbo DNase(AM2238/AM2239,Thermo⁃fisher,USA)和RNase I(AM2295/AM2294,Thermo⁃fisher,USA)处理,然后用QIAamp viral RNA kit(52904,Qiagen,Germany)提取病毒核酸。
方法3[13⁃14]:1.5~6 mL 脑脊液样本使用QIAmp CircμLating Nucleic Acid Kit(55114,Qiagen,Ger⁃many)进行脑脊液上清液的cf DNA 提取,使用QIAamp DNA Mini Kit(51304,Qiagen,Germany)进行脑脊液细胞团的DNA 提取。
脑脊液是一种无菌体液,在采集的时候应注意无菌操作和防止血污染。脑脊液病原体核酸量较少,需要采用富集方法对核酸进行富集。另外,脑脊液中的病原主要以菌体的形式存在,在提取核酸时需要“破壁”处理,来提高胞内菌/真菌的检出率。
2.3 胸腔积液
胸腔积液的常见原因有胸膜或邻近组织感染,常见致病菌有葡萄球菌、链球菌、大肠埃希菌、脆弱类杆菌、绿脓杆菌等。胸腔积液样本处理方法如下:使用MagNALyzer 仪(Roche Diagnostics GmbH,Switzerland)加上SeptiFast Lysis kit(Roche,Switzer⁃land)对细菌细胞进行机械破壁来获得DNA,然后在MagNA Pure 紧凑型自动化仪器(MagNA Pure 96,Roche,Switzerland)上进行DNA 提取和纯化[15]。胸腔积液中常见的病原为菌体,需要对样本进行破壁处理以提高核酸提取效率。
2.4 关节积液
膝关节是人体滑膜最多,关节面最大和结果最复杂的关节,由于膝关节滑膜广泛并位于肢体较表浅部位,故遭受损伤和感染的机会较多。如细菌感染造成的细菌性关节炎、结核性滑膜炎等。关节积液样本处理方法如下:
DNA 提取之前,使用MolYsis Basic5 kit(D⁃301⁃050,Molzym,Germany)通过促溶剂选择性的裂解人源细胞,释放出来的hDNA 使用MolDNase 降解。然后将样品中存在的细菌沉淀,洗涤,然后使用MoBio Bacteremia DNA isolation kit(12240⁃50,Qiagen,Germany)进行DNA 提取和分离[16]。
关节积液的保存,必须离心除去细胞,因为细胞内酶释放出来会改变关节积液的成分,也会影响积液中病原核酸的组成,影响病原的检出率。
2.5 感染的组织
与无菌体液相比,组织增加了人类宿主背景,导致微生物reads 数量和比例减少,从而导致mNGS 敏感性降低。所以需要去除人源宿主,大部分去除宿主的方法对唾液、血液或粪便样本有利,但对感染的组织样本是无效的。在DNA 提取前,对组织进行匀浆处理,可以使宿主细胞保留到裂解液中促进宿主细胞的裂解。感染组织样本处理方法如下。
2.5.1 新鲜组织样本
方法1(DNA 提取)[17]:为了选择最有效的微生物提取方法来去除宿主DNA 的污染,又不影响感染组织样本对微生物多样性的分析。实验者比较了5 种常见的DNA 提取方法。见图3、表1。
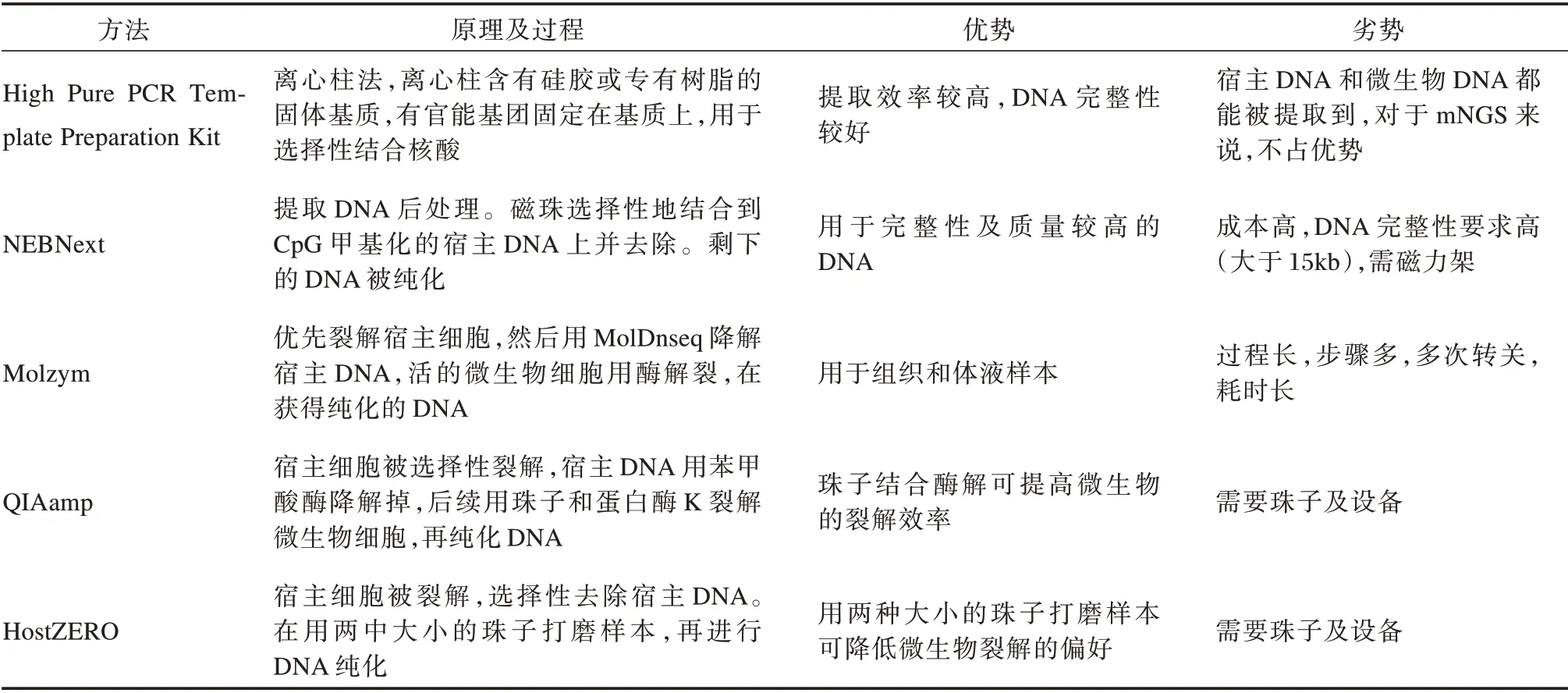
表1 几种去除宿主DNA 方法的优劣势比较[17]Table 1 Comparison of several advantages and disadvantages of removing host DNA[17]
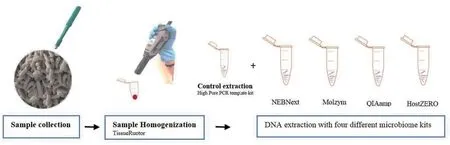
图3 新鲜组织样本处理方法示意图[17]Figure 3 Schematic diagram of fresh tissue sample processing method[17]
由于单份糖尿病足感染(DFI(Diabetic foot in⁃fection))活检样本体积小,实验者将这5 份样本混合在一起来比较5 种DNA 提取方法。总共380 mg 的混合DFI 样本在1.5 mL 无核酸酶水中使用Tissue RuptorⅡinstrument(230 V,50/60 Hz,中速10 s)(9002756,Qiagen,Germany)进行匀浆处理。然后被分成15 等份,每一份含100 μL 约25 mg。使用5 种方法进行DNA 提取,每种提取方法重复三次,提取方法有High Pure PCR Template Preparation Kit(对照)(11796828001,Roche,Swit⁃zerland)、NEBNext Microbiome DNA enrichment kit(E2612S/L,NEB Inc,USA)、Molzym Ultra⁃Deep Microbiome Prep(G⁃020⁃025,Molzym,Germany)、QIAamp DNA Microbiome Kit(51704,Qiagen,Germany)、HostZERO microbial DNA kit(D4310,Zymo Research,USA)。18S/16S rRNA 定量PCR,16 s 扩增子测序结果显示HostZERO 和QIAamp 试剂盒宿主DNA 的含量较低。
方法2(DNA 提取):将取自骨移植相关感染的病人的软组织活检样本平均分成两份,组织2(同样大小和重量)。一份按Ultra⁃Deep Microbi⁃ome Prep kit(G⁃020⁃025,Molzym,Germany)说明书进行提取,另一份用改进的方法:延长蛋白酶K孵育时间(由原来的10 min 延长到20 min),接着裂解人细胞,降解细胞外DNA,细胞用1 mLTSB重悬,重复上一步骤,14 000xg 离心。使用HBB 和nuc⁃gene qPCR、MiION 测序来比较两种方法。改进后的方法HBB 和nuc⁃gene qPCR 的ct 值都比未改进的方法高,MiION 测序后hDNA 的reads 数为1 755(为改进方法reads 数为60063)[18]。
方法3:新鲜组织冷冻样本使用AllPrep DNA/RNA FFPE kit(80234,Qiagen,Germany)和QIAamp DNA microbiome kit(51704,Qiagen,Germany)[19]。
2.5.2 组织切片样本
甲醛固定石蜡包埋处理会使组织样本中核酸发生核酸发生断裂或降解,需要对原始样本进行脱蜡和DNA 修复后,AllPrep DNA/RNA FFPE kit(80234,Qiagen,Germany)和QIAamp DNA micro⁃biome kit(51704,Qiagen,Germany)对FFPE样本进行总DNA 提取[19]或使用GeneRead DNA FFPE Kit(180134,Qiagen,Germany)进行DNA的提取[20]。
组织样本千差万别,即使是同样大小的组织样本,来源不同,取样时间的不同,细胞数量也是千差万别的。对于肝脏和脾脏转录非常活跃的器官,其蛋白质和RNA 含量都很高。因此在制备基因组DNA时,就可以适当减少组织用量。此外,有些组织中含有收缩蛋白、结缔组织、胶原等,都提升了核酸提取的难度,需要根据组织样本的特性做特殊的处理。对于FFPE,需要对其进行脱蜡和DNA 的修复。
3 总结
不同病原微生物的基因组大小不同(寄生虫>真菌>细菌>病毒),核酸提取效率也存在差异[难易程度:病毒<革兰阴性菌<革兰阳性菌(不包括分枝杆菌、需氧放线菌等)<真菌]。应该根据病原微生物的特征选择针对性的提取方法。比如,血液样本的病原NGS 检测的主要是血浆中的游离核酸cfDNA[21]。而组织标本中,其病原主要以菌体形式存在,核酸是存在于病原细胞中,所以对于这类标本会存在“破壁”的过程,让核酸释放出来再进行检测[10]。临床样本多种多样,但对于mNGS 技术来说,无菌部位样本比无菌部位样本更具临床价值。因此,本文阐述了常见无菌部位样本的特性及处理方法,以期为医疗工作者及科研人员提供详实的参考信息。
