鼻咽癌外泌体通过LncTUG1促进内皮细胞增殖和血管生成*
2022-03-23王科马敏蒋晋安赵琳张海鹏
王科 马敏 蒋晋安 赵琳 张海鹏
(西安医学院第一附属医院耳鼻咽喉头颈外科,陕西 西安 710100)
鼻咽癌是我国南方地区常见的头颈部上皮性恶性肿瘤,Epstein-Barr病毒感染、饮食和遗传因素与其病因有关[1]。放疗是早期鼻咽癌患者的有效治疗方法,但绝大多数(75%~90%)鼻咽癌患者在初诊时已发生转移,这阻碍了鼻咽癌的有效治疗,并增加了疾病复发的风险[2]。肿瘤血管生成对肿瘤的生长、浸润和转移都有重要作用。肿瘤发展过程中,血管生成开关被激活,从而导致血管增生。血管生成开关的激活受肿瘤细胞或肿瘤微环境所引起的各种因素的调节[3]。因此,探究肿瘤血管生成的机制对于肿瘤治疗具有重要意义。长非编码RNA(Long noncoding RNAs,LncRNAs)通过调控癌细胞增殖、迁移、侵袭和凋亡等过程,参与调控癌症的发生和发展[4]。外泌体是一种直径为30~150 nm的膜状囊泡,其可通过携带蛋白质和遗传物质(DNA、LncRNA、miRNA和mRNA)等分子货物,介导细胞间信息转导,在肿瘤中发挥多种生物学功能[5]。先前的研究表明,长非编码RNA牛磺酸上调基因1(Long noncoding RNA taurine upregulated gene 1,LncTUG1)在多种肿瘤中高表达,可通过调控肿瘤细胞周期及血管生成参与肿瘤的发生、发展过程[6]。目前,关于LncTUG1在鼻咽癌中的具体作用机制尚不明确。基于此,本研究旨在探究鼻咽癌外泌体中LncTUG1对内皮细胞(HUVECs)增殖和血管生成的作用,以期为鼻咽癌的治疗提供新思路。
1 材料与方法
1.1 主要材料 人鼻咽癌细胞株CNE1、CNE2、HONE1、正常鼻咽上皮NP69和人脐静脉内皮细胞购自中科院上海细胞库;PKH67试剂盒购自美国Sigma-Aldrich公司;ActinRed购自美国Invitrogen公司;CD63、CD9、TSG101和GAPDH抗体购自英国Abcam公司;SYBRRPremix Ex TaqTMⅡ试剂盒购自日本Takara公司;sh-LncTUG1-1、sh-LncTUG1-2、sh-LncTUG1-3和sh-NC由上海吉玛制药技术有限公司设计并合成;CCK-8试剂盒购自日本同仁化学研究所;5-乙炔基-2′-脱氧尿苷(EdU)购自大连美仑生物技术有限公司;Matrigel基质胶购自美国BD Biocoat公司。
1.2 方法
1.2.1 细胞培养 CNE1、CNE2、HONE1和NP69细胞用含10% FBS的RPMI-1640培养基于37℃、5% CO2培养箱中培养,HUVECs 用含10% FBS的DMEM/F12培养基于37℃、5% CO2培养箱中培养。所有细胞每2天更换一次培养基。
1.2.3 细胞转染 将CNE1细胞按4×105个/孔密度接种于6孔板,于37℃、5% CO2培养箱中培养24 h后,将细胞随机分为Blank组、sh-NC组、sh-LncTUG1-1组、sh-LncTUG1-2组和sh-LncTUG1-3组,每组设置3个重复。按照Lipofectamine2000TM说明书进行sh-NC、sh-LncTUG1-1、sh-LncTUG1-2和sh-LncTUG1-3的转染。另外,将细胞随机分为CNE1-sh-NC组和CNE1-sh-LncTUG1组,每组设置3个重复。按照Lipofectamine2000TM说明书进行sh-NC和sh-LncTUG1(干扰效率最高的sh-LncTUG1)的转染。37℃、5% CO2条件下培养48 h后,进行后续实验。
1.2.4 外泌体的分离及鉴定 ①外泌体的分离:将对数期生长的NP69和CNE1细胞接种于培养皿中,添加含10% FBS的无外泌体的培养基,37℃、5% CO2条件下培养72 h,待细胞密度达到80%~90%时,收集细胞培养上清液。2000 g离心20 min,去除沉淀;10000 g离心30 min去除沉淀。上清液用超速离心机4℃、100000 g离心70 min,无菌PBS重悬沉淀后,重复此步骤一次。沉淀用无菌PBS重悬后,0.22 μm滤器过滤,所得分别为NP69和CNE1细胞来源外泌体,简称NP69-Exo和CNE1-Exo。用转染了sh-NC和sh-LncTUG1的CNE1细胞,按照以上实验步骤进行分离,所得的外泌体分别命名为CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1。所有外泌体于-80℃条件下保存备用。②外泌体的鉴定:取适量NP69-Exo、CNE1-Exo、CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1置于铜网,3%磷钨酸负染色液染色5 min,去除染色液。铜网晾干后,透射电镜观察外泌体形态。取适量NP69-Exo、CNE1-Exo、CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1,PBS稀释,0.22 μm滤器过滤后,Nanosight纳米粒度颗粒跟踪分析仪进行外泌体粒径检测。Western blot实验检测外泌体标志性蛋白CD63、CD9、TSG101蛋白表达。
1.2.5 外泌体标记示踪 按照PKH67试剂盒说明书标记分离的CNE1-Exo,用10% FBS的RPMI-1640培养基停止过度染色。PBS清洗外泌体后,将外泌体加入HUVECs中,37℃、5% CO2培养箱中培养24 h后,HUVECs细胞骨架用ActinRed染色,并用4′,6-二氨基-2-苯基吲哚(DAPI)复染细胞核。激光共聚焦显微镜观察HUVECs中外泌体的摄取情况。
1.2.6 Western blot检测外泌体标志性蛋白CD63、CD9和TSG101蛋白表达 收集外泌体或细胞,RIPA裂解液裂解外泌体或细胞,取上清,BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离,湿转法将蛋白转至PVDF膜上。10%脱脂奶粉室温封闭3 h,CD63抗体(1∶1000)、CD9抗体(1∶2000)、TSG101抗体(1∶1000)和GAPDH抗体(1∶2000)4℃孵育过夜, HRP标记二抗(1∶5000)室温孵育1 h。 ECL发光液显色,暗室曝光。
1.2.7 外泌体与HUVECs的共培养 HUVECs以4×105个/孔密度接种于6孔板,将HUVECs分为PBS组和CNE1-Exo组或PBS组、CNE1-Exo-sh-NC组和CNE1-Exo-sh-LncTUG1组,每组设置3个重复。按照分组,向细胞中添加50 μg/mL CNE1-Exo、CNE1-Exo-sh-NC、CNE1-Exo-sh-LncTUG1和等量PBS。细胞继续培养48 h后,进行后续实验。
1.2.8 CCK-8检测HUVECs细胞活力 HUVECs接种于96孔板,每孔5×103个细胞,继续培养12 h后,将细胞分为PBS组和CNE1-Exo组或PBS组、CNE1-Exo-sh-NC组和CNE1-Exo-sh-LncTUG1组。按照分组,向细胞中添加CNE1-Exo、CNE1-Exo-sh-NC、CNE1-Exo-sh-LncTUG1和等量PBS。细胞继续培养12、24、48和72 h后,向每孔细胞中加入10 μL CCK-8,37℃条件下孵育3 h。酶标仪测定各孔在450 nm处的光密度(OD)值。
1.2.9 5-乙炔基-2′-脱氧尿苷(EdU)实验检测HUVECs细胞增殖 取1.2.7中的HUVECs以2×105个/孔数量接种于24孔板中,培养12 h后,根据说明书,向细胞中添加EdU至终浓度为10 μm。继续培养2 h后,弃去培养基, 4%多聚甲醛固定15 min,0.5%Triton X-100穿透20 min, Apollo®567避光染色30 min, DAPI染核5 min。激光共聚焦显微镜观察细胞,其中蓝色荧光代表细胞核,红色荧光代表EdU阳性细胞。
1.2.10 Matrigel血管形成实验检测HUVECs血管形成能力 取1.2.7中的HUVECs,DMEM/F12培养基重悬细胞,以2×105个/孔细胞数量接种于加有Matrigel胶的24孔板,37℃、 5% CO2条件下培养10 h后,记录各组细胞所有管状结构交叉点数目。
其中,k∈[0,3],i∈[1,Q],Q=NSmax。因此,Q=2π/θ。另外,参数为两个在[0,1]之间的随机变量。当排除了以上4种充电失败情况发生的概率后,可推得基于波束成形的一对一无线充电成功的概率为:

2 结果
2.1 LncTUG1在不同鼻咽癌细胞系中的表达及sh-LncTUG1干扰效率筛选 RT-PCR检测结果显示,CNE1、CNE2和HONE1细胞中LncTUG1表达水平均高于NP69细胞(P<0.01),且CNE1细胞中LncTUG1表达水平最高,因此选取CNE1细胞进行后续实验。sh-LncTUG1-1组、sh-LncTUG1-2组和sh-LncTUG1-3组CNE1细胞中LncTUG1表达明显低于sh-NC组(P<0.01),其中sh-LncTUG1-3组LncTUG1表达水平最低,因此选取sh-LncTUG1-3进行后续实验,简称sh-LncTUG1。见图1。
2.2 LncTUG1在鼻咽癌细胞来源外泌体中的表达水平 透射电镜结果显示, NP69-Exo和CNE1-Exo均呈圆形囊泡结构(图2A)。粒径分析显示NP69-Exo和CNE1-Exo直径约为100 nm(图2B)。Western blot实验结果显示NP69-Exo和CNE1-Exo中外泌体标志性蛋白CD63、CD9、TSG101蛋白呈阳性表达(图2C)。RT-PCR结果显示,CNE1组中LncTUG1的表达明显高于NP69组(P<0.001),CNE1-Exo中LncTUG1的表达明显高于NP69-Exo组(P<0.001)(图2D)。激光共聚焦结果显示,PKH67标记的外泌体可被HUVECs摄取,见图2E。

图2 LncTUG1在鼻咽癌细胞外泌体中的表达水平
2.3 CNE1-Exo对内皮细胞增殖的影响 RT-PCR实验结果显示,CNE1-Exo组内皮细胞中lncTUG1的表达明显高于PBS组(P<0.001)(图3A);CCK-8实验结果显示,CNE1-Exo组在不同时间点的细胞活力明显高于PBS组(P<0.05)(图3B);EdU实验结果显示, CNE1-Exo组EdU阳性细胞率明显高于PBS组(P<0.001),见图3C。

图3 CNE1-Exo对内皮细胞增殖的影响
2.4 外泌体对内皮细胞血管生成的影响 Matrigel成管实验结果显示,CNE1-Exo组HUVECs管状网络结构数量明显高于PBS组(P<0.001),见图4。
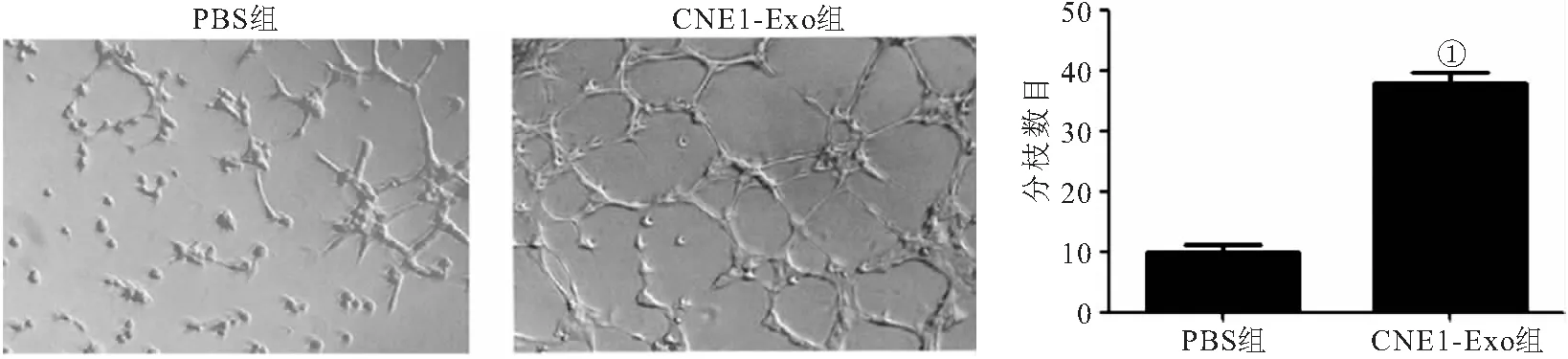
图4 外泌体对HUVECs血管生成的影响
2.5 LncTUG1在CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1中的表达 透射电镜结果显示,CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1均呈圆形囊泡结构(图5A)。粒径分析显示CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1直径约为100 nm(图5B)。Western blot实验结果显示CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1中外泌体标志性蛋白CD63、CD9、TSG101蛋白呈阳性表达(图5C)。RT-PCR结果显示,CNE1-Exo-sh-NC组中LncTUG1的表达明显高于PBS组(P<0.001),CNE1-Exo-sh-LncTUG1组中LncTUG1的表达明显低于CNE1-Exo-sh-NC组(P<0.001),见图5D。

图5 LncTUG1在CNE1-Exo-sh-NC和CNE1-Exo-sh-LncTUG1中的表达
2.6 sh-LncTUG1对内皮细胞增殖的影响 CCK-8实验结果显示,CNE1-Exo-sh-NC组在12、24、48和72 h的细胞活力明显高于PBS组(P<0.05),CNE1-Exo-sh-LncTUG1组在24、48和72 h的细胞活力明显低于CNE1-Exo-sh-NC组(P<0.05)。EdU实验结果显示,CNE1-Exo-sh-NC组EdU阳性细胞率明显高于PBS组(P<0.001),CNE1-Exo-sh-LncTUG1组EdU阳性细胞率明显低于CNE1-Exo-sh-NC组(P<0.001),见图6。

图6 sh-LncTUG1对HUVECs细胞增殖的影响
2.7 sh-LncTUG1对内皮细胞血管生成的影响 Matrigel成管实验结果显示,CNE1-Exo-sh-NC组HUVECs管状网络结构数量明显高于PBS组,CNE1-Exo-sh-LncTUG1组HUVECs管状网络结构数量明显低于CNE1-Exo-sh-NC组(均P<0.001),见图7。

图7 sh-LncTUG1对HUVECs血管生成的影响
3 讨论
鼻咽癌是一种具有特定地理分布的头颈部肿瘤。据统计,2018年全世界约有13万名患者受其影响,发病率最高的地区是华南、东南亚和北非。70%以上的患者在发病时被诊断为局部晚期疾病[7]。最近研究发现,LncRNAs在鼻咽癌组织中差异表达,LncRNAs参与原发性鼻咽癌的发病机制并与鼻咽癌复发相关[8]。已有研究表明,LncTUG1在肿瘤中发挥着致癌作用,敲低LncTUG1可抑制癌细胞增殖、侵袭、迁移和上皮间质转化过程,并诱导细胞凋亡[9]。目前,关于LncTUG1在鼻咽癌中的作用尚未可知。因此,本研究旨在探究LncTUG1对鼻咽癌血管生成的作用及其可能的作用机制,以期为鼻咽癌发病机制的探明和开发新的治疗靶点提供新的科学资料。
在正常情况下,血管生成只发生在胚胎发育、女性生殖周期和伤口修复过程中。然而,异常血管生成是肿瘤发生发展的关键介质和主要过程[10]。肿瘤细胞利用各种细胞间通讯机制来适应局部微环境,操纵免疫系统,促进转移。外泌体释放是细胞间通讯的一种新机制。这些纳米囊泡通过所运输的核酸、蛋白质等活性物质参与肿瘤的发生发展[11]。研究表明,高转移潜能的宫颈癌细胞来源外泌体通过向低转移潜能癌细胞传递miR-29,促进低转移潜能癌细胞转移[12]。星形胶质瘤细胞来源外泌体中的miR-1246可通过靶向细胞黏附分子1,促进胶质瘤细胞增殖和转移[13]。此外,骨肉瘤来源的外泌体中miR-1307的高表达可促进骨肉瘤细胞增殖并抑制细胞凋亡[14]。鼻咽癌细胞来源外泌体通过miR-9靶向MDK和调节PDK/AKT信号通路,抑制HUVECs血管生成和迁移[15]。本研究成功分离鼻咽癌细胞CNE1外泌体(CNE1-Exo),随后用CNE1-Exo处理HUVECs发现,CNE1-Exo可促进HUVECs增殖和血管生成。该研究结果表明,CNE1以外泌体的形式,促进HUVECs增殖和血管生成。
LncRNAs是超过200个核苷酸长的转录本,没有编码潜力,但其在肿瘤发生、发展过程中具有一定的致癌或抑癌作用[16]。已有研究表明,敲低LncTUG1可抑制口腔鳞状细胞癌细胞增殖并诱导凋亡,促进自然杀伤细胞杀伤敏感性[17]。LncTUG1在鼻咽癌细胞中高表达,抑制LncTUG1表达可显著降低鼻咽癌细胞的增殖、迁移、侵袭和上皮间质转化[18]。不难看出,LncTUG1可能是鼻咽癌诊断、预后和治疗的有效靶点。本研究检测了人鼻咽癌细胞株CNE1、CNE2、HONE1和正常鼻咽上皮NP69中lncTUG1的表达,发现LncTUG1在鼻咽癌细胞中呈高表达,其中CNE1表达差异最明显。
一些研究表明,癌源性外泌体LncRNAs具有功能性,可以向邻近细胞传递不同的表型模式,如耐药性和血管生成增加[19]。外泌体LncRNAs在肿瘤早期诊断、治疗监测和预后评估中具有潜在临床应用价值[20]。用高表达LncSNHG14的乳腺癌细胞来源的外泌体处理癌细胞,可诱导其曲妥珠单抗耐药性,而敲低LncSNHG14可消除这种作用[2]。LncMALAT1在转移性上皮性卵巢癌细胞及其外泌体中表达上调。上皮性卵巢癌细胞外泌体中LncMALAT1通过外泌体转移到受体HUVECs中,介导HUVECs促血管生成活性[22]。本研究结果显示,LncTUG1在CNE1来源外泌体中高表达,用CNE1来源外泌体处理HUVECs后,HUVECs中LncTUG1表达升高,HUVECs增殖能力和血管生成能力升高;敲低LncTUG1后,CNE1来源外泌体中LncTUG1表达下调,对应的HUVECs中LncTUG1表达也下调,HUVECs增殖能力和血管生成能力受到抑制。
4 结论
鼻咽癌细胞外泌体通过LncTUG1促进HUVECs增殖和血管生成,在鼻咽癌进展中发挥重要作用。该研究结果为明确鼻咽癌的发病机制和开发新的临床治疗靶点提供了新的实验依据。
