ACVR1对成牙本质细胞极性及牙本质形成的作用
2022-03-23王爽爽史册刘苍维胡月周怡君闫广兴孙宏晨
王爽爽,史册,刘苍维,胡月,周怡君,闫广兴,孙宏晨
(1.中国医科大学口腔医学院·附属口腔医院口腔病理科,辽宁省口腔疾病重点实验室,沈阳 110002;2.吉林大学口腔医院病理科,长春 130021;3.中国医科大学口腔医学院·附属口腔医院口腔修复科,辽宁省口腔疾病重点实验室,沈阳 110002;4.吉林大学口腔医院修复科,长春 130021)
牙本质是牙齿的主体结构,是由分化成熟的成牙本质细胞分泌的基质矿化形成。在成牙本质细胞分化过程中,细胞的极化是成牙本质细胞成熟并发挥功能不可缺少的环节。因此,研究成牙本质细胞的极化或极性建立的过程及调控机制对进一步理解牙本质的形成过程具有重要意义。细胞极性是指细胞在结构和功能上的不对称性,包括顶底细胞极性(apico-basal cell polarity,ABP)、平面细胞极性、前后细胞极性和不对称细胞分裂[1]。成牙本质细胞具有典型的ABP特征,但目前对该细胞的顶底极性所知甚少。已有对ABP的研究多集中于上皮细胞,由于成牙本质细胞与上皮细胞在形态、功能、成分及发育过程中存在很多相似之处[2],因此,本研究拟基于对上皮细胞极性的了解探讨成牙本质细胞的极性特征。
成牙本质细胞的分化过程有多种信号通路参与,其中,骨形态发生蛋白(bone morphogenetic protein,BMP) 信号通路在此过程中必不可少[3]。本研究组已证明在小鼠牙源性间充质中敲除BMP受体活化素A受体1(activin A receptor type 1,Acvr1) 基因后,形成骨样牙本质[4],且前期牙本质增厚[5],但具体的细胞学机制尚不明确。因此,本研究通过在小鼠牙源性间充质细胞中敲除Acvr1基因,用组织学和免疫荧光(immunofluorescence,IF) 染色等方法进一步探索ACVR1在成牙本质细胞极性和牙本质形成中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:利用基因型为Acvr1 fx/fx和Acvr1 +/-;Osterix-Cre(+)/(-) 的基因修饰小鼠配对合笼[5],收集子代小鼠。敲除组小鼠基因型为Osterix-Cre(+)/(-);Acvr1fx/-,对照组小鼠基因型为Osterix-Cre(+)/(-);Acvr1fx/+。收集出生后21 d(postnatal day 21,PN21) 小鼠下颌骨用于本研究。
1.1.2 仪器及试剂:荧光倒置显微镜(日本Olympus公司);包埋机、切片机(德国Leica公司);小鼠抗GM130抗体(美国B&D公司);小鼠抗顶端极性蛋白激酶C zeta(protein kinases C Zeta,PKCζ) 抗体(美国Santa Cruze公司);兔抗ZO-1抗体、FITC标记亲和纯化山羊抗兔IgG、Alexa Fluor 594标记的山羊抗小鼠IgG(美国Proteintech公司);DAPI溶液、天狼星红试剂盒(中国Solarbio公司)。
1.2 方法
1.2.1 标本制备:收集对照组及敲除组PN21小鼠,分离下颌骨,4%多聚甲醛4 ℃固定过夜,次日15%EDTA脱钙,脱钙3周后梯度乙醇脱水,二甲苯透明,浸蜡,包埋。3 μm厚度连续切片,于4 ℃保存。
1.2.2 苏木素-伊红(hematoxylin-eosin,HE) 染色:烤片,常规脱蜡至水,苏木素染色5 min,冲洗,分化10 s,返蓝10 s,伊红染色10 min。常规梯度脱水、透明,中性树胶封片,观察拍照,常温保存。
1.2.3 IF染色:将切片常规脱蜡至水后,置于PBS缓冲液中,95 ℃柠檬酸水浴修复5 min,冷却至室温,PBS冲洗5 min 3次,BSA室温封闭1 h,加入一抗(ZO-1,1∶100;GM130,1∶200;PKCζ,1∶200),37 ℃孵育2 h,PBS冲洗5 min 3次,荧光二抗(羊抗兔或羊抗鼠) 室温避光孵育2 h,PBS冲洗5 min 3次,水溶性防淬灭DAPI封片后拍照。
1.2.4 天狼星红染色:将切片常规脱蜡至水,铁苏木素染色液weigert A和B染液按1∶1混合,用移液枪吸取100 μL(取液量以能完全覆盖组织面为准) 混合液滴于组织上,湿盒内染色20 min,水洗5 min后,将天狼星红染色液100 μL滴于组织上,湿盒内37 ℃染色1 h,流水稍微冲洗,去除切片表面染液。常规脱水、透明,中性树胶封固。明场和偏光镜下拍照,染色后的切片常温保存。
2 结果
2.1 Acvr1敲除后形成骨样牙本质,成牙本质细胞形态异常
PN21小鼠下颌切牙标本HE染色可见,对照组小鼠切牙矿化牙本质和前期牙本质分界清晰平坦,且厚度均匀(图1B),成牙本质细胞呈高柱状,细胞排列整齐有序(图1C),并可见细胞核远离牙本质侧,位于细胞的基底端(图1C放大图)。与对照组相比,敲除组小鼠切牙矿化牙本质和前期牙本质分界线曲折不平,厚度不均,前期牙本质层明显增厚(图1F),牙尖处有细胞埋在牙本质内形成骨样牙本质(图1E箭头处),成牙本质细胞排列散乱不规则(图1F),细胞丧失高柱状形态,变为矮柱状或立方状,细胞核排列不规律(图1F放大图)。说明ACVR1通过影响成牙本质细胞的极性促进了成牙本质细胞的分化,从而影响牙本质的形成。
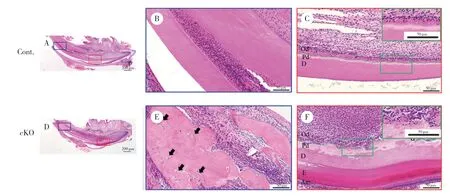
图1 PN21小鼠下颌切牙HE染色Fig.1 HE staining of mandibular incisors in mice at PN21
2.2 Acvr1基因敲除后成牙本质细胞内极性相关蛋白定位异常
IF染色结果显示,对照组小鼠成牙本质细胞内紧密连接蛋白ZO-1(图2B、2D) 和PKCζ(图3B、3D)均匀有序表达于细胞顶端,而在敲除组小鼠切牙成牙本质细胞内,上述蛋白表达位置由细胞顶端转移至细胞基底侧,且排列不规则(图2F、2H、3F、3H)。同样,GM130 IF染色可见高尔基体相对细胞核的位置发生改变,对照组高尔基体位于胞核的顶端侧(图4B、4D),而敲除组小鼠成牙本质细胞内高尔基体与细胞核的位置不固定,大部分高尔基体位于细胞核的牙髓侧即细胞底端,有些则位于细胞侧面(图4F、4H)。说明ACVR1参与调节细胞内紧密连接蛋白、极性蛋白和高尔基体的定位,从而促进成牙本质细胞的极化。

图2 PN21小鼠下颌切牙ZO-1免疫荧光染色Fig.2 IF staining of ZO-1 in mandibular incisors at PN21
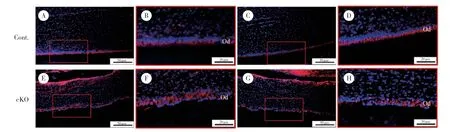
图3 PN21小鼠下颌切牙PKCζ免疫荧光染色Fig.3 IF staining of PKCζ in mandibular incisors at PN21

图4 PN21小鼠下颌切牙GM130免疫荧光染色Fig.4 IF staining of GM130 in mandibular incisors at PN21
2.3 Acvr1基因敲除后牙本质胶原纤维无序排列且成熟度降低
对PN21小鼠切牙行HE染色和IF染色,结果表明,Acvr1基因敲除后成牙本质细胞丧失极性形态,推测成牙本质细胞功能可能受到影响。因此,利用天狼星红染色检测牙本质胶原的排列和成熟程度。偏振光显微镜下可见对照组切牙牙本质胶原染色呈鲜亮的橙红色(图5B),胶原纤维束有序排列(图5E、5F、5G),而敲除组小鼠牙本质胶原染色呈黄绿色(图5D),成熟程度较低,且可见胶原纤维排列稀疏不规则(图5H、5I、5J)。说明ACVR1促进了牙本质胶原的有序排列和成熟。

图5 PN21小鼠下颌切牙天狼星红染色Fig.5 Sirius red staining of mandibular incisors at PN21
3 讨论
上皮细胞顶底极性具有以下特征:(1) 相邻两极性上皮细胞之间形成紧密连接、黏附连接、缝隙连接和桥粒,其中紧密连接分隔细胞顶端面和基底侧面;(2) 极性上皮细胞内有3种极性复合体,包括PAR(PAR3/PAR6/aPKC) 复合体、Crumbs(CRB/PALS1/PATJ) 复合体和Scribble(SCRIB/LGL/DLG) 复合体,其中PAR复合体在细胞极化过程中发挥主要作用[6];(3) 细胞在建立极性的过程中细胞器发生重定位。成熟的成牙本质细胞是具有典型顶底极性特征的细胞,细胞呈高柱状紧密平行排列,细胞顶端有成牙本质细胞突突入前期牙本质和牙本质,基底面朝向牙髓侧,细胞核整齐排列在细胞基底端。成牙本质细胞的极性建立(也称极化) 是其正常分化且发挥功能的关键一步。众所周知,BMP信号通路是成牙本质细胞分化和牙本质形成过程中非常重要的信号通路,本课题组的前期研究[5]表明,Ⅰ型BMP受体Acvr1基因敲除后形成骨样牙本质,且前期牙本质增厚,为进一步研究ACVR1在成牙本质细胞分化和牙本质形成中的作用,本研究应用Osterix-Cre在小鼠牙源性间充质细胞中敲除Acvr1基因,观察牙本质的形成及细胞间连接、极性蛋白复合体及高尔基体的定位。
本研究结果显示,Acvr1基因敲除后的小鼠切牙成牙本质细胞丧失高柱状形态,细胞核排列杂乱无章,形态学上提示了成牙本质细胞的极性紊乱。为了进一步明确极性相关蛋白在成牙本质细胞中的定位,进一步行ZO-1、PKCζ和GM130 IF染色。ZO-1是细胞间紧密连接蛋白。研究[7]表明,3D培养的犬肾细胞整齐排列形成单个管状结构,而敲除紧密连接蛋白ZO-1基因后,细胞紧密连接组装和极性建立出现延迟,细胞排列杂乱无章,形成多个管腔或无管腔结构。顶端极性蛋白复合物Par6/Par3/aPKC对促进紧密连接的形成具有关键作用,其中aPKC是多种细胞建立极性过程中发挥磷酸化作用的关键酶[8]。PKCζ是aPKC的一个亚型[9],可磷酸化闭合蛋白,以促进紧密连接组装[10]。在调节细胞极性所必需的极性蛋白中,有一半以上被鉴定为aPKC的底物。aPKC的缺失会导致果蝇胚胎上皮细胞丧失顶底极性[11]。GM130是高尔基复合体的标志物,极性状态下,细胞核位于细胞的基底端,高尔基体分布在细胞核的顶端,高尔基体与细胞核的相对位置决定了具有顶底极性的细胞的分泌轴方向[8,12]。越来越多的证据表明高尔基体与细胞极化有关[12]。在小鼠浦肯野神经元中敲除高尔基体基质蛋白GM130会导致高尔基体断裂和高尔基体定位缺陷,进而使细胞分泌物极化运输受损,细胞形态改变,浦肯野细胞树突萎缩[13]。因此,ZO-1、PKCζ和高尔基复合体的定位决定了细胞的极化状态。本研究中,IF染色结果表明这3种蛋白在敲除组中的定位均出现异常,说明Acvr1基因敲除后,可能通过影响PKCζ的定位,导致紧密连接蛋白的组装异常,成牙本质细胞不能建立极性,高尔基体定位无规律,进一步影响成牙本质细胞分泌牙本质基质。
此外,HE染色结果还显示,Acvr1基因敲除后,矿化牙本质和前期牙本质之间以及前期牙本质和成牙本质细胞层之间的分界线曲折不平,前期牙本质和矿化牙本质厚度不均,还可见骨样牙本质形成,这可能是由于牙本质胶原分泌和(或) 矿化过程受到影响。成牙本质细胞分泌牙本质基质的方向由高尔基体与细胞核的相对位置决定,GM130定位异常提示成牙本质细胞不能正常建立极性,进一步影响细胞器的定位,使细胞分泌轴的方向改变,导致骨样牙本质的形成,同时也影响细胞的分泌功能[12],导致矿化牙本质和前期牙本质之间以及前期牙本质和成牙本质细胞层之间分界不清。为了进一步明确Acvr1基因敲除后成牙本质细胞的分泌功能是否受到影响,行天狼星红染色,结果发现Acvr1基因敲除后牙本质胶原排列不整齐,且胶原成熟度降低。提示丧失极性的成牙本质细胞由于细胞分泌轴的改变影响了胶原纤维的定向分泌,进而影响了胶原纤维束的有序排列和成熟。
综上所述,本研究探讨了小鼠牙源性间充质中ACVR1在调节成牙本质细胞极性和促进牙本质形成中的作用,发现ACVR1可能通过定位PKCζ促进紧密连接蛋白的组装,高尔基体重定位,使成牙本质细胞建立极性,进而有序分泌牙本质基质并矿化形成牙本质。但ACVR1影响成牙本质细胞极性的具体机制以及对牙本质基质分泌和(或) 矿化阶段的影响仍需进一步探讨。
