Hp阳性的早期胃癌患者肿瘤组织中miR-134和 PBP1A的表达及其临床意义
2022-03-22黄新春伍学强
薛 倩 刘 鹏 黄新春 王 燕 伍学强
胃癌是消化系统常见的恶性肿瘤之一,发病率在中国消化道恶性肿瘤中居第2位[1]。胃癌的病因尚未完全阐明,研究表明幽门螺杆菌(Hp)感染是胃癌发生、发展的主要危险因素之一[2]。故探究评估Hp感染胃癌发生、发展及预后的生物标志物是目前临床上研究的难点和热点。miR-134在肿瘤的发生、发展中起重要作用,可抑制结直肠癌、肾癌、肝癌等肿瘤细胞的增殖、迁移或侵袭能力[3-4]。研究表明,miR-134在胃癌中作为肿瘤抑制因子发挥作用[5]。青霉素结合蛋白1A(PBP1A)与Hp患者服用阿莫西林后产生耐药性密切相关[6]。Huang等[7]研究表明,PBP1A基因突变阳性的Hp通过抑制miR-134的表达促进胃癌上皮-间质转化,推测miR-134、PBP1A可能在胃癌的发生、发展中共同发挥作用。本文探究了Hp阳性的早期胃癌患者组织中miR-134和PBP1AmRNA的表达水平及意义,以期为Hp阳性胃癌的早期诊断和预后评估提供可靠的参考指标。
1 资料与方法
1.1 一般资料
选取2013年1月至2015年2月于北京航天总医院住院治疗并在术后经病理证实的131例胃癌患者作为研究对象,患者均经活体组织检查证实存在Hp感染。131例Hp阳性的早期胃癌患者中,男59例,女72例,年龄32~78岁,平均年龄为(60.43±10.26)岁。同期纳入131例Hp阴性的早期胃癌患者作为对照,其中男54例,女77例,年龄30~78岁,平均年龄为(60.24±10.83)岁。
纳入标准:(1)符合2010年卫生部发布并实施的胃癌诊断标准[8],且经胃镜及病理组织学检查确诊为早期胃癌者,早期胃癌定义为肿瘤组织仅侵及胃黏膜层及黏膜下层,而不论肿瘤大小及有无淋巴结转移;(2)临床资料记录完整者;(3)无胃镜检查禁忌证者;(4)无其他消化系统疾病者。排除标准:(1)有肝、肾、心、肺等脏器功能不全及相关手术史者;(2)伴有其他感染性疾病者;(3)合并其他类型恶性肿瘤者;(4)同时参与其他研究者。本研究中所有患者均由两名及以上主治医师明确诊断,均由专业人员详细告知研究内容并签署知情同意书。本研究经医院医学伦理委员会批准。
1.2 主要试剂与仪器
RNA提取试剂盒(货号dp419)购自天根生化科技(北京)有限公司;miScript SYBR®Green qPCR Kit(货号218076)购自德国QIAGEN公司;反转录试剂盒(货号ALH266-PTO)购自北京百奥莱博科技有限公司。CFX384实时荧光定量PCR(real-time qPCR)仪购自美国Bio-Rad公司。
1.3 样品采集及保存
经腹腔镜胃癌根治术获取早期胃癌患者的肿瘤组织及癌旁组织(距离肿瘤病灶边缘>5 cm),之后进行石蜡包埋,制成组织标本,置于-80 ℃保存待测。记录患者的临床病理特征参数,主要包括肿瘤最大径、分化程度、Borrmann分型、淋巴结转移情况。
1.4 miR-134和PBP1A mRNA表达水平的检测
采用qRT-PCR法检测早期胃癌患者肿瘤组织及癌旁组织中miR-134和PBP1AmRNA的表达水平。使用RNA试剂盒提取组织总RNA,用反转录试剂盒将RNA反转录为cDNA,具体操作步骤严格按照试剂盒说明书进行。应用qRT-PCR仪对miR-134、PBP1A及 其 内 参(U6、GAPDH)进行扩增,引物序列见表1。qRT-PCR反应体系共 20 µL,包括cDNA(50 ng/µL)2 µL、miScript SYBR®Green Mix 10 µL、上下游引物(10 µM)各0.8 µL、ddH2O 6.4 µL。引物由生工生物工程(上海)股份有限公司合成。反应条件:95 ℃预变性5 min; 95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个 循 环。每份样品均设3个重复孔,采用2-ΔΔCT法计算肿瘤组织及癌旁组织中miR-134、PBP1AmRNA的相对表达量。

表1 引物序列
1.5 随访
采用电话或复查的方式对131例Hp阳性的早期胃癌患者进行为期5年的随访,术后第1~3年每3~6个月随访1次,之后每6个月随访1次。记录患者的生存情况,其生存期从手术之日起计算,随访截至2020年2月29日或患者死亡。
1.6 统计学分析
应用SPSS 23.0软件对数据进行统计学分析。计量资料均符合正态分布,以均数±标准差(x±s)表示,两组间比较行t检验。计数资料以例(%)表示,组间比较行χ2检验。Hp阳性的早期胃癌患者肿瘤组织中miR-134与PBP1AmRNA的关系采用Pearson相关性分析。采用Kaplan-Meier法分析Hp阳性的早期胃癌患者肿瘤组织中miR-134、PBP1AmRNA的表达水平与患者术后生存的关系,并行Log-rank检验。采用Cox多因素回归分析影响Hp阳性的早期胃癌患者术后生存的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 Hp阳性的早期胃癌患者组织中miR-134和PBP1A mRNA表达水平的比较
Hp阳性的早期胃癌患者肿瘤组织中miR-134的相对表达量为0.37±0.12,PBP1AmRNA的相对表达量为0.30±0.11,均低于癌旁组织(1.00±0.31、1.00±0.33),差异均有统计学意义(P均<0.05)。
2.2 Hp阳性与Hp阴性的早期胃癌患者组织中miR-134和PBP1A mRNA表达水平的比较
与Hp阴性的早期胃癌患者比较,Hp阳性的早期胃癌患者组织中miR-134和PBP1AmRNA的表达水平均较低,差异均有统计学意义(P均< 0.05)。见表2。

表2 Hp阳性和Hp阴性早期胃癌患者肿瘤组织中miR-134和PBP1A mRNA表达水平的比较
2.3 Hp阳性的早期胃癌患者组织中miR-134与PBP1A mRNA的关系
Pearson相关性分析结果显示,Hp阳性的早期胃癌患者组织中miR-134与PBP1AmRNA呈正相关(r=0.503、P<0.05)。见图1。
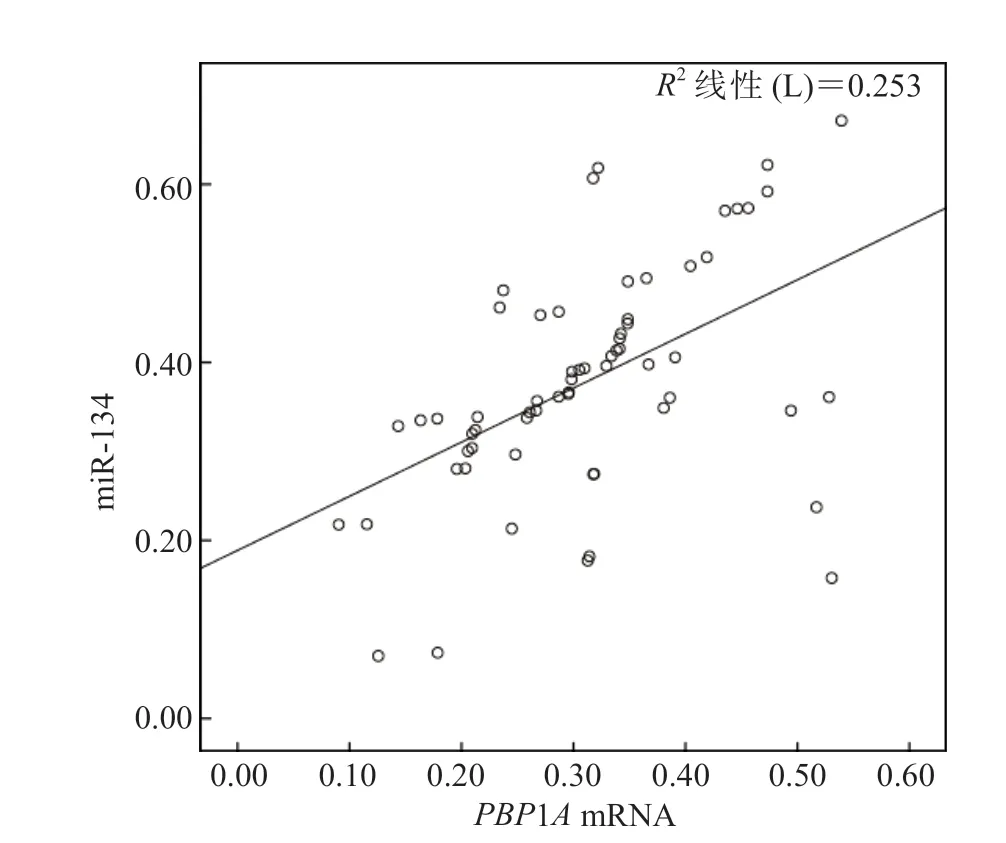
图1 Hp阳性的早期胃癌患者组织中miR-134与PBP1A mRNA的相关性分析
2.4 Hp阳性的早期胃癌患者组织中miR-134和PBP1A mRNA的表达水平与临床病理特征的关系
以Hp阳性的早期胃癌患者组织中miR-134相对表达量的平均值将患者分为高表达miR-134组(>0.37,67例)和低表达miR-134组(≤0.37,64例),以PBP1AmRNA相对表达量的平均值将患者分为高表达PBP1AmRNA组(>0.30,65例)和低表达PBP1AmRNA组(≤0.30,66例)。结果显示,Hp阳性的早期胃癌患者组织中miR-134、PBP1AmRNA的表达水平与年龄、肿瘤最大径无关(P>0.05),而与肿瘤分化程度、Borrmann分型、淋巴结转移有关(P<0.05)。见表3。

表3 miR-134和PBP1A mRNA与Hp阳性的早期胃癌患者临床病理特征的关系
2.5 Hp阳性的早期胃癌患者组织中miR-134、PBP1A mRNA的表达与患者术后生存情况的关系
Kaplan-Meier法分析结果显示,低表达miR-134组的5年生存率为23.44%(15/64),低于高表达miR-134组(47.76%,32/67);低表达PBP1AmRNA组的5年生存率为19.70%(13/66),低于高表达PBP1AmRNA组(52.30%,34/65),组间差异均有统计学意义(P均<0.05)。见图2、图3。

图2 Hp阳性的早期胃癌患者肿瘤组织中miR-134的表达水平与患者生存情况的关系
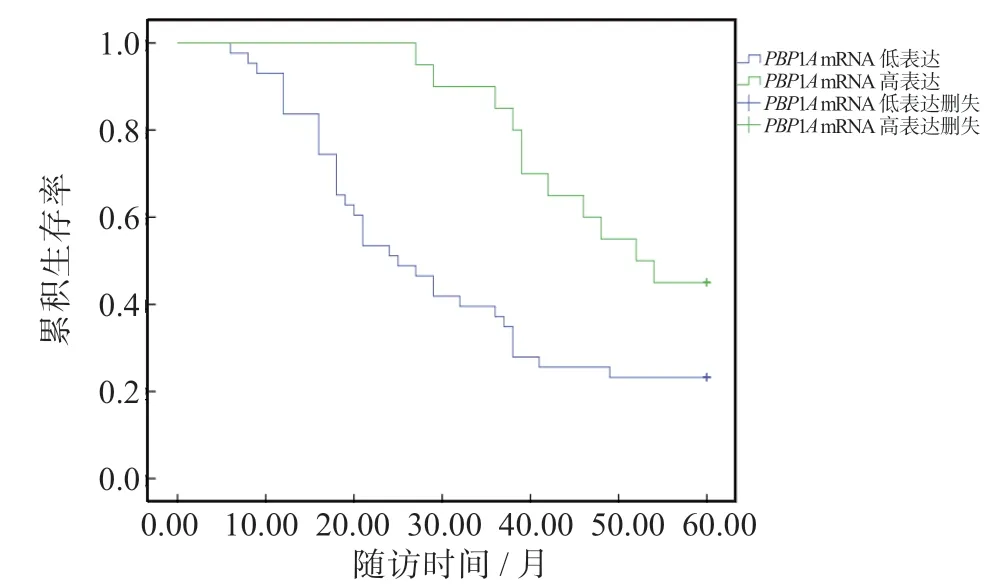
图3 Hp阳性的早期胃癌患者肿瘤组织中PBP1A mRNA的表达水平与患者生存情况的关系
2.6 影响Hp阳性的早期胃癌患者术后生存的危险因素
以Hp阳性的早期胃癌患者术后生存情况作为因变量,以肿瘤分化程度、Borrmann分型、淋巴结转移、miR-134、PBP1AmRNA作为自变量,纳入Cox多因素回归分析,结果显示低表达miR-134、低表达PBP1AmRNA是Hp阳性的早期胃癌患者术后生存的独立危险因素(P<0.05)。见表4。
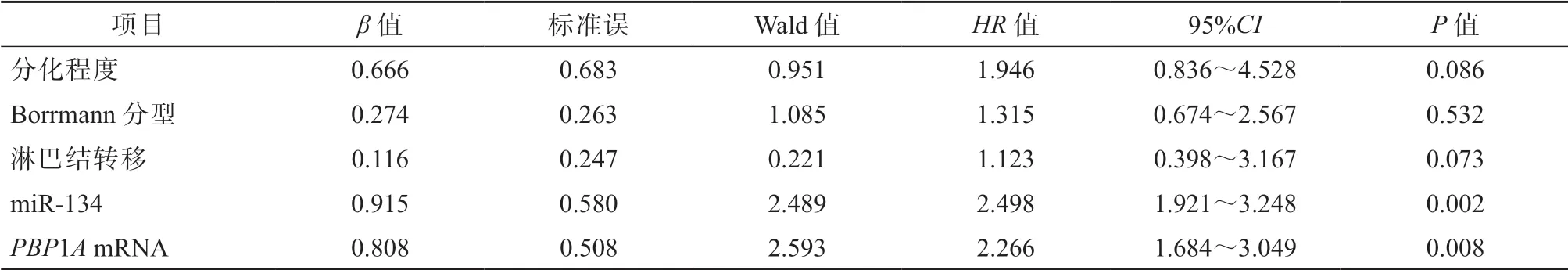
表4 影响Hp阳性的早期胃癌患者术后生存的多因素分析
3 讨论
胃癌是全球病死率较高的恶性肿瘤,长期酗酒或吸烟、饮食习惯不良、过度情绪压抑、真菌、毒素等均是引发胃癌的危险因素[9]。研究表明,Hp感染是消化性溃疡、慢性胃炎的致病因素,且与胃癌的发生密切相关[10]。探寻能够准确预测Hp阳性的早期胃癌患者预后情况的相关指标,有助于为肿瘤发生、发展的分子机制研究提供新的治疗靶基因,以便对患者进行针对性根除Hp治疗,提高治疗的特异性,从而降低预后不良的发生率。
miRNA参与各种细胞功能的改变,其异常表达可导致多种肿瘤疾病的发生和发展,目前基于miRNA的靶向治疗已成为近年来肿瘤治疗研究的热点[11]。研究表明,miR-134可调控胚胎干细胞的发育和分化,调控神经系统神经元的功能,参与肿瘤细胞的多药耐药机制,并且与肿瘤的生物学及临床特征相关[12]。本研究结果显示,Hp阳性的早期胃癌患者肿瘤组织中miR-134的表达水平低于癌旁组织,且Hp阳性的早期胃癌患者组织中miR-134的表达水平低于Hp阴性的早期胃癌患者。徐强等[13]研究发现,胃癌组织中miR-134的表达水平较低,且与术后辅助化学治疗的预后有关。Liu等[14]研究显示,与癌旁非癌组织相比,胃癌组织中miR-134的表达水平显著下降。以上结果均提示低表达miR-134可能是导致胃癌发生的重要因素,且Hp感染可影响miR-134的表达水平。此外,本研究发现低表达miR-134的患者5年生存率低于高表达miR-134者,且低表达miR-134是影响Hp阳性的早期胃癌患者术后生存的独立危险因素。miRNA可在转录后水平负性调节靶基因表达,由此推测本研究中miR-134的表达下调可能造成肿瘤细胞中部分靶基因和靶蛋白表达上调,进而促进胃癌细胞的发生和转移,导致患者的生存率降低。
PBP是能与青霉素G共价结合的细菌内膜靶位点,是一系列合成细菌细胞壁肽聚糖层的酶,其中PBP1是PBP中相对分子质量较高的一种酶[15]。本研究结果显示,Hp阳性的早期胃癌患者肿瘤组织中PBP1AmRNA水平低于癌旁组织,这提示低表达PBP1AmRNA可能与胃癌的发生、发展密切相关。本研究指出,低表达PBP1AmRNA患者的5年生存率低于高表达PBP1AmRNA者,且低表达PBP1AmRNA是影响Hp阳性的早期胃癌患者术后生存的独立危险因素。在胃癌术后抗Hp治疗中,阿莫西林是一种重要的治疗药物,它可专一地与细菌内膜上靶位点结合,使细菌由于胞壁破裂而死亡[16]。研究表明,PBP基因突变可使阿莫西林无法与Hp结合,这可能是阿莫西林耐药性产生的主要原因[17]。本研究中低表达PBP1AmRNA患者的5年生存率较低,推测低表达PBP1AmRNA不利于患者存活。此外,本研究结果显示,Hp阳性早期胃癌患者肿瘤组织中miR-134与PBP1AmRNA的表达水平呈正相关,且二者均与肿瘤组织分化程度、Borrmann分型、淋巴结转移有关。这进一步提示miR-134、PBP1AmRNA可能通过相互作用参与Hp阳性早期胃癌的发生和发展。
综上所述,miR-134、PBP1AmRNA在Hp阳性早期胃癌患者肿瘤组织中的表达水平较低,且与肿瘤组织分化程度、Borrmann分型、淋巴结转移及患者术后生存情况有关,二者可能在Hp阳性早期胃癌的发生和发展过程中起重要作用。miR-134、PBP1A有可能作为Hp阳性早期胃癌患者预后评估的候选标志物,对化学治疗方案的确定具有重要意义。
