沉默PRMT5基因对胃癌细胞株SGC-7901细胞 周期的影响及机制研究
2022-03-22吴雅琼王黎黎
付 波 吴雅琼 王黎黎
全球范围内的统计表明,胃癌的发病率位居恶性肿瘤的第4位,病死率位居第3位,且其发病率在中国逐年升高[1-2]。胃癌在早期以体质量降低、腹胀、烧心等亚临床症状为主,缺乏特异性,多数患者在确诊时已进入中晚期,无法进行手术治疗,仅能采取放射治疗、化学治疗等姑息性治疗方式,预后不佳[3]。随着分子遗传学、生物学及基因工程技术的不断发展,基因治疗已成为一种新的肿瘤治疗方式。蛋白质精氨酸甲基转移酶5(PRMT5)是一种细胞周期调控酶,在食管癌、乳腺癌等肿瘤中表达异常,其可通过介导细胞凋亡的信号通路参与肿瘤细胞的形成[4-5]。目前关于PRMT5在胃癌中的表达及分子调控机制的研究报道较少。本研究通过开展体外细胞实验,观察沉默PRMT5基因对人胃癌细胞株SGC-7901的细胞周期、凋亡的影响,并探讨相关机制。
1 材料与方法
1.1 试剂和仪器
正常胃黏膜细胞系GES-1和人胃癌细胞株SGC-7901均购自武汉普诺赛生命科技有限公司;PRMT5小干扰RNA(siRNA)、阴性对照载体(NC siRNA)均由上海吉玛制药技术有限公司合成;碘化丙啶(PI)染色液、AnnexinⅤ-FITC试剂盒均购自北京中杉金桥生物技术有限公司;兔抗人PRMT5、蛋白激酶B(AKT)、磷酸化AKT (p-AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)、p-mTOR一抗均购自美国Abcam公司;FACSCanto Ⅱ流式细胞仪购自美国BD公司;CheniDoc XRS+化学发光成像分析系统购自美国Bio-rad公司。
1.2 细胞培养
SGC-7901细胞在标准环境下(5% CO2、37 ℃、饱和湿度)培养于RPMI-1640培养基(含有10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素)中;GES-1细胞在标准环境下培养于DMEM培养基(含有10%胎牛血清和1%双抗)中。在细胞生长至融合度≥80%时,经0.25%胰蛋白酶(含0.01% EDTA)消化、传代,取对数生长期细胞用于后续实验。
1.3 PRMT5蛋白相对表达量的检测
采用蛋白质印迹法检测细胞PRMT5蛋白的相对表达量。选取GES-1细胞和SGC-7901细胞,预冷PBS缓冲液,预冷RIPA细胞裂解液,采用BCA法定量蛋白浓度。取40 μg待测样本上样,经10% SDS聚丙烯酰氨凝胶电泳后湿转至膜,室温下封闭液封闭2 h,加入稀释度为1∶500的PRMT5一抗, 4 ℃摇床孵育过夜,洗涤,加入稀释度为1∶2 000的山羊抗兔二抗,室温孵育1 h,暗室中曝光、显影、定影,使用凝胶成像系统扫描。PRMT5蛋白的相对表达量以“PRMT5蛋白条带灰度值/内参GAPDH条带灰度值”表示。
1.4 SGC-7901细胞转染和分组
在SGC-7901细胞生长至融合度≥90%时弃去培养液,用胰蛋白酶消化,取对数生长期细胞接种至6孔板,每孔2 mL,细胞密度为1×105个/mL, 培养过夜。将SGC-7901细胞分为control组、NC组、PRMT5 siRNA组和PRMT5 siRNA+胰岛素样生长因子-Ⅰ(IGF-Ⅰ)组,其中control组不进行处理,NC组按照LipofectamineTM3000脂质体法转染说明书转染NC siRNA,PRMT5 siRNA组转染PRMT5 siRNA,PRMT5 siRNA+IGF-Ⅰ组 转 染PRMT5 siRNA并加入IGF-Ⅰ使其终浓度为10 ng/mL。 转染48 h后,采用蛋白质印迹法检测各组细胞PRMT5蛋白的相对表达量。
1.5 细胞周期的检测
采用PI染色法检测细胞周期。在各组细胞生长至融合度≥80%时,使用0.25%胰蛋白酶消化,终止培养,将细胞转移至15 mL离心管中,以 2 000 r/min在4 ℃下离心5 min;PBS液冲洗,继续离心5 min;100 μL PBS液重悬,加入1 mL预冷的70%乙醇,混合均匀;4 ℃固定12 h,离心,PBS液冲洗;加入染液(含有25 μL的PI染液、10 μL 的RNaseA和0.5 mL的染色缓冲液),避光冰浴 30 min;使用300目细胞滤网过滤,用流式细胞仪检测细胞周期。所有操作重复3次,取均值。
1.6 AnnexinⅤ-FITC/PI双染法检测细胞凋亡率
选取各组细胞,转染48 h后,用binding buffer液充分洗涤,离心后弃上清液,用binding buffer液重悬,与5 μL的AnnexinⅤ-FITC混匀,4 ℃遮光孵育20 min,加入5 μL的PI染液并混匀,遮光孵育30 min;之后,在60 min内使用流式细胞仪检测细胞凋亡率。所有操作重复3次,取均值。
1.7 AKT、p-AKT、mTOR和p-mTOR蛋白相对表达量的检测
采用蛋白质印迹法检测各组细胞AKT、p-AKT、mTOR和p-mTOR蛋白的相对表达量。选取各组细胞,操作步骤同1.3小节,目的蛋白的相对表达量以“目的蛋白条带灰度值/内参GAPDH条带灰度值”表示。
1.8 统计学方法
应用SPSS 21.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间比较采用LSD-t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两种细胞中PRMT5蛋白的相对表达量比较
蛋白质印迹法检测结果表明,SGC-7901细胞中PRMT5蛋白的相对表达量为0.86±0.09,显著高于GES-1细胞(0.42±0.06),两组差异有统计学意义(P<0.05)。见图1。
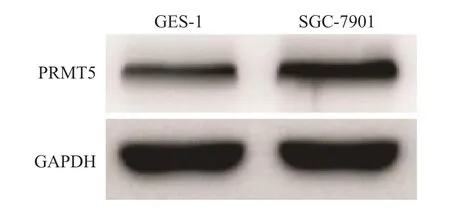
图 1 蛋白质印迹法检测两种细胞中PRMT5蛋白的表达水平
2.2 SGC-7901细胞各组中PRMT5蛋白的相对表达量比较
蛋白质印迹法检测结果表明,control组、NC组、PRMT5 siRNA组和PRMT5 siRNA+IGF-Ⅰ组中PRMT5蛋白的相对表达量分别为0.85±0.08、0.87±0.09、0.21±0.03和0.50±0.06。与control组、NC组比较,PRMT5 siRNA组中PRMT5蛋白的相对表达量均较低,差异均有统计学意义(P均<0.05); 与PRMT5 siRNA组比较,PRMT5 siRNA+IGF-Ⅰ组中PRMT5蛋白的相对表达量较高,差异有统计学意义(P<0.05)。control组与NC组中PRMT5蛋白的相对表达量差异无统计学意义(P>0.05)。见图2。
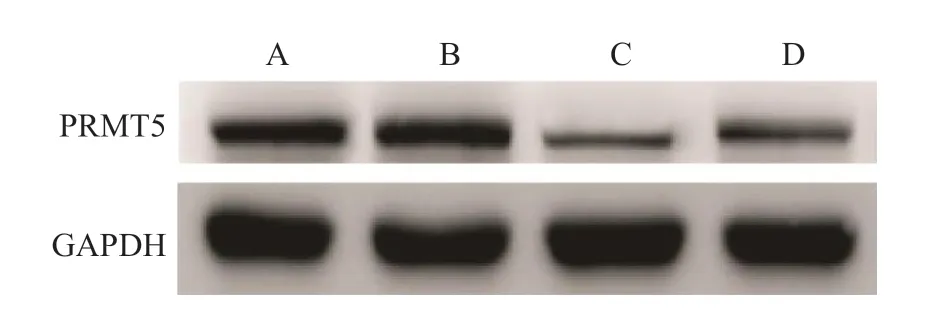
图 2 蛋白质印迹法检测各组中PRMT5蛋白的表达水平
2.3 各组细胞周期情况的比较
流式细胞仪检测结果表明,与control组、NC组比较,PRMT5 siRNA组中G0/G1期细胞的占比较高,而S期、G2/M期细胞的占比较低,差异均有统计学意义(P均<0.05);与PRMT5 siRNA组比较,PRMT5 siRNA+IGF-Ⅰ组中G0/G1期细胞的占比较低,而S期、G2/M期细胞的占比较高,差异均有统计学意义(P均<0.05)。control组与NC组中 G0/G1期、S期、G2/M期细胞的占比差异均无统计学意义(P均>0.05)。见表1。

表1 各组细胞周期情况的比较/%
2.4 各组细胞凋亡率的比较
AnnexinⅤ-FITC/PI双染法检测的结果表 明,control组、NC组、PRMT5 siRNA组 和PRMT5 siRNA+IGF-Ⅰ组的细胞凋亡率分别为(1.57±0.32)%、(1.60±0.31)%、(35.74±4.96)%和(15.24±2.07)%。与control组、NC组 比 较,PRMT5 siRNA组的细胞凋亡率均较高,差异均有统计学意义(P均<0.05);与PRMT5 siRNA组比较,PRMT5 siRNA+IGF-Ⅰ组的细胞凋亡率较低,差异有统计学意义(P<0.05)。control组与NC组的细胞凋亡率差异无统计学意义(P>0.05)。见图3。

图3 流式细胞仪检测各组细胞的凋亡率 A control组 B NC组 C PRMT5 siRNA组 D PRMT5 siRNA+IGF-Ⅰ组
2.5 各组细胞p-AKT/AKT和p-mTOR/mTOR的比较
与control组、NC组 比 较,PRMT5 siRNA组细胞p-AKT/AKT、p-mTOR/mTOR均较低,差异均有统计学意义(P均<0.05);与PRMT5 siRNA组比较,PRMT5 siRNA+IGF-Ⅰ组细胞p-AKT/AKT、p-mTOR/mTOR较高,差异有统计学意义(P<0.05)。control组与NC组细胞p-AKT/AKT、p-mTOR/mTOR 的差异无统计学意义(P>0.05)。见表2、图4。

图 4 蛋白质印迹法检测各组AKT、p-AKT、mTOR、p-mTOR蛋白的表达水平
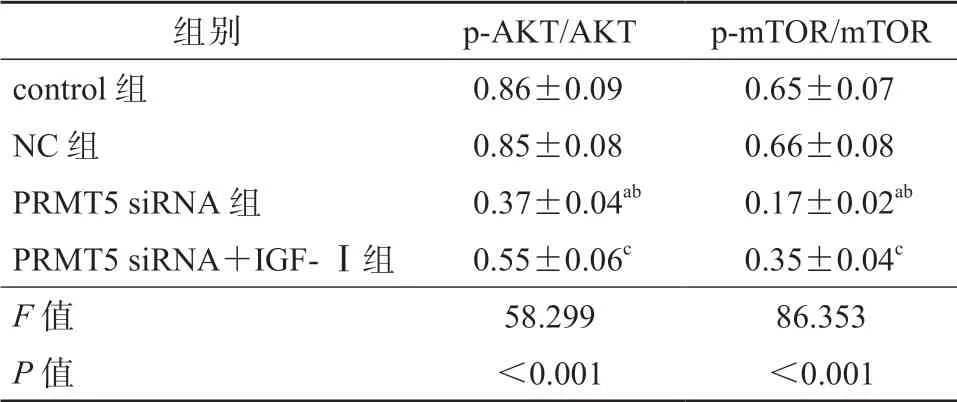
表 2 各组细胞p-AKT/AKT、p-mTOR/mTOR的比较
3 讨论
胃癌是由多种致病因素综合作用的结果,幽门螺杆菌感染、胃息肉史、不良饮食习惯、遗传等均为胃癌发病的危险因素[6-7]。目前手术治疗、放射治疗和化学治疗是胃癌的主要治疗方式,可在一定程度上延长患者的生存时间,但上述治疗方式在中晚期患者的治疗中效果并不理想。研究表明,已发现有140余种基因表达异常或基因产物变异参与了胃癌的发展进程[8-9]。本研究结果显示,与正常胃黏膜细胞系GES-1比较,人胃癌细胞株SGC-7901中PRMT5蛋白的表达水平升高,这提示PRMT5基因异常高表达于胃癌细胞中,沉默该基因可能会为胃癌的治疗提供新的思路。
PRMT5定位于哺乳动物的细胞核及细胞质中,其不仅是重要的表观遗传酶,而且是介导实体肿瘤发展进程的促癌基因,可通过调控转录后表达、RNA加工、可变剪切诱导甲基化组蛋白、非组蛋白底物精氨酸残基发生甲基化,调控多条信号通路及靶基因,参与细胞增殖、分化、凋亡及肿瘤形成等过程。研究表明,PRMT5异常高表达于非小细胞肺癌、结直肠癌、膀胱癌等多种实体瘤中,且其表达水平与肿瘤TNM分期、分化程度、远处转移及淋巴结转移、预后等密切相关[10-12]。Liu等[13]在研究胃癌的发病机制时发现,癌基因c-Myc可与PRMT5直接相互作用,促进胃癌细胞的生长,这提示PRMT5具有促进胃癌进展的作用。本研究结果显示,与control组比较,PRMT5 siRNA组中G0/G1期细胞的占比、细胞凋亡率较高,而S期、 G2/M期细胞的占比较低,这提示沉默PRMT5基因可将细胞阻滞于G0/G1期,并促进其凋亡。
PI3K是酪氨酸激酶下游重要的信号元件,可通过激活细胞膜上的第二信使诱导下游AKT、mTOR表达。PI3K介导的信号通路异常激活在肿瘤的形成过程中起着重要作用,可引发AKT依赖性或不依赖性信号转导,调控肿瘤细胞的增殖、分化、迁移、凋亡等过程[14]。Xu等[15]研究发现,PI3K/AKT信号通路是促进胃癌进展的主要通路之一,使用该通路抑制剂可抑制胃癌细胞增殖,其可能是治疗胃癌的潜在靶标。蛋白质磷酸化是指由蛋白质激酶催化,将ATP的磷酸基转移至底物蛋白质氨基酸残基上的过程,在细胞信号转导的过程中起着重要作用,也是调控蛋白质功能的重要机制。部分蛋白质可通过磷酸化发挥生物调节作用,磷酸化蛋白/总蛋白表示总蛋白被激活的程度。本研究结果显示,转染PRMT5 siRNA可降低SGC-7901细胞的p-AKT/AKT和p-mTOR/mTOR;在转染PRMT5 siRNA后,再添加PI3K/AKT信号通路激活剂IGF-Ⅰ,可减弱PRMT5 siRNA对SGC-7901细胞周期的阻滞作用及细胞凋亡的促进作用,这提示PRMT5可能通过抑制PI3K/AKT信号通路参与胃癌细胞周期及凋亡的调控。
综上所述,沉默PRMT5基因可阻滞人胃癌细胞株SGC-7901的细胞周期,并促进其凋亡,推测其作用机制可能与抑制PI3K/AKT信号通路有关。本研究存在一定不足,如未进行体内试验,未能阐明PRMT5基因在机体内的作用机制;此外,PRMT5基因可能通过多条信号通路参与胃癌的调控,需在今后的研究中持续探索,以便为临床提供更多的治疗靶点。
