不同强度启动子ACC脱氨酶工程菌株的构建及功能研究
2022-03-22刘文亮
仲 惟,李 涛 ,刘文亮,赵 君,陈 玮
(1. 河南科技大学应用工程学院,河南 三门峡 472000;2. 哈密市疾病预防控制中心,新疆 哈密 839000)
0 引言
【研究意义】植物根际促生细菌(Plant growth promoting rhizobacteria,PGPR)是指能够自主定殖于植物根际,通过产生某些特殊代谢物质可促进植物种子萌发、植株生长并提高其对矿质营养的吸收和利用,同时可抑制有害病原菌繁殖的有益微生物群落[1]。大量研究表明,农业生产中使用PGPR菌肥,可有效减少化肥及农药的施用量各30%以上,对农作物增产效果亦十分显著,甚至高达80%,因此在当前发展绿色农业、减肥增效上应用前景十分广阔[2-3]。【前人研究进展】然而PGPR菌剂在大田应用场景中的施用效果并不稳定,会受到地块位置、土壤营养状况、种植年份、种植气候及植株品系等因素的影响,如何使得在实验室有良好促生效果的PGPR菌剂能够在大田表现优良,需要探讨影响PGPR菌剂在植物根际定殖并良好稳定传代存活的机理[4]。有研究表明,PGPR在植物根际的定殖数量与其对植株的促生效果呈显著正相关[5],且PGPR在植物根际定殖行为与其对植物根系分泌物的趋化作用有关[6],将其与趋化相关的基因敲除后,PGPR在植物根际的定殖能力显著下降[7]。【本研究切入点】本课题组前期研究发现,PGPR菌的典型代表Pseudomonas putidaUW4能够趋化1-氨基环丙烷-1-羧酸(ACC),而敲除了其ACC脱氨酶(1-aminocyclopropane-1-carboxylicacid deaminase,AcdS)基因的UW4△AcdS和趋化蛋白(CheR)基因的UW4△cheR均丧失了对 ACC的趋化作用[8],表明ACC是UW4的一种新的代谢依赖型趋化物。另外,AcdS活力高的菌株在根系定殖量也明显较多[9],基于此我们推测ACC脱氨酶的催化反应速度可能影响PGPR菌株对ACC的趋化响应强度,进而影响其定殖及促生效果。【拟解决的关键问题】选用典型的产AcdS的UW4及其AcdS基因敲除突变株UW4△AcdS,采用同源重组技术将其ACC脱氨酶启动子进行替换,从而构建一系列不同ACC脱氨酶活性菌株,以此探究ACC脱氨酶活性对PGPR趋化作用的影响,分析ACC趋化反应强度与代谢速率之间的关系,从而为选育高效PGPR菌株、稳定和提高PGPR的应用效果提供理论支撑,切实为我国农业增产增收作出贡献。
1 材料与方法
1.1 菌剂、质粒及其他
恶臭假单胞菌Pseudomonas putidaUW4、UW4△AcdS为本实验室保藏菌株,由加拿大滑铁卢大学Glick教授馈赠;大肠杆菌E.coliDH5α购自TaKaRa公司;克隆用ZT4-Blunt质粒购自北京庄盟国际生物基因科技有限公司;pBBR1MCS-2表达质粒购自上海泽叶生物科技有限公司;三菌杂交辅助质粒pRK2013由广西大学生命科学学院惠赠;硝酸纤维素薄膜购自北京索莱宝科技有限公司。
1.2 不同ACC脱氨酶活性菌株的构建
1.2.1 分别构建含4种启动子的表达质粒 参照文献[10]中Braatsch20强启动子、Braatsch10中等强度启动子、Braatsch1弱启动子及UW4菌Acds基因自身启动子与目的Acds基因和终止子融合片段的序列分别进行引物设计、片段扩增及测序(表1)。将测序成功的4个片段Bra20A/ Bra10A/ Bra1A/PAA分别连接至pBBR1MCS-2质粒的MCS区,构建出含4种不同启动子序列的表达质粒。

表 1 含不同强度启动子片段的引物设计Table 1 Primers with promoters of different strength
1.2.2 三菌杂交构建目标菌株 采用三菌杂交接合转移,先将4类含不同强度启动子的pBBR1MCS-2质粒转化大肠杆菌DH5a(供体菌),分别活化UW4△AcdS(受体菌)及含质粒pRK2013的帮助菌(大肠杆菌HB101,Kana),以pBBR1MCS-2空载质粒为阴性对照。分别挑取供体菌、UW4△AcdS及帮助菌单菌落添加对应抗性,供体菌和帮助菌置于37 ℃,UW4△AcdS置于30 ℃过夜培养。培养至各菌液OD600nm≈1.0,按1∶100(V/V)分别接至LB液体培养基中培养3~4 h。培养结束后将供体菌、受体菌和帮助菌按2∶2∶1体积比进行混合,将混合菌液滴加在置于LB固体平板的硝酸纤维素膜上,30 ℃恒温静置培养24 h。吸取750 μL 0.85%的NaCl溶液将菌体从硝酸纤维素膜冲洗下来,超纯水重悬菌液(可梯度稀释)涂布于含抗性LB固体培养基,30 ℃恒温静置培养过夜,待菌落长出后进行转化子鉴定。
1.2.3 菌株生长曲线及ACC脱氨酶活性测定 将恶臭假单胞菌UW4、UW4△AcdS及鉴定过的4种含不同启动子序列的转化株进行LB培养基划线培养,待长出单菌落后各自挑取一环接至液体LB培养基,30 ℃,220 r·min-1培养过夜后调节菌液OD600nm≈ 1.0,1∶100(V/V)转接至新鲜液体LB培养基中,30 ℃,220 r·min-1开始培养,每隔1 h测定菌液OD600nm直至平台期,每个菌株平行测定3次。以菌液培养时间为横坐标,所测OD值为纵坐标,绘制各菌株生长曲线。ACC脱氨酶活力测定采用Penrose等[11]的方法,于540 nm下测定AcdS催化ACC裂解生成的α-酮丁酸的含量。
1.2.4 菌株AcdS基因表达量测定 吸取1.2.3中过夜培养的各菌液接至新鲜液体LB中,30 ℃,220 r·min-1培养至菌体OD600nm约0.5,各取6 mL,4 ℃,12 000 r·min-1,离心5 min后弃去上清,将菌体重悬转移至1.5 mL EP管中4 ℃离心1 min,液氮速冻后作为处理前样品。将剩余菌液中添加3.0 mmol·L-1ACC 诱导培养45 min后按上述操作进行处理后样品采集。提取各样品RNA后反转录合成cDNA第一链,分别设计假单胞菌属管家基因gyrB荧光定量PCR扩增F引 物:5′-CCTGTCGGAAGAGCTGGT-3′,R引物:5′-ACCGTGGACGTAAGTCTGTT-3′,AcdS片段荧光定量PCR扩增F引物:5′-ACTACATCGTGGT CTGCTCGGT-3′,R引物:5′-CA CATCCTCTTCAGT GATTTCG-3′。进行各菌株gyrB及AcdS基因的荧光定量PCR扩增,采用 2-ΔΔCt法进行各菌株AcdS基因表达量分析。
1.2.5 定性趋化试验 采用改良的点滴趋化方法[12],将构建好的4种目标菌株与UW4、UW4△Acds分别进行活化培养,各吸取菌液10 mL,4 ℃,8 000 r·min-1离心5 min收集菌体,用甘油盐液体培养基洗菌2次后重悬至10 mL,吸取2.5 mL接至250 mL 甘油盐液体 培 养 基 中 培 养24 h(需 添 加ACC 3 mmol·L-1,UW4△AcdS培养瓶中以硫酸铵代替ACC)。吸取15 mL菌液4 ℃,8 000 r·min-1离心5 min后弃上清,吸取10 mL 经4 ℃ 预冷的趋化缓冲液(CMB)洗菌3次后,将菌体重悬至OD600nm≈1.0。取2 μL 菌液滴加于10% 稀释LB游动平板中央,每个平皿中倒入10% 稀释LB培养基15 mL,在其中添加ACC 3 mmol·L-1。将此游动平板置于30 ℃培养24 h观察各菌株的定性趋化。
1.2.6 盆栽小麦生物量及根际定殖菌数测定 将小麦种子消毒后浸泡于OD600nm=1的UW4、UW4△AcdS及4种目标菌株菌悬液中吸胀处理,无菌水做空白对照,之后培养箱中催芽,将一端露白的籽粒种植于育苗穴盘,初始培养前2 d分别以不同菌液浇灌小麦植株,待植株生长约15 d后,拔出植株抖落培养土剪取根茎进行生物量测定。另剪取根部组织研磨后将匀浆上清梯度稀释后涂布于含Amp 抗性100μg·mL-1的LB固体平皿,以长出的菌落数计各菌株在小麦根际的定殖数量。
1.3 数据分析方法
采用SPSS Statistics 24.0中的Duncan检验对数据进行统计及显著性分析(P<0.05)。
2 结果与分析
2.1 目标菌株的菌液PCR鉴定
挑取三菌杂交所得转化子接至液体LB培养基中培养过夜,分别进行菌液PCR鉴定(图1),所得Bra20A、Bra10A、Bra1A目标片段约1 400 bp,PAA片段约1 800 bp,均符合预期大小,说明4种含不同启动子序列的目标菌株UW4△AcdS+Bra20A、UW4△AcdS+Bra10A、UW4△AcdS+Bra1A、UW4△AcdS+PAA构建成功。

图 1 4种目标菌株菌液RCR凝胶电泳图Fig. 1 Gel electrophoresis of 4 target strains
2.2 菌株生长曲线测定
由图2可见,UW4、UW4△AcdS及4种含不同启动子序列的目标菌株培养过程中生长速率基本一致,无显著性差异。

图 2 各菌株生长曲线对比Fig. 2 Growth of individual strains
2.3 菌株ACC脱氨酶活性对比
将UW4、UW4△AcdS、UW4△AcdS+Bra20A、UW4△AcdS+Bra10A、UW4△AcdS+Bra1A、UW4△AcdS+PAA菌株在含3 mmol·L-1ACC的液体LB培养基中过夜诱导培养,收集菌体破碎细胞进行酶活测定,结果(图3)发现,除 UW4 和 UW4△AcdS+PAA以外,各菌株ACC脱氨酶活性差异均较大(P<0.05),且酶活数值基本与启动子序列强弱呈正比关系,因此推测各菌株对ACC的趋化为代谢依赖型。

图 3 各菌株ACC脱氨酶活性对比Fig. 3 ACC deaminase activity of strains
2.4 菌株Acds基因表达量
通过实时荧光定量PCR测定各菌株在ACC诱导下的AcdS基因表达量,以未经ACC诱导的野生株UW4的表达量作为对照,测得UW4、UW4△AcdS+Bra20A、UW4△AcdS+Bra10A、UW4△AcdS+Bra1A及UW4△AcdS+PAA菌株Acds基因表达量。结果(图4)发现,UW4△AcdS+Bra20A的AcdS基因表达量最高,其次是UW4,UW4△AcdS+Bra10A、UW4△AcdS+PAA表达量较低且两者无显著性差异,UW4△AcdS+Bra1A表达量最低(P<0.05),此结果与ACC脱氨酶活测定结果规律基本一致,说明AcdS基因表达量、ACC脱氨酶活与启动子强弱之间呈现正相关,菌株的ACC脱氨酶活性越高,其对ACC代谢速率也越高。

图 4 各菌株Acds基因表达量对比Fig. 4 Acds expressions of strains
2.5 菌株对ACC的定性趋化
采用稀释LB半固体平板进行各菌株对ACC的定性趋化能力验证,结果见图5。敲除了ACC脱氨酶基因的UW4△AcdS丧失对ACC的趋化能力,含强启动子序列的UW4△AcdS+Bra20A菌株形成的趋化圈直径最大,UW4△AcdS+PAA和野生UW4形成趋化圈直径较大且数值基本一致,UW4△AcdS+Bra10A形成趋化圈略小于上述两个菌株,含弱启动子序列的UW4△AcdS+Bra1A菌所形成趋化圈直径最小,说明菌株对ACC代谢速率直接影响其ACC趋化能力的大小。

图 5 各菌株对ACC的定性趋化Fig. 5 Qualitative chemotaxis on ACC of various strains
2.6 各菌株在小麦根际定殖数量
剪取各菌株处理过的盆栽小麦的根部组织研磨后将匀浆上清涂布LB固体平板,测得各菌株在小麦根际定殖数量,结果(图6)发现,UW4△AcdS+Bra20A菌株定殖数量最多,UW4和UW4△AcdS+Bra10A定殖数量次之,此二者间无显著性差异,UW4△AcdS+PAA菌株定殖数量一般,UW4△AcdS和UW4△AcdS +Bra1A菌株定殖数量较少,此二者亦无显著性差异(P<0.05)。
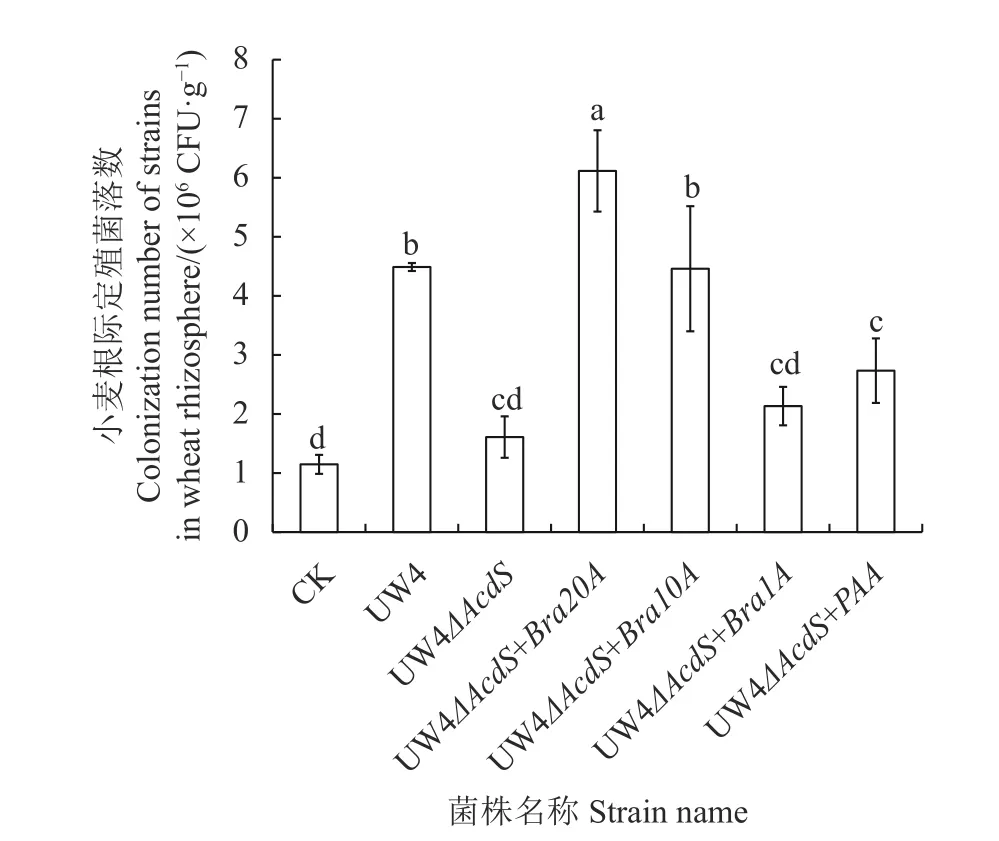
图 6 各菌株在小麦根际定殖数量Fig. 6 Colonization number of strains in wheat rhizosphere
2.7 菌株对盆栽小麦生物量影响
各菌悬液进行小麦种子处理后进行盆栽试验,待植株生长15 d后剪取其根部和茎部烘干后准确称重,结果发现,UW4△AcdS+Bra20A菌株处理后小麦茎干最重,其次是UW4、UW4△AcdS+Bra10A和UW4△AcdS+PAA菌株处理后的茎干重,三者间无显著性差异;UW4△AcdS+Bra1A和UW4△AcdS菌株处理后的小麦茎干较轻,尤其UW4△AcdS菌株处理后茎干重量与对照差距不显著(P<0.05)(图7-A)。UW4△AcdS+Bra20A、UW4△AcdS+Bra10A和UW4△AcdS+Bra1A菌株处理后的小麦根部重量均较重,三者差异不显著;其次UW4和UW4△AcdS+PAA菌株处理后的小麦根部较重,二者无显著性差异;UW4△AcdS菌株处理后的小麦根部重量最轻,与对照间无显著性差异(P<0.05)(图7-B)。

图 7 各菌株对小麦植株促生效果Fig. 7 Growth promoting effect of strains on wheat plant
综上所述,菌株的AcdS基因表达量及ACC脱氨酶活性均与启动子强弱呈现正相关;菌株对ACC代谢速率越高其趋化作用越强,对植株的促生效果也越好。
3 讨论与结论
假单胞菌属的趋化路径与大肠杆菌有所不同,类似另一种类球红细菌(Rhodobacter sphaeroides)为代表的趋化信号通路,鞭毛除了细胞端部受体复合体的调控外,还要受到位于细胞质的受体复合体的调控作用。目前对细胞质受体复合体所结合配体分子了解甚少,但已有研究发现,细菌对某些氨基酸、糖类及三羧酸循环的中间产物等许多代谢依赖性趋化物的趋化作用需要细胞质受体的参与[13-14]。如恶臭假单胞菌F1的McpS蛋白可作为6种三羧酸(TCA)循环中间体和丁酸盐的特异性趋化受体,且对苹果酸、琥珀酸、延胡索酸、草酰乙酸有高的亲和力,据此推测MCP对趋化物的亲和力大小与趋化反应强度有关[15]。另外三羧酸循环或β-酮己二酸循环的中间代谢产物浓度的大小直接影响参与代谢依赖性趋化反应的MCP蛋白和转运蛋白的表达[16]。这也表明某些物质的趋化、转运和代谢密切相关,因此代谢速度可能是影响趋化反应强度的另一个因素。
本研究设计将4种不同强弱启动子序列Bra20A/Bra10A/ Bra1A/PAA分别连至pBBR1MCS-2质粒,构建出含4种不同启动子序列的表达质粒。采用三亲本接合转移将表达质粒导入受体菌株UW4△AcdS,成功构建出4种含不同强弱AcdS启动子序列的目标菌株。研究中所采用的pBBR1MCS-2表达质粒在单个菌株细胞中拷贝数约为5个,较高的拷贝数和表达强度可提高目标AcdS基因表达量及ACC脱氨酶活,但同时也为宿主菌引入较高代谢负荷[17],如各转化株在以ACC为氮源的甘油盐培养基中生长缓慢。另外可能受mRNA寿命或蛋白折叠构建系统影响,酶活力并未随AcdS基因表达量增高呈现同等比例增加。
对各菌株生长曲线测定发现各菌株生长速率基本一致无显著性差异。ACC脱氨酶活数值基本与启动子序列强弱呈正相关。UW4△AcdS+Bra20A菌株Acds基因表达量最高,此结果与ACC脱氨酶活测定结果规律基本一致,说明AcdS基因表达量、ACC脱氨酶活与启动子强弱之间呈现正相关,菌株的ACC脱氨酶活性越高,其对ACC代谢速率也越高。定性趋化结果显示:UW4△AcdS丧失对ACC的趋化能力,含强启动子序列的UW4△AcdS+Bra20A菌株形成的趋化圈直径最大,说明菌株对ACC代谢速率直接影响其ACC趋化能力的大小。各菌株在小麦根际定殖数量及对小麦生物量影响结果显示:UW4△AcdS+Bra20A菌株定殖数量最多,且处理后小麦茎干及根部重量均最重,UW4△AcdS+Bra1A和UW4△AcdS菌株处理后的小麦茎干较轻,UW4△AcdS菌株处理后的小麦根部重量最轻(P<0.05),说明ACC确实为UW4向植物根际定殖的较强趋化物质,是菌株生长的物质来源,与植物间形成互利共赢的共生关系[8],因此菌株对ACC的代谢速率越高其趋化作用亦越强,UW4的趋化作用越强其在根系定殖后对植株的促生效果越显著。
