葱地种蝇幼虫伴生细菌多样性及两种培养基分离效果比较
2022-03-22张新建周方园
刘 梅,张新建,周方园
[1. 齐鲁工业大学(山东省科学院)生态研究所/山东省应用微生物重点实验室,山东 济南 250013;2. 湖北大学生命科学学院,湖北 武汉 430062]
0 引言
【研究意义】自然界中,细菌和昆虫形成了紧密的共生关系[1-3],这些细菌分布于昆虫的体表、肠道以及细胞内,在多个方面协助昆虫提高适应性[4]。例如,细菌可为昆虫提供营养物质,特别是一些肠道菌可合成多种维生素和氨基酸,也可协助昆虫消化难降解甚至有毒的食物[5-8]。此外,伴生细菌会影响寄主昆虫的生长发育以及社会行为[9,10]。早期关于昆虫伴生细菌功能的研究主要以常规分离方法获得纯菌株随后验证菌株功能为主。而近十年以来,鉴于一些微生物难以获得纯培养菌株,越来越多的学者开始使用高通量测序技术研究昆虫伴生细菌的多样性和功能[11]。但是目前通过高通量测序所获得的菌属的功能主要是通过已有数据库来预测,具有不确定性。而伴生细菌功能的验证往往仍然需要获得纯菌株。因此,高效的分离技术在高通量测序技术发达的现在依然十分重要。【前人研究进展】目前,昆虫伴生细菌一般通过依赖培养的分离方法来获得。常用的分离培养基主要有LB[12-15]、TSB[13,16,17]和NB[18,19]等。例如有研究者成功使用LB培养基从木食性白蚁[14]以及蜜蜂[15]等昆虫的肠道内分离出多种细菌。还有研究者使用TSB培养基从淡色库蚊肠道内成功分离得到10种细菌[17]。也有研究发现可以使用NB培养基从斜纹夜蛾[18]以及蝗虫肠道中分离多种细菌[19]。据以往研究,不同昆虫的伴生细菌往往差异较大,因此在分离方法尤其是培养基的选择上往往具有特异性,这也表明了针对不同昆虫,研究其伴生细菌分离培养基种类选择的必要性。【本研究切入点】葱地种蝇(Delia antiqua),俗称“蒜蛆”,是危害大蒜、大葱、洋葱等百合科蔬菜的重要地下害虫。蒜蛆幼虫取食危害大蒜等作物根茎,给作物生产造成严重的损失[20]。现有研究发现蒜蛆伴生菌可帮助蒜蛆适应不利的食物环境[21,22],产生抗菌活性化合物抵抗多种病原真菌感染蒜蛆[23,24]。然而有关蒜蛆幼虫伴生细菌多样性的系统研究鲜见报道。另外,以往对于蒜蛆伴生细菌分离鉴定的研究只采用LB培养基[24],其他培养基对蒜蛆幼虫伴生细菌的分离效果也有待深入探讨。【拟解决的关键问题】鉴于此,本研究首先使用高通量扩增子测序技术对蒜蛆幼虫肠道和体表的伴生细菌进行解析,随后分别采用LB和TSB两种培养基分离蒜蛆体表和肠道的伴生细菌,比较两种培养基的分离效果,以期探明蒜蛆幼虫体表和肠道细菌的多样性,同时筛选出分离效果较好的蒜蛆伴生细菌分离培养基,为研究蒜蛆伴生细菌的功能及蒜蛆伴生细菌的分离提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 试虫 供试蒜蛆2~3龄幼虫于2020年5月采集于泰安范镇 (N36°14', E117°25)大蒜田受蒜蛆危害的大蒜植株。采集时确保每棵受害大蒜相互间距100m以上,幼虫使用无菌镊子采集后,来自于同一植株的蒜蛆幼虫单独置于同一无菌采样袋内,置于冰盒内保存带回实验室备用。共从32棵大蒜植株采集到51头幼虫,试验中每个受害植株只挑选1头幼虫使用。
1.1.2 主要试剂、培养基和仪器 dNTPs、Taq酶、DL2000 DNA Marker、10 ×Buffer购自北京索莱宝科技有限公司。16 S rRNA基因扩增引物27 F和1 492 R由生工生物工程股份有限公司合成。引物序列信息如下:27 F(5′-AGA-GTT-TGA-TCC-TGG-CTC-AG-3′);1 492 R(5′-TAC-GGC-TAC-CTT-GTT-ACGACT-T-3′)[24]。DNA裂 解 液Buffer 1:25 mmol·L-1NaOH和0.2 mmol·L-1Na2-EDTA (pH = 12),121 °C高压灭 菌15 min;中和液Buffer 2:40 mmol·L-1Tris-HCl (pH = 7.5),121 °C高 压 灭 菌15 min[25]。Luria-Bertani 固体培养基(LB):胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠10 g·L-1,琼脂20 g·L-1。胰蛋白胨大豆琼脂培养基(TSB):40 g·L-1,购自北京索莱宝科技有限公司。PCR仪(Mastercycler X50a)购自艾本德中国有限公司,电泳仪(PowerPac)购自伯乐生命医学产品(上海)有限公司。
1.2 试验方法
1.2.1 蒜蛆幼虫体表和肠道伴生细菌多样性测序
(1) 样品制备
将蒜蛆幼虫放入装有200 μL 10% 磷酸缓冲盐溶液(PBS)的1.5 mL无菌离心管中离心超声处理30 s、震荡1 min,取出幼虫后的洗液作为幼虫体表伴生菌测序样本。将上述取出的幼虫使用75%乙醇消毒30 s,然后使用无菌PBS清洗(超声处理30 s、震荡1 min)3次。随后将幼虫从侧面剪开,解剖出幼虫肠道,摘除附着于肠道的白色脂肪后,整个肠道放入装有200 μL 10% PBS的1.5 mL无菌离心管中充分研磨,作为肠道测序样本。碾碎后在室温下超声震荡1 min。上述样本使用5头幼虫作为5个重复进行测序。
(2) DNA的提取
使用细菌基因组 DNA 快速抽提试剂盒[生工生物工程(上海)股份有限公司]按照说明进行总DNA的提取,提取的DNA用1.2%的琼脂糖凝胶电泳进行检测,用NanoDrop进行DNA浓度和纯度的检测确保其质量,保存至-20 ℃用于后续试验。
(3) PCR扩增测序
对16 S rDNA V3-V4区进行扩增,引物序列为338 F (5′- ACT-CCT-ACG-GGA-GGC-AGC-AG -3′)和806 R (5′- GGA-CTA-CHV-GGG-TWT-CTA-AT -3′),上机测序引物含4 bp长度的barcode标签用于后期数据处理时区分不同样品,由上海美吉生物科技股份有限公司提供。PCR反应体系为:10 × Pyrobest Bufer 5 μL,dNTPs 4 μL,引物各2 μL,Pyrobest DNA Polymerase 0.3 μL,模板DNA 3 μL,补充ddH2O 至50 μL。PCR反应条件为:95 ℃预变性10 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,30个循环;72 ℃ 10 min。每样品PCR扩增3次后的产物混合,用2%琼脂糖凝胶电泳观察产物,使用Wizard SV Gel and PCR Clean-up System试剂盒[普洛麦格(北京)生物技术有限公司]切胶回收PCR产物后送上海美吉生物科技股份有限公司使用Illumina Miseq PE300测序。
(4)测序数据处理
使 用 QIIME v.1.9.1(Quantitative Insights Into Microbial Ecology)对原始数据进行拼接、过滤和嵌合体去除以得到有效序列[26]。随后用USEARCH软件包中的UPARS按照97 %相似性阈值对序列进行OTU聚类[27],选取丰度最高的序列作为该OTU的代表性序列使用RDP classifier v.2.2进行分类学分析,使用SILVA数据库(http://www.arb-silva.de)将置信阈值设为70 %进行分类学注释[28,29],统计不同分类水平下各个样本的OTU组成和reads数,生成OTU表。
1.2.2 蒜蛆幼虫体表和肠道细菌的分离和鉴定
使用LB和TSB平板从蒜蛆幼虫的体和肠道分离细菌,为了防止丝状真菌和酵母菌污染,在两种培养基中加入制霉菌素(40 mg·L-1)和放线菌酮(0.5 mg·L-1)[30]。
(1)体表伴生细菌的分离
取单头蒜蛆幼虫放入装有200 μL 10% PBS 1.5 mL离心管中,随后室温下超声30 s,涡旋震荡1 min,然后将100 μL悬浮液按10倍梯度稀释至10万倍。选择稀释倍数为102~105用无菌移液枪移取50 μL滴加到LB和TSB平板上均匀涂布,待菌液充分吸收后用封口膜封口,每个浓度重复3次涂布。试验使用5头幼虫分离体表细菌。
(2)肠道伴生细菌的分离
单头幼虫用70%的乙醇进行体表消毒30 s并用10% PBS冲洗,反复3次,随后使用眼科手术剪从虫体侧面将幼虫体壁剪开,用镊子将幼虫肠道从体内拉出,摘除附着于肠道的脂肪后将其放入装有200 μL 10% PBS的1.5 mL无菌离心管中,充分研磨后超声30 s,涡旋震荡1 min,然后将100 μL悬浮液按10倍梯度稀释至10万倍,选择稀释倍数为102~105用无菌移液枪移取50 μL滴加到LB和TSB平板上均匀涂布,每个浓度重复3次涂布。试验使用5头幼虫分离肠道细菌。
将所有涂布好的平板倒置于28 ℃的培养箱中培养12~48 h。每个平板上选择颜色、大小、厚度、透明度和质地不同的菌落,分别在LB和TSB培养基上用接种环采用三区划线法进行划线纯化。纯化后的菌株根据菌落形态进行分组[31]。
(3)蒜蛆伴生细菌的鉴定
取10 μL超纯水加入到96孔板中,用10 μL枪头从固体培养基纯培养物上蘸取少量菌体至96孔板中反复吹吸至混匀;将16.6 μL Buffer 1加入到上述PCR板中吸打混匀,然后离心。离心完的样品封膜后放入PCR仪中运行95 ℃、30 min,随后加入16.6 μL Buffer 2 吸打混匀离心后作为DNA模板备用。16S rDNA的PCR扩增引物采用27 F和1 492 R[30,31]。反 应 体 系 为30 μL 体 系:3 μL 10×Buffer、2.4 μL dNTPs(10 mmol·L-1)、3 μL DNA模板、0.3 μL各引物(10 μmol·L-1)、0.15 μLTaq酶、27 μL ddH2O。扩增程序为:95 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。扩增产物使用1.2%琼脂糖凝胶进行检测,目的片段大小1 500bp[32,33]。阳性结果PCR产物送至上海生工生物工程股份有限公司进行测序。所得序列在NCBI上进行BLAST分析,下载亲缘关系较近的序列,使用Mega 7最大似然法构建系统发育树(bootstrap值500)[34],参考前人已经发表的结果使用亲缘关系远且所覆盖的分类单元多的Anabaena affinis(AF247591.1)作为外群[35,36]。
1.2.3 两种培养基分离效果的比较
分别在种水平和属水平上比较高通量测序和两种培养基上分离到的细菌的数量,使用韦恩图比较测序和LB、测序和TSB、LB和TSB之间体表和肠道细菌共有和特有数量。
1.2.4 数据处理
测序数据处理方法详见1.2.1。采用Sigmaplot 14.0和R 3.3.1作图。
2 结果与分析
2.1 蒜蛆幼虫体表和肠道细菌的多样性
所有样品测序的稀释曲线最后都基本趋于平缓,说明测序数据量充分,高通量测序能较好地反映物种的丰度及多样性。其中从蒜蛆幼虫体表和肠道分别获得了424 579和408 741个有效reads。根据97%相似度对抽平后的序列进行OTU聚类,从蒜蛆幼虫体表检测到59个OTU,从蒜蛆幼虫肠道检测到203个OTU。
经过测序一共得到4个门、66个科、115个属。如图1和图2测序结果所示,蒜蛆幼虫体表和肠道样本中的序列大部分不能鉴定到种水平,基本上都是鉴定到属水平。如图1,蒜蛆幼虫体表共鉴定得到4个门、16个科、21个属,其中丰度较高的属包括稳杆菌属Empedobacter(48.1%)、乳球菌属Lactococcus(20.8%)、不 动 杆 菌 属Acinetobacter(12.7%)、肠球菌属Enterococcus(4.0%)、普罗威登斯菌属Providencia(3.3%)、鞘氨醇杆菌属Sphingobacterium(2.5%)和丛毛单胞菌属Comamonas(1.3%)。上述属中,能鉴定到种的只有短稳杆菌Empedobacter brevis、韩国丛毛单胞菌Comamonas koreensis、河流瓦格球菌Vagococcus fluvialis、拟黄杆菌Ochrobactrum pseudogrignonense和戴尔福特菌Delftia tsuruhatensis五个种。如图2,蒜蛆幼虫肠道共鉴定得到4个门、65个科、115个属,其中丰度较高的属包括罗威登斯菌属Providencia(80.2%)、肠球菌属Enterococcus(8.9%)、沃尔巴克氏体属Wolbachia(7.7%)、乳球菌属Lactococcus(1.6%);上述属中绝大部分种类均不能够鉴定到种。

图 1 蒜蛆幼虫体表伴生细菌测序样本中物种属水平(a)和种水平(b)相对丰度Fig. 1 Relative abundance of bacteria on D. aniqua larval surface at genus (a) and species (b) levels

图 2 蒜蛆幼虫肠道细菌测序样本中属水平(a)和种水平(b)物种丰度Fig. 2 Relative abundance of bacteria in D. aniqua guts at genus (a) and species (b) levels
2.2 LB和TSB分离蒜蛆幼虫体表和肠道细菌结果
使用LB培养基从蒜蛆幼虫体表和肠道共分离得到463株细菌,根据形态选取97株菌进行测序,鉴定后共得到29种细菌(表1、图3、图4),分别属于放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)4个门,分属于11个科18个属。使用TSB培养基从蒜蛆幼虫的体表和肠道共分离得到391株细菌,选取53株菌进行测序,经测序后共鉴定到44种细菌(表1、图3、图4)。这些细菌分属于放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)4个门,分别属于19个科28个属。由图3、图4可知两种培养基一共分离得到65种细菌,其中两种培养基分离得到6种相同的细菌,分别为摩根氏菌Morganella morganii、雷氏普罗威登斯菌Providencia rettgeri、拟黄杆菌O.pseudogrignonense、微 杆 菌Microbacteriumsp.1、铬还原白杆菌Leucobacter chromiireducens和苍黄假棍状杆菌Pseudoclavibacter helvolus。
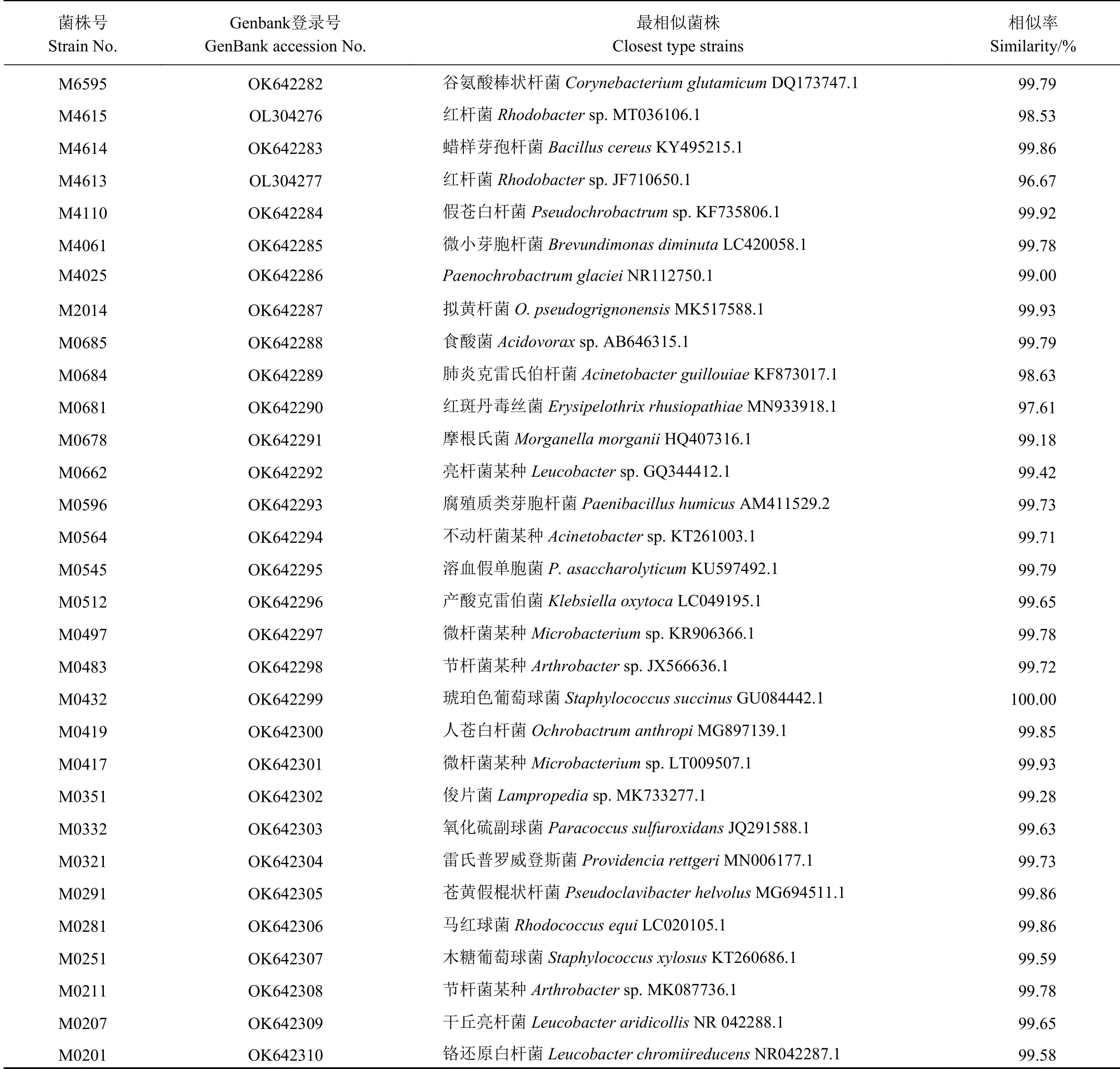
表 1 使用两种培养基分离得到的蒜蛆幼虫伴生细菌菌株的GenBank号以及种属鉴定信息Table 1 GenBank codes and species identification information on bacteria associated with D. antiqua larvae isolated on two media
使用LB培养基从蒜蛆幼虫体表和肠道分离得到的伴生细菌的分离频率结果如图5所示,体表伴生细菌29种,分离频率较高的种(图5-a)包括雷氏普罗威登斯菌P. rettgeri(24.05%)、 金肠球菌Enterococcus gilvus(11.45%)和摩根氏菌M. morganii(9.16%);肠道伴生细菌13种,分离频率较高的种(图5-b)分别为摩根氏菌M.morganii(44.33%)、雷氏普罗威登斯菌P.rettgeri(21.65%)和稳杆菌Empedobactersp. (15.46%)。
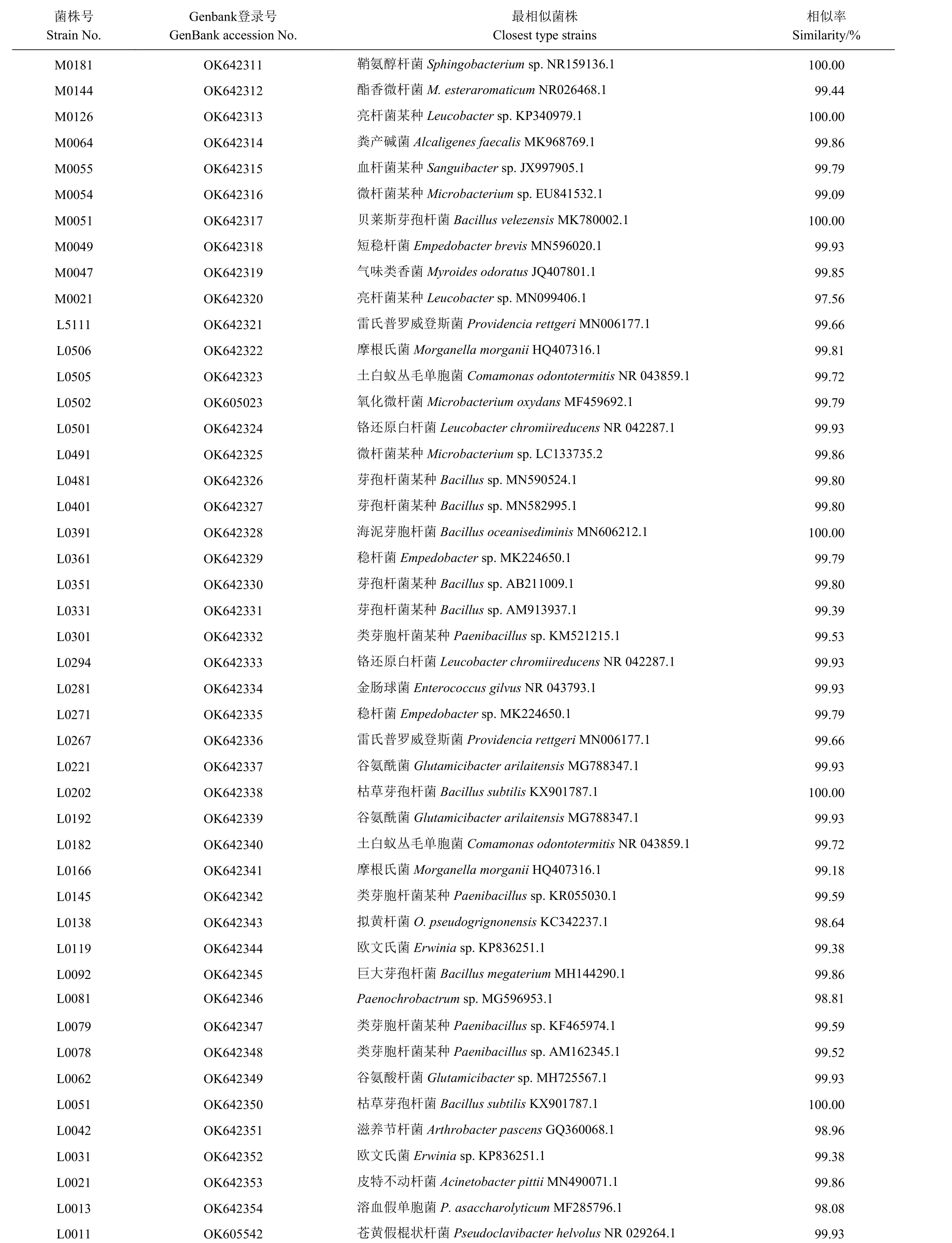
续上表
使用TSB培养基从蒜蛆幼虫体表和肠道分离得到的伴生细菌的分离频率结果如图6所示,体表伴生细菌43种,分离频率较高的种(图6-a)包括摩根氏菌M. morganii(20.93%)和酯香微杆菌Microbacterium esteraromaticum(11.63%)。肠 道 伴生细菌18种,分离频率较高的种(图6-b)包括摩根氏菌M. morganii(42.34%)、短稳杆菌E. brevis(11.71%)、溶血假单胞菌Pseudochrobactrum asaccharolyticum(7.21%)。

图 3 两种培养基分离蒜蛆幼虫细菌的16S rDNA最大似然树Fig. 3 Maximum likelihood trees for 16S rDNA sequences of strains on D. antiqua larva isolated on two media
2.3 LB和TSB两种培养基分离蒜蛆幼虫体表和肠道细菌结果比较
2.3.1 LB和TSB两种培养基分离蒜蛆幼虫体表和肠道细菌数量比较 在种水平上,使用LB培养基从蒜蛆幼虫体表分离得到29个种的细菌,使用TSB培养基共分离得到43个种的细菌;使用两种培养基从蒜蛆幼虫体表在种水平上分离得到5种相同的细菌,分别为铬还原白杆菌Leucobacter chromiireducens、摩根氏菌M.morganii、拟黄杆菌O.pseudogrignonense、假苍白杆菌Pseudochrobactrumsp.和苍黄假棍状杆菌Pseudoclavibacter helvolus(图7-a)。在种水平上,使用LB培养基从蒜蛆幼虫肠道共分离得到13个种的细菌,使用TSB培养基从蒜蛆幼虫肠道共分离得到18个种的细菌;使用两种培养基从蒜蛆幼虫肠道在种水平上分离得到3种相同的细菌,分别为铬还原白杆菌L.chromiireducens、摩根氏菌M.morganii和雷氏普罗威登斯菌P.rettgeri(图7-b)。

图 4 变形菌门(Proteobacteria,a)、放线菌门(Actinobacteria,b)和拟杆菌门(Bacteroidetes,c)的16S rDNA最大似然树Fig. 4 Maximum likelihood trees for 16S rDNA sequences of Proteobacteria (a), Actinobacteria (b), and Bacteroidetes (c)
在属水平上,使用LB培养基从蒜蛆幼虫体表共分离得到17个属,而使用TSB培养基分离得到25个属;两培养基分离到的相同的属有11个,分别为:节杆菌属Arthrobacter、芽孢杆菌属Bacillus、稳杆菌属Empedobacter、亮节杆菌属Leucobacter、微杆菌属Microbacterium、摩根氏菌属Morganella、苍白杆菌属Ochrobactrum、Paenochrobactrum、普罗威登斯菌属Providencia、假苍白杆菌属Pseudochrobactrum和伪假苍黄菌属Pseudoclavibacter(图7-c)。在属水平上,使用LB培养基从蒜蛆幼虫肠道共分离得到13个属,而使用TSB培养基分离得到12个属;两培养基分离到的相同的属有7个,分别为不动杆菌属Acinetobacter、丛毛单胞菌属Comamonas、稳杆菌属Empedobacter、亮节杆菌属Leucobacter、摩根氏菌属Morganella、苍白杆菌属Ochrobactrum、类芽孢杆菌属Paenibacillus、Paenochrobactrum和普罗威登斯菌属Providencia(图7-d)。

图 5 LB培养基上分离蒜蛆幼虫体表(a)和肠道(b)细菌分离频率Fig. 5 Frequency of isolating bacteria on D. antiqua surface (a) and in guts (b) by using LB medium

图 6 TSB培养基上分离蒜蛆幼虫体表(a)和肠道(b)细菌分离频率Fig. 6 Frequency of isolating bacteria on D. antiqua surface (a) and in guts (b) by using TSB medium
2.3.2 LB和TSB两种培养基分离蒜蛆幼虫体表和肠道细菌与高通量测序结果的比较 以测序结果为标准,分别比较LB和TSB两种培养基的分离效率与测序结果的差异。
在属水平上,使用LB培养基从蒜蛆幼虫体表共分离得到17个属,使用高通量测序共检测到21个属;两者共有的属有9个,分别为:不动杆菌属Acinetobacter、丛毛单胞菌属Comamonas、稳杆菌属Empedobacter、肠球菌属Enterococcus、亮节杆菌属Leucobacter、苍白杆菌属Ochrobactrum、类芽孢杆菌属Paenibacillus、Paenochrobactrum和普罗威登斯菌属Providencia(图7-e)。在属水平上,使用LB培养基从蒜蛆幼虫肠道共分离得到13个属,使用高通量测序共检测到115个属;两者共有的属有8个,分别为: 不动杆菌属Acinetobacter、丛毛单胞菌属Comamonas、肠球菌属Enterococcus、亮节杆菌属Leucobacter、苍白杆菌属Ochrobactrum、类芽孢杆菌属Paenibacillus、Paenochrobactrum和普罗威登斯菌属Providencia(图7-f)。
在属水平上,使用TSB培养基从蒜蛆幼虫体表共分离得到25个属,使用高通量测序共检测到21个属;两者共有的属有6个,分别为: 稳杆菌属Empedobacter、亮节杆菌属Leucobacter、苍白杆菌属Ochrobactrum、Paenochrobactrum、普罗威登斯菌属Providencia和鞘氨醇杆菌属Sphingobacterium(图7-g)。在属水平上,使用TSB培养基从蒜蛆幼虫肠道共分离得到12个属,使用高通量测序共检测到115个属;两者共有的属有7个,分别为芽孢杆菌属Bacillus、亮节杆菌属Leucobacter、苍白杆菌属Ochrobactrum、类芽孢杆菌属Paenibacillus、Paenochrobactrum、普罗威登斯菌属Providencia和假苍白杆菌属Pseudochrobactrum(图7-h)。

图 7 蒜蛆幼虫使用LB、TSB培养基以及测序分离细菌种类比较Fig. 7 Bacteria from D. antiqua larva as identified by LB, TSB,and high throughput sequencing methods
3 讨论与结论
本研究通过高通量扩增子测序对蒜蛆幼虫体表和肠道的伴生细菌进行了检测,从体表和肠道一共得到4个门、66个科、115个属的细菌。其中,蒜蛆幼虫体表优势菌属主要是稳杆菌属Empedobacter、乳球菌属Lactococcus和不动杆菌属Acinetobacter;蒜蛆幼虫肠道的优势菌属为普罗威登斯菌属Providencia、肠球菌属Enterococcus和乳球菌属Lactococcus。由于目前测序技术的限制,测序所得序列长度有限,大部分序列不能注释到种甚至是属。
本研究采用两种培养基对蒜蛆幼虫体表和肠道的伴生细菌进行分离。使用LB培养基共分离得到29种细菌,分布在4门、11科、18属。本研究与之前研究结果相比有很大的差异,已有研究使用LB培养基从蒜蛆幼虫体表和肠道分离得到41株细菌经鉴定属于4个门12个属15个种[24]。这种差异可能是由于取样地点差异、实验操作差异造成的。本研究取样点与前人研究取样点存在一定的地理差异,可能导致蒜蛆幼虫体表和肠道伴生细菌种类的差异。但是,本研究也与之前的研究有相似之处,比如前人研究中柠檬酸杆菌属Citrobacter、肠杆菌属Enterobacter、假单胞菌属Pseudomonas、沙雷氏菌属Serratia、鞘氨醇杆菌属Sphingobacterium和寡养单胞菌属Stenotrophomonas的细菌在本研究中也有分离到[24]。
我们通过高通量测序和传统的分离培养得到的优势菌属在之前的研究中也有报道,例如在培养基中添加稳蝇Stomoxys calcitrans伴生细菌稳杆菌属Empedobacter的细菌能促进幼虫生长[37]。从肠道分离得到的乳球菌属Lactococcus可以协助昆虫例如天牛和蜜蜂进行纤维素的降解[38,39],同时发现不动杆菌属Acinetobacter的细菌有降解木质素的能力[40,41]。从麻蝇肠道分离得到的普罗威登斯菌属Providencia的细菌能帮助昆虫适应环境[42]。橄榄树主要害虫中的普罗威登斯菌属Providencia的伴生细菌能协助昆虫利用L-rhamnose[43]。从果蝇肠道分离得到的普罗威登斯菌属Providencia和摩根氏菌属Morganella的细菌有固氮和解毒功能[44]。家蚕肠道伴生菌肠球菌属Enterococcus通过降低肠道pH和提供碱性条件提高了寄主的适应性[45]。从昆虫肠道伴生菌微杆菌属Microbacterium中纯化能得到氨基酸水解酶[46]。因此推断这些优势菌属在蒜蛆适应性以及对营养物质的利用方面可能发挥了重要作用。
本研究使用两种培养基对蒜蛆幼虫体表和肠道的伴生细菌进行了分离,使用LB培养基共分离得到29种细菌,使用TSB培养基共分离得到44种细菌。这两种培养基分离到的细菌数量存在巨大差异。这可能是由于培养基营养成分和菌株的生长特性、营养需求差异导致的。LB培养基富含丰富的碳和氮等营养物质,可以满足各种细菌的生长需求[47]。TSB主要用作观察菌落形态并获得纯细菌菌株的初始生长培养基[48]。部分细菌可能在LB培养基上生长速度差异较大,在挑取单菌落时,生长较慢的菌株可能会被忽略掉,导致LB平板上分离到的细菌种类偏少。
另外,值得注意的是,本研究中有些使用LB或者TSB培养基分离到的属在高通量测序数据中未检测到。这可能由两方面的原因导致:一是由于样品差异,二是由于测序数据的读长太短导致注释不全面。本研究中细菌分离和测序分别采用两批样品,分菌样品中可能存在一些环境中的细菌不存在于测序样品中。此外,受制于目前二代测序技术读长的限制,某些属的序列比如普罗威登斯菌属Providencia不能注释到种,所以分离到的某些鉴定到种的菌株如雷氏普罗威登斯菌P. rettgeri在测序检测时不能被认定为检测到。
总体来说,使用TSB培养基能够分离到更多种类的蒜蛆伴细菌。但是使用LB能够分离到的部分菌株在TSB中未分离到,说明在分离蒜蛆幼虫伴生菌时最好同时使用两种培养基分离。而高通量测序结果表明,两种分离方法虽然都分离到了蒜蛆幼虫体表和肠道的优势细菌,但使用常规培养的分离方法能够分离到的伴生细菌种类还相当有限。以往任何验证伴生菌功能的研究往往需要纯菌株来验证,基于此,未来可以参考作物根际微生物的高通量分离方法[26],从昆虫的体表和肠道分离更多的伴生菌。
