SP94-melittin与RGD-melittin杂合肽抗肿瘤性及溶血性研究
2022-03-21曹静
曹 静
(商丘师范学院 生物与食品学院,河南 商丘 476000)
临床上肿瘤的传统治疗方式对正常细胞具有很大损伤性,在用药过程中会产生较大的副作用;另外传统抗肿瘤药物由于长时间使用而形成的耐药性问题也亟待解决.针对肿瘤治疗中药物产生的毒副作用和耐药性问题,开发减毒增效的新型抗肿瘤药物已经成为发展趋势[1-3].
抗菌肽是一类具有广谱抗细菌、真菌和部分病毒能力的小分子多肽[4],其中阳离子型抗菌肽还具有抗肿瘤效果,如蜂毒素(melittin),Tachyplesin I(鲎素I),天蚕素A 和 B等[5,6],进一步研究发现某些抗菌肽不仅可以特异性抑制某些肿瘤细胞的生长,而且对正常细胞损伤小,该特性为寻找新型抗癌药物带来新的方向[7,8].Melittin来源于蜂毒,具有很高的生物学活性和药理作用,具有抗炎、抗菌、抗病毒、抗肿瘤[9,10]等作用,但Melittin具有的溶血性限制了它在肿瘤治疗上的应用.
近年来肿瘤的靶向治疗成为研究热点,靶向治疗可以克服传统治疗存在的弊端.靶向药物通过特异性结合到肿瘤细胞上,针对性的杀死肿瘤细胞同时降低对正常组织和细胞的损伤.研究表明运用靶向抗肿瘤药物[11,12],可以改善抗肿瘤药物的选择毒性,提高抗肿瘤药物的治疗效果.本研究根据抗菌肽Melittin序列特点选择连接的靶向肽具有分子量小、特异性强、免疫反应性低的特点,从而达到减毒增效的目的[13-15].
ELISA和流式细胞检测技术显示PC型小肽中的PC94、肝癌细胞具有最高的结合活性,并且PC94在正常细胞中不存在,多肽SP94与肝癌细胞具有较强的结合活性,可竞争性抑制PC94与肝癌细胞的结合,因此SP94可作为肝癌细胞的靶向多肽[16].
整合素avP3受体是一种在肿瘤组织新生血管内皮细胞膜和多种恶性肿瘤细胞表面均有高表达,而在绝大多数正常器官系统和成熟血管内皮细胞不表达的肿瘤标志物[17].RGD多肽(精氛酸-甘氨酸-天冬氣酸Arg-Gly-Asp)能够结合肿瘤细胞或者新生血管特异表达的整合素avβ3受体,从而能够将药物靶向性导入肿瘤部位,达到降低对正常组织细胞的损害,提高治疗效果的目标[14].
本研究选择了两种靶向肽SP94、RGD分别与melittin连接,对比了melittin连接两者后抗肿瘤性和溶血性变化,对不同靶向肽连接多肽后生物活性的变化情况进行探讨和分析.
1 材料与方法
1.1 材料
(1)细胞与培养基:人宫颈癌细胞(Hela)、人肝癌细胞(HepG2)购自中国科学院细胞库;MEM、NEAA(Hyclone)、DMEM购自南京生兴生物技术公司,胎牛血清(Millipore)购自南京福麦斯公司;细胞培养液为10% FBS,90% DMEM(MEM).
(2)多肽:melittin、SP94-melittin、RGD-melittin多肽由上海安驰生物技术公司合成.
melittin、SP94-melittin、RGD-melittin多肽序列见表1:

表1 melittin、SP94-melittin、RGD-melittin多肽序列
(3)主要实验试剂:Triton-100、二甲基亚砜(DMSO)购自南京鼎国生物技术公司;JC-1凋亡细胞线粒体膜电位试剂盒、流式细胞凋亡试剂盒购自南京优宁维生物技术公司.
1.2 实验方法
(1)细胞培养:Hela、HepG2于10%胎牛血清的DMEM培养液中培养,细胞培养箱条件为 37 ℃,5% CO2.
(2)细胞铺板加药试验:调整细胞密度达到2×105/mL,铺12孔板,置培养箱中过夜.次日孔内加入0、1、2、4、7、10 μM的药物浓度刺激细胞24 h,反应结束后开始进行下一步实验.
(3)检测细胞凋亡情况:首先使用胰酶消化细胞,800 rpm,离心5 min,弃上清收集细胞于离心管,接着加入Binding buffer 195 μL和AV染料5 μL,振荡混匀后室温放置10 min,注意避光;反应结束后每管内再加入Binding buffer 190 μL和PI染料 10 μL,振荡混匀后冰上放置于流式细胞仪上进行检测.
(4)检测细胞线粒体膜电位变化情况:取1 mL细胞悬液,800 rpm,5 min,离心后弃上清.管内加入0.5 mL JC-1工作液,充分混匀,放置于培养箱(37 ℃,5% CO2)10 min.洗涤细胞:每管加2 mL 1× Assay Buffer,悬浮细胞,800 rpm,5 min,离心后弃上清,重复一次;洗涤后各管加入1× Assay Buffer 0.5 mL于流式细胞仪上进行检测.
(5)溶血试验:准备1 mL采集的血液,加入10 mM PBS,1000 rpm,15 min,去上清,多次洗涤至上清澄清.离心去上清后,取500 μL,加24.5 mL 10 mM PBS,混匀,制成血液制品.取500 μL制备好的血液样品置于水浴锅中37 ℃孵育15 min,然后加入500 μL待测品,同时制备阳性对照组(Triton-100)和阴性对照组(PBS组),37 ℃水浴锅孵育1 h.溶血率计算:

注:于OD 540处检测吸光度值
1.3 数据处理
采用SPSS方差分析程序对实验数据进行单因素方差分析,结果以平均数±标准差(Mean±SD)表示.
2 结果
2.1 melittin,SP94-melittin 和RGD-melittin促HepG2细胞凋亡情况
靶向肽SP94和RGD对肝癌细胞都具有较高的结合活性,将抗菌肽melittin分别与其连接,比较Melittin、SP94-melittin和RGD-melittin促肝癌细胞HepG2凋亡情况的差异性,以此分析靶向肽的不同对抗菌肽抗肿瘤性的影响.
图1 (A)显示不同浓度melittin作用HepG2细胞24 h后细胞调亡情况:10 μM melittin 诱导HepG2细胞凋亡率接近83%,诱导的凋亡率随浓度增加而升高;图1(B)显示随SP94-melittin剂量的增加,HepG2细胞凋亡率有所增加,但上升较为缓慢;图1(C)显示2 μM RGD-melittin作用24 h后,HepG2即有25%凋亡率;当浓度达到4 μM时,凋亡率达到51%;浓度为7、10 μM时,凋亡率分别为62%、90%,凋亡百分率随着剂量的增加而提高.
比较melittin,SP94-melittin 和RGD-melittin促HepG2细胞凋亡情况(见图1(D)):三者在低浓度1、2 μM时,HepG2细胞凋亡率区别不大;当浓度增加到4 μM时,差异性开始明显,RGD-melittin、melittin、SP94-melittin细胞凋亡率分别为51%、31%和24%;而当浓度增加到7 μM,RGD-melittin与melittin细胞凋亡率分别为62%、53%,两者差距缩小,而SP94-melittin细胞凋亡率仅为26%,与4 μM相比较区别不大;当浓度增大到10 μM,melittin与RGD-melittin细胞凋亡率分别为90%、83%,而SP94-melittin较低为60%;从以上结果可以看出SP94-melittin促HepG2细胞凋亡效果明显低于melittin和RGD-melittin;而RGD-melittin效果强于melittin(P<0.01).
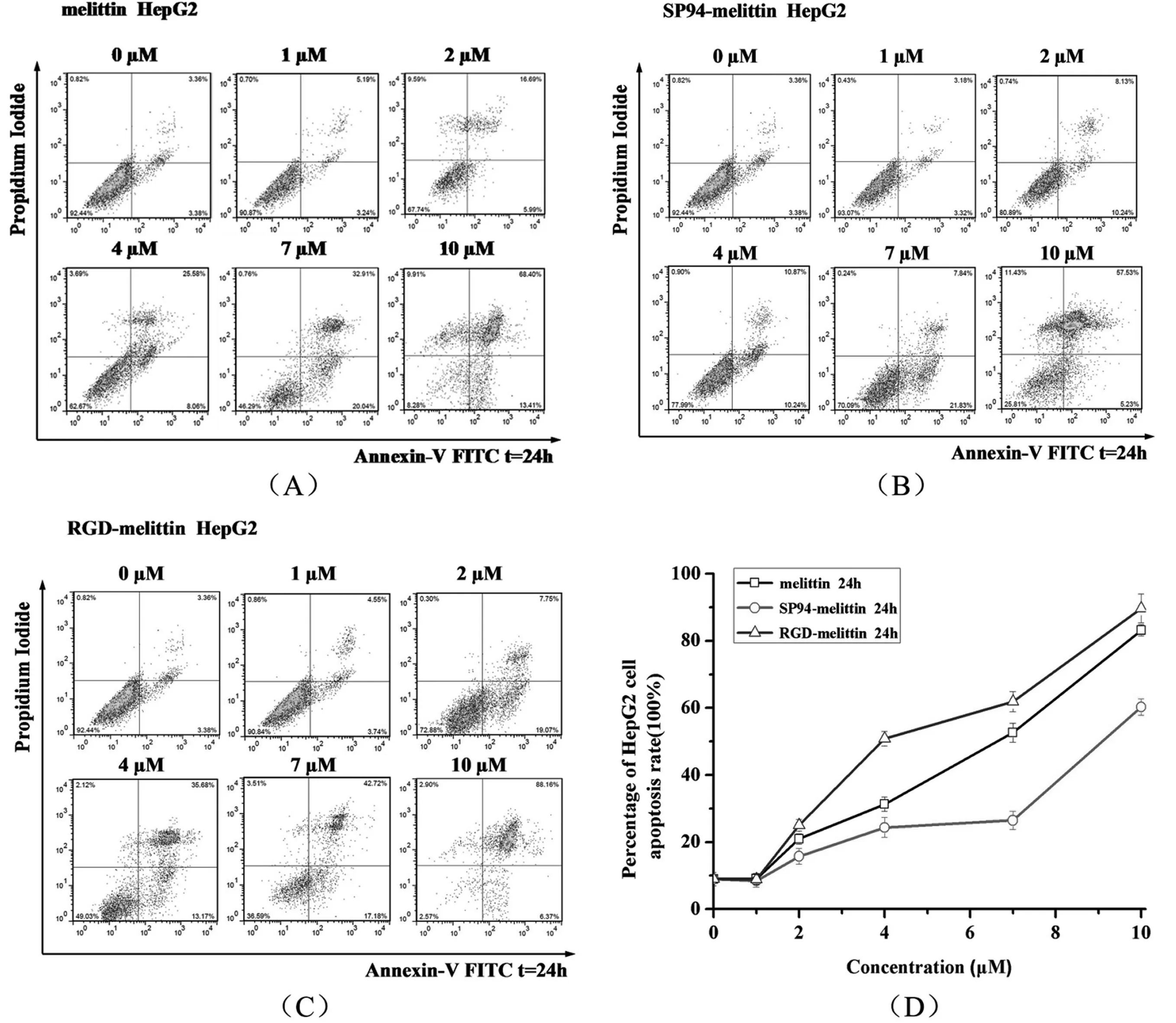
(A)melittin促HepG2细胞凋亡情况 (B)SP94-melittin促HepG2细胞凋亡情况 (C)RGD-melittin促HepG2细胞凋亡情况 (D)melittin,SP94-melittin和RGD-melittin促HepG2细胞凋亡情况;数据以平均数±标准差(Mean±SD)表示,n=3,p < 0.01图1 melittin,SP94-melittin 和RGD-melittin促HepG2细胞凋亡情况
2.2 melittin,SP94-melittin 和RGD-melittin促Hela细胞凋亡情况
为进一步证明melittin的抗肿瘤效果及验证RGD的靶向性,本研究选用Hela细胞作为模式细胞.由图2 (A)可见,4 μM melittin可以诱导Hela细胞产生明显凋亡(P<0.01),而且凋亡比例随浓度的增加而逐渐增大.图2 (B)显示SP94-melittin在1 μM、2 μM、4 μM低浓度时,Hela细胞凋亡率较低;在高浓度10 μM时,作用24 h后诱导Hela细胞大部分凋亡;SP94-melittin组凋亡率在高浓度处较为明显.由图2(C)可见1 μM、2 μM的 RGD-melittin凋亡率相差不大;4 μM RGD-melittin 24h诱导Hela细胞产生明显的凋亡(P<0.01),随着剂量的增加,凋亡百分率升高.
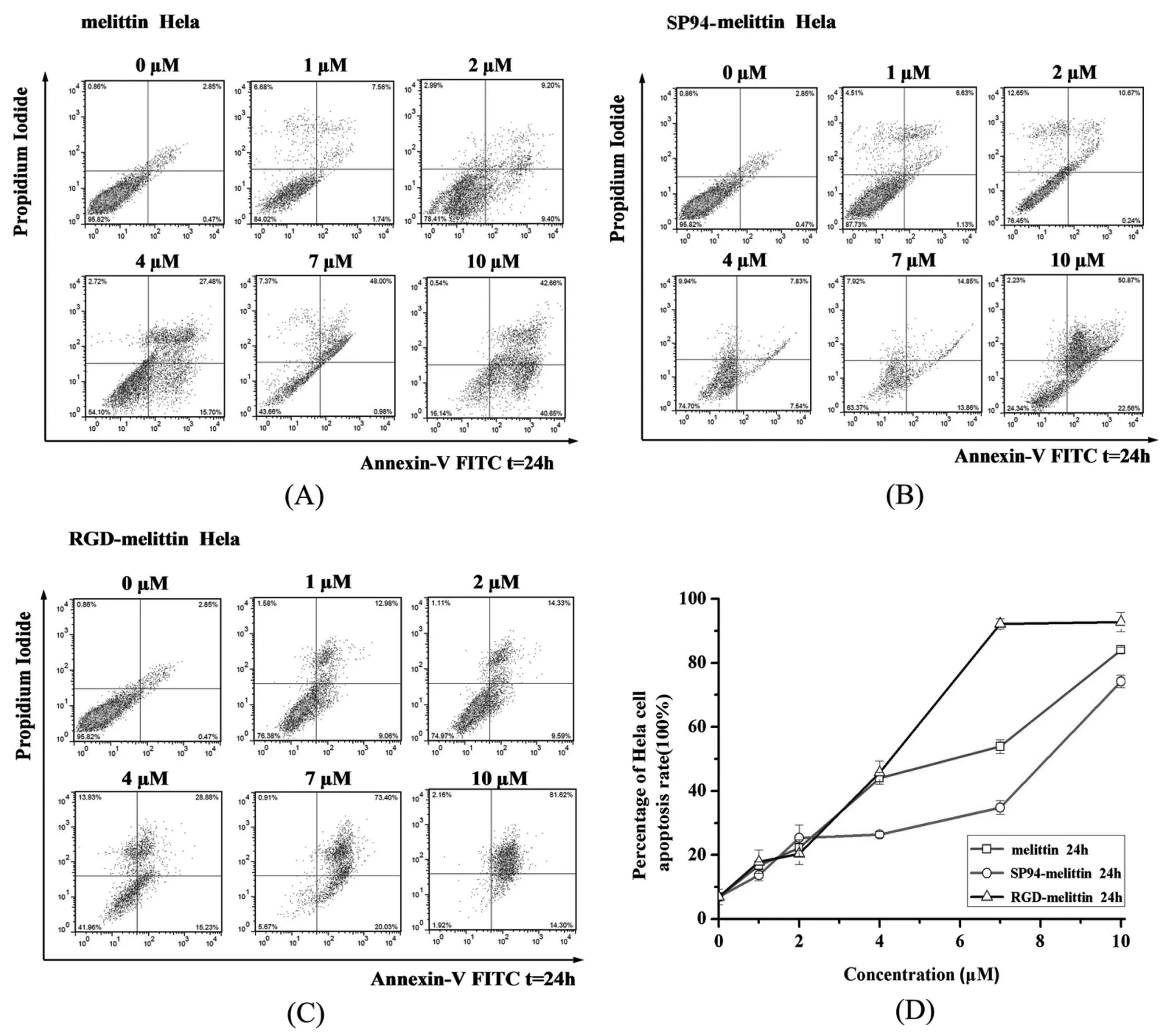
(A)melittin促Hela细胞凋亡情况 (B)SP94-melittin促Hela细胞凋亡情况 (C)RGD-melittin促Hela细胞凋亡情况 (D)melittin,SP94-melittin和RGD-melittin促Hela细胞凋亡情况;数据以平均数±标准差(Mean±SD)表示,n=3,p < 0.01图2 melittin,SP94-melittin 和RGD-melittin促Hela细胞凋亡情况
从图2(D)比较melittin、SP94-melittin和RGD-melittin促Hela细胞凋亡情况:在低浓度1 μM、2 μM时,三者凋亡情况相似;而当浓度升至4 μM,melittin和RGD-melittin约为45%左右,SP94-melittin约为26%与低浓度相比变化不大;当浓度增加到7 μM,从高到低依次为RGD-melittin(92%)、melittin(54%)、SP94-melittin(35%),三者差别较大;在10 μM处差距缩小,从高到低依次为RGD-melittin(92%),melittin(84%),SP94-melittin(74%).4 μM 的melittin与RGD-melittin即有明显的抗肿瘤性,而 SP94-melittin作用较弱;随浓度提高,RGD-melittin表现最为显著,在7 μM浓度时凋亡率即达到92%,超出melittin 38%,SP94-melittin 57%,差异极显著(P<0.01);
根据以上结果本研究可以得出,连接有靶向肽SP94的melittin促凋亡效果在HepG2、Hela细胞上明显低于单独的melittin和RGD-melittin,尤其在4 μM、7 μM时;而RGD-melittin效果强于melittin(P<0.01).
2.3 SP94-melittin、RGD-melittin对HepG2细胞线粒体膜电位的影响
研究证明线粒体膜电位的降低是细胞凋亡的重要特征之一,因此本实验采用JC-1线粒体膜电位试剂盒标记细胞,最终通过流式细胞仪检测线粒体膜电位变化来观察抗菌肽RGD-melittin和SP94-melittin对肝癌细胞HepG2线粒体膜电位的影响.
如图3所示:4 μM和7 μM浓度的 SP94-melittin作用HepG2细胞24h后,线粒体膜电位与阴性组相比分别降低10%、15%;4 μM和7 μM浓度的RGD-melittin作用HepG2细胞24h后,线粒体膜电位与阴性组相比分别降低55%、45%;该结果再次证明SP94-melittin和RGD-melittin对HepG2抗肿瘤性;另外比较RGD-melittin和SP94-melittin线粒体膜电位变化情况得出,在7 μM与4 μM浓度作用下RGD-melittin抗肿瘤性显著强于SP94-melittin.
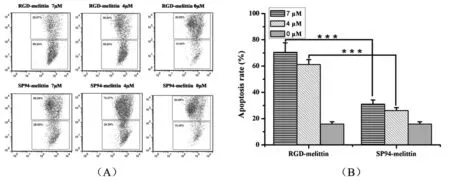
数据以平均数±标准差(Mean±SD)表示,n=3,***p < 0.001图3 流式细胞仪检测HepG2细胞线粒体膜电位变化情况
2.4 melittin,SP94-melittin 和 RGD-melittin溶血性比较
本实验将抗菌肽melittin分别与靶向肽SP94和RGD连接以达到增强抗菌肽靶向性同时减低其溶血性的目的.如图4可见,各个浓度的melittin与SP94-melittin相比溶血率没有显著差异(P>0.05),RGD-melittin在0.04 μM及4 μM与melittin与SP94-melittin无显著差异(P>0.05),但在0.2 μM、1 μM、2 μM浓度处与melittin与SP94-melittin相比差异极显著(P<0.01).
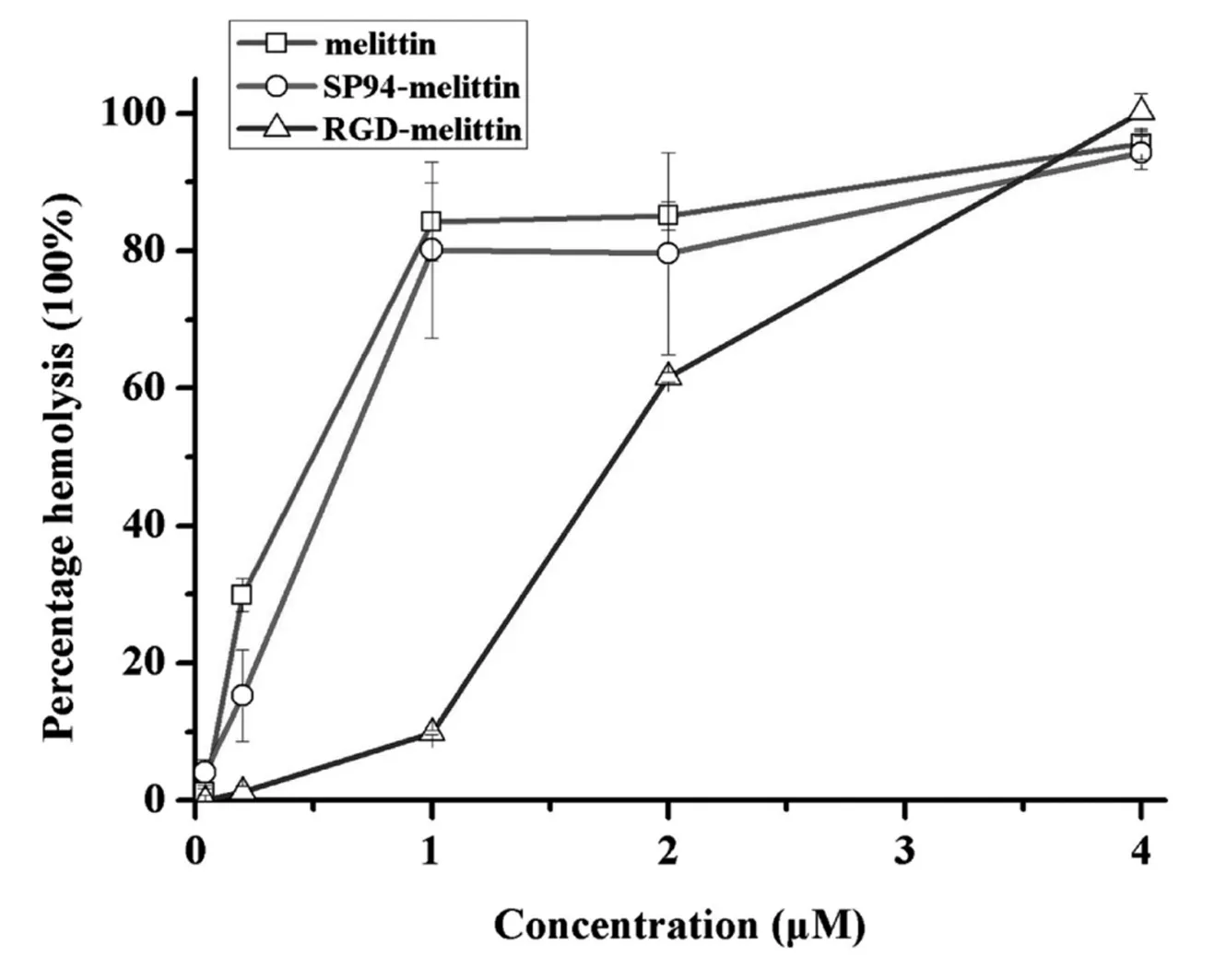
图4 melittin,SP94-melittin 和RGD-melittin溶血性比较
3 讨 论
抗菌肽中的阳离子型抗菌肽不但具有广谱抗细菌、真菌和部分病毒的能力,还具有抗肿瘤活性,同时还可以刺激机体增强免疫力.通过本研究再次证实抗菌肽melittin具有较强的抗肿瘤活性,与前人研究结果一致[9,10],另外本研究采用生物公司合成的多肽序列同样具有正常的生物活性.
为使melittin在体内对肿瘤细胞具有更强的靶向性,将melittin分别与对肿瘤细胞具有靶向性的多肽序列SP94、RGD连接,比较连接后的多肽序列的抗肿瘤性和溶血性的变化;抗肿瘤性由强到弱依次为RGD-melittin、melittin、SP94-melittin;SP94-melittin抗肿瘤性明显低于melittin和RGD-melittin.线粒体膜电位变化也再次证明RGD-melittin抗肿瘤性强于SP94-melittin,并具有显著(P<0.05)或极显著差异(P<0.01).
据文献报道Melittin的抗肿瘤机制是通过自身的二维结构α-螺旋穿过肿瘤细胞膜引起细胞膜破裂,从而引起细胞内容物外泄,导致细胞凋亡[18];另有研究人员报道如果降低阳离子型抗菌肽的螺旋性会引起该抗菌肽抗菌活性降低[19];对于本文中不同靶向肽连接melittin后抗肿瘤性产生明显差异,本研究分析melittin通过10个连接子与12氨基酸长度的SP94连接,melittin通过3个连接子与3个氨基酸序列的RGD连接,连接较长序列的SP94-melittin促肿瘤细胞凋亡性远远低于melittin和连接较短序列的RGD-melittin,而RGD-melittin与melittin相比促肿瘤细胞凋亡性增强,说明连接较长序列的靶向肽可能会降低melittin的α-螺旋结构的生物活性,连接的较短序列对多肽的二维结构影响有限,并且因其特异性,反而增加抗菌肽自身生物活性;从实验结果可以得出不同的靶向肽及靶向肽的长度、特异性可能会影响多肽自身的生物活性.
从溶血性结果可以得出RGD-melittin溶血性显著低于melittin与SP94-melittin,而SP94-melittin与melittin溶血性无明显差异,其溶血性改变的机制尚不清楚.
本研究通过肿瘤细胞凋亡实验、线粒体膜电位测定和溶血实验比较melittin、SP94-melittin、RGD-melittin抗肿瘤性和溶血性,得出melittin连接不同靶向肽及连接序列的长度对其生物活性具有一定的影响,设计人员在设计杂合肽序列时需要充分考虑各肽的生物活性及连接序列长度对彼此间的影响.本研究对设计靶向抗肿瘤杂合肽具有一定参考价值;另外本研究设计的肿瘤靶向杂合肽RGD-melittin可作为纳米粒子的运载药物靶向在肿瘤部位释放以发挥其抗肿瘤效果.
