焦性没食子酸在纯溶剂体系中的溶解度和热力学性质
2022-03-21石排风刘文举申艳敏
石排风,刘文举,申艳敏,王 朝
(河南工业大学 化学化工学院,河南 郑州 450001)
1 引言
1.1 焦性没食子酸的概述
焦性没食子酸(CAS:87-66-1;C6H6O3)[1~3],化学名:1,2,3-三羟基苯,别名:焦倍酸,连苯三酚,焦倍酚,属白色有光泽的结晶粉末,有苦味,是一种多取代的芳基化合物,在空气中及光照下容易被氧化变成灰色。焦性没食子酸有很强的还原性,可以把感光后的卤化银还原成金属银,又因含有酚羟基所以很容易进行甲基化。焦性没食子酸是作为化工化学试剂以及医药的中间体,常用于新型感光材料、抗肿瘤药物、精细化工、印刷、照相显影和贵金属分析。化学分析中可以作为煤气、烟道气、水煤气的除氧剂,在摄影工业中由于在高温、pH值大的条件下可以显影出优图像,一直被广泛用作显影剂[4]。焦性没食子酸在高分子化学中一般用作阻聚剂及防老剂。
焦性没食子酸暴露空气中和光下会被氧化成灰色,在化工生产中该性质不利于物质的保存和使用,所以要研究焦性没食子酸的有机溶剂中溶解度,再根据溶解度得出相应的热力学性质,以期在化工、药物、材料应用中能发挥更大作用。
1.2 固液相平衡介绍
相平衡[5]是化学热力学领域里的重要研究对象,是指多相系统中各相变化达到的极限状态。从宏观来看,相平衡时各相的物质不随时间变化发生迁移,但从微观来看,相际间方向相反的物质传递始终在进行,只是传递速率相同。对于多相系统,到达平衡时,各相具有相同的温度和压力,任一组分在含有该组分的各相中的化学势相等,即:
Tα=Tβ=…=TΦ
(1)
Pα=Pβ=…=PΦ
(2)
μBα=μBβ=…=μBΦ
(3)
式(1)~式(3)中,T为温度(K),P为压力(Pa),μ为化学势(J/mol),上标α,β,…,Φ表示各个相,下标B表示各相中的任一物质。在混合体系中,组分i的逸度和化学势之间的关系式为[4]:
(4)
式(4)中,λi(T)表示标准化学势,是关于温度的函数(J/mol),在一定温度下,当体系达到固液平衡时,可推导出:
(5)
当固相可近似看作纯物系时,可近似认为:
(6)
2 文献综述
2.1 溶解度测定方法
溶解度是指在一定压力和温度下,物质在一定量溶剂中溶解的最高量.一般以100 g溶剂中能溶解的物质的克数来表示。溶解度是衡量物质在溶剂里溶解性大小的尺度,是溶解性的定量表示[7]。物质溶解与否,溶解能力的大小,一方面决定于物质(指的是溶剂和溶质)的本性;另一方面也与外界条件如温度、压强、溶剂种类等有关。在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。
溶解度的测定一般有动态法和平衡法[8]。动态法是指在一定量的溶剂中多次加入溶质溶解直至达到饱和状态,平衡法也称静态法是指在一定量溶剂中加入过量溶质溶解使溶液达到过饱和状态,取上层清液测出溶解度。本实验采用的是平衡法[9]测定焦性没食子酸在纯溶剂中的溶解度.
2.2 实验材料
(1)实验溶剂和药物见表1。实验仪器见表2。

表1 实验溶质和溶剂

表2 实验使用仪器
2.3 实验模型
2.3.1 溶解度计算
计算溶解度公式:
(7)
式(7)中,m1,m2分别代表溶质和溶剂的实际质量(g),M1,M2分别代表溶质和溶剂的相对分子质量(g/mol)。
2.3.2 Apelbalt方程
Apelbalt方程[10,11]是将实验溶解度数据与热力学温度相关联的数学模型,其表达式如下:
(8)
式(8)中,A,B,C是模型参数,x1是溶质的摩尔分数溶解度,T是绝对温度(K)。
2.3.3 热力学性能计算模型
化工生产中的分离和纯化设计过程中会用到相平衡中的热力学性质[12],根据In(x)和(1/T-1/Thm)的相关关系得出摩尔焓(ΔH0)和吉布斯自由能(ΔG0),用ζH和ζTS表示(ΔH0)对(ΔG0)相对贡献度和(ΔS0)对(ΔG0)的相对贡献度。
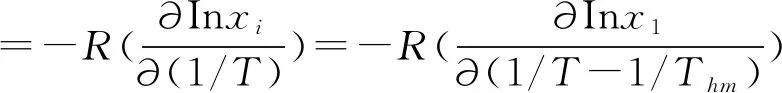
=-R·slope
(9)
(10)
ΔG0=-R·Thm·intercept
(11)
(12)
(13)
(14)
3 实验
3.1 实验过程
实验采用平衡法进行溶解度的测定,用恒温水浴连通双层玻璃反应釜[13,14],确保釜内溶液温度稳定。在釜内加入磁力转子并安置在磁力搅拌器上,在釜内加入一定量的实验所需溶剂,加焦性没食子酸到溶剂中直到不溶,确保溶质过量,溶液在设定温度下恒温水浴搅拌6 h,然后静置2 h直至有上层清液出现,用吸管取上层清液到称好质量的培养皿中,并记下质量,放入烘箱干燥,称量烘干后培养皿和样品质量。需要注意的是由于焦性没食子酸不能见光所以需要在玻璃反应釜外套上锡纸。
3.2 实验数据处理
实验结果见表3、4和图1。

表3 焦性没食子酸在5 种纯溶剂的实验溶解度和拟合溶解度

续表3
4 结果讨论
从图1中可以看出焦性没食子酸在5 种溶剂中的溶解度大小为:正戊醇>乙酸乙脂>正丁醇>乙酸甲酯>乙腈。其溶解度都是随着温度升高而降低,在乙酸乙酯中溶解度随着温度升高变化幅度大,在正丁醇中的溶解度随着温度升高变化幅度小。焦性没食子酸在正丁醇的溶解度小于正戊醇,有机醇类溶剂中随着C链 的增多溶解度越大。在乙酸乙酯的溶解度大于在乙酸甲酯中的溶解度,也是随着C链的增加焦性没食子酸的溶解度增加。
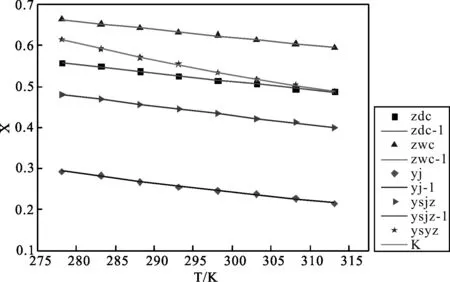
注:从上往下溶剂依次为正戊醇,乙酸乙酯,正丁醇,乙酸甲酯,乙腈。实心图标点是实验数据点,溶解度线是Apelbalt方程拟合结果解度数据进行热力学性质的研究,表4是计算得出的焦性没食子酸在纯溶剂溶解过程的标准摩尔吉布斯能(ΔG0),标准摩尔焓(ΔH0)和标准摩尔熵(ΔS0)ΔH0是负值表明焦性没食子酸在所有溶剂中的溶解过程都是放热的,都是正值表明溶解过程系统混乱无序程度是减少的。ΔG0为正值证明溶解过程是熵驱动的。
本实验结果使用了Apelbalt方程进行数拟合,在表3中拟合结果的ARD和RMSD都非常的小,说明拟合效果比较好,Apelbalt方程是比较适用于焦性没食子酸在纯溶剂中的溶解度。用λh方程拟合出的溶

表4 焦性没食子的热力学性质
