初生及35 日龄滩羊睾丸组织化学特征及INSL3表达比较
2022-03-20陈少宇袁莉刚杨洪早陶金忠丁伟
陈少宇,袁莉刚,杨洪早,陶金忠,丁伟
(1. 甘肃农业大学动物医学院,甘肃 兰州 730070;2. 宁夏大学农学院,宁夏 银川 750021;3. 宁夏农林科学院动物科学研究所,宁夏 银川 750021)
胰岛素样因子3(insulin-like factor3,INSL3)是胰岛素样激素超家族中的一员,由131 个氨基酸组成,又称松弛素样因子,因其特异性表达于Leydig细胞,被称为Leydig 细胞源胰岛素样肽[1]。INSL3 具有广泛的生物活性和功能,可促进细胞的增殖和分化,调节机体出生后的生长发育[2]。婴儿出生后睾丸从腹腔下降至阴囊中,其下降过程可分为腹腔内下降及腹股沟下降两个阶段。INSL3在腹腔内下降过程中发挥了重要作用,INSL3 在成年小尾寒羊睾丸的表达量较其他组织高,是睾丸发育成熟的指标[2-3]。INSL3 在出生前后的Leydig 细胞中特异性表达,雄性大鼠血液中的INSL3 浓度从出生第10 天开始升高,并一直持续到分娩第39 天达到成年水平[1]。INSL3在出生前后的高水平表达对胚胎及初生时期睾丸形态及功能的发育有重要调节功能。研究表明,在人[3]和小鼠[4]中,若INSL3 的表达缺失或低于正常水平时会造成隐睾症的发生。INSL3与Leydig细胞的数量及分化状态密切相关,是Leydig 细胞分化的标志。研究表明,在公牛青春期以前未成熟的Leydig细胞中,其表达量极少[5]。在衰老小鼠Leydig细胞中水平明显下降[6]。有证据表明,公牛[5]、大鼠[7]和人[5]等睾丸INSL3 在RNA 水平或蛋白水平随年龄而变化,由于雄激素对垂体的反馈作用,性成熟初期雄激素及INSL3 稳定在较低的水平。因此,INSL3 表达水平随睾丸的发育及调节机能改变而变化。
滩羊是我国独特的裘皮用绵羊,其生长发育的特殊时期(出生到30 d 左右)表现独特的二毛皮特性,主要受胚胎发育和生态环境因素等方面的影响,尤其是二毛皮被毛卷曲的形成受遗传因素及营养管理等影响明显[8]。INSL3在动物出生前后对生长发育有重要调节功能。滩羊早期生长发育相关影响因子密切关系到滩羊二毛皮的特征表现,为此,本研究通过组织化学染色、免疫组织化学法和免疫荧光技术,对初生及35日龄(二毛皮)滩羊睾丸组织中纤维成分、糖原及INSL3等成分的分布进行比较分析,探究其生长发育特点,为滩羊二毛皮形成期的遗传和生殖发育研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 样品采自宁夏回族自治区吴忠市滩羊选育中心,采用睾丸摘除手术收集初生及35日龄滩羊正常睾丸,4 mL/L 福尔马林固定液中备用。
1.1.2 主要药品试剂及仪器 Masson三色染色试剂(S0075)、网状纤维染色试剂(S0071);兔源抗胰岛素样因子3(INSL3);荧光素Alexa Fluor 555标记链霉亲和素(bs-0437P-AF555);DAPI 染色液(D-9106);抗荧光淬灭封片液(C02-04003);免疫组化染色试剂盒(SP-0023,美国ZYMED 生产),以上材料均购自北京博奥森生物技术有限公司。DAB 显色试剂盒(ZLI-9018,购自北京中杉金桥生物技术有限公司)。
Epon812包埋机,NIKON ECLIPSE 80i显微摄像系统,LKB8800型超薄切片机,正倒置一体荧光显微镜(RVL100-G,ECHO,USA),激光扫描共聚焦显微镜(LSM800,Carl Zeiss,Germany)。
1.2 试验方法
1.2.1 样品制备 新鲜组织样品切取1 cm×1 cm×0.6 cm 大小,经4 mL/L福尔马林固定液固定一周备用;常规梯度酒精脱水,石蜡包埋,超薄切片机连续切片(片厚4 μm),相邻切片分为10套。
1.2.2 特殊染色方法 苏木精-伊红(H.E)常规染色;Masson 胶原纤维染色,胶原纤维和细胞核呈蓝色;Gomori 银氨法染色(Gordon-Sweets method),网状纤维呈黑色,细胞核呈红色,细胞质呈淡黄色;阿利新蓝染色(Alcian,AB),酸性糖原类物质呈蓝色,细胞核为红色;PAS 过碘酸雪夫染色(periodic acid-schiff stain,PAS),中性糖原类物质呈红色,细胞核呈蓝色;AB-PAS 染色,糖原、中性黏蛋白等呈紫红色,酸性糖原类物质呈蓝色。
1.2.3 免疫组织化学法 1)石蜡切片常规脱蜡;2)PBS 振洗3次,每次5 min,高压法暴露抗原,冷却至室温,PBS 振洗;3)滴加30 g/L H2O2阻断过氧化物酶活性,37 ℃孵育15 min,随后PBS 振洗3 次,每次5 min;4)滴加山羊血清白蛋白,37 ℃孵育15 min 后倾去血清;5)分别滴加胰岛素样受体INSL3 (稀释度1∶400),阴性对照组用PBS 代替抗体,37 ℃孵育4 h后PBS 振洗;6)滴加生物素标记山羊抗兔IgG 二抗工作液,孵育15 min;PBS振洗;7)依次滴加50 μL辣根酶标记链霉卵白素工作液,37 ℃孵育,PBS 振洗;8)滴加新鲜配制的DAB显色液置于暗盒显色,常规脱水、透明、封片。观察时,棕褐色显示阳性区域,苏木精将细胞核染成蓝色。
1.2.4 免疫荧光法 操作步骤均与免疫组织化学相同,将生物素标记山羊抗兔IgG 二抗替换为荧光素Alexa Fluor 555 标记链霉亲和素(稀释度1∶800)孵育2 h,PBS 振洗3 次,每次5 min;DAPI染色液孵育10 min后PBS 振洗,抗荧光淬灭封片液封片。采用激光扫描共聚焦显微镜观察拍照。观察时,红色组织显示AF555 的荧光着色;蓝色组织表示DAPI标记的核荧光着色。
1.3 数据统计
切片在NIKON ECLIPSE 80i 显微摄像系统进行照相。每组随机选取5张切片,分别拍摄8个不重复视野(×1 000)。用Image Pro Plus 6.0 软件统计每个视野下横切面圆管形生精小管内Sertoli 细胞数,生精小管管径、横截面积及周围间质组织面积,进而计算间质面积/管腔截面积,同时检测免疫组化阳性反应物的平均光密度值,用统计软件SPSS 23.0对数据进行单因素方差分析。免疫荧光染色在蔡司LSM 800 激光扫描共聚焦显微镜观察拍照。每组随机选取5 张切片,每张切片拍摄6 个不重复视野(×400)。检测免疫组化阳性反应物的平均光密度值,所得统计数据使用SPSS 23.0统计学软件进行单因素方差分析,以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。结果采用半定量的形式对染色结果的分布密度进行描述,-:无阳性表达;+/-:偶有阳性表达; +:阳性表达; + +:中等强度阳性表达; + + +:强阳性表达; + + + +:高密度强阳性表达。
2 结果与分析
2.1 初生及35日龄滩羊睾丸组织化学特征比较
初生滩羊生精小管尚未出现空腔,由1层Sertoli细胞和少量生殖母细胞构成,Sertoli沿固有膜分布,胞浆丰富,突向管腔中央,胞核呈圆形,可见分裂象;生殖母细胞多位于生精小管中央,细胞核深染,呈卵圆形(图1-A);Leydig 细胞成群分布于睾丸间质组织,核多呈椭圆形或不规则形。生精上皮固有膜HE着色较深,管周肌样细胞呈单层分布于固有膜外周,核呈长梭形,胶原纤维丰富(图1-B);Leydig细胞群及生精小管固有膜中网状纤维分布明显(图1-C);生精小管基膜AB染色呈弱阳性(图1-D),PAS染色呈阳性反应(图1-E);AB-PAS 染色蓝紫色条带明显,偶有Leydig细胞呈酸性糖原亮蓝色强阳性表达。(图1-F)。
35日龄滩羊生精小管亦无明显空腔,由1~2层Sertoli细胞和生殖母细胞构成,Sertoli细胞紧贴固有膜排列;生殖母细胞核深染,呈卵圆形,胞浆丰富,个别生殖母细胞接近于生精小管管壁分布(图1-G);Leydig 细胞数量增多,部分细胞核深染。生精上皮固有膜胶原纤维和网状纤维分布增加(图1-H、图1-I);AB 染色在生精小管基膜处阳性反应明显(图1-J);生殖母细胞PAS染色阳性反应增强(图K);ABPAS 染色在生精小管固有膜上紫红色条带增强,Leydig细胞呈紫红色强阳性数量增加明显(图1-L)。

图1 初生及35日龄滩羊睾丸组织化学特征Figure 1 Histochemical characteristics of testicle of newborn and 35 day-old Tan sheep
统计结果表明,初生与35日龄滩羊Sertoli细胞数差异显著(P<0.01),35日龄滩羊生精小管平均直径较初生滩羊有明显增长(P<0.01),生精小管面积极显著增大(P<0.01);间质/管腔截面积比差异显著(表1)。35日龄相对初生滩羊Leydig细胞其细胞核明显缩小;Sertoli 细胞胞质显著增大(P<0.05);管周肌样细胞增大(P<0.05),生殖母细胞胞质未有明显差异(P>0.05),细胞核缩小,管腔内各细胞核质比均显著下降(P<0.05)(表2)。
表1 初生及35日龄滩羊睾丸生精小管特征指数Table 1 The characteristics of spermatogenic tubules in testes of newborn and 35 day⁃old Tan sheep(±s,n=40)

表1 初生及35日龄滩羊睾丸生精小管特征指数Table 1 The characteristics of spermatogenic tubules in testes of newborn and 35 day⁃old Tan sheep(±s,n=40)
同列相同字母表示差异不显著 (P>0.05),相邻字母表示差异显著(P<0.05),相间字母表示差异极显著(P<0.01)。Column with the same letters mean no significant difference (P>0.05),the adjacent small letters mean significant difference(P<0.05); the alternate small letters mean extremely significant difference (P<0.01).
组别Group初生滩羊Newborn Tan sheep 35日龄滩羊35 days Tan sheep Sertoli细胞数/(个·生精小管-1)Number of Sertoli cells per seminiferous tubule 11.53±0.86 a 15.87±1.25 b管腔直径/μm Lumen diameter 34.51±0.65 a 43.31±0.62 b管腔截面积/μm2 Lumen area 935.01±34.64 a 1 473.01±42.36b间质组织截面积/管腔截面积Interstitial tissue area/lumen area 1.17±0.16 a 0.90±0.16 b
表2 初生及35日龄滩羊睾丸组织部分细胞特征指数Table 2 The characteristic index of some cells in the testicular tissue of the newborn and 35⁃day⁃old Tan sheep (±s,n=40)
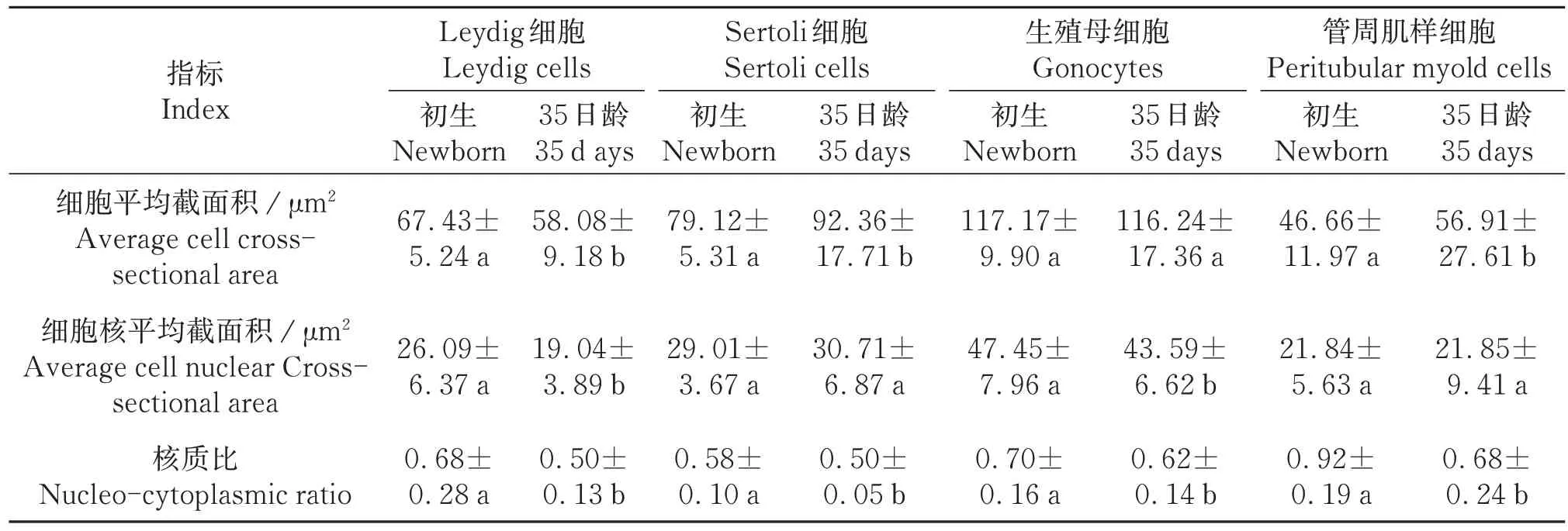
表2 初生及35日龄滩羊睾丸组织部分细胞特征指数Table 2 The characteristic index of some cells in the testicular tissue of the newborn and 35⁃day⁃old Tan sheep (±s,n=40)
同行相同字母表示差异不显著(P>0.05),相邻字母表示差异显著(P<0.05),相间字母表示差异极显著(P<0.01)。Column with the same letters mean no significant difference (P>0.05),the adjacent small letters mean significant difference(P<0.05),the alternate small letters mean extremely significant difference (P<0.01).
指标Index细胞平均截面积/μm²Average cell crosssectional area细胞核平均截面积/μm²Average cell nuclear Crosssectional area核质比Nucleo-cytoplasmic ratio Leydig细胞Leydig cells初生Newborn 67.43±5.24 a 26.09±6.37 a 0.68±0.28 a 35日龄35 d ays 58.08±9.18 b 19.04±3.89 b 0.50±0.13 b Sertoli细胞Sertoli cells初生Newborn 79.12±5.31 a 29.01±3.67 a 0.58±0.10 a 35日龄35 days 92.36±17.71 b 30.71±6.87 a 0.50±0.05 b生殖母细胞Gonocytes初生Newborn 117.17±9.90 a 47.45±7.96 a 0.70±0.16 a 35日龄35 days 116.24±17.36 a 43.59±6.62 b 0.62±0.14 b管周肌样细胞Peritubular myold cells初生Newborn 46.66±11.97 a 21.84±5.63 a 0.92±0.19 a 35日龄35 days 56.91±27.61 b 21.85±9.41 a 0.68±0.24 b
2.2 初生及35日龄滩羊睾丸中INSL3的分布定位
免疫组化结果显示,INSL3 在初生滩羊睾丸组织Leydig 细胞呈强阳性表达,生殖母细胞呈中等强阳性表达,Sertoli细胞呈阳性表达,管周肌样细胞偶有阳性表达(图2-A);阴性对照组未有阳性表达(图2-B);INSL3 在35 日龄睾丸组织Leydig 细胞、生殖母细胞呈中等阳性表达,Sertoli 细胞和管周肌样细胞偶有阳性表达(图2-C);阴性对照未见阳性表达(图2-D)。免疫组织荧光所得结果显示,初生滩羊睾丸组织中Leydig 细胞红色阳性表达明显,生殖母细胞、Sertoli细胞、管周肌样细胞发出的阳性表达较弱(图2-E,2-F,2-G),阴性对照组无表达(图2-H);35日龄滩羊生殖母细胞、Sertoli细胞、管周肌样细胞发出的阳性表达相对较弱(图2-I,图2-J,图2-K)。平均光密度值统计结果显示(图3,表3),35 日龄睾丸组织INSL3 表达量相对初生睾丸组织显著下降(P<0.05),且Leydig 细胞、Sertoli 细胞、生殖母细胞、管周肌样细胞中INSL3 表达水平显著降低(P<0.05)。

图2 INSL3在初生及35日龄滩羊睾丸组织分布定位比较Figure 2 Comparison of the distribution of INSL3 in testicular tissue of newborn and 35 day-old Tan sheep
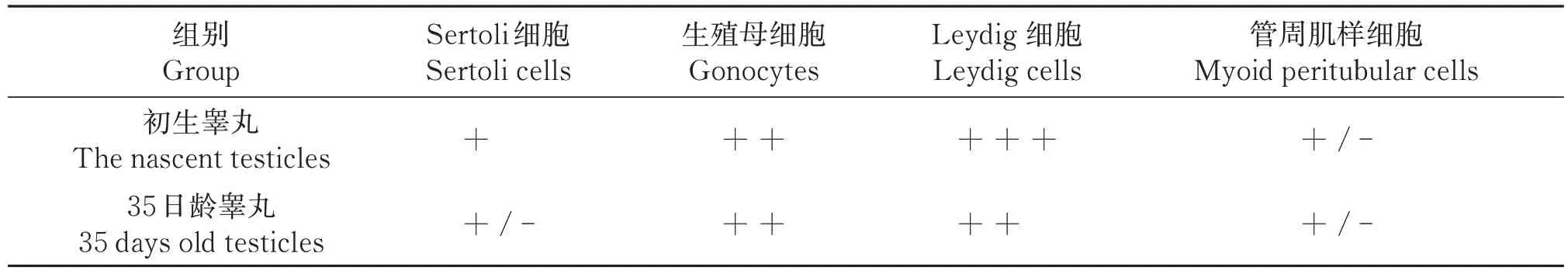
表3 INSL3在滩羊睾丸中不同细胞阳性分布统计Table 3 Positive distribution statistics of INSL3 in different cells in testis of Tan sheep

图3 INSL3在初生及35日龄滩羊睾丸中平均光密度值统计结果Figure 3 Statistical results of average optical density of INSL3 in testis of newborn and 35 day-old Tan sheep
3 讨 论
3.1 初生及35日龄滩羊睾丸组织特征比较
哺乳动物的睾丸组织在性成熟前发育明显,其生精功能随之发生变化。湖羊在初生至60日龄生精小管内出现精原细胞和Sertoli 细胞[9]。Sertoli 细胞是决定精原干细胞(Spermatogonial stem cells,SSCs)分化命运的关键细胞,动物性成熟前后Sertoli细胞通过不同信号通路的激活控制着SSCs 增殖和细胞分化相关因子的表达[10]。研究表明,大鼠出生后Sertoli细胞快速增殖[7];3月龄牦牛的生精小管以大量处于分裂期的幼稚型Sertoli细胞为主[11]。与此相一致,本试验中初生及35日龄的滩羊生精小管尚未形成管腔,管内主要为Sertoli 细胞及尚未分化的生殖母细胞。亦有研究表明:江香猪的Sertoli 细胞数量从15 日龄到30 日龄并没有显著的增加[12]。这种区别可能是由于物种间发育特点的差异所致。
幼稚Sertoli细胞核近圆形,表面有小凹陷,成熟后细胞核凹陷加深,细胞停止分裂并出现细胞间连接复合体[11]。研究表明,初生小鼠生精小管呈实心的索状[13]。大鼠生精小管平均面积从出生至3月龄迅速增大并达到最大值[7]。本研究中,初生及35 日龄滩羊Sertoli 细胞均为幼稚型,分布于生精小管基底部固有膜内侧,胞质呈锥形并突向管腔中央。35日龄滩羊生精小管的平均截面积相比初生滩羊显著增大;Sertoli细胞数量增多,提示35日龄滩羊的生精小管管径增加主要是以Sertoli 细胞的数量增加为主。
生殖母细胞是介于原始生殖细胞和精原干细胞间过渡态的细胞类型[14]。动物出生后的早期发育阶段,生殖母细胞迁移至睾丸生精小管基膜附近并分化为精原细胞[1]。研究发现,1月龄山羊睾丸中存在大量位于生精小管中央的生殖母细胞,部分迁移到生精小管边缘[15]。研究报道,新生田鼠生殖母细胞数量较少,随发育向生殖细胞索周边迁移[16]。与此相一致,本试验中初生滩羊生殖母细胞多位于生精小管中央,而35日龄滩羊的生殖母细胞已有部分位于生精小管基膜周围,提示生殖母细胞逐渐向管壁迁移。
Leydig细胞是睾丸组织中分泌睾酮的重要体细胞,其发育过程中存在胚胎型Leydig 细胞(Fetal Leydig cells,FLCs)和成年型Leydig 细胞(Adult Leydig cells,ALCs)[17]。Leydig 细胞的发育及分化一般只限于胚胎发生和青春期初期,一旦形成后,其细胞数量不会再发生显著变化[18]。初生小鼠睾丸间质中仅有分化较低且无分泌功能的间质祖细胞(pro⁃genitor LC,PLCs),出生后28~35 d,PLCs逐渐分化为具有分泌功能的未成熟间质细胞(immature LC,ILCs),PLCs与ILCs在形态上最大的差异是从纺锤形变为圆形,细胞核也变大[19]。研究表明,初生小香猪睾丸中存在大量形态较小的Leydig细胞,1月龄时则出现大的Leydig 细胞,生精小管单位面积Leydig细胞数量减少[20]。本试验中,初生至35日龄的滩羊Leydig 细胞核明显缩小,核质比下降,核由椭圆形、不规则形逐渐趋向圆形,且细胞核深染;提示初生至35日龄的滩羊Leydig类型由PLCs向ILCs分化。
管周肌样细胞是围绕生精小管呈环形排列的类肌成纤维细胞,即有成纤维细胞的特点又有平滑肌细胞的特性,细胞扁平呈星形或长形,核椭圆,与Sertoli 细胞一起形成精原干细胞龛的细胞边界[21]。研究表明,管周肌样细胞会产生胶质细胞源性神经营养因子(GDNF),并向未分化的精原细胞发出信号,参与精原细胞与Sertoli 细胞的功能调节[22]。本试验中管周肌样细胞呈单层环形分布于固有膜外周,初生至35日龄滩羊管周肌样细胞增加且随生精小管的增大而更加细长,提示管周肌样细胞形态发育趋势与生精小管体积的增大保持一致,其功能变化有待于进一步研究。
3.2 初生及35日龄滩羊睾丸组织化学特征比较
睾丸组织中糖类物质是精子发生所必须的营养,通过血管及固有膜提供给生精上皮。研究表明,睾丸中细胞能量代谢是Sertoli细胞通过葡萄糖转运蛋白(GLUT)将睾丸间质中的葡萄糖进行糖酵解,产生的乳酸通过单羧酸转运蛋白(MCT)转运出细胞外供生精细胞利用[23]。王乾梅等[24]研究表明,正常山羊生精小管周围分布有较多的酸性糖原。PAS及AB-PAS 阳性反应的糖原,糖蛋白以及蛋白多糖存在于睾丸结缔组织,粘液以及基膜中,健康大鼠睾丸PAS阳性反应随生精细胞的成熟而逐渐增强,糖原类物质代谢与正常睾丸发育水平呈正比[25]。而老龄牦牛睾丸间质血管及生精小管固有膜中PAS 及AB-PAS阳性反应增强与间质组织中结缔组织合成增加有关[26]。因此,随着睾丸的发育,睾丸内多糖类物质的增多与睾丸发育水平呈正相关,本研究中,初生至35日龄滩羊的生精小管固有膜上糖原类物质分布增加,且酸性糖原的增长明显,表明在睾丸发育过程中酸性糖类物质代谢优于其他糖类成分。
研究发现,小鼠睾丸间质结缔组织的变化可能会影响睾丸局部代谢,其与生精上皮的发育以及精子的发生密切相关[27]。幼龄期牦牛睾丸组织被膜发育基本完善,结缔组织部分主要为胶原纤维,随着牦牛发育,睾丸内网状和胶原纤维逐渐致密并同步增长;性成熟前牦牛睾丸间质组织中胶原纤维含量较少,网状纤维较多[28]。藏绵羊生精小管外周胶原纤维分布明显,Leydig 细胞散在分布于丰富的胶原纤维之间,固有膜及血管外周的网状纤维较丰富[29]。本研究中,35日龄较初生滩羊睾丸间质中胶原分布有明显增长,网状纤维分布变化不明显,表明网状纤维在滩羊睾丸发育过程中形成较早,其生成早于胶原纤维。
3.3 初生及35日龄滩羊睾丸组织INSL3分布特征比较
INSL3 为Leydig 胰岛 素样因子 或Leydig 细胞特异性胰岛素样肽(LEY-IL)[30]。正常男性,INSL3主要表达于出生前和出生后Leydig 细胞,胎儿期Leydig 细胞上高表达,对引带及睾丸的发育起到促进作用[3]。婴儿出生后其表达量逐渐下降至青春期前最低。研究证实,人类男性胚胎期血清INSL3 浓度是青春期前的2~4倍,青春期Leydig细胞逐渐成熟,血清INSL3水平会再度升高,对睾丸的成熟起到重要作用[31]。本研究中,INSL3在初生和35日龄滩羊Leydig 细胞中均有较高的阳性表达,提示在早期发育阶段Leydig 细胞可以通过分泌INSL3 调控睾丸组织的发育;在初生至35日龄滩羊的Leydig细胞中INSL3 表达强度显著下降,这可能与FLCs 细胞在睾丸组织中所占比例逐渐减少有关。
INSL3 可抑制公猪睾丸的生殖细胞凋亡[32],刺激小鼠Leydig 细胞系TM3 在体外的增殖[33]。Sa⁃bine H K 等[34]研究表明,INSL3 在生殖细胞有丝分裂高峰时Sertoli 细胞中高表达,从而间接影响精原细胞的分裂,提示INSL3 在介导促性腺激素作用中的重要性。本研究中,INSL3在Sertoli细胞、管周肌样细胞中生殖母细胞INSL3 的表达量相对较弱,且随时间推移呈下降趋势,提示INSL3 的含量与生殖母细胞的发育呈负相关。
4 结 论
综上所述,初生及35日龄滩羊生精小管管腔尚未形成,生精小管以未成熟的Sertoli细胞为主,并随着Sertoli 细胞数量和体积的增加而增大;滩羊初生至35日龄睾丸发育过程中,酸性糖类物质代谢优于其他糖类成分,网状纤维生成早于胶原纤维。INSL3 对睾丸生精细胞无明显调节作用;其表达降低与Leydig 细胞中FLCs 细胞群逐渐减少相一致。本研究为INSL3 对Leydig 细胞分泌功能调控机制的研究提供了参考。
