PD-1、PD-L1蛋白在子宫内膜癌组织中的表达及其临床意义*
2022-03-16秦绪颖刘秀芳张丽丽隋红梅李爱华
秦绪颖,刘秀芳,张丽丽,隋红梅,李爱华
252000 山东 聊城,山东第一医科大学附属聊城医院 妇产科(秦绪颖、张丽丽、隋红梅、李爱华); 252000 山东 聊城,聊城市东昌府区妇幼保健院 产科(刘秀芳)
子宫内膜癌(endometrial carcinoma,EC)是最常见的妇科恶性肿瘤之一[1],高级别和转移/复发性EC患者预后差且存活率低,目前尚无明确推荐的靶向药物。肿瘤微环境(tumor microenvironment,TME)是肿瘤细胞和宿主免疫系统相互作用的主要位点[2],是目前肿瘤学家关注的热点。PD-1表达于多种免疫细胞表面[3],是免疫检查点,可抑制过度免疫反应,防止自身免疫[4]。PD-L1作为PD-1的特异性配体,发挥分子“屏蔽”作用,使PD-L1表达阳性的肿瘤细胞免受CD8阳性T细胞介导的免疫杀伤作用[5]。PD-1/PD-L1通路是TME影响肿瘤发生发展的关键机制之一。
阻断PD-1/PD-L1通路能够在具有高度免疫原性的肿瘤中表现出持久的肿瘤抑制作用,并带来长期缓解[6]。一项对宫颈鳞状细胞癌的研究显示,PD-L1阳性患者对pembrolizumab(帕博利珠单抗)显示出良好的反应性[7]。而nivolumab(纳武利优单抗)在铂类耐药卵巢癌患者中也显示出令人鼓舞的疗效[8]。EC被认为是一种具有高度免疫原性的疾病[9],已有学者对其开展了关于PD-1/PD-L1通路的临床试验[10],但相关研究仍然较少。本课题通过检测EC组织中PD-1、PD-L1表达情况,探讨其作为EC组织中TME机制与生存期的关系,以期为EC的免疫治疗提供更多依据。
1 资料与方法
1.1 主要试剂
兔抗人PD-L1单克隆抗体(SP142)、免疫组化抗原修复缓冲液(pH 8.0/9.0):北京中杉金桥生物技术有限公司;鼠抗兔PD-1抗体(MX033);即用型免疫组化EliVixion plus试剂盒(鼠/兔)(Kit-9901)、DAB显色试剂盒(20×)(DAB-0031):福州迈新生物技术开发有限公司。
1.2 研究对象
收集本院病理科2007年1月至2009年1月的子宫内膜组织石蜡标本,其中正常子宫内膜标本20例,EC标本112例,患者年龄36~79岁,中位58.5岁;未绝经者63例,已绝经者49例;Ⅰ型(子宫内膜样癌)标本102例,Ⅱ型EC标本10例(透明细胞EC2例,浆液性EC8例);高、中分化EC 62例,低分化EC 50例;分期参照2009年FIGO标准:早期(Ⅰ~Ⅱ期)80例,晚期(Ⅲ~Ⅳ期)32例;淋巴结阳性79例,淋巴结阴性33例,浅肌层浸润49例,深肌层浸润63例。所有标本均由2位经验丰富的病理科专家阅片,所有患者术前均未进行过任何辅助治疗,具有完整的病历资料,随访从手术日起到随访日期或死亡日期,10例失访。所有患者家属知情并签署知情同意书,本研究由本院伦理委员会审查并批准。
1.3 实验方法
采用免疫组化SP法检测PD-1、PD-L1蛋白表达。评分标准及结果判定:该实验选用双盲法,由两位病理科专业医师单独阅片并进行评分(本研究中以PD-1、PD-L1在淋巴细胞中的染色为阳性表达),镜下随机观察5个高倍镜视野,每视野计数100个淋巴细胞,观察淋巴细胞的染色强度及数目,评估样品PD-L1和PD-1阳性淋巴细胞的染色强度和所占百分比,无染色为0分,淡黄色为1分,黄色至褐色为2分,深褐色3分,超过5%淋巴细胞染色强度≥2认定为阳性。
1.4 统计学分析
使用SPSS 25.0统计软件处理数据,卡方检验(Pearson、Fisher精确检验)用于分析PD-1、PD-L1组间表达差异及其与临床病理特征的相关性,采用Spearman分析EC组织中PD-1与PD-L1表达的相关性;通过Kaplan-Meier法进行生存分析,P<0.05有统计学意义。
2 结 果
2.1 PD-1、PD-L1在正常子宫内膜及EC组织中的表达情况
2.1.1 PD-1在正常子宫内膜及EC组织中的表达 正常子宫内膜组织中PD-1阳性表达率为25.0%,主要定位于淋巴细胞细胞膜和细胞质中,显示为散在的淡棕黄色颗粒;EC组织中PD-1阳性表达率为61.6%,定位于肿瘤间质淋巴细胞的细胞膜和细胞质,弥漫或散在分布,表现为黄色、棕色、棕褐色颗粒。EC组织中PD-1阳性表达率明显高于正常子宫内膜(表1,图1)。
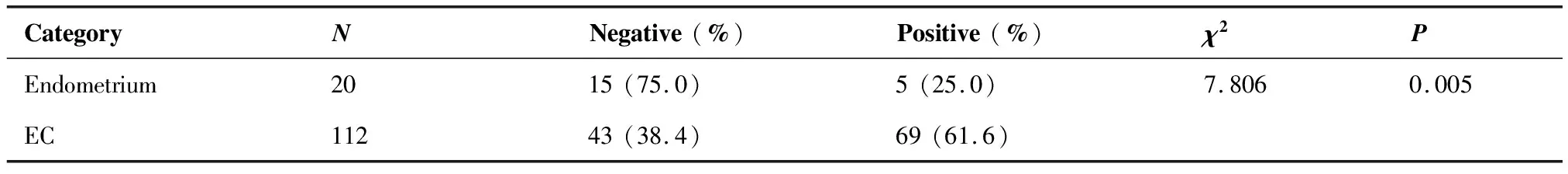
表1 正常子宫内膜组织和子宫内膜癌组织中PD-1的表达情况
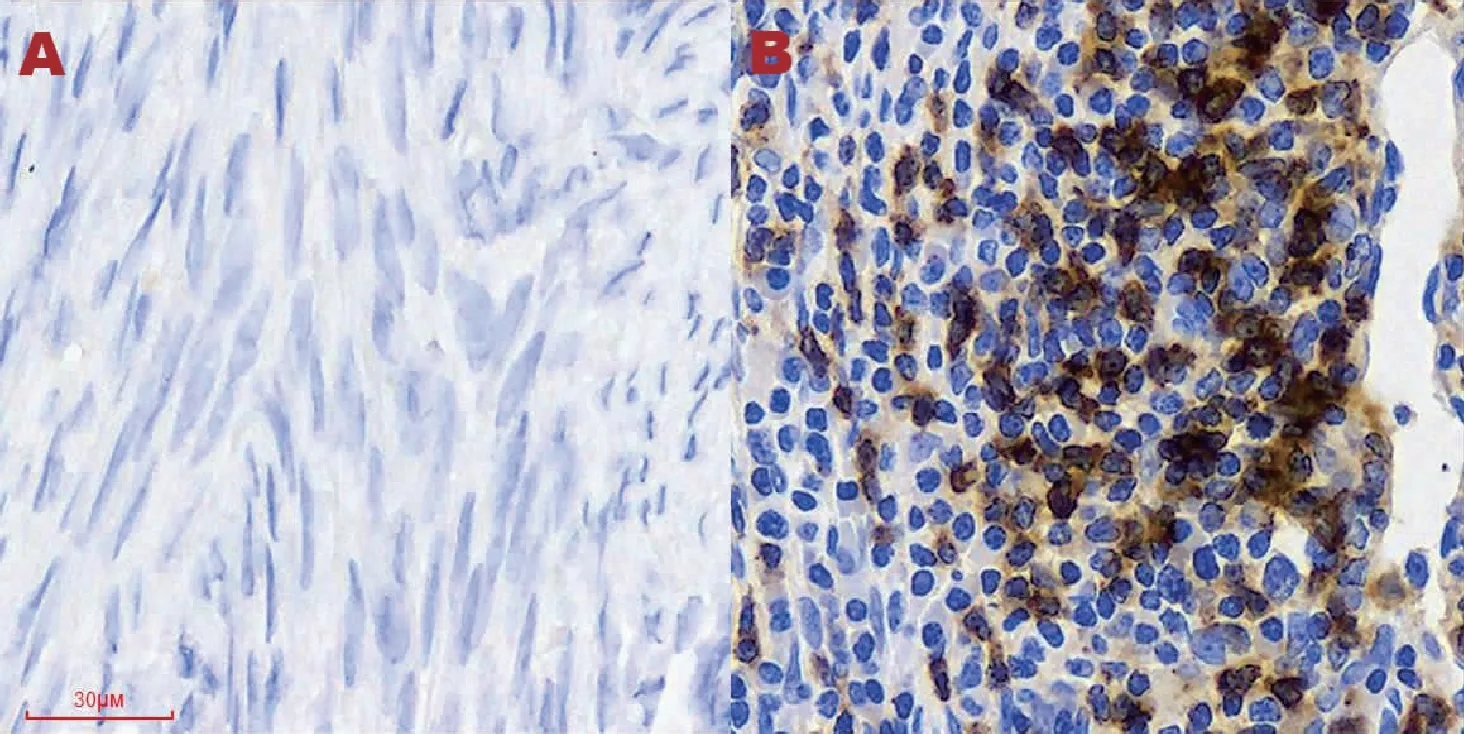
图1 PD-1在正常子宫内膜及子宫内膜样腺癌中的表达
2.1.2 PD-L1在正常子宫内膜及EC组织中的表达 PD-L1在正常子宫内膜组织中阳性表达率为30.0%,主要定位于淋巴细胞的细胞质或细胞膜,为散在的棕黄色颗粒,或弥漫的黄色物质。在EC组织中PD-L1蛋白主要定位于肿瘤间质淋巴细胞的细胞质和细胞膜上,表现为散在或弥漫的棕黄色、黄色颗粒,少数定位于肿瘤细胞的细胞质和细胞膜上,PD-L1在EC组织中的阳性表达率为64.7%,明显高于正常子宫内膜(表2,图2)。
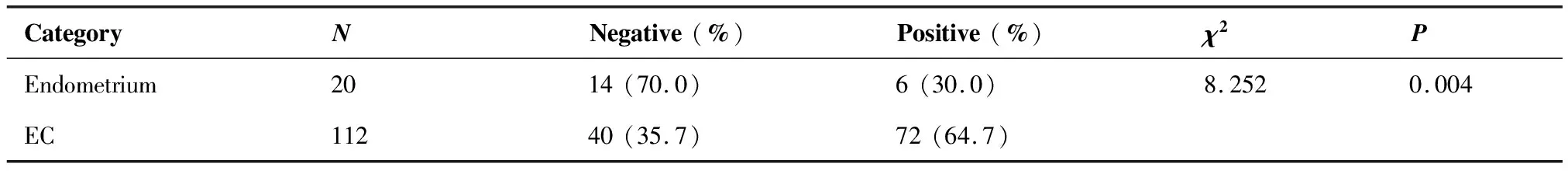
表2 正常子宫内膜组织和子宫内膜癌组织中PD-L1的表达情况
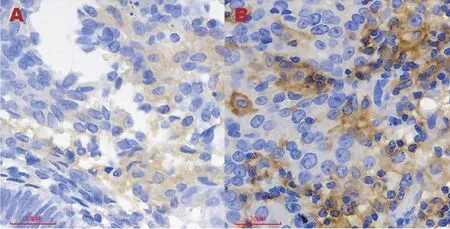
图2 PD-L1在正常子宫内膜及子宫内膜样腺癌中的表达
2.2 EC组织中 PD-1、PD-L1的表达与不同临床病理参数的关系
2.2.1 EC组织中 PD-1的表达与临床病理参数的关系 EC组织中PD-1阳性表达率,高中分化组高于低分化组(75.8%vs50.0%,χ2=7.911,P=0.005),早期高于晚期(78.8%vs53.1%;χ2=5.168,P=0.023),淋巴结阴性组高于阳性组(79.7%vs48.5%;χ2=5.839,P=0.016),浅肌层浸润组高于深肌层组(77.6%vs46.0%;χ2=5.873,P=0.015),均呈负相关,差异均有统计学意义;PD-1表达与年龄、绝经状态、EC类型无关(表3)。
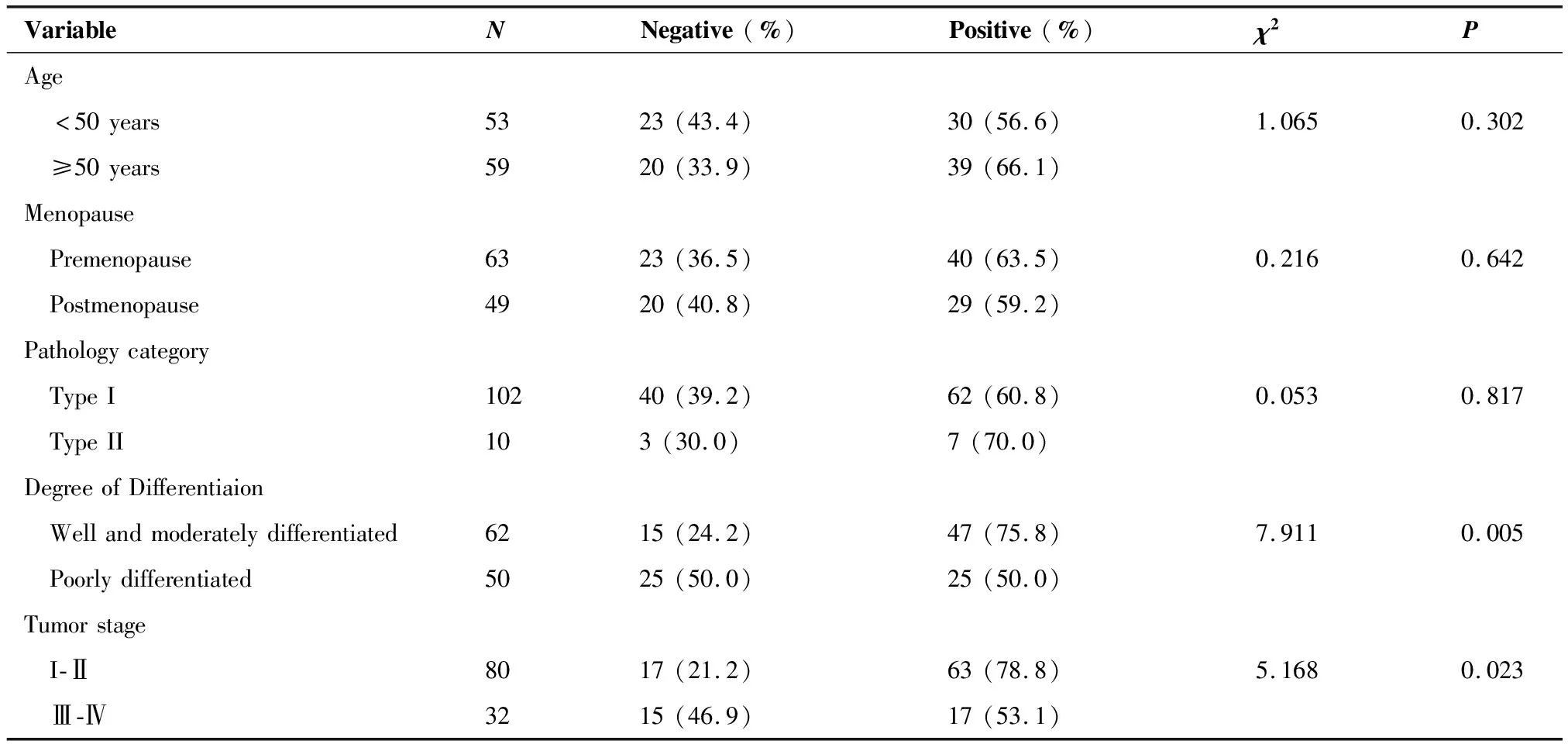
表3 患者临床病理特征与子宫内膜癌组织中PD-1的表达情况
2.2.2 EC组织中PD-L1的表达与临床病理参数的关系 EC组织中PD-L1阳性表达率,低分化组高于高中分化组(78.0%vs53.2%;χ2=7.399,P=0.007),晚期高于早期(87.5%vs55.0%;χ2=9.148,P=0.002),淋巴结阳性组高于阴性组(87.9%vs54.4%;χ2=9.933,P=0.002),深肌层浸润组高于浅肌层组,均呈正相关,差异均有统计学意义(74.6%vs51.0%;χ2=6.677,P=0.010)。除此之外,PD-L1阳性表达率与患者年龄、绝经状态无关(表4)。

表4 患者临床病理特征与子宫内膜癌组织中PD-L1的表达情况
2.3 EC组织中 PD-L1和PD-1 蛋白表达的相关性
在EC组织,PD-1的阳性表达率为61.6%,PD-L1的阳性表达率为64.7%,Spearman相关性分析检验显示:rs=0.025,P=0.797,二者表达没有相关性(表5)。

表5 PD-1表达与PLD-L1表达的相关性
2.4 EC组织中PD-1和PD-L1蛋白表达与患者术后总生存期的关系
采用 Kaplan-Meiri法分析 PD-1及PD-L1表达与总生存期(overall survival,OS)的关系,PD-1阳性组优于阴性组[(95.8±3.8)个月vs(79.6±5.0)个月;χ2=6.551,P=0.010];PD-L1阴性组优于阳性组[(111.5±3.3)个月vs(77.25±3.7)个月;χ2=27.020,P<0.001]。另外,单因素分析显示OS与病理类型、FIGO分期、淋巴结转移、肌层浸润深度、PD-1、PD-L1表达有关,多因素分析表明病理类型、FIGO分期、PD-1、PD-L1蛋白表达是独立预后因素(表6,图3、4)。
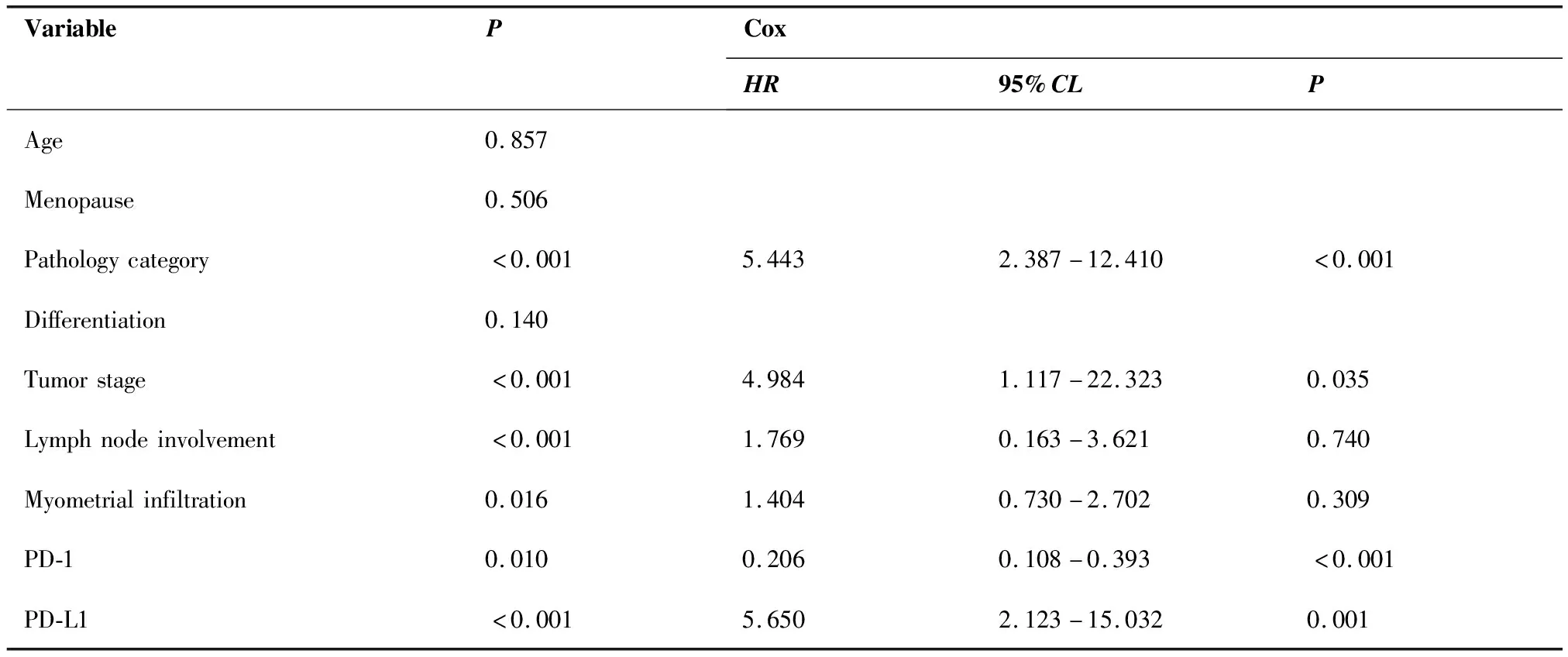
表6 Kaplan-Meier生存分析
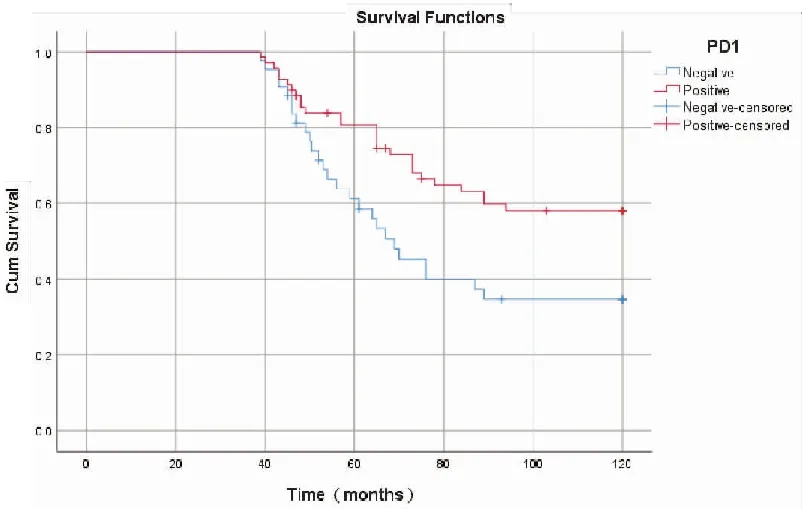
图3 EC组织中PD-1蛋白表达与生存关系图
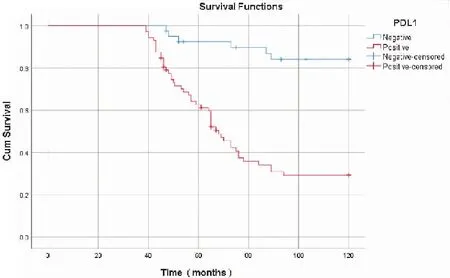
图4 EC组织中PD-L1蛋白的表达与生存关系图
根据PD-1、PD-L1蛋白在EC中的表达将其分为4种类型,I型:PD-1阳性+PD-L1阳性;II型:PD-1阳性+PD-L1阴性;III型:PD-1阴性+PD-L1阳性;IV型:PD-1阴性+PD-L1阴性。采用Kaplan-Meiri对4个组合进行生存分析,结果表明:II型患者OS最长,III型OS最差(χ2=43.915,P<0.001),各组数据两两比较统计学意义如下:IvsII(P=0.018);IvsIII(P=0.038);IvsIV(P=0.256);IIvsIII(P<0.001);IIvsIV(P=1.000);IIIvsIV(P<0.001)(图5、6)。

图5 依据PD-1、PD-L1表达的子宫内膜癌四分型(40×)
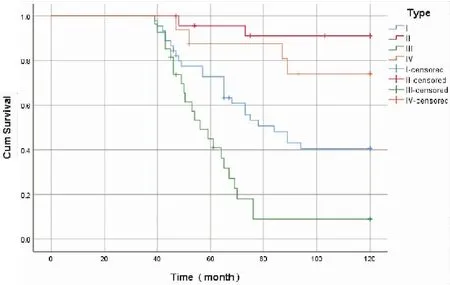
图6 EC组织中PD-1、PD-L1蛋白组合表达与生存关系图
3 讨 论
3.1 PD-1、PD-L1在不同肿瘤组织中表达及与临床病理特征的关系
PD-1及PD-L1在许多类型恶性肿瘤中表达上调,与临床病理参数存在密切联系。Chiu等[11]研究发现PD-1和PD-L1在胃癌组织中均表达升高,其中PD-1在肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)特别是CD3阳性效应T细胞表达升高;而PD-L1表达与肿瘤大小、浸润深度、淋巴结转移以及组织学分级显著相关[12-15]。在乳腺癌中的研究结果与此相似,且PD-1和PD-L1表达也存在较强的相关性[14],因此作者认为表达于肿瘤细胞的PD-L1与TIL细胞表面PD-1相互作用,从而抑制免疫系统启动对癌细胞的杀伤作用[14,16]。
本研究结果显示,EC组织中PD-1主要分布于肿瘤间质淋巴细胞的细胞膜和细胞质中,阳性表达率为61.6%,显著高于正常子宫 内膜,表达与组织分化、FIGO分期、淋巴结转移、肿瘤浸润深度呈负相关。而PD-L1蛋白主要分布于肿瘤间质淋巴细胞的细胞质和细胞膜上,少数分布于肿瘤细胞的细胞质和细胞膜(本研究将淋巴细胞PD-L1表达阳性定义为组织表达阳性)。但在2例子宫内膜透明细胞癌组织中PD-L1主要定位于肿瘤细胞。PD-L1阳性表达率为64.7%,显著高于正常子宫内膜,表达与病理类型、组织学分级、FIGO分期、淋巴结转移、浸润深度呈正相关,与患者年龄、绝经状态无关。EC组织和正常子宫内膜中PD-1和PD-L1蛋白的表达差异及二者与临床病理特征之间的相关性进一步证明了PD-1/PD-L1蛋白可能成为预测EC不良结局的独立因素。然而,在本研究中EC组织的PD-1与PD-L1蛋白表达并没有显示出相关性。
3.2 PD-1、PD-L1表达的预后价值
多项研究表明PD-L1表达与癌症患者的预后密切相关,如黑色素瘤[17]、肾癌[18]、肺癌[19]和结肠直肠癌[20],PD-L1过表达的患者预后较差,其原因可能在于PD-L1表达可导致TIL功能受损,阻碍抗肿瘤免疫[14]。本研究结果显示,在EC组织中PD-1阳性组OS优于阴性组,PD-L1阴性组OS优于阳性组,单因素分析显示OS与PD-1、PD-L1表达、病理类型、FIGO分期、淋巴结转移、浸润深度有关,多因素分析表明病理类型、FIGO分期、PD-1、PD-L1蛋白表达是EC的独立预后因素,结果证实了EC组织中PD-L1表达对预后的不良影响,以及PD-1高表达的生存获益[15]。基于PD-1与PD-L1在EC中的表达情况,将其分为四种类型,Ⅰ型:PD-1阳性+PD-L1阳性;Ⅱ型:PD-1阳性+PD-L1阴性;Ⅲ型:PD-1阴性+PD-L1阳性;Ⅳ型:PD-1阴性+PD-L1阴性。采用Kaplan-Meier对4种组合进行生存分析,结果表明:Ⅱ型患者OS最长,Ⅲ型OS最差。尽管有临床研究报道了免疫细胞[21]和肿瘤细胞[22]PD-L1不同的预后价值,但均未能充分证明其生物标记物意义[23-24],而我们通过对PD-1及PD-1L组合的方法可以更加准确地评估EC的预后,进一步证实了PD-1及PD-1L作为EC预后的生物标志意义。
3.3 EC相关PD免疫治疗
近年来,TME成为肿瘤治疗学研究的热点[25]。PD-1是属于T细胞受体CD28家族免疫检查点受体,其配体PD-L1在TME中被激活,有助于抗肿瘤免疫逃避[25]。针对PD-1/PD-L1途径的单克隆抗体在非小细胞肺癌、肾细胞癌和错配修复缺陷相关结直肠癌显示出很好的疗效[20,22,26]。免疫检查点抑制剂可诱导T细胞活性恢复,释放抗肿瘤免疫反应[25,27]。肿瘤进展是肿瘤侵袭和宿主免疫防御失衡的结果[28],肿瘤进展过程中往往伴随着免疫细胞或免疫因子的变化[29],而越来越多的研究表明:一些免疫标记物较TNM分期更有预测价值[30]。
目前可用于PD-1抑制剂疗效预测的分子标志物有:1)PD-L1表达水平;2)微卫星不稳定和基因错配修复缺陷;3)肿瘤突变免疫负荷检测;4)肿瘤浸润淋巴细胞表达。Pembrolizumab在多种肿瘤类型中表现出强大的抗肿瘤活性和良好的安全性,60多个国家已批准其应用于晚期恶性肿瘤的治疗,KEYNOTE-028研究发现Pembrolizumab应用于晚期EC患者维持治疗的疗效满意[31],为靶向治疗提供了重要参考。本研究中PD-1与PD-L1在EC中表达情况的组合分析,不仅具有指导预后的意义,而且对于靶向治疗的选择也具有一定的指导意义。
3.4 研究的优势及局限性
本研究结果显示EC组织中PD-1/PD-L1单克隆抗体显示出良好的反应性,明确了EC组织中PD-1高表达的生存获益和PD-L1表达对预后的不良影响,为EC的预后提供了重要参考;此外,本研究通过对PD-1、PD-L1蛋白的表达组合后进行生存分析,进一步发现PD-1阳性+PD-L1阴性组患者预后最好,而PD-1阴性+PD-L1阳性者预后最差,不仅提供预后信息,也为EC靶向治疗提供了重要参考,为其他相关研究提供了新的研究思路。局限性:样本均取自初次行手术治疗的EC患者;没有研究子宫内膜上皮内瘤变及复发性EC;没有评估PD-1/PD-L1在子宫内膜不同病变状态的演变;由于样本量少,未深入探讨PD-1、PD-L1在II型EC中的意义;未对淋巴细胞进一步标记,无法判断肿瘤间质中染色的免疫细胞是否为TIL;目前用于预测免疫治疗疗效的分子标志物还有:MSI、dMMR、TMB及TIL表达,但本研究未对其他分子标志物进行检测,无法和其他因子进行对照。
总之,EC中PD-1/PD-L1的深入研究,有助于筛选适当的EC患者进行免疫治疗,使他们得到更好的生存获益。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
