基于染色体片段置换系群体检测水稻株型性状QTL
2022-03-16王小雷李炜星欧阳林娟陈小荣边建民胡丽芳彭小松贺晓鹏傅军如周大虎贺浩华孙晓棠朱昌兰
王小雷 李炜星 欧阳林娟 徐 杰 陈小荣 边建民 胡丽芳 彭小松 贺晓鹏 傅军如 周大虎 贺浩华 孙晓棠 朱昌兰
基于染色体片段置换系群体检测水稻株型性状QTL
王小雷 李炜星 欧阳林娟 徐 杰 陈小荣 边建民 胡丽芳 彭小松 贺晓鹏 傅军如 周大虎 贺浩华 孙晓棠*朱昌兰*
江西农业大学 / 作物生理生态与遗传育种教育部重点实验室 / 江西省超级稻工程技术研究中心, 江西南昌 330045
株型是由多个形态和生理性状集成的复合性状, 它与水稻产量密切相关。挖掘优异株型等位基因或QTL, 对水稻超高产育种具有重要意义。本研究利用籼稻昌恢121和粳稻Koshihikari构建的208个染色体片段置换系(chromosome segment substitution lines, CSSLs), 在3个环境下, 对控制株高、剑叶形态和分蘖数的QTL进行检测, 共鉴定到35个株型性状QTL, 分布于11条染色体上(除9号染色体以外), 解释表型变异2.00%~22.86%。值得关注的是、和均能在3个环境下被检测到, 其中为1个新鉴定到的剑叶宽QTL。对和位点进行鉴定, 验证了这2个位点等位基因的加性效应和环境稳定性。本研究为株型性状QTL的进一步精细定位、克隆及分子辅助聚合育种奠定了基础。
水稻; 染色体片段置换系; 株型; 数量性状基因座位
株型与产量密切相关, 是水稻育种的重要目标性状。通过将多个优异株型基因聚合在一起的育种方法被称为理想株型育种, 它能够最大限度地利用光能, 促进结实转化, 从而增加经济系数[1]。理想株型兼顾水稻的生物产量, 同时优化产量结构, 是超高产育种主要途径之一[2]。水稻株型涉及株高、剑叶长、剑叶宽、剑叶夹角和分蘖数等指标[3]。其中, 株高决定水稻生物量和收获指数, 较高的株高能够改善水稻通风和叶片光照条件, 但易引起倒伏, 反之则会影响光合效率; 分蘖数影响水稻生长空间、光合作用及产量, 且受环境因素影响较大[4]; 剑叶形态包括剑叶长、剑叶宽和剑叶夹角, 直接影响群体的叶面积指数和受光效率, 从而影响产量及品质[5]。
株型是受多基因调控的数量性状, 调控水稻株型的基因网络非常复杂[6]。迄今为止, 利用不同遗传群体已鉴定到大量与株型相关的QTL, 根据Gramene (http://www.gramene.org/)和国家水稻数据库中心(http://www.ricedata.cn/gene/)公布的数据可知,株高、剑叶形态和分蘖数这3个性状, 已有1500多个相关的QTL被报道, 被克隆的基因超过300个, 如[7][8]、()[9][10]等。其中,和是调控水稻株型的3个关键基因,编码GA20氧化酶(GA20ox), 该基因突变导致水稻矮化, 能够增加水稻产量, 并使抗倒伏能力增强[7]。围绕这个基因进行的水稻矮化育种, 带动了水稻第一次绿色革命。编码一个C2H2锌指蛋白, 该位点上的野生稻等位基因在编码区的突变造成了氨基酸变化, 使基因丧失功能和活力, 从而导致栽培稻直立生长、每穗粒数增加和产量提高[8,11-12]。是调控水稻理想株型形成的主效基因, 编码一个含有SBP-box结构域的转录因子, 调控多个生长发育过程。其功能缺失突变体表现出无效分蘖少、茎秆粗壮抗倒伏、穗大粒多、产量高等优异农艺性状[9,13-15]。近几年研究发现,既能提高水稻产量, 又具有增强对稻瘟病抗性的调控新机制[16]。目前, 虽然已经鉴定和克隆了许多株型基因, 但这些有利的株型等位基因绝大部分已经应用在育成的品种中,要想进一步提高水稻产量, 有必要继续挖掘不同遗传资源中的株型相关基因/QTL, 在阐明其遗传机制的基础上加以利用。
籼稻和粳稻是亚洲栽培稻中的2个亚种, 其基因组存在着高度的遗传分化, 籼粳杂交具有强大的杂种优势潜力, 后代群体的农艺性状、生理和生态特性等各方面表现出超亲现象。利用籼稻和粳稻间杂交构建的CSSL, 能够对水稻优异等位基因/QTL进行定位[17], 解析因遗传分化造成的等位基因互作差异[18]; 同时还可以将优良基因/QTL进行聚合育种[19]。此外, 选择CSSL株系和受体亲本进行回交, 分离得到的F2和F3群体, 可以对单个QTL进行精细定位和克隆[20-21]。本研究利用籼稻昌恢121与粳稻Koshihikari构建的BC3F8、BC4F7和BC5F6共208个CSSLs, 旨在对株高、剑叶形态和分蘖数等株型性状进行QTL检测, 为进一步精细定位、克隆相应的株型性状QTL以及分子标记辅助育种奠定基础。
1 材料与方法
1.1 试验材料
供试材料籼稻昌恢121 (Changhui 121, CH121)是由本课题组选育的强优势籼稻恢复系, 培育出农业部超级稻淦鑫688等一系列强优势杂交组合[22]; Koshihikari为日本粳稻品种。本课题组利用CH121和Koshihikari构建的一套染色体片段置换系(chromosome segment substitution lines, CSSLs), 包括BC3F8、BC4F7和BC5F6共208个CSSLs。该套CSSL分子连锁图谱包含180个SSR分子标记, 覆盖水稻全基因组的1427.7 cM, 平均间距为7.93 cM, 最大间距为25.3 cM。平均每个株系置换的分子标记数占总标记数的比例为4.56%, 置换的标记数目为9个。其中, 纯合供体基因型标记为7个, 杂合基因型标记为2个[23]。
1.2 材料种植
于2015年在江西南昌中稻季(E1)、2016年海南三亚(E2)和2016年江西南昌中稻季(E3)共3个环境, 种植CH121、Koshihikari和208个CSSLs (表1), 采用完全随机区组设计, 重复3次, 每个重复种植3行,每行10株。种植株行距为17 cm × 22 cm, 田间管理遵循正常的水稻生产程序。
1.3 株型性状调查
在水稻齐穗期, 选取中间行有代表性的8个单株, 分别对水稻主茎的剑叶长、剑叶宽和剑叶夹角进行测定; 成熟期测量株高和分蘖数, 3次生物学重复。每个性状的具体测量方法见表2。
1.4 QTL定位
利用QTL IciMapping 4.1[24-25]软件中的CSL程序(ICIM-CSL)进行检测, 以LOD≥2.5作为阈值, 当LOD值大于2.5时认为具有有效QTL的存在。遗传连锁图使用MapChart软件[26]进行绘制。使用SPSS17.0, 采用单因素方差分析(ANOVA)对统计数据进行显著差异分析, 当0.01 << 0.05时, 用“*”表示;< 0.01时, 用“**”表示。使用SPSS17.0一般线性模型, 计算表型变量的方差组分, 评估株型性状的遗传率。
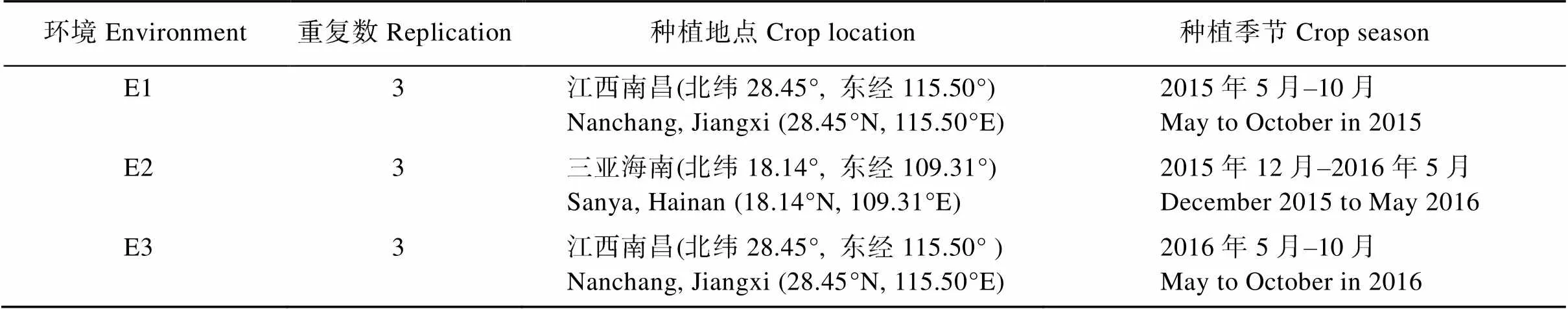
表1 昌恢121、Koshihikari和208个CSSLs的种植环境
E1: 2015年江西南昌中稻季; E2: 2016年海南三亚; E3: 2016年江西南昌中稻季。
E1: middle-season rice in 2015 in Nanchang, Jiangxi; E2: in 2016 in Sanya, Hainan; E3: middle-season rice in 2016 in Nanchang, Jiangxi.

表2 株型性状的测量方法
2 结果与分析
2.1 CH121和Koshihikari表型比较
亲本CH121和Koshihikari在株高(plant height, PH)、剑叶长(flag leaf length, FLL)、剑叶宽(flag leaf width, FLW)、剑叶夹角(flag leaf angel, FLA)和分蘖数(tiller numbers, TN)表型上存在较明显差异(图1和表3), 其中, CH121的株高和剑叶宽显著大于Koshihikari, 株高的增幅达13.0%~26.9%, 剑叶宽的增幅达38.5%~66.7%; 剑叶夹角则是Koshihikari显著大于CH121, 增幅达1.56~2.37倍。
2.2 CSSL群体的株型表型变异与相关性分析
由表3和图2可知, 2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季种植的208个CSSLs群体, 各株型性状的表型值均表现为连续变异, 且存在双向超亲分离现象, 呈现出数量性状的遗传特点。通过对株型各性状之间的相关性分析发现, 株高分别与剑叶长和剑叶夹角呈极显著正相关; 剑叶长与剑叶宽呈极显著正相关(表4)。

图1 昌恢121和Koshihikari的株型性状
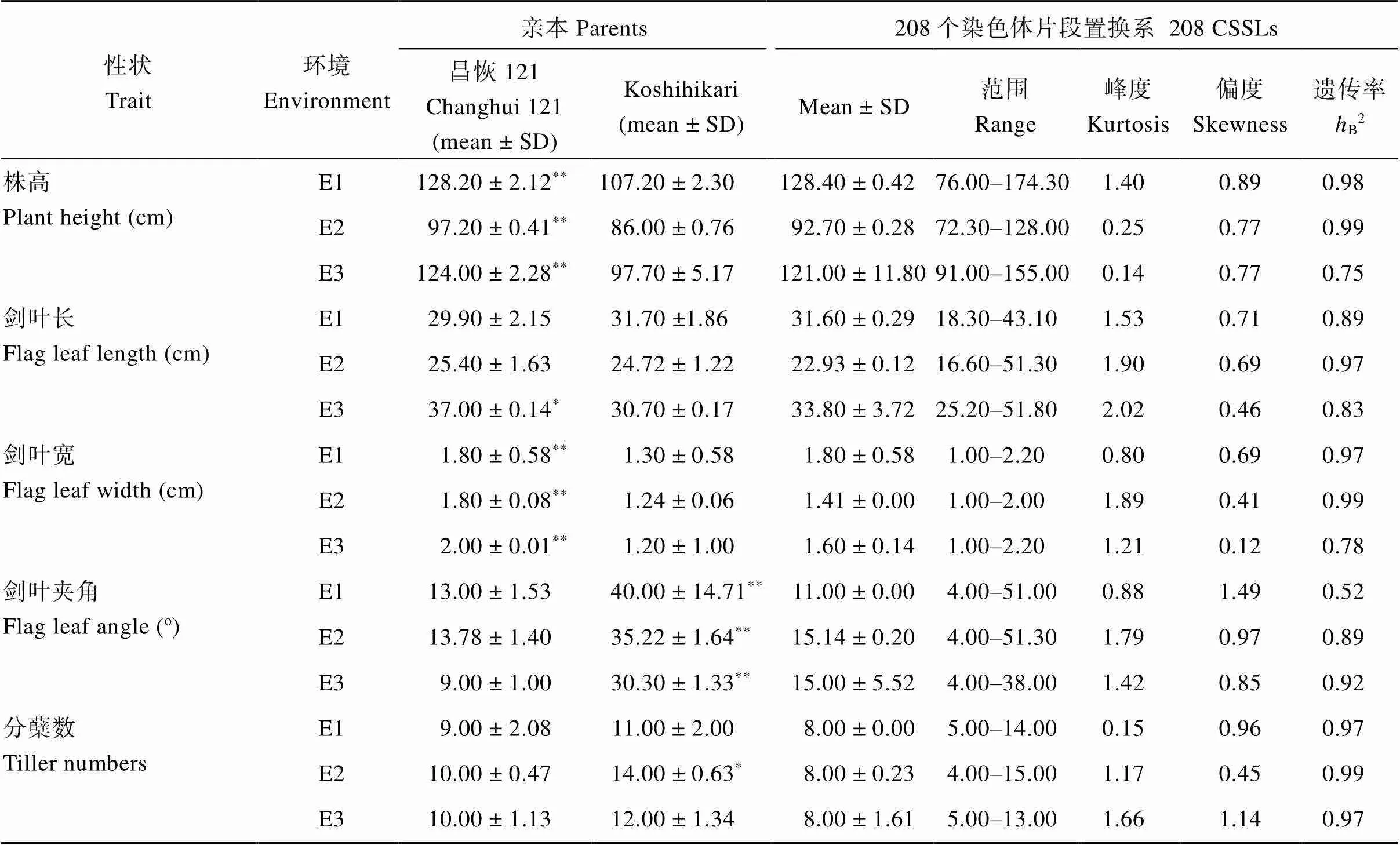
表3 昌恢121、Koshihikari和208个CSSLs的株型性状
E1: 2015年江西南昌中稻季; E2: 2016年海南三亚; E3: 2016年江西南昌中稻季。
*:< 0.05,**:< 0.01.E1: middle-season rice in 2015 in Nanchang, Jiangxi; E2: in 2016 in Sanya, Hainan; E3: middle-season rice in 2016 in Nanchang, Jiangxi.
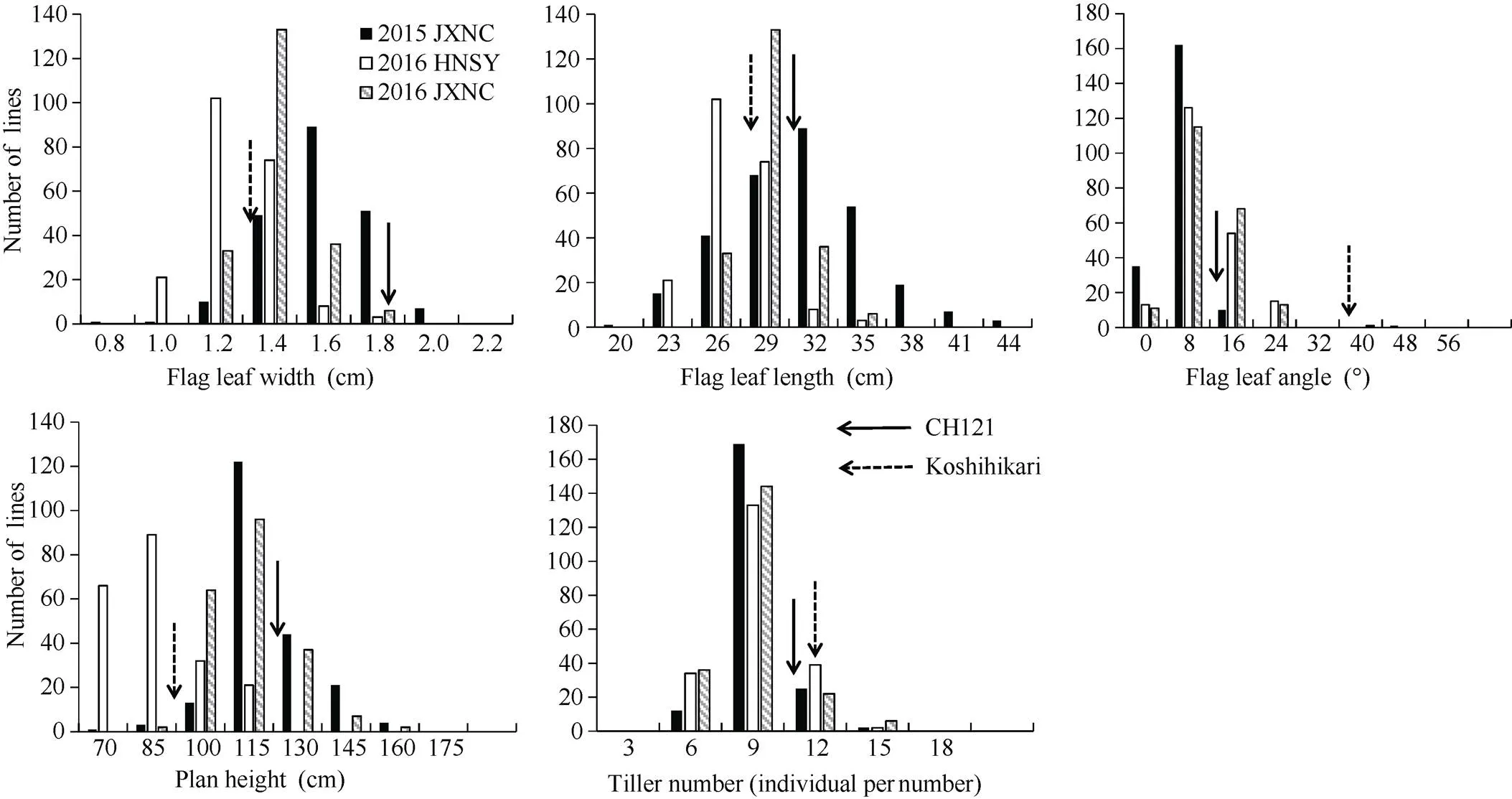
图2 208个CSSLs的株型分布图
2015 JXNC: 2015江西南昌中稻季; 2016 HNSY: 2016海南三亚; 2016 JXNC: 2016江西南昌中稻季。FLW: 剑叶宽; FLL: 剑叶长; FLA: 剑叶夹角; PH: 株高; TN: 分蘖数。
2015 JXNC: middle-season rice in 2015 in Nanchang, Jiangxi; 2016 HNSY: in 2016 in Sanya, Hainan; 2016 JXNC: middle-season rice in 2016 in Nanchang, Jiangxi.
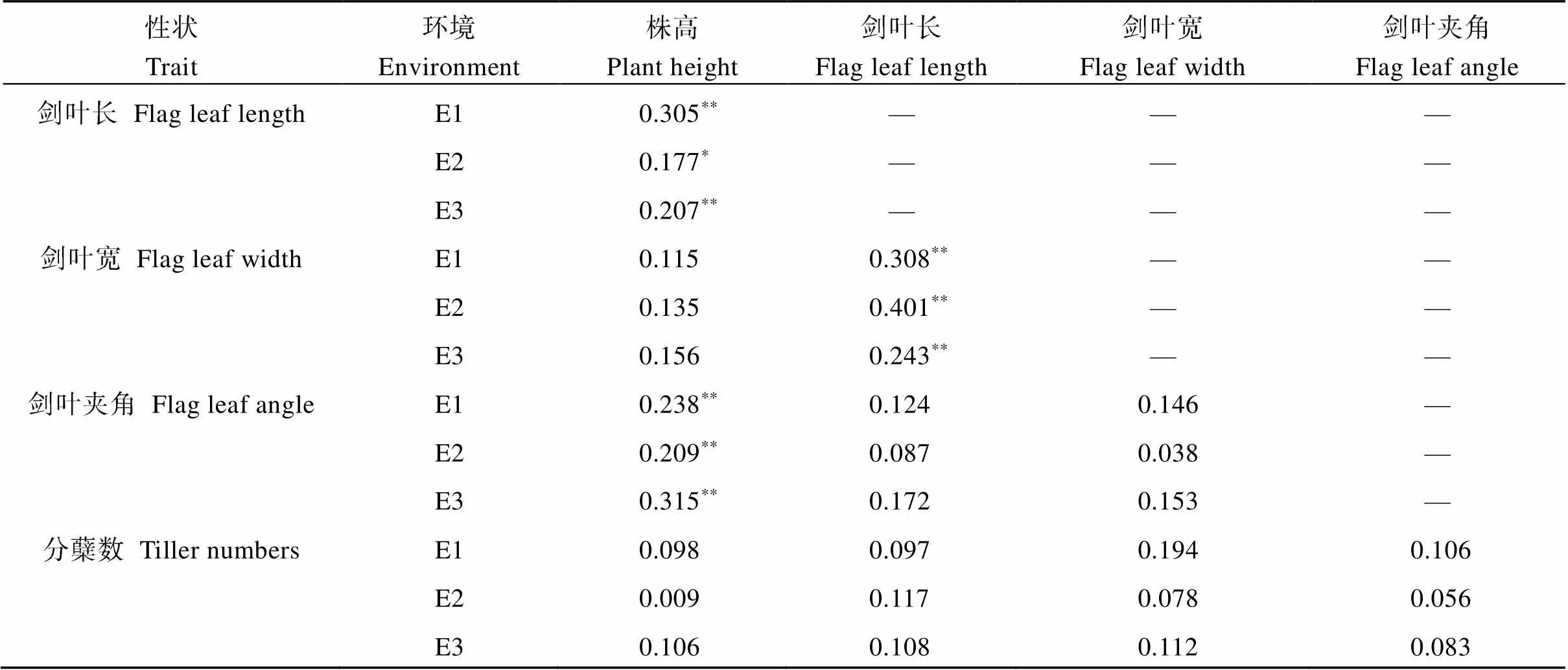
表4 株型性状之间的相关系数
E1: 2015年江西南昌中稻季; E2: 2016年海南三亚; E3: 2016年江西南昌中稻季。
E1: middle-season rice in 2015 in Nanchang, Jiangxi; E2: in 2016 in Sanya, Hainan; E3: middle-season rice in 2016 in Nanchang, Jiangxi.*:< 0.05;**:< 0.01.
2.2 QTL定位
利用208个CSSLs对株高、剑叶长、剑叶宽、剑叶夹角和分蘖数性状进行QTL检测, 结果共检测到35个QTL, 分布于除9号染色体以外的11条染色体上, LOD值介于2.59~21.11之间, 分别解释相应表型变异的2.00%~22.86% (表5和图3)。其中, 株高、剑叶长、剑叶宽、剑叶夹角和分蘖数的QTL数目, 分别为9个、5个、7个、8个和6个, 具体如下:
株高(PH): 检测到9个株高QTL, 分别位于1、2、3、4、5、7和12号染色体上, LOD值介于3.07~11.51之间, 表型贡献率介于3.53%~14.53%之间。2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季, 分别定位到4个、6个和3个株高QTL, 分别解释了总表型变异的32.92%、44.66%和11.43%。其中,能够在3个环境下被重复检测到, 平均表型贡献率为6.62%;在2个环境下都被检测到, 其余7个QTL仅能够在1个环境下被检测到。、、、和的增效等位基因来自Koshihikari;、、和的增效等位基因来自CH121。
剑叶长(FLL): 检测到5个剑叶长QTL, 分别位于5、6、7和12号染色体上, 这5个QTL仅能够在1个环境下被检测到, LOD值介于2.59~19.15之间, 表型贡献率介于2.03%~15.80%之间。2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季, 分别定位到1个、3个和1个剑叶长QTL, 分别解释了总表型变异的13.97%、25.24%和4.79%。其中,和的增效等位基因来自Koshihikari;、和的增效等位基因来自CH121。
剑叶宽(FLW):检测到7个剑叶宽QTL, 分别位于1、3、4、5、6、7和10号染色体上, LOD值介于3.31~21.11之间, 表型贡献率介于2.31%~22.86%之间。2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季, 分别定位到2个、6个和4个剑叶宽QTL, 分别解释了总表型变异的19.72%、39.83%和38.51%。其中,能够在3个环境下被重复检测到, 平均表型贡献率为9.50%;、和在2个环境下能够被重复检测到;、和仅能够在1个环境下被检测到。其中、和的增效等位基因来自Koshihikari;、、和的增效等位基因来自CH121。
剑叶夹角(FLA): 检测到8个剑叶夹角QTL, 分别位于1、2、3、4、5、6和10号染色体上, LOD值介于3.97~13.59之间, 表型贡献率介于3.55%~21.11%之间。2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季, 分别定位到5个、2个和4个剑叶夹角QTL, 分别解释了总表型变异的41.54%、35.98%和34.17%。其中能够在3个环境下被重复检测到, 平均表型贡献率为12.01%;能够在2个环境下被检测到, 其余6个QTL仅能够在1个环境下被检测到。、和的增效等位基因来自Koshihikari;和的增效等位基因来自CH121。
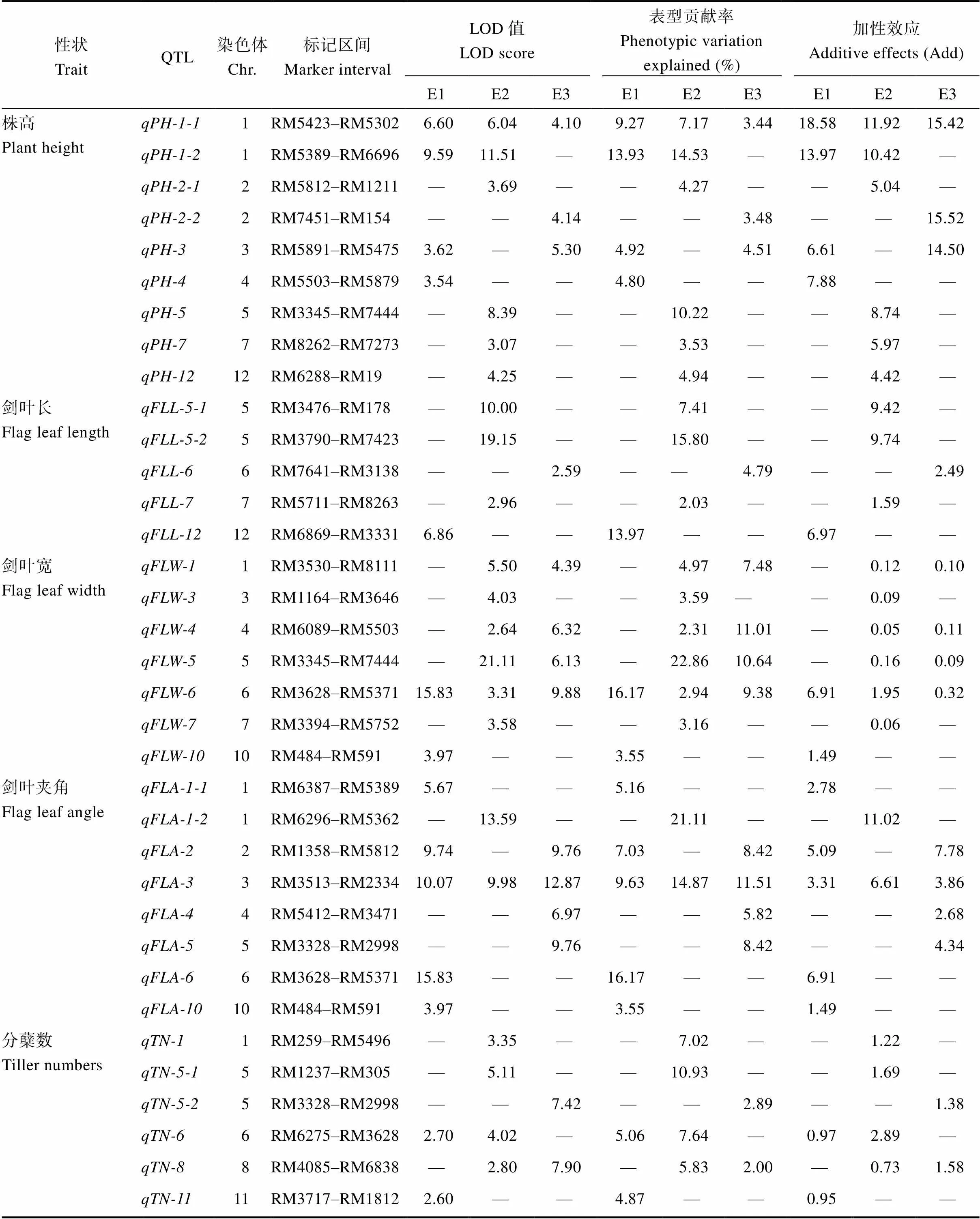
表5 昌恢121/Koshihikari 208个CSSLs群体检测到的株型性状QTL
E1: 2015年江西南昌中稻季; E2: 2016年海南三亚; E3: 2016年江西南昌中稻季。正值和负值分别表示增效等位基因来自Koshihikari和昌恢121。
E1: middle-season rice in 2015 in Nanchang, Jiangxi; E2: in 2016 in Sanya, Hainan; E3: middle-season rice in 2016 in Nanchang, Jiangxi.Positive value and negative value indicated that the positive allele came from Koshihikari and Changhui 121, respectively.

图3 昌恢121/Koshihikari 208个CSSLs中检测到的株型性状QTL在染色体上的分布
PH: 株高; FLL: 剑叶长; FLW: 剑叶宽; FLA: 剑叶夹角; TN: 分蘖数。2015 JXNC: 2015年江西南昌中稻季; 2016 SYHN: 2016年海南三亚; 2016 JXNC: 2016年江西南昌中稻季。
PH: plant height; FLL: flag leaf length; FLW: flag leaf width; FLA: flag leaf angle; TN: tiller numbers.2015 JXNC: middle-season rice in 2015 in Nanchang, Jiangxi; 2016 SYHN: in 2016 in Sanya, Hainan; 2016 JXNC: middle-season rice in 2016 in Nanchang, Jiangxi.
分蘖数(TN): 检测到6个分蘖数QTL, 分布于1、5、6、8和11号染色体上, LOD值介于3.60~7.90之间, 表型贡献率介于2.00%~10.93%之间。2015年江西南昌中稻季、2016年海南三亚和2016年江西南昌中稻季, 分别定位到2个、4个和2个分蘖数QTL, 分别解释了总表型变异的9.93%、31.42%和3.89%。其中和能够在2个环境下被检测到, 其余4个QTL仅能够在1个环境下检测到。这6个分蘖数QTL的增效等位基因均来自Koshihikari。
2.3 株型QTL稳定性分析
根据株型性状QTL检测结果, 发现、和均能够在3个环境下被检测到,、、、、、、和在2个环境下能够被检测到, 其余24个株型性状QTL仅能够在1个环境下被检测到, 说明水稻株型性状QTL检测结果重复性差, 易受环境的影响。分析发现的增效等位基因来自于CH121;和增效等位基因来自于Koshihikari。比较分析背景亲本CH121与和位点置换株系的表型差异,可以分别验证这2个位点的加性效应和环境稳定性。定位于3号染色体RM3513~RM2334区段内,其增效等位基因来自Koshihikari,对应的3个染色体片段置换系CSSL8、CSSL90和CSSL115,在3个环境下的剑叶夹角均显著或极显著大于CH121。定位于1号染色体RM5423~RM5302区段内,其减效等位基因来自Koshihikari,对应的染色体置换系CSSL21、CSSL49和CSSL161,在3个环境下的株高均极显著小于CH121。
3 讨论
株型性状是水稻育种的重要目标性状。通过对株型性状进行QTL检测, 可以鉴定到一些控制株型性状的QTL, 有利于对株型调控的分子机制进行更深入的了解, 利用与其紧密连锁的分子标记, 使用分子辅助选育的方法培育具有理想株型的高产水稻品种。对株型性状之间的相关性进行分析, 可以了解到性状与性状之间的关联, 为分子设计育种提供一定的理论参考。本研究利用CH121与Koshihikari构建的BC3F8、BC4F7和BC5F6共208个CSSLs, 在3个环境下对株型性状的QTL进行检测, 共检测到35个株型性状QTL, 其中, 株高、剑叶长、剑叶宽、剑叶夹角和分蘖数相关的QTL数目, 分别为9个、5个、7个、8个和6个, 分布于除9号染色体以外的11条染色体上。
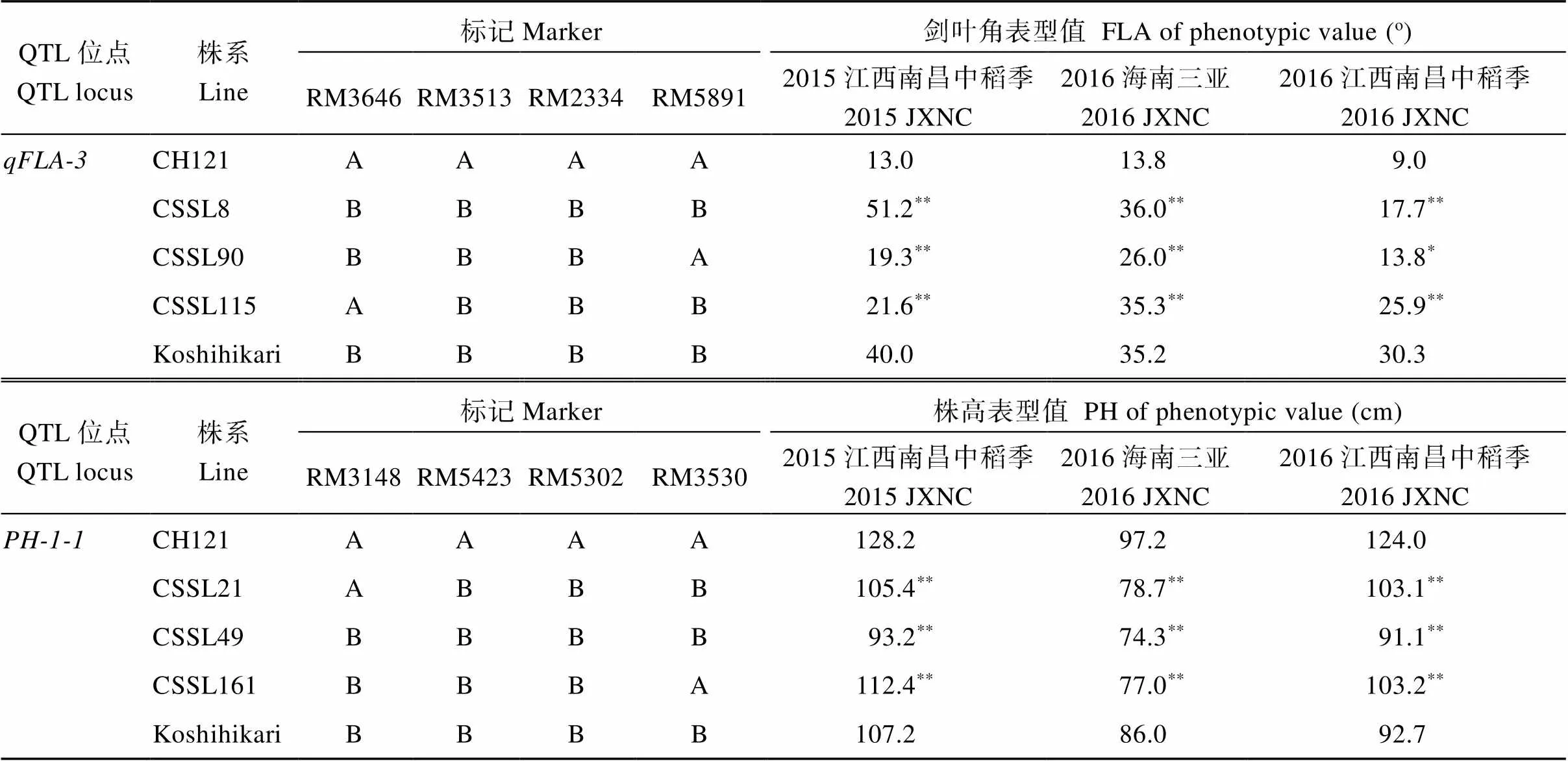
表6 2个亲本和目标置换系在3个环境中的株型性状
A表示为昌恢121基因型; B表示为Koshihikari基因型。2015 JXNC: 2015年江西南昌中稻季; 2016 SYHN: 2016年海南三亚; 2016 JXNC: 2016年江西南昌中稻季。**< 0.01.
A represents Changhui 121 genotype; B represents Koshihikari genotype.2015 JXNC: middle-season rice in 2015 in Nanchang, Jiangxi; 2016 SYHN: in 2016 in Sanya, Hainan; 2016 JXNC: middle-season rice in 2016 in Nanchang, Jiangxi.**< 0.01.
3.1 QTL的多效性
众多研究发现, 一些相关性状的QTL常被定位于相同或相邻近的染色体区域, 这些QTL同时控制多个相关性状, 具有多效性。如邹德堂等[27]定位到2个多效QTL, 同时控制剑叶长、剑叶宽和剑叶面积; 张习春等[28]在1号染色体上的RM128~RM8236区间检测到1个同时控制株高和剑叶长宽比的QTL; 张玲等[29]研究表明, 在8号染色体的RM556~RI03300区间存在着1个同时控制株高和剑叶长的QTL; 彭伟业等[30]在4号染色体RM252~SFP4_6区间检测到1个主效QTL同时影响粒长、剑叶长和剑叶面积。本研究利用CH121与Koshihikari构建的BC3F8、BC4F7和BC5F6共208个CSSLs, 在3个环境下对控制株高、剑叶长、剑叶宽、剑叶夹角和分蘖数的QTL进行检测, 共发现有4个QTL多效位点(表7)。其中5号染色体RM3345~RM7444区间检测到1个同时控制株高和剑叶宽的QTL; 5号染色体RM3328~RM2998区间检测到1个同时影响剑叶夹角和分蘖数的QTL; 6号染色体RM3628~RM5371和10号染色体RM3628~RM5371区间分别检测到1个同时控制剑叶宽和剑叶夹角的QTL。
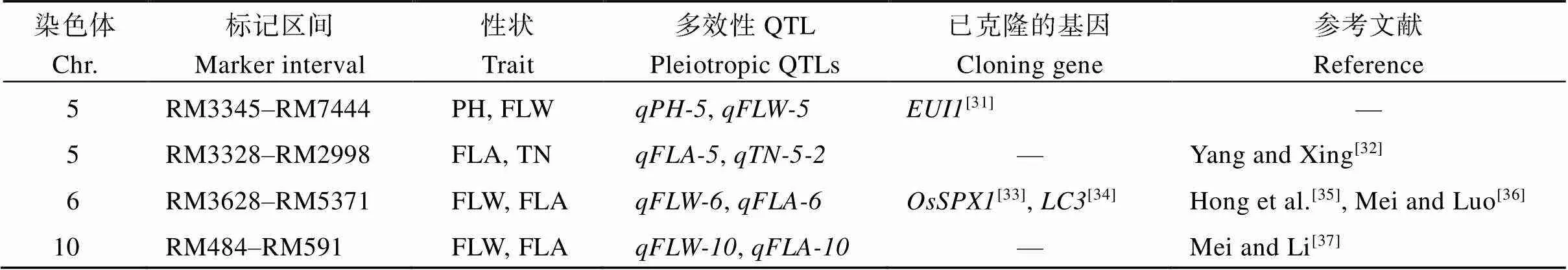
表7 QTL多效性区域分析
3.2 与已报道的QTL比较
水稻株型是水稻品种选育的重要指标, 其QTL定位一直受到科研人员的广泛关注, 目前已有许多关于株型性状QTL定位的研究报道。本研究检测到的大部分QTL与前人定位的区间相同或者相近。如Marri等[38]利用种间测交BC2为材料, 在1号染色体上检测到1个株高位点, 该位点与本研究检测到的存在部分重合区域; 张玲等[29]以泸恢99/沈农265构建的RIL群体为材料, 检测到1个株高位点, 此位点与本研究检测到的存在重合区域。本研究检测到的剑叶夹角位点和与洪凯等[35]利用培矮64s为母本与籼稻品种93-11为父本构建的132个重组自交系定位到的处于相同区域; 剑叶夹角位点与张克勤等[39]在3号染色体RZ328~RZ575区间定位到的处于相邻位置。本研究检测到的剑叶长位点与周丽慧等[40]利用02428DD/南京11构建的F2群体定位到的位于同一区域。孙佩等[41]以云南地方品种Ch5-10和Ch6-11为亲本构建RIL群体, 检测到1个分蘖数位点, 该位点与本研究检测到的处于相邻区域。值得关注的是, 在所在区域迄今未见定位到调控剑叶宽QTL的报道, 推测为1个新鉴定到的剑叶宽QTL。上述定位到的QTL与已报道的相关QTL之间的关系还需要进一步验证。本研究检测到的大部分株型性状QTL区间都已有相关QTL的报道, 表明本研究的定位结果可靠性较高, 以及这些QTL具有较好的遗传稳定性。对于多个环境下定位到的位点(、和), 之后可以通过构建剩余杂合体以及加密分子标记对其进行精细定位和克隆。
4 结论
利用CH121与Koshihikari构建的BC3F8、BC4F7和BC5F6共208个CSSLs, 在3个环境下对株高、剑叶长、剑叶宽、剑叶夹角和分蘖数的QTL进行检测, 共检测到35个株型性状QTL, 其中株高、剑叶长、剑叶宽、剑叶夹角和分蘖数的QTL数目分别为9个、5个、7个、8个和6个, 分布于除9号染色体以外的11条染色体上。值得关注的是,、和均能够在3个环境下被检测到, 其中为1个新鉴定到的剑叶宽QTL。这些株型性状QTL的检测结果为进一步开展相关基因的精细定位、克隆和分子辅助育种奠定了基础。
[1] 马梦影, 巩文靓, 康雪蒙, 段海燕.水稻理想株型改良的研究进展.中国农学通报, 2020, 36(29): 1–6.
Ma M Y, Gong W L, Kang X M, Duan H Y.The improvement of ideal plant type of rice: a review., 2020, 36(29): 1–6 (in Chinese with English abstract).
[2] 陈温福, 徐正进, 张龙步.水稻超高产育种——从理论到实践.沈阳农业大学学报, 2003, 34: 324–327.
Chen W F, Xu Z J, Zhang L B.Rice breeding for super high yield—from theories to practices., 2003, 34: 324–327 (in Chinese with English abstract).
[3] 程式华, 曹立勇, 庄杰云, 吴伟明.关于超级稻品种培育的资源和基因利用问题.中国水稻科学, 2009, 23: 223–228.
Cheng S H, Cao L Y, Zhuang J Y, Wu W M.Discussion on germplasm and gene utilization in breeding of super rice., 2009, 23: 223–228 (in Chinese with English abstract).
[4] 刘化龙, 杨洛淼, 徐善斌, 刘华东, 邹德堂.多环境下水稻株型相关性状QTL解析.东北农业大学学报, 2020, 51: 1–9.
Liu H L, Yang L M, Xu S B, Liu H D, Zou D T.QTL analysis on plant type related traits of rice under multi-environment., 2020, 51: 1–9 (in Chinese with English abstract).
[5] 周丽慧, 赵春芳, 赵凌, 张亚东, 朱镇, 陈涛, 赵庆勇, 姚姝, 于新, 王才林.利用染色体片段置换系群体检测水稻叶片形态QTL.中国水稻科学, 2013, 27: 26–34.
Zhou L H, Zhao C F, Zhao L, Zhang Y D, Zhu Z, Chen T, Zhao Q Y, Yao S, Yu X, Wang C L.QTL detection for leaf morphology of rice using chromosome segment substitution lines., 2013, 27: 26–34 (in Chinese with English abstract).
[6] 李红, 何炜, 连玲, 魏毅东, 蔡秋华, 王颖姮, 谢华安, 张建福.水稻株型的研究进展.福建稻麦科技, 2020, 38: 61–66.
Li H, He W, Lian L, Wei Y D, Cai Q H, Wang Y H, Xie H A, Zhang J F.Research advances on plant type of rice., 2020, 38: 61–66 (in Chinese with English abstract).
[7] Sasaki A, Ashikari M, Ueguchi-Tanaka M, Itoh H, Nishimura A, Swapan D, Ishiyama K, Saito T, Kobayashi M, Khush G S, Kitano H, Matsuoka M.Green revolution: a mutant gibberellin-synthesis gene in rice., 2002, 416: 701–702.
[8] Tan L B, Li X R, Liu F X, Sun X Y, Li C G, Zhu Z F, Fu Y C, Cai H W, Wang X K, Xie D X, Sun C Q.Control of a key transition from prostrate to erect growth in rice domestication., 2008, 40: 1360–1364.
[9] Zhang L, Yu H, Ma B, Liu G F, Wang J J, Wang J M, Gao R C, Li J J, Liu J Y, Xu J, Zhang Y Y, Li Q, Huang X H, Xu J L, Li J M, Qian Q, Han B, He Z H, Li J Y.A natural tandem array alleviates epigenetic repression of IPA1 and leads to superior yielding rice., 2017, 8: 14789.
[10] Sakamoto T, Morinaka Y, Ohnishi T, Sunohara H, Fujioka S, Ueguchi-Tanaka M, Mizutani M, Sakata K, Takatsuto S, Yoshida S, Tanaka H, Kitano H, Matsuoka M.Erect leaves caused by brassinosteroid deficiency increase biomass production and grain yield in rice., 2006, 24: 105–109.
[11] Jin J, Huang W, Gao J P, Yang J, Shi M, Zhu M Z, Luo D, Lin H X.Genetic control of rice plant architecture under domestication., 2008, 40: 1365–1369.
[12] Wang Y H, Li J Y.Rice, rising., 2008, 40: 1273–1275.
[13] Jiao Y Q, Wang Y H, Xue D W, Wang J, Yan M X, Liu G F, Dong G J, Zeng D L, Lu Z F, Zhu X D, Qian Q, Li J Y.Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice., 2010, 42: 541–544.
[14] Liu M M, Shi Z Y, Zhang X H, Wang M X, Zhang L, Zheng K Z, Liu J Y, Hu X M, Di C R, Qian Q, He Z H, Yang D L.Inducible overexpression of ideal plant architecture1 improves both yield and disease resistance in rice., 2019, 5: 389–400.
[15] Wang F, Han T W, Song Q X, Ye W X, Song X G, Chu J F, Li J Y, Chen Z J.The rice circadian clock regulates tiller growth and panicle development through strigolactone signaling and sugar sensing., 2020, 32: 3124–3138.
[16] Wang J, Zhou L, Shi H, Chern M S, Yu H, Yi H, He M, Yin J J, Zhu X B, Li Y, Li W T, Liu J L, Wang J C, Chen X Q, Qing H, Wang Y P, Liu G F, Wang W M, Li P, Wu X J, Zhu L H, Zhou J M, Ronald P C, Li S G, Li J Y, Chen X W.A single transcription factor promotes both yield and immunity in rice., 2018, 361: 1026–1028.
[17] 王小雷, 李炜星, 曾博虹, 孙晓棠, 欧阳林娟, 陈小荣, 贺浩华, 朱昌兰.基于染色体片段置换系对水稻粒形及千粒重QTL检测与稳定性分析.作物学报, 2020, 46: 1517–1525.
Wang X L, Li W X, Zeng B H, Sun X T, Ou-Yang L J, Chen X R, He H H, Zhu C L.QTL detection and stability analysis of rice grain shape and thousand-grain weight based on chromosome segment substitution lines., 2020, 46: 1517–1525 (in Chinese with English abstract).
[18] 孙永建, 周济, 徐华山, 余四斌.利用代换系分析水稻株高QTL及其互作效应.分子植物育种, 2010, 8: 1068–1073.
Sun Y J, Zhou J, Xu H S, Yu S B.QTL and their interactions for plant height in rice chromosomal substitution segment lines., 2010, 8: 1068–1073 (in Chinese with English abstract).
[19] 杨梯丰, 曾瑞珍, 朱海涛, 陈岚, 张泽民, 丁效华, 李文涛, 张桂权.水稻粒长基因在聚合育种中的效应.分子植物育种, 2010, 8: 59–66.
Yang T F, Zeng R Z, Zhu H T, Chen L, Zhang Z M, Ding X H, Li W T, Zhang G Q.Effect of grain length genein pyramiding breeding of rice., 2010, 8: 59–66 (in Chinese with English abstract).
[20] Hu Z J, Lu S J, Wang M J, He H H, Sun L, Wang H R, Liu X H, Jiang L, Sun J L, Xin X Y, Kong W, Chu C C, Xue H W, Yang J S, Luo X J, Liu J X.A novel QTLencodes the GSK3/SHAGGY-Like kinase OsGSK5/OsSK41 that interacts with OsARF4 to negatively regulate grain size and weight in rice., 2018, 11: 736–749.
[21] Zhang T, Wang S M, Sun S F, Zhang Y, Li J, You J, Su T, Chen W B, Ling Y H, He G H, Zhao F M.Analysis of QTL for grain size in a rice chromosome segment substitution line Z1392 with long grains and fine mapping of., 2020, 13: 40.
[22] 贺浩华, 傅军如, 朱昌兰, 贺晓鹏, 彭小松, 陈小荣, 刘宜柏.香型超级杂交稻新组合淦鑫688.杂交水稻, 2008, 23(3): 80–82.
He H H, Fu J R, Zhu C L, He X P, Peng X S, Chen X R, Liu Y B.Ganxin 688, a new combination of fragrant super hybrid rice., 2008, 23(3): 80–82 (in Chinese with English abstract).
[23] 王小雷, 刘杨, 孙晓棠, 欧阳林娟, 潘锦龙, 彭小松, 陈小荣, 贺晓鹏, 傅军如, 边建民, 胡丽芳, 徐杰, 贺浩华, 朱昌兰.不同环境下稻米品质性状QTL的检测及稳定性分析.中国水稻科学, 2020, 34: 17–27.
Wang X L, Liu Y, Sun X T, Ou-Yang L J, Pan J L, Peng X S, He X P, Ru J R, Bian J M, Hu L F, Xu J, He H H, Zhu C L.Identification and stability analysis of QTL for grain quality traits under multiple environments in rice., 2020, 34: 17–27 (in Chinese with English abstract).
[24] Wang J K, Wan X Y, Crossa J, Crouch J, Weng J F, Zhai H Q, Wan J M.QTL mapping of grain length in rice (L) using chromosome segment substitution lines., 2006, 88: 93–104.
[25] Meng L, Li H H, Zhang L Y, Wang J K.QTL IciMapping: integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations., 2015, 3: 269–283.
[26] Voorrips R E.MapChart: software for the graphical presentation of linkage maps and QTLs., 2002, 93: 77–78.
[27] 邹德堂, 王晋, 王敬国, 刘化龙, 刘宇强, 贾琰.水稻剑叶形态与单株产量的基因定位分析.东北农业大学学报, 2014, 45: 23–28.
Zou D T, Wang J, Wang J G, Liu H L, Liu Y Q, Jia Y.QTL analysis of flag leaf characteristics and ears weight in rice., 2014, 45: 23–28 (in Chinese with English abstract).
[28] 张习春, 张应洲, 圣忠华, 龙武华, 吴健强, 朱速松, 魏祥进.水稻株型相关性状QTL定位研究.江苏农业科学, 2019, 47: 102–108.
Zhang X C, Zhang Y Z, Sheng Z H, Long W H, Wu J Q, Zhu S S, Wei X J.Study on QTL mapping for plant type traits in rice ()., 2019, 47: 102–108 (in Chinese with English abstract).
[29] 张玲, 李晓楠, 王伟, 杨生龙, 李清, 王嘉宇.水稻株型相关性状的QTL分析.作物学报, 2014, 40: 2128–2135.
Zhang L, Li X N, Wang W, Yang S L, Li Q, Wang J Y.Analysis of QTLs for plant type traits in rice ()., 2014, 40: 2128–2135 (in Chinese with English abstract).
[30] 彭伟业, 孙平勇, 潘素君, 李魏, 戴良英.水稻品种魔王谷粒形、剑叶性状和株高QTL定位.作物学报, 2018, 44: 1673–1680.
Peng W Y, Sun P Y, Pan S J, Li W, Dai L Y.Mapping QTLs for grain shape, flag leaf traits, and plant height in rice variety Mowanggu., 2018, 44: 1673–1680 (in Chinese with English abstract).
[31] Zhu Y Y, Nomura T, Xu Y H, Zhang Y Y, Peng Y, Mao B Z, Hanada A, Zhou H C, Wang R X, Li P J, Zhu X D, Mander L, Kamiya Y, Yamaguchi S, He Z H.ELONGATED UPPERMOST INTERNODE encodes a cytochrome P450 monooxygenase that epoxidizes gibberellins in a novel deactivation reaction in rice., 2006, 18: 442–456.
[32] Yang G H, Xing Y Z, Li S Q, Ding J Z, Yue B, Deng K, Li Y S, Zhu Y G.Molecular dissection of developmental behavior of tiller number and plant height and their relationship in rice (L.)., 2006, 143: 236–245.
[33] Ruan W Y, Guo M N, Xu L, Wang X Q, Zhao H Y, Wang J M, Yi K K.An SPX-RLI1 module regulates leaf inclination in response to phosphate availability in rice., 2018, 30: 853–870.
[34] Chen S H, Zhou L J, Xu P, Xue H W.SPOC domain-containing protein leaf inclination 3 interacts with LIP1 to regulate rice leaf inclination through auxin signaling., 2018, 14: e1007829.
[35] 洪凯, 张斌, 高阳, 阮班普, 彭友林, 马伯军, 钱前, 高振宇.水稻剑叶夹角和单株产量的QTL分析.分子植物育种, 2015, 13: 761–768.
Hong K, Zhang B, Gao Y, Ruan B P, Peng Y L, Ma B J, Qian Q, Gao Z Y.Dissection of QTLs for flag leaf angel and yield per plant in rice., 2015, 13: 761–768 (in Chinese with English abstract).
[36] Mei H W, Luo J L, Ying C S, Wang Y P, Yu X Q, Guo L B, Paterson A H, Li Z K.Gene actions of QTLs affecting several agronomic traits resolved in a recombinant inbred rice population and two testcross populations., 2003, 107: 89–101.
[37] Mei H W, Li Z K, Shu Q Y, Guo L B, Wang Y P, Yu X Q, Ying C S, Luo L J.Gene actions of QTLs affecting several agronomic traits resolved in a recombinant inbred rice population and two backcross populations., 2005, 110: 649–659.
[38] Marri P R, Sarla N, Reddy L V, Siddiq E A.Identification and mapping of yield and yield related QTLs from anaccession of., 2005, 6: 33.
[39] 张克勤, 戴伟民, 樊叶杨, 沈波, 郑康乐.水稻剑叶角度与主穗产量的遗传剖析.中国农学通报, 2008, 24(9): 186–192.
Zhang K Q, Dai W M, Fan Y Y, Shen B, Zheng K L.Genetic dissection of flag leave angle and main panicle yield traits in rice., 2008, 24(9): 186–192 (in Chinese with English abstract).
[40] 周丽慧, 谢永楚, 陈涛, 张亚东, 朱镇, 赵庆勇, 姚姝, 于新, 赵凌, 王才林.水稻剑叶形态与产量的关系及相关性状的QTL分析.江苏农业学报, 2012, 28: 1207–1211.
Zhou L H, Xie Y C, Chen T, Zhang Y D, Zhu Z, Zhao Q Y, Yao S, Yu X, Zhao L, Wang C L.Relations between flag leaf morphology and yield and QTL analysis of related traits., 2012, 28: 1207–1211 (in Chinese with English abstract).
[41] 孙佩, 才宏伟, 卫晓轶.水稻最高分蘖数和有效分蘖数的QTL分析.河南农业科学, 2014, 43: 12–15.
Sun P, Cai H W, Wei X Y.QTL mapping of maximum tiller number and effective tiller number in rice (L.)., 2014, 43: 12–15 (in Chinese with English abstract).
QTL mapping for plant architecture in rice based on chromosome segment substitution lines
WANG Xiao-Lei, LI Wei-Xing, OU-YANG Lin-Juan, XU Jie, CHEN Xiao-Rong, BIAN Jian-Min, HU Li-Fang, PENG Xiao-Song, HE Xiao-Peng, FU Jun-Ru, ZHOU Da-Hu, HE Hao-Hua, SUN Xiao-Tang*, and ZHU Chang-Lan*
Key Laboratory of Crop Physiology, Ecology and Genetic Breeding, Ministry of Education / College of Agronomy, Jiangxi Agricultural University / Research Center of Super Rice, Engineering and Technology, Nanchang 330045, Jiangxi, China
Plant architecture is a compound trait integrated with multiple morphological and physiological traits, and it is closely related to rice yield.Deciphering excellent plant architecture alleles or QTLs is of great significance for high-yield rice breeding.In this study, we constructed a set of Changhui 121/Koshihikari chromosome segment substitution lines (CSSLs) with the size of 208 in our laboratory.QTLs controlling plant height, flag leaf morphology, and tiller numbers were detected under three environments.A total of 35 QTLs for rice architecture were identified on 11 chromosomes except chromosome 9, and the range of the phenotypic variation explaining was 2.00%–22.86%.It was worth noting that,, andcould be detected in three environments, among whichwas a newly identified QTL of the flag leaf width.Phenotypic identification verified that the additive effects and environmental stability of the two locus alleles by the replacement lines carryingand sites.The results of this study laid the foundation for further fine mapping and cloning of QTLs for rice plant architecture and the molecular marker-assisted selection (MAS) in rice breeding.
rice; chromosome segment substitution lines; plant architecture; quantitative trait locus
2021-04-07;
2021-09-09;
(网络出版日期): 2021-10-15.
10.3724/SP.J.1006.2022.12024
通信作者(Corresponding authors): 朱昌兰, E-mail: zhuchanglan@163.com; 孙晓棠, E-mail: 45101034@qq.com
E-mail: wxl0vip@163.com
本研究由国家自然科学基金项目(31860373)和江西省“5511”优势科技创新团队项目(20165BCB19005)资助。
This study was supported by the National Natural Science Foundation of China (31860373) and the “5511” Superior Science and Technology Innovation Team Project of Jiangxi Province, China (20165BCB19005).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211014.2314.006.html
