隆两优与晶两优系列杂交稻的稻瘟病抗性基因分析
2022-03-16符辰建严天泽符星学胡小淳刘珊珊杨远柱
邓 钊 江 南 符辰建 严天泽 符星学 胡小淳 秦 鹏,2 刘珊珊 王 凯,3,* 杨远柱,2,3,*
隆两优与晶两优系列杂交稻的稻瘟病抗性基因分析
邓 钊1,2,**江 南1,2,**符辰建1严天泽1符星学1胡小淳1秦 鹏1,2刘珊珊1王 凯1,3,*杨远柱1,2,3,*
1农业农村部南方水稻品种创制重点实验室 / 抗病虫水稻育种湖南省工程实验室/ 袁隆平农业高科技股份有限公司, 湖南长沙 410128;2湖南农业大学农学院, 湖南长沙 410128;3湖南杂交水稻研究中心 / 杂交水稻国家重点实验室, 湖南长沙 410125
隆科638S与晶4155S是袁隆平农业高科技股份有限公司于2014年培育出的抗病优质高配合力中籼型两用核不育系。本研究对2015—2019年通过国家审定的隆两优和晶两优系列杂交稻品种区试稻瘟病抗性评价数据进行分析, 并利用基于KASP技术开发的针对16个稻瘟病抗性基因的标记组合, 对隆两优和晶两优系列杂交稻品种进行基因型检测, 以期为隆两优和晶两优系列杂交稻品种的布局和进一步改良提供理论依据。结果表明, 隆两优和晶两优系列杂交稻品种, 中抗至高抗稻瘟病的比例达43.92%, 综合抗性指数和穗瘟最高损失率均值分别为3.3和4.7; 品种携带3~7个抗性基因, 平均携带5.1个抗性基因;和基因在品种中的检出频率较高, 达到50%以上, 其中的检出频率达到100%, 而、、和基因未被检出; 随着抗性基因数量的增加, 品种的综合抗性指数与穗瘟最高损失率均值都呈现整体下降趋势。据此提出, 将基因导入至隆科638S与晶4155S中, 可进一步提升其组合的稻瘟病抗性。
稻瘟病; 抗性基因; KASP; 杂交稻; 育种
由子囊真菌()引起的稻瘟病是极具毁灭性的水稻病害之一, 俗称“水稻癌症”, 是影响水稻高产、稳产的主要限制性因素。稻瘟病在全球85个水稻种植国家和地区发生, 对全球粮食安全造成严重威胁[1-2]。长期实践证明, 培育和推广抗稻瘟病品种是防治稻瘟病最经济、环保和有效的措施[3]。在20世纪60年代, 世界各国科学家开始广泛开展水稻稻瘟病抗性遗传、基因发掘和利用研究, 迄今为止, 报道的主效稻瘟病抗性基因已超过100个, 其中有35个抗性基因被克隆[4]。随着分子生物学的快速发展和高通量基因分型技术的进步, 极大地促进了抗性基因在水稻抗稻瘟病育种中的应用。
杂交水稻是我国具有原创性的重大科技创新成果, 为保障全球的粮食安全和农业可持续发展作出了巨大贡献[5]。目前, 已大规模商业化的杂交水稻主要包括三系法和两系法[6-7]。与三系法相比, 两系法杂交水稻简化了生产程序, 杂种优势利用不受恢保关系的限制, 配组自由, 可克服细胞质负效应, 有利于选配强优势组合[8]。截至2018年, 有超过1300个两系杂交稻品种通过省级以上审定, 年推广面积约550万公顷[7,9]。隆科638S和晶4155S是袁隆平农业高科技股份有限公司(以下简称“隆平高科”)利用矮秆抗倒优质软米早籼不育系核心种质(湘陵628S)改良骨干中籼两用不育系(C815S和Y58S)[10-12], 采用“自然环境和人工环境双重压力选择法”对后代筛选, 经湖南长沙、海南陵水两地穿梭种植, 利用自主开发的基于扩增阻滞突变系统PCR (Amplification Refractory Mutation System PCR, ARMS-PCR)技术的分子标记, 对稻瘟病抗性基因和稻米品质关键基因进行逐代检测和选择, 最终培育出的早籼遗传背景为主的抗病优质高配合力中籼两用核不育系[13-14]。隆科638S和晶4155S因分别聚合有抗稻瘟病基因+与+, 表现出一定的稻瘟病抗性。为提高测交筛选效率, 我们对包括隆科638S和晶4155S在内的当前骨干两系不育系、恢复系和常规稻品种, 进行了基于全基因组简化重测序数据的杂种优势群划分, 通过杂交水稻双亲“强优势种群间配组、抗性基因互补、品质基因一致”的分子设计配组技术体系的研创与应用, 再经规范化、标准化测试, 选育出一批抗病优质广适高产的隆两优与晶两优系列杂交稻新品种, 通过审定并迅速成为我国南方稻区杂交水稻主栽品种。
KASP (Kompetitive Allele-Specific PCR)技术, 即竞争性等位基因特异性PCR, 是一种基于SNP的新型基因分型技术。KASP技术具有高转化率、高准确性、低成本、简单快捷以及灵活等特点[15], 已被广泛用于作物质量控制分析、基因和QTL的遗传定位、大规模等位基因型筛选以及分子标记辅助育种[16-21]。在水稻中, 品质、抗性、育性等性状相关基因的功能SNP和InDel被转化成KASP分子标记[22-24], 为育种提供了高效的选择工具。本研究基于KASP技术, 开发了针对16个已知稻瘟病抗性基因的特异分子标记组合, 并利用这组KASP标记对隆两优和晶两优系列杂交稻品种携带的稻瘟病抗性基因进行检测, 结合区试稻瘟病抗性评价数据, 分析抗性基因分布、基因数量与抗性的关系, 以期为隆两优与晶两优系列杂交稻品种的合理布局和进一步改良奠定理论基础。
1 材料与方法
1.1 试验材料
通过国家审定的隆两优与晶两优系列杂交稻品种93个(148次) (附表1)。其中, 用于稻瘟病抗性基因分析的73个国审品种及其60个亲本, 共计133份(附表1), 用于稻瘟病抗性基因KASP标记验证的水稻材料30份(附表3), 所有材料种子均由隆平高科提供。
1.2 稻瘟病抗性评价
隆两优和与晶两优系列杂交稻品种稻瘟病抗性评价数据, 均来源于国家水稻数据中心(http://www.ricedata.cn/variety/index.htm, 附表1)。其中, 稻瘟病综合抗性指数为2年数据均值。
1.3 稻瘟病抗性基因KASP标记
在水稻基因组上存在诸多变异, 其中有影响基因功能的变异位点, 有基因特异性或稀有的变异位点, 通过对这些位点的不同等位变异设计标记可以有效实现对基因的特定等位基因型进行检测。在本研究中针对等16个稻瘟病抗性基因, 通过文献信息挖掘, 获取稻瘟病抗性基因功能变异位点或共分离标记位点[25-26], 或利用NCBI (https://www.ncbi.nlm.nih.gov/)数据库获取水稻抗性基因位点序列, 并进行blast分析, 获取基因特异性SNP或InDel变异位点, 同时利用水稻变异数据库RiceVarMap v2.0 (http://ricevarmap.ncpgr.cn/)[27]分析变异位点不同等位型分布频率以及进行共分离位点挖掘, 选取目标基因特有或稀有的变异位点作为候选标记位点, 最终每个基因获得2~3个候选变异位点进行KASP标记开发。针对已搜集标记位点, 利用Python软件包primer3-py进行KASP引物设计, 经筛选验证获得优选KASP标记(表1)。
1.4 DNA提取与抗性基因分型
取水稻幼苗期叶片, TPS法提取基因组DNA。以FLU-ARMS 2×PCR Mix (广州固德生物技术有限公司)为KASP扩增试剂, 利用Gene Matrix高通量基因分型系统(成都瀚辰光翼科技有限责任公司)进行基因型检测: 以Matrix Arrayer反应板制备仪自动化构建PCR体系, 利用Matrix Cycler高通量水浴热循环仪进行PCR扩增, PCR扩增采用Touchdown反应条件: 95℃预变性15 min; 95℃变性10 s, 65~57℃退火并延伸60 s, 进行10个循环反应, 每个退火与延伸反应温度降低0.8℃; 95℃变性10 s、57℃退火并延伸60 s, 进行26个循环反应。完成PCR扩增后在Matrix Scanner高速荧光扫描仪上进行荧光检测, 最后利用Matrix Master软件进行基因分型。
1.5 数据分析
使用Microsoft Excel 2019对研究中获得各类数据进行整理和作图。使用Python软件中statsmodels包进行线性回归分析。
2 结果与分析
2.1 隆两优与晶两优系列杂交稻品种稻瘟病抗性
截至2019年, 共有隆两优与晶两优系列杂交稻新品种107个(205次)通过省级以上审定。其中, 93个(148次)品种通过国家审定(附表1)。由于各省稻瘟病抗性鉴定和评价标准不一致, 因此本研究仅针对国家审定品种的稻瘟病抗性进行分析。这些品种中抗以上(穗瘟损失率最高级≤3级)的品种比例达到43.92%, 其中隆两优系列为38.20%, 晶两优系列为52.54%, 而同期国家审定的其他两系杂交水稻中抗以上品种的比例仅为12.35% (图1-A)。从不同生态区域看, 武陵山区审定的7个品种均达到中抗及以上水平(图1-B), 综合抗性指数均值为1.8, 穗瘟损失率最高级均值为1.3; 华南稻区审定的32个品种, 中抗及以上比例为65.63%, 综合抗性指数均值为3.5, 穗瘟损失率最高级均值为4.2; 长流中下游稻区审定的品种数量最多, 达到78个, 中抗及以上比例为38.46%, 综合抗性指数均值为3.3, 穗瘟损失率最高级均值为5.1; 长江上游稻区审定了31个品种, 中抗及以上比例为22.58%, 为4个生态区域中最低, 并且没有表现为抗的品种, 综合抗性指数均值为3.4, 穗瘟最高损失率均值为5.0。
2.2 稻瘟病抗性基因KASP分子标记设计与分型效果验证
基于KASP技术, 针对16个稻瘟病抗性基因设计开发了一组KASP标记。为验证KASP标记的有效性, 选取30份水稻材料(包括部分已知抗性基因的供体)进行基因型分型检测和全基因组重测序, 以验证KASP标记的实用性。结果显示, 稻瘟病抗性基因KASP标记组合可有效区分不同材料携带稻瘟病抗性基因的基因型, 与重测序结果完全一致(附表3)。以和基因为例, Pi2-KASP和Pi9-KASP标记能将携带基因的3份材料华占、矮华丝苗、南秀软占以及携带基因的材料75-1-127与不携带2个抗性基因的材料进行区分(图2)。
2.3 隆两优与晶两优系列杂交稻品种中稻瘟病抗性基因类型、数量与分布
利用稻瘟病抗性基因分型KASP标记组合, 对73个隆两优与晶两优系列杂交稻品种及其亲本进行了检测(附表1)。隆科638S和晶4155S分别携带有+与+抗性等位型, 与选育过程中的分子标记辅助选择聚合结果相一致。因不育系均含有, 因此在73个杂交稻品种中的检出频率为100% (图3-A)。和在父本中的检出频率也较高, 分别达71.2%和70.0%。、、和抗性等位型在父母本与杂交稻品种中均未检出。与在杂交稻品种中的检出频率也较低, 仅为9.6%。
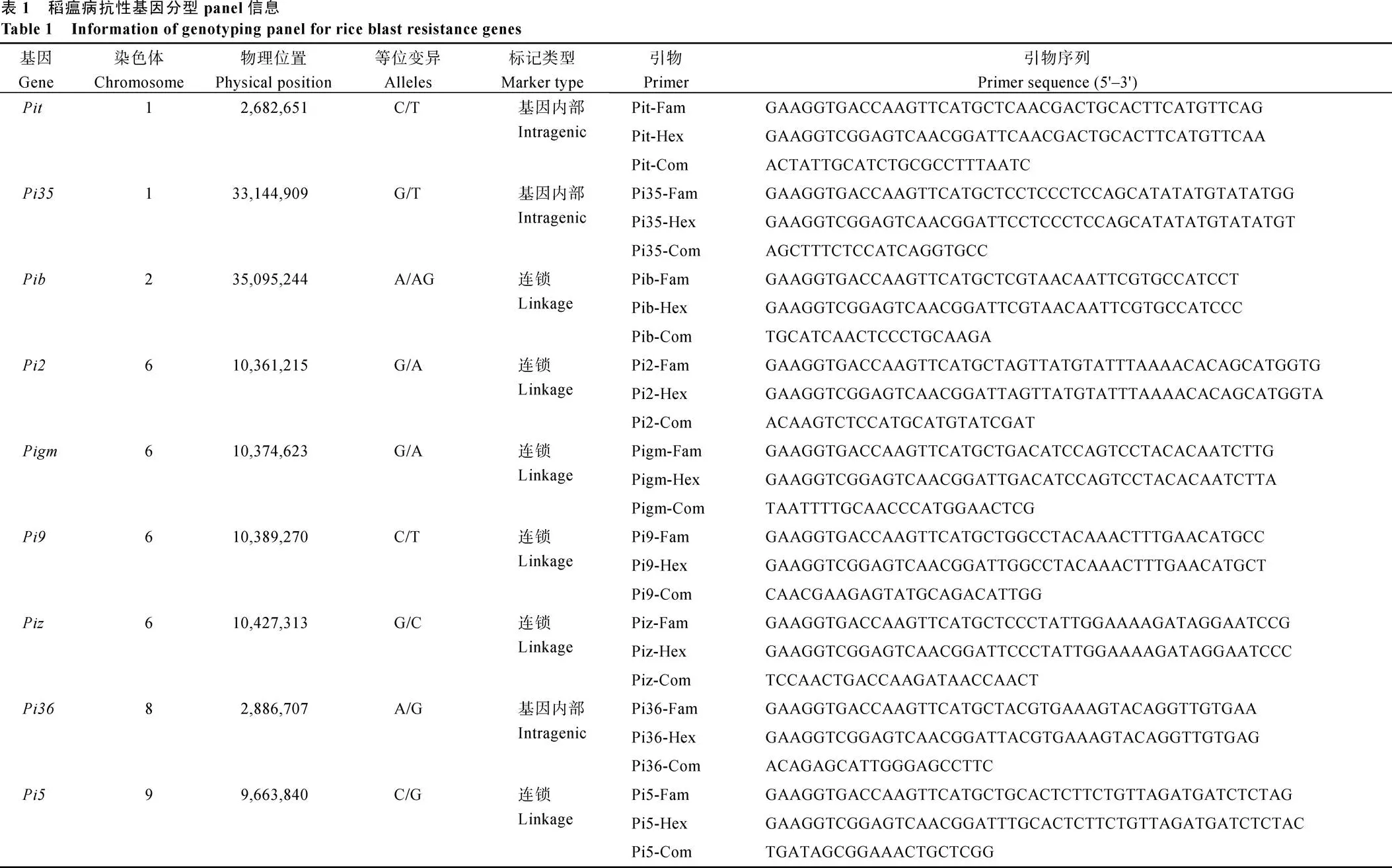
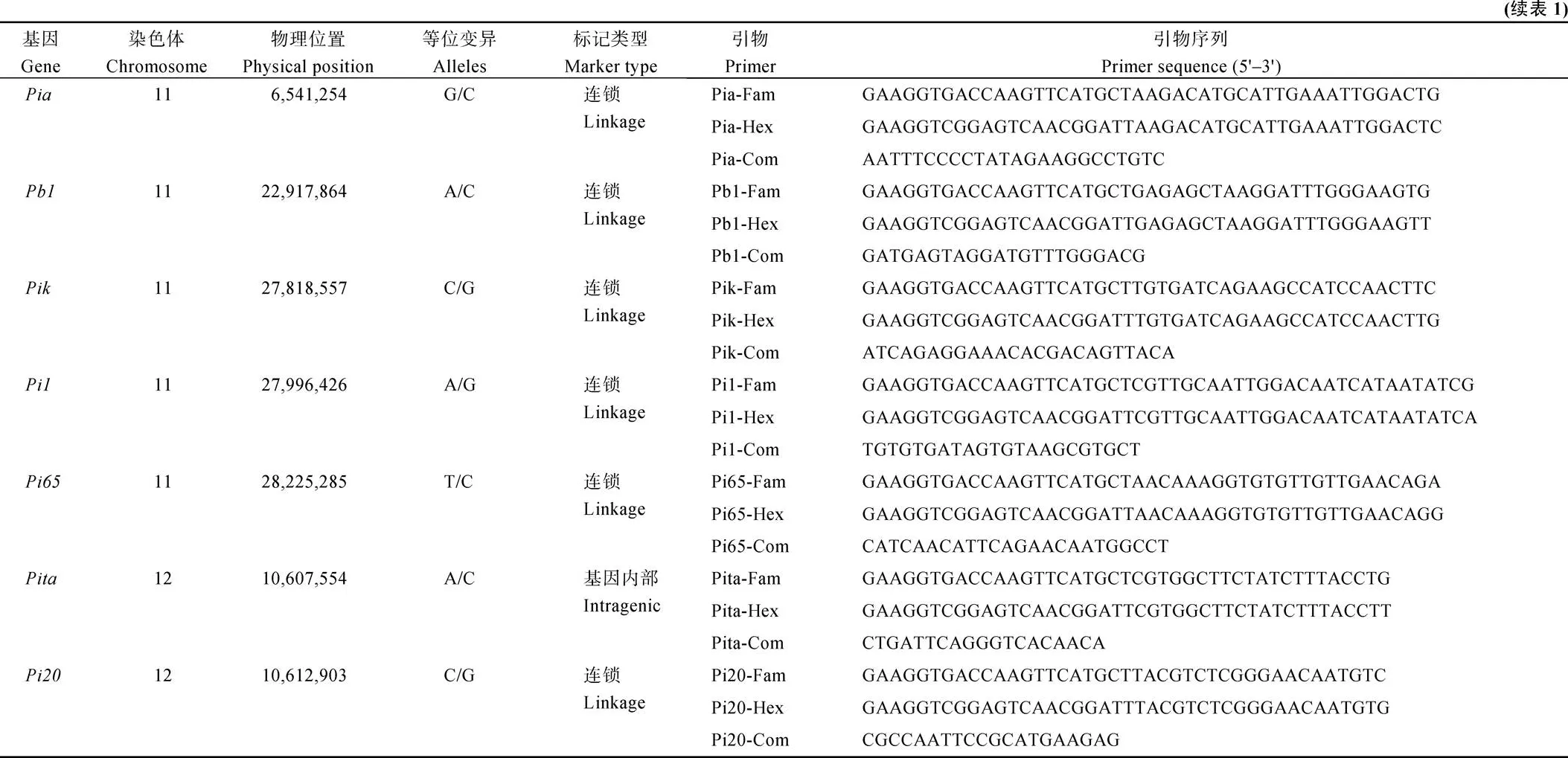
图1 隆两优与晶两优系列杂交稻品种稻瘟病抗性分析
Fig.1 Blast resistance of Longliangyou and Jingliangyou hybrid rice varieties
A: 隆两优与晶两优系列杂交稻品种与同期审定的其他两系杂交稻品种抗性比例。B: 隆两优与晶两优系列杂交品种在不同生态区域抗性水平分布频率。
A: percentage of resistant Longliangyou, Jingliangyou and other two-line system hybrid rice varieties.B: distribution frequency of resistant levels of Longliangyou and Jingliangyou hybrid rice varieties in different ecological regions.
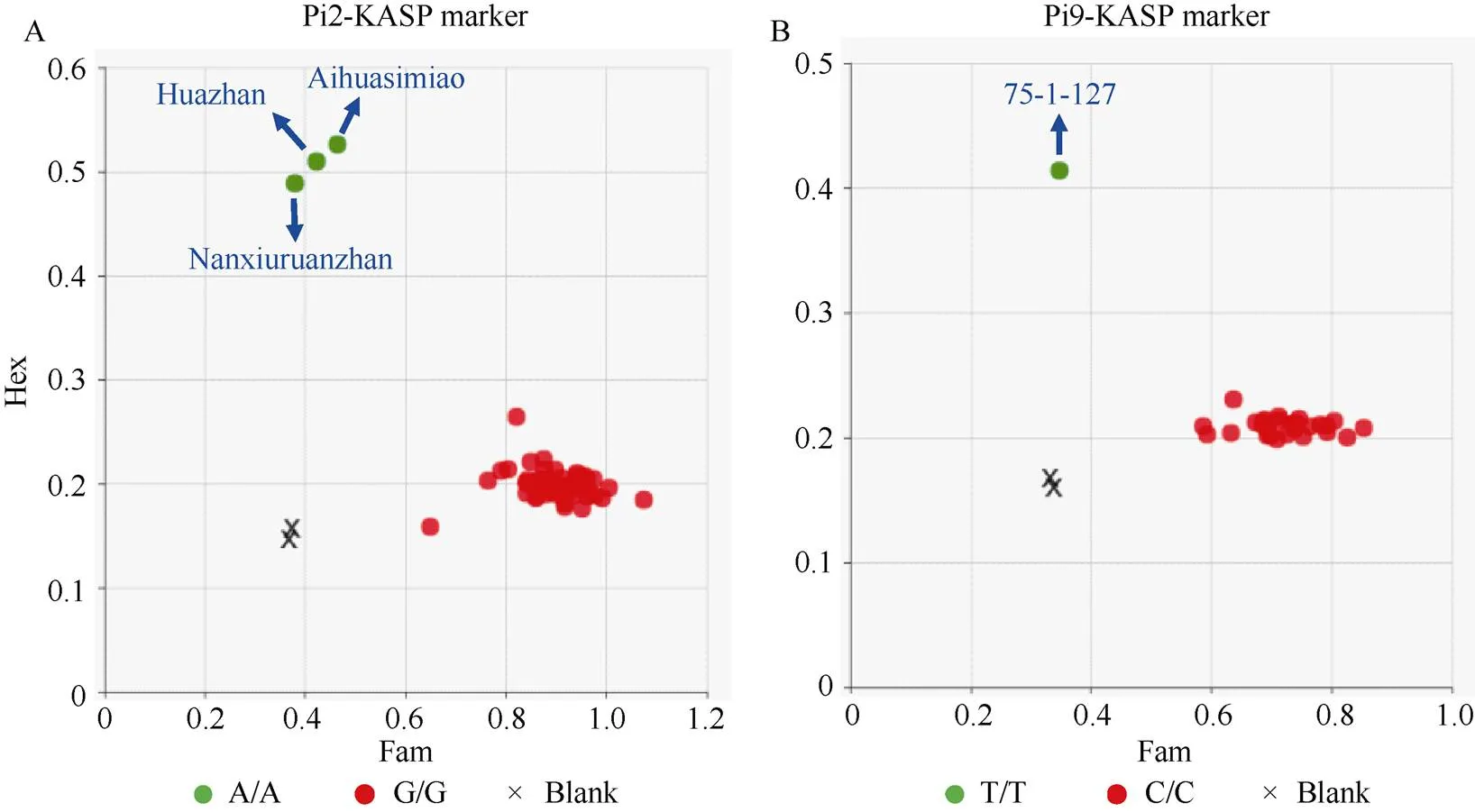
图2 Pi2-KASP (A)与Pi9-KASP (B)分子标记的验证
(图3)
A: 抗性基因在隆两优和晶两优系列杂交稻品种中的分布。B: 隆两优和晶两优系列杂交稻品种中抗性基因的数量。C: 在不同生态区域审定的隆两优和晶两优系列杂交稻品种中抗性基因的数量。
A: distribution of resistance genes in Longliangyou and Jingliangyou hybrid rice varieties.B: number of resistance genes in Longliangyou and Jingliangyou hybrid rice varieties.C: number of resistance genes in Longliangyou and Jingliangyou hybrid rice varieties certified in different ecological regions.
隆科638S和晶4155S各携带2个稻瘟病抗性基因, 父本携带2~6个抗性基因。杂交稻组合携带3~7个抗性基因(图3-B), 其中携带5个基因的品种最多, 有32个(占比43.8%); 携带3个基因的品种最少, 仅4个; 有6个品种携带有7个基因, 分别为晶两优1212、隆两优1377、隆两优1308、隆两优7810、隆两优1111和隆两优1212。从生态区域分析, 武陵山区与长江上游稻区审定的品种携带抗性基因数量相对较多, 平均为5.57个和5.48个(图3-C); 华南与长江中下游稻区审定的品种携带基因数量相对较少,平均为5.31个和5.13个。
2.4 抗性基因数量与稻瘟病抗性关系
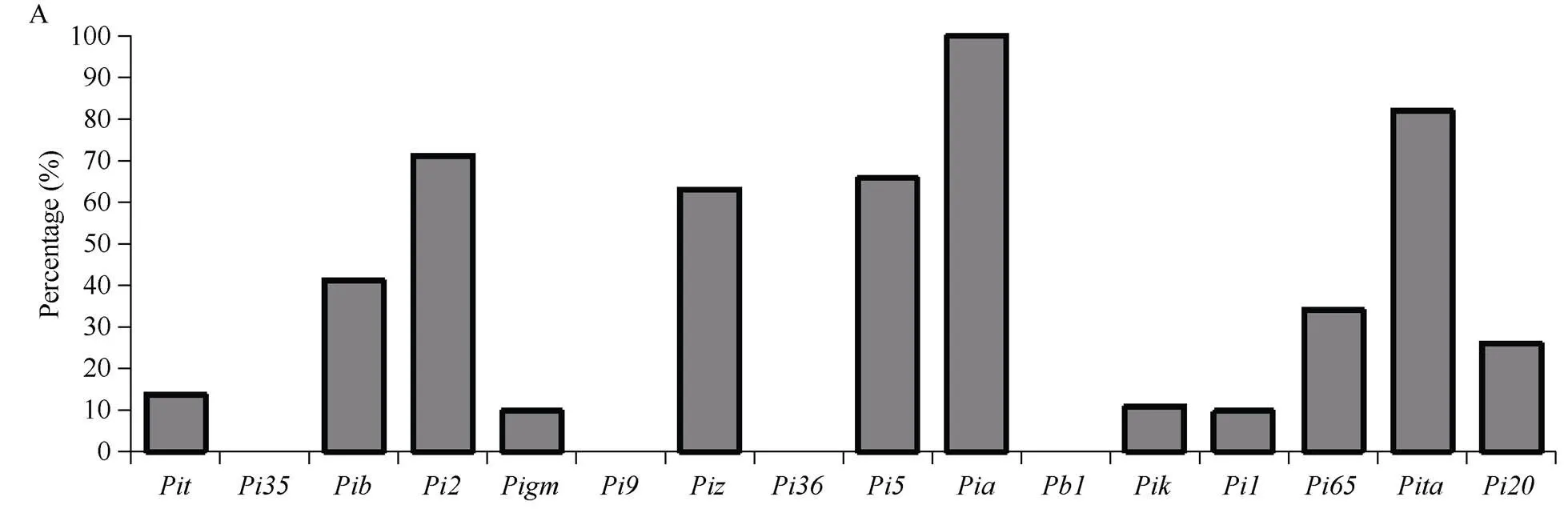
隆两优和晶两优系列杂交稻随着聚合抗性基因数量的增加, 综合抗性指数与穗瘟最高损失率平均值都呈现整体下降趋势(图4), 携带3个基因的品种综合抗性指数和穗瘟最高损失率均值分别为3.7和5.5, 而携带7个基因的品种则降低至2.8和3.6。对隆两优和晶两优系列杂交稻携带的抗病基因数与综合抗性指数平均值、穗瘟最高损失率平均值分别进行回归分析, 发现携带的的抗病基因数多少与综合抗性指数平均值、穗瘟最高损失率平均值的决定系数2分别为0.7735和0.7846, 且均达到统计显著水平(值分别为0.050和0.045) (图4), 表明综合抗性指数平均值、穗瘟最高损失率平均值与携带的抗病基因数均极显著相关。同时另外值得注意的是, 携带5个基因的品种综合抗性指数和穗瘟最高损失率平均值均低于6个基因的品种, 这可能与某些广谱抗性基因在品种中是否分布有关, 作为在育种实践中应用较为广泛的广谱抗性基因, 在携带5个基因的品种中的分布频率较高, 达到82.5%, 而6个基因的品种中的分布频率为66.7%。
3 讨论
3.1 隆两优与晶两优系列杂交稻品种稻瘟病抗性水平总体较强
隆科638S和晶4155S在培育过程中, 有目的性地进行稻瘟病抗性基因MAS聚合和稻瘟病病圃的表型胁迫筛选, 旨在提升不育系的稻瘟病抗性。隆科638S和晶4155S分别聚合有+与+基因, 选育的杂交稻品种抗性水平较强, 通过国家审定的隆两优与晶两优系列杂交稻品种中抗及以上品种的比例达到38.20%和52.54%, 显著高于同期国家审定的其他两系杂交稻品种(中抗稻瘟病品种比例仅12.35%)。分子标记检测、严格的表型筛选和精准测配, 可大大提升测配效率和选育强优势抗性品种的几率。
3.2 聚合双亲多个抗性基因是提高杂交稻品种抗性的有效途径
由于稻瘟菌生理小种的多样性且快速和频繁变异, 单基因的品种抗性容易丧失, 利用杂交稻双亲配组的设计优势, 合理聚合抗性基因是培育持久广谱抗性杂交稻的有效途径[28-29]。杂交稻双亲携带不同抗性基因, 可实现杂交组合聚合更多基因的目的。在本研究中, 我们基于“双亲抗性基因互补”配组原则, 即选择至少携带或或等主效抗病基因的父本, 与携带、的隆科638S和携带、的晶4155S进行配组, 使培育的隆两优、晶两优品种至少聚合3个及以上抗稻瘟病基因[(母本:+/+) + (父本://+n)], 其中有6个品种聚合7个抗性基因。我们的研究发现随着抗性基因数量的增加, 稻瘟病抗性呈现整体上升趋势。此外, 携带不同抗谱的抗性基因, 是拓宽水稻抗谱的有效手段之一, 可在一定程度上提高杂交水稻品种的适应性[30]。晶两优534等7个隆两优和晶两优杂交稻品种通过4个生态区域的国家审定, 它们携带了5~7个抗性基因, 平均为5.4个, 综合抗性指数均值为2.8, 穗瘟损失率最高级均值为3.2。然而, 导入过多抗性基因, 会带来育种时间、成本和技术难度的增加。因此, 在亲本选育过程中, 增加对抗谱较广抗性基因的使用, 减少或放弃对抗谱较窄的抗性基因, 父母本导入不同抗性基因, 可提升多基因聚合的效率和效果。然而, 携带基因数量不是影响抗性的唯一因素, 遗传背景、基因组合类型以及基因之间的互作均会影响最终的抗性[31-36]。如Xiao等[33- 34]发现聚合与基因的株系抗性水平低于仅携带单个基因的株系, 而聚合与基因株系抗性频率低于仅携带基因的株系。因此, 我们在抗性基因聚合育种时, 需要加强对育种材料的抗性评估, 以便选出最优的基因组合。另一方面, 抗性基因之间分子互作机制有待进一步解析, 以便为指导抗性育种提供理论依据。
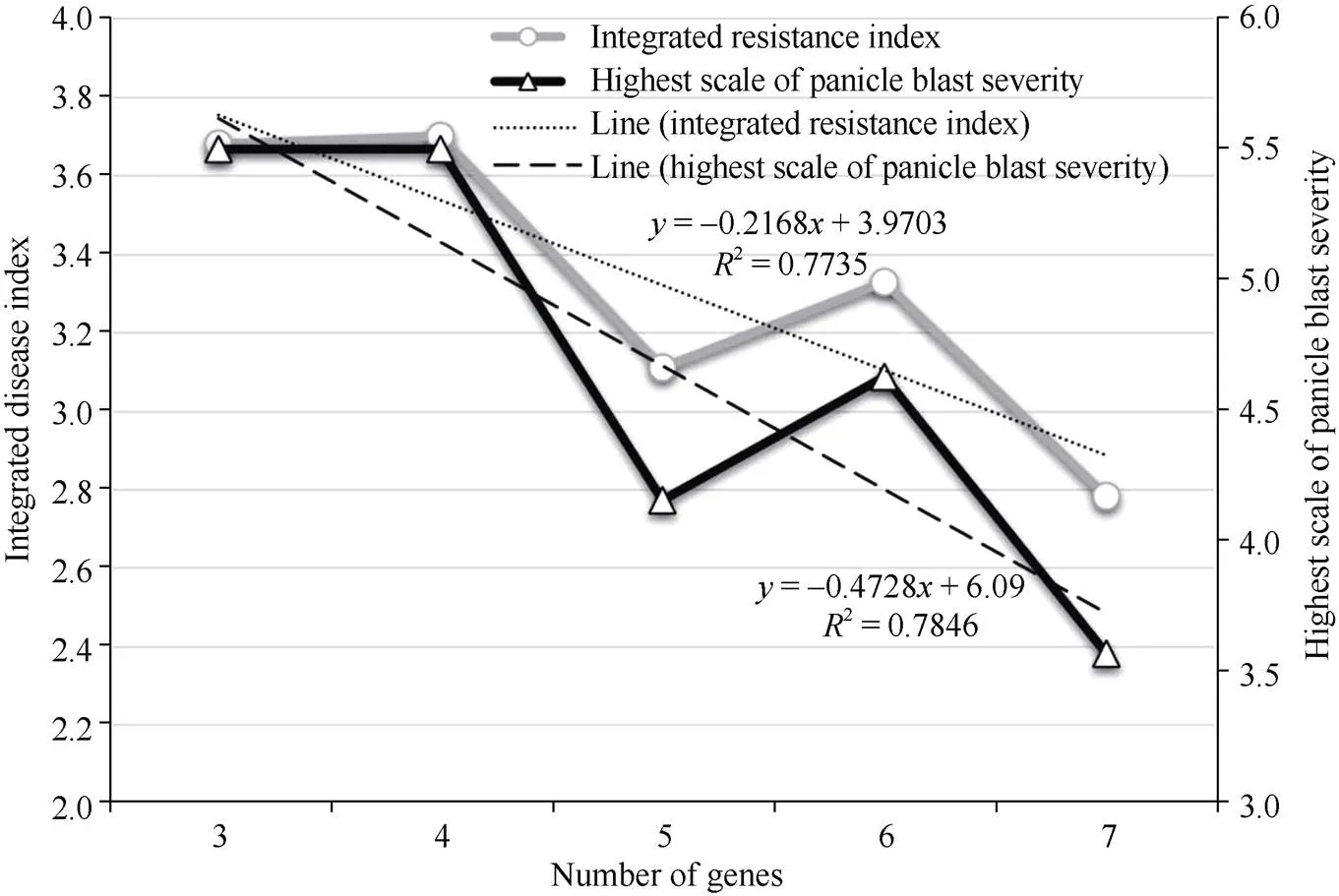
图4 抗性基因数量与稻瘟病抗性间的关系
3.3 进一步提升隆科638S与晶4155S稻瘟病抗性
虽然隆科638S与晶4155S均携带了2个抗性基因, 但是、和的抗谱相对较窄, 抗性水平相对较低, 有进一步提升空间。Xing等[37]研究发现、和对182个湖南省稻瘟菌生理小种的抗性频率分别为12.6%、39.6%和61.5%, 而的抗性频率在24个抗性基因中最高, 达到91.6%。Yang等[38]研究发现、和对163个广东省稻瘟菌生理小种的抗性频率仅为0.6%、12.3%和23.3%。未来可考虑通过增加抗性基因数量, 尤其是引入广谱抗性基因, 来进一步提升杂交稻品种的稻瘟病抗性以及应对稻瘟菌生理小种变异带来的抗性丧失的风险。例如,基因在本研究的供试杂交稻品种的亲本中未被检测到, 而在Xiao等[30]研究中发现, 在我国54个优异杂交稻品种中,基因也未被检出, 该基因具有潜在应用价值。因此, 可考虑将基因导入至隆科638S与晶4155S中, 进一步提升其组合的稻瘟病抗性。
4 结论
隆两优与晶两优系列杂交稻品种稻瘟病抗性来源于多个主效基因聚合效应, 多基因聚合可以有效增强品种抗稻瘟病能力。本研究结果为隆两优与晶两优系列杂交稻品种后续布局以及进一步改良提供了理论依据。
附表 请见网络版: 1) 本刊网站http://zwxb. chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3)万方数据http://c.wanfangdata.com.cn/Periodical- zuowxb.aspx。
[1] Ou S H.Rice Disease, 2nd edn.Kew, Eng.: Commonwealth Mycological Institute, 1985.pp 109–201.
[2] Kato H.Rice blast disease., 2001, 12: 23–25.
[3] Miah G, Rafii M Y, Ismail M R, Puteh A B, Rahim H A, Asfaliza R, Latif M.Blast resistance in rice: a review of conventional breeding to molecular approaches., 2013, 40: 2369–2388.
[4] Meng X, Xiao G, Telebanco-Yanoria M J, Siazon P M, Padilla J, Opulencia R, Bigirimana J, Habarugira G, Wu J, Li M, Wang B, Lu G D, Zhou B.The broad-spectrum rice blast resistance () geneencodes a novelprotein unique from., 2020, 13: 1–15.
[5] 胡培松.杂交水稻产业发展与技术创新.中国农业科技导报, 2010, 12(2): 17–23.
Hu P S.Development and technological innovation of hybrid rice industry., 2010, 12(2): 17–23 (in Chinese with English abstract).
[6] 武小金, 张克明.杂交水稻发展的现状与前景.农业现代化研究, 1996, 17(4): 234–236.
Wu X J, Zhang K M.Current status and prospects of hybrid rice development., 1996, 17(4): 234–236 (in Chinese with English abstract).
[7] 牟同敏.中国两系法杂交水稻研究进展和展望.科学通报, 2016, 35: 3761–3769.
Mou T M.The research progress and prospects of two-line hybrid rice in China., 2016, 35: 3761–3769 (in Chinese with English abstract).
[8] 龙彭年.中国两系法杂交水稻研发成就和发展策略.世界农业, 2002, (8): 36–38.
Long P N.The research achievements and development strategies of two-line hybrid rice in China., 2002, (8): 36–38 (in Chinese with English abstract).
[9] 鄂志国, 程本义, 孙红伟, 汪玉军, 朱练峰, 林海, 王磊, 童汉华, 陈红旗.近40年我国水稻育成品种分析.中国水稻科学, 2019, 33: 523–531.
E Z G, Cheng B Y, Sun H W, Wang Y J, Zhu L F, Lin H, Wang L, Tong H N, Chen H Q.Analysis on Chinese improved rice varieties in recent four decades., 2019, 33: 523–531 (in Chinese with English abstract).
[10] 符辰建, 秦鹏, 胡小淳, 宋永帮, 孙振彪, 杨远柱.水稻温敏核不育系湘陵628S的选育.中国农业科技导报, 2010, 12(6): 90–97.
Fu C J, Qin P, Hu X C, Song Y B, Sun Z B, Yang Y Z.Breeding of thermo-sensitive genic male sterile line Xiangling 628S., 2010, 12(6): 90–97 (in Chinese with English abstract).
[11] 唐文邦, 陈立云, 肖应辉, 刘国华, 邓化冰.水稻两用核不育系C815S的选育与利用.湖南农业大学学报(自然科学版), 2007, 22(2): 49–53.
Tang W B, Chen L Y, Xiao Y H, Liu G H, Deng H B.Breeding and utilization of dual-purpose genic male sterile rice C815S.(Nat Sci Edn), 2007, 22(2): 49–53 (in Chinese with English abstract).
[12] 邓启云.广适性水稻光温敏不育系Y58S的选育.杂交水稻, 2005, 20(2): 15–18.
Deng Q Y.Breeding of widely adaptable photo-thermo-sensitive sterile line Y58S., 2005, 20(2): 15–18 (in Chinese).
[13] 符辰建, 胡小淳, 符星学, 秦鹏, 王凯, 黎琛子, 吴挺飞, 刘珊珊, 杨远柱.优质抗病高配合力中籼两用核不育系隆科638S的选育及应用.中国稻米, 2021, 27(3): 61–66.
Fu C J, Hu X C, Fu X X, Qin P, Wang K, Li C Z, Wu T F, Liu S S, Yang Y Z.Breeding and application of mid-season thermo- sensitive sterile line Longke 638S with good grain quality, blast resistance and high combining ability., 2021, 27(3): 61–66 (in Chinese with English abstract).
[14] 符辰建, 胡小淳, 秦鹏, 符星学, 孙振彪, 杨广, 王凯, 杨远柱.抗病优质高配合力中籼型两用核不育系隆科晶4155S的选育及应用.杂交水稻, 2021, 36(4): 18–24.
Fu C J, Hu X C, Qin P, Fu X X, Sun Z B, Yang G, Wang K, Yang Y Z.Breeding and application of mid-season thermo-sensitive sterile line Jing 4155S with blast resistance, good grain quality and high combining ability., 2021, 36(4): 18–24 (in Chinese with English abstract).
[15] Semagn K, Babu R, Hearne S, Olsen M.Single nucleotide polymorphism genotyping using Kompetitive Allele Specific PCR (KASP): overview of the technology and its application in crop improvement., 2014, 33: 1–14.
[16] Ertiro B T, Ogugo V, Worku M, Das B, Olsen M, Labuschagne M, Semagn K.Comparison of Kompetitive Allele Specific PCR (KASP) and genotyping by sequencing (GBS) for quality control analysis in maize., 2015, 16: 908.
[17] Pham A T, Harris D K, Buck J, Hoskins A, Serrano J, Abdel-Haleem H, Cregan P, Song Q, Roger Boerma H, Li Z.Fine mapping and characterization of candidate genes that control resistance toK.Hara in two soybean germplasm accessions., 2015, 10: e0126753.
[18] Mackay I J, Bansept-Basler P, Barber T, Bentley A R, Cockram J, Gosman N, Greenland AJ, Horsnell R, Howells R, O’Sullivan D M, Rose GA.An eight-parent multiparent advanced generation inter-cross population for winter-sown wheat: creation, properties, and validation., 2014, 4: 1603–1610.
[19] Leal-Bertioli S C M, Cavalcante U, Gouvea E G, Ballén-Taborda C, Shirasawa K, Guimarães P M, Jackson S A, Moretzsohn M C.Identification of QTLs for rust resistance in the peanut wild speciesand the development of KASP markers for marker-assisted selection.:, 2015, 5: 1403–1413.
[20] Steele K A, Quinton-Tulloch M J, Amgai R B, Dhakal R, Khatiwada S, Vyas D, Heine M, Witcombe J R.Accelerating public sector rice breeding with high-density KASP markers derived from whole genome sequencing ofrice., 2018, 38: 38.
[21] Yang G, Chen S, Chen L, Sun K, Huang C, Zhou D, Huang Y, Wang J, Liu Y, Wang H, Chen Z, Guo T.Development of a core SNP arrays based on the KASP method for molecular breeding of rice., 2019, 12: 1–18.
[22] Yang G, Chen S, Chen L, Gao W, Huang Y, Huang Y, Huang C, Zhou D, Wang J, Liu Y, Huang M, Xiao W, Wang H, Guo T, Chen Z.Development and utilization of functional KASP markers to improve rice eating and cooking quality through MAS breeding., 2019, 215: 66.
[23] Qi Y, Wang L, Song J, Ma G, Wang J.Development and utilization of the functional co-dominant KASP marker for thermo- sensitive genic male sterility in rice., 2021, https://doi.org/10.21203/rs.3.rs-260801/v1.
[24] Sang S, Wang J, Zhou J, Cao M, Wang Y, Zhang J, Ji S, Zhang W.Development and application ofPi-kco-dominant marker for rice blast resistance gene., 2021, 12: 1–9.
[25] Kitazawa N, Shomura A, Mizubayashi T, Ando T, Nagata K, Hayashi N, Takahashi A, Yamanouchi U, Fukuoka S.Rapid DNA-genotyping system targeting ten loci for resistance to blast disease in rice., 2019, 69: 68–83.
[26] Ashkani S, Rafii M Y, Shabanimofrad M,Ghasemzadeh A, Ravanfar S A, Latif M A.Molecular progress on the mapping and cloning of functional genes for blast disease in rice (L.): current status and future considerations., 2016, 36: 353–367.
[27] Zhao H, Yao W, Ouyang Y D, Yang W N, Wang G W, Lian X M, Xing Y Z, Chen L L, Xie W B.RiceVarMap: a comprehensive database of rice genomic variations., 2015, 43(D1): D1018–1022.
[28] 陈羽.扬稻6号背景下不同稻瘟病广谱抗性基因聚合效应研究.扬州大学硕士学位论文, 江苏扬州, 2016.
Chen Y.Polymer Effect of Different Broad-spectrum Blast Resistance Genes under the Background of YD6.MS Thesis of Yangzhou University, Yangzhou, Jiangsu, China, 2016.pp 22–54 (in Chinese with English abstract).
[29] 张长伟, 郑家奎, 蒋开锋, 朱永川, 万先齐.杂交水稻叶瘟抗性杂种优势的遗传分析.植物病理学报, 2000, 30: 7–12.
Zhang C W, Zheng J K, Jiang K F, Zhu Y C, Wan X Q.Genetic analysis for heterosis of resistance to leaf blast in hybrid rice., 2000, 30: 7–12 (in Chinese with English abstract).
[30] Xiao G, Yang J, Zhu X, Wu J, Zhou B.Prevalence of ineffective haplotypes at the rice blast resistance () gene loci in Chinese elite hybrid rice varieties revealed by sequence-based molecular diagnosis., 2020, 13: 6.
[31] Tabien R E, Li Z, Paterson A H, Marchetti M A, Stansel J W, Pinson S R M, Park W D.Mapping of four major rice blast resistance genes from ‘Lemont’ and ‘Teqing’ and evaluation of their combinatorial effect for field resistance., 2000, 101: 1215–1225.
[32] Hittalmani S, Parco A, Mew T V, Zeigler R S, Huang N.Fine mapping and DNA marker-assisted pyramiding of the three major genes for blast resistance in rice., 2000, 100: 1121–1128.
[33] Xiao N, Wu Y, Pan C, Yu L, Chen Y, Liu G, Li Y, Zhang X, Wang Z, Dai Z, Liang C, Li A.Improving of rice blast resistances inby pyramiding majorgenes., 2017, 7: 1918.
[34] Xiao N, Wu Y, Wang Z, Li Y, Pan C, Zhang X, Yu L, Liu G, Zhou C, Ji H, Huang N, Jiang M, Dai Z, Li A.Improvement of seedling and panicle blast resistance in Xian rice varieties followingintrogression., 2018, 38: 142.
[35] Wu Y, Xiao N, Chen Y, Yu L, Pan C, Li Y, Zhang X, Huang N, Ji H, Dai Z, Chen X, Li A.Comprehensive evaluation of resistance effects of pyramiding lines with different broad-spectrum resistance genes againstin rice (L.)., 2019, 12: 11.
[36] Ning X, Yunyu W, Aihong L.Strategy for use of rice blast resistance genes in rice molecular breeding., 2020, 27: 263–277.
[37] Xing J, Jia Y, Peng Z, Shi Y, He Q, Shu F, Zhang W, Zhang Z, Deng H.Characterization of molecular identity and pathogenicity of rice blast fungus in Hunan province of China., 2017, 101: 557–561.
[38] Yang J, Chen S, Zeng L, Chen Y, Li Y, Chen Z, Li C, Zhu X.Race specificity of major rice blast resistance genes toisolates collected fromrice in Guangdong, China., 2008, 15: 311–318.
Analysis of blast resistance genes in Longliangyou and Jingliangyou hybrid rice varieties
DENG Zhao1,2,**, JIANG Nan1,2,**, FU Chen-Jian1, YAN Tian-Zhe1, FU Xing-Xue1, HU Xiao-Chun1, QIN Peng1,2, LIU Shan-Shan1, WANG Kai1,3,*, and YANG Yuan-Zhu1,2,3,*
1Key Laboratory of Southern Rice Innovation & Improvement, Ministry of Agriculture and Rural Affairs, Hunan Engineering Laboratory of Disease and Pest Resistant Rice Breeding, Yuan Longping High-Tech Agriculture Co., Ltd., Changsha 410128, Hunan, China;2College of Agronomy, Hunan Agricultural University, Changsha 410128, Hunan, China;3State Key Laboratory of Hybrid Rice, Hunan Hybrid Rice Research Center, Changsha 410125, Hunan, China
Longke 638S and Jing 4155S, developed by Yuan Longping High-Tech Agriculture Co., Ltd.in 2014, were two thermo-sensitive genic male sterile (TGMS) lines with disease resistance, high grain quality and combining ability for producing mid-seasonhybrid rice.In this study, we analyzed the blast resistance evaluation data from the regional trials of the Longliangyou and Jingliangyou hybrid rice varieties approved by the state from 2015 to 2019.Meanwhile, to provide theoretical basis for distribution and further improvement of these hybrid rice varieties, a genotyping panel containing 16 rice blast resistance () genes based on KASP (Kompetitive Allele-Specific PCR) technology was developed and used for molecular detection of these hybrid rice varieties.The results showed that 43.92% of Longliangyou and Jingliangyou hybrid rice varieties conferred moderate resistance to high resistance to blast disease.The mean value of integrated disease index (IDI) and highest scale of panicle blast severity (HSPBS) was 3.3 and 4.7, respectively.These hybrid rice varieties carried different number ofgenes, ranging from 3 to 7.The average number ofgenes in each variety was 5.1.The distribution frequency of the five genes including,,,, andwere higher by more 50%, among which, it was 100% forgene.In contrast,,,, andgenes were not detected in Longliangyou and Jingliangyou hybrid rice varieties.With the increase of the number ofgenes in the varieties, the mean values of IDI and HSPBS were generally decreased.In conclusion, we suggested that introduction ofinto Longke 638S and Jing 4155s might lead to the further improvement of blast resistance of Longliangyou and Jingliangyou hybrid rice varieties.
rice blast; resistance gene; KASP; hybrid rice; breeding
2021-01-18;
2021-09-09;
2021-10-12.
10.3724/SP.J.1006.2022.12002
通信作者(Corresponding authors):杨远柱, E-mail: yzhuyah@163.com; 王凯, E-mail: wk8587@163.com
**同等贡献(Contributed equally to this work)
邓钊, E-mail: dengzhao@lpht.com.cn; 江南, E-mail: jiangnan1984731@126.com
本研究由国家重点研发计划项目(2018YFD0100900), 杂交水稻国家重点实验室(湖南杂交水稻研究中心)开放课题基金(2018KF03), 国家自主创新示范区专项(2018XK2005)和湖南省科技创新计划项目(2018NK1020)资助。
This study supported by the National Key Research and Development Project (2018YFD0100900), the State Key Laboratory of Hybrid Rice (Hunan Hybrid Rice Research Center) Open Project Fund (2018KF03), the National Independent Innovative Demonstration Zone Project (2018XK2005), and the Science and Technology Innovation Program of Hunan (2018NK1020).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211012.1418.002.html
