巧辨析 知平衡
——例谈化学平衡状态的判断
2022-03-15安徽省蒙城第一中学
■安徽省蒙城第一中学 郝 丹
■安徽省合肥市第六中学 马善恒
可逆反应知识是高中化学中的重要内容,深刻认识可逆反应中的化学平衡状态的判断,对于学习可逆反应至关重要。化学平衡内容较为抽象,判断可逆反应是否达到平衡状态成为学习中的难点。
一、化学平衡状态的建立
1.化学平衡状态。在一定条件下,当一个可逆反应进行到正反应速率和逆反应速率相等时,反应物的浓度和生成物的浓度不再发生变化,达到一种表面静止的状态。
2.化学平衡状态的建立过程。
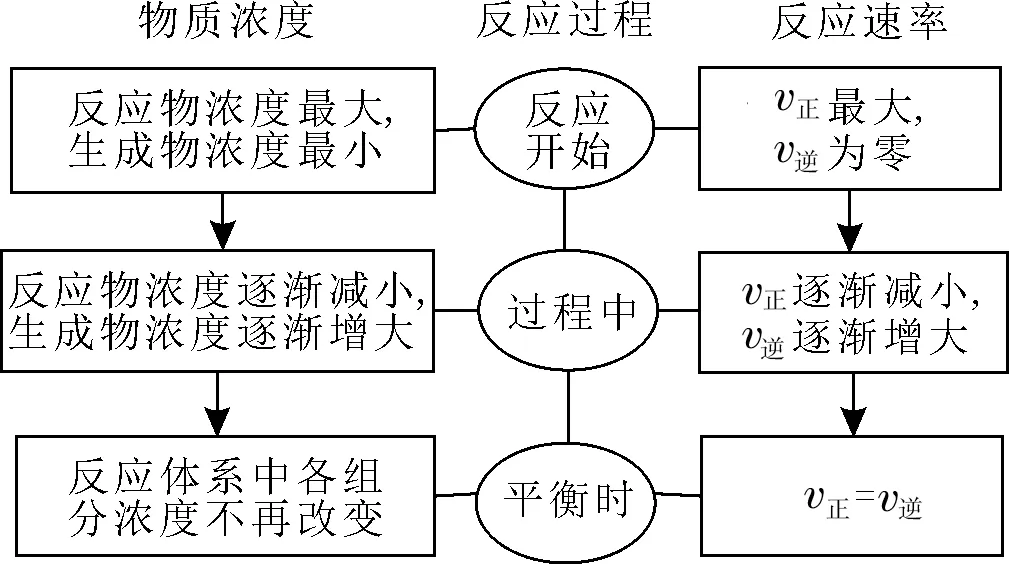
3.化学平衡建立过程中化学反应速率的变化图像(见图1)。

图1
二、化学平衡状态的特征

三、化学平衡状态的判定
1.直接判定。
(1)对于同一种物质而言,这种物质的生成速率等于它的消耗速率,说明反应达到化学平衡状态。
(2)对于不同物质而言,化学反应速率之比等于化学计量数之比,但是方向必须相反。即必须是v正与v逆之比等于化学计量数之比才能判断是平衡状态。
2.间接判定(一般是指恒温恒容条件下)。
(1)各组分的物质的量、物质的质量、分子数、气体的体积、物质的量浓度保持不变,说明反应达到化学平衡状态。
(2)一般情况下各组分的质量分数、物质的量分数、气体体积分数保持不变,说明反应达到化学平衡状态。
(3)若反应前后的物质都是气体,当ΔVg≠0时,气体的总物质的量,总压强,平均摩尔质量,混合气体的密度(恒温恒压)保持不变,说明反应达到化学平衡状态。
(4)对同一物质而言,断裂的化学键的物质的量与形成化学键的物质的量相等,说明反应达到化学平衡状态。
(5)反应物的转化率不再发生改变,产物的产率不再发生改变,说明反应达到化学平衡状态。
(6)化学反应一般都有热效应(吸热或放热),在绝热的密闭体系中发生反应时,当体系中的温度保持不变时,则反应达到化学平衡状态。
(7)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
总之,遵循变量不变的思想,便可判断反应达到平衡。
3.具体方法。
在研究化学平衡时要注意“二审”:一审题干条件是恒温恒容还是恒温恒压;二审反应特点,各物质的状态和左右两边气体计量数之和是否相等。另外要注意学会用公式,密度ρ=平均摩尔质量以及PV=nRT推出结论,再进行讨论,具体问题具体分析。
四、典型题目解析
1.反应前后物质状态都是气体且化学计量数不相等的反应。
例1在一定条件下,某体积不变的绝热密闭容器中进行可逆反应N2(g)+3H2(g)2NH3(g),请判断下列各种情况下能说明该反应已经达到化学平衡状态的有( )。
①N2、H2、NH3的浓度相等
②各组分的浓度不再改变
③容器中N2、H2、NH3浓度之比为1∶3∶2
④v正(N2):v正(NH3)=1∶2
⑤v正(N2):v逆(H2)=1∶3
⑥3v正(H2)=2v逆(NH3)
⑦反应混合气体的物质的量不再变化
⑧反应混合体系的密度不再变化
⑨单位时间内生成n mol N2的同时生成3n mol的H2
⑩体系的温度不再改变
A.4个 B.5个 C.6个 D.7个
解析:①化学平衡时反应物浓度可能等于生成物浓度,也可能不等,与各物质的初始浓度及转化率有关,故错误。②各组分的浓度不再改变,说明正逆反应速率相等,达到平衡状态,故正确。③化学平衡时容器中N2、H2、NH3浓度之比可能为1∶3∶2,也可能不等于1∶3∶2,与各物质的初始浓度及转化率有关,故错误。④v正(N2)∶v正(NH3)=1∶2,都体现正反应速率,未体现正与逆的关系,故错误。⑤v正(N2)∶v逆(H2)=1∶3,正逆反应速率相等,达平衡状态,故正确。⑥3v正(H2)=2v逆(NH3),速率之比不等于计量数之比,故错误。⑦正反应体积减小,反应混合气体的物质的量不再变化,达平衡状态,故正确。⑧体积不变,都是气体参与的反应,由知容器内气体的密度始终不变化,故错误。⑨单位时间内生成n mol N2的同时生成3n mol的H2,都体现逆反应速率,未体现正与逆的关系,故错误。⑩正反应放热,且是绝热密闭容器,因此体系的温度不再改变,反应达平衡状态,故正确。
答案:A
2.反应前后物质状态都是气体且化学计量数相等的反应。
例2在恒温恒容条件下,进行反应Br2(g)+H2(g)2HBr(g),下列不能作为该反应达到化学平衡状态的判断标志的是( )。
①v正(H2)=2v逆(HBr)
②每有1 mol Br—Br共价键断裂的同时,有2 mol H—Br共价键形成
③混合气体的密度不随时间变化而变化
④混合气体的平均相对分子质量不随时间变化而变化
⑤混合气体的颜色不随时间变化而变化
⑥混合气体中氢气的体积分数不随时间变化而变化
⑦混合气体总压强不随时间变化而变化
⑧混合气体中HBr的质量不随时间变化而变化。
A.②⑦ B.①②⑦
C.⑤⑥⑧ D.①②③④⑦
答案:D
3.反应前后物质状态既有气体又有固体的反应。
例3在一定温度下的定容容器中,发生反应Fe2O3(s)+3CO(g2Fe(s)+3CO2(g),能判断反应已经达到化学平衡状态的是( )。
A.混合气体的压强不变
B.混合气体的密度不变
C.混合气体的体积不变
解析:该反应是一个气体体积不变的反应,无论反应是否达到平衡,气体的压强均不变,则混合气体的压强不变不能判断反应已经达到化学平衡状态,故A项错误。由化学方程式可知,反应中气体的质量增大,在定容容器中,由知混合气体的密度增大,则混合气体的密度不变,说明反应已经达到化学平衡状态,故B项正确。该反应是一个气体体积不变的反应,无论反应是否达到平衡,气体的体积均不变,则混合气体的体积不变不能判断反应已经达到化学平衡状态,故C项错误。由化学方程式可知,反应向右进行时,减小,则混合气体中不变时,说明正逆反应速率相等,反应已经达到化学平衡状态,故D项正确。
答案:BD
4.反应物为单一固体,生成物全是气体的反应。
例4在一定温度下的恒容密闭容器中,加入少量A发生反应:A(s)B(g)+2C(g)。当下列物理量不再发生变化,可以判断该反应达到化学平衡状态的是( )。
①B的体积分数
②混合气体的压强
③混合气体的总质量
④混合气体的平均相对分子质量
A.①②③ B.②③
C.①④ D.①②③④
解析:①固体A是反应物,B、C是生成物且为气体,任何时刻生成1 mol B的同时会生成2 mol C,B与C的物质的量之比始终为1∶2,B的体积分数任何时刻都不变,①错误。②这是一个反应前后气体分子数改变的反应,只有达到平衡时,混合气体总压强才不变,因此②正确。③固体A是反应物,B、C是生成物且为气体,反应正向进行,混合气体的质量增加,当混合气体的总质量不变时,说明反应已经达到平衡状态,③正确。④不论反应达没达到平衡状态,B和C的物质的量之比都是1∶2,则任何时刻混合气体的平均相对分子质量都不变,④错误。
答案:B
5.反应物为单一固体,生成物部分是气体的反应。
例5恒温恒容条件下,容器中加入A发生可逆反应A(s)3C(g)+2D(s),下列不能说明该反应达到平衡状态的是( )。
A.容器内的压强保持不变
B.气体的物质的量浓度保持不变
C.容器内气体的密度保持不变
D.气体的平均相对分子质量保持不变
解析:由于该反应中只有生成物C是气体,恒温恒容条件下,随着反应的进行,气体C的质量和物质的量在变化,当不再变化时,说明气体的密度和浓度也不再变化,说明达到了平衡态。因此A项、B项、C项均可说明反应达到了平衡态。D选项,由于生成物只有一种气体,所以相对分子质量一直不变,不能说明反应是否达到平衡态。
答案:D
6.给定投料比的反应。
例6已知反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),在恒温恒压的容器中通入1 mol CO2和1 mol H2,下列一定能说明反应已达平衡状态的是( )。
A.气体的平均相对分子质量不变
B.气体的密度不变
C.CO2的体积分数不变
D.容器内气体的总压不变
解析:根据反应知前后都是气体物质,气体质量保持不变,左右两边气体计量数不相等,由知,平均相对分子质量在变化,不变则为平衡态,因此A项正确。气体质量保持不变,左右两边气体计量系数不相等,恒温恒压条件下,气体体积在变化,由知密度在变化,不变则为平衡态,因此B项正确。给定投料比情况下,如CO2(g)+3H2(g)CH3OH(g)+H2O(g),在恒温恒压的容器中通入 1 mol CO2和 1 mol H2,CO2的体积分数不变不能说明是平衡状态,因为根据“三段式”计算:

可知CO2的体积分数为一直不变,C项错误。恒压体系,压强一直不变,所以根据D项不能判断是平衡状态。
答案:AB
