营养缺失对具鞘微鞘藻胞外多糖和糖原分配模式的影响
2022-03-15葛红梅周雅茹柳诗莺王贤哲韩兴烨汪淑廉胡春香
葛红梅 周雅茹 柳诗莺 王贤哲 韩兴烨 汪淑廉 胡春香
(1. 湖北工业大学河湖生态修复与藻类利用湖北省重点实验室, 武汉 430068; 2. 中国科学院水生生物研究所, 武汉 430072)
34亿年前, 蓝藻是地球上唯一的光合自养生物,当今, 它仍然是很多生境中非常重要的光合植物类群, 特别是作为严酷贫瘠生境中最早的初级生产者,对地球生态系统的形成和演化起着非常重要的作用。而它成功拓殖的根源很大部分来自细胞外的胞外多糖(Exopolysaccharides, EPS), 因这部分的存在大大提高了蓝藻抵抗干旱、辐射、风沙和盐碱等多种胁迫的能力[1,2]。
蓝藻光合作用的初级产物大多数是糖原[3]。虽然糖原不仅调节胞内碳浓度、抵御饥饿[4], 还具有抵抗盐胁迫和氧化损伤的功能[5], 但为了抵御和适应多种胁迫环境, 蓝藻还分配相当的能量到胞外,特别地形成由紧密结合的荚膜多糖(Capsular polysaccharides, CPS)和松散结合能分泌到周围环境中的释放多糖(Released polysaccharides, RPS)构成的EPS。而且由于糖原[6]和EPS[7,8]诱人的工业应用前景, 大量研究都只关注其中一方的积累, 仅少量研究探讨了蓝藻糖原和EPS在同一培养条件下的变化规律, 如Ge等[9]研究发现光照强度明显影响具鞘微鞘藻细胞内糖原与胞外EPS的分配格局; Myriam等[10]通过文献调研和统计分析, 推断出光强、温度、高盐和氮限制是能影响钝顶节旋藻(Arthrospira platensis)EPS和糖原合成和分泌的环境因子, 其中光强的影响作用最明显, 而并未在实验条件下研究钝顶节旋藻在同一培养条件下藻细胞中碳流在糖原/EPS代谢生物合成途径中的分配。大量研究发现, 氮限制[6]、光[6,7,9]、盐[3]和重金属[8]胁迫等逆境环境明显刺激蓝藻EPS的分泌或糖原的合成, 在沙漠环境中, 营养元素的匮乏是极其常见的。基于此,本文以分布在生物土壤结皮中的蓝藻优势种具鞘微鞘藻(Microcoleus vaginatusGomont)为实验材料,研究其在不同营养元素缺失条件下细胞胞外EPS和胞内糖原合成的规律, 以探究具鞘微鞘藻胞外多糖和糖原代谢合成过程中碳流分配规律, 从而深入了解结皮蓝藻抵抗逆境的机制。
1 材料与方法
1.1 藻种及其培养
具鞘微鞘藻(FACHB-896)购自中国科学院水生生物研究所淡水藻种库, 最初分离自腾格里沙漠沙坡头试验站的生物结皮中。M. vaginatus在10 L BG-11[11]培养基中通气培养, 收集藻体, 并用蒸馏水清洗3遍后转接到含50 mL培养基的100 mL的锥形瓶中。培养基为分别缺失NO3-、PO43-、Mg2+、Ca2+和Fe2+离子的BG-11及BG-11; BG-11培养基为对照, 缺失NO3-、PO43-、Mg2+、Ca2+和Fe2+离子的培养基分别为BG-11中未加入NaNO3、K2HPO4、MgSO4、CaCl2和柠檬酸铁铵等化合物。藻种和实验藻体都在25℃(±1℃), 40 μE/(m2·s)单侧白质光连续光照培养。每个处理设3个平行, 每瓶每天手动摇4次。
1.2 生物量测定
在培养第4和第8天取样, 每次取样20 mL, 藻体用蒸馏水清洗1遍后, 8000×g离心4min, 真空冷冻干燥(Christ ALPHA 1-2 LD plus, German)后称重。
1.3 光系统Ⅱ(PSⅡ)的最大光合效率(Fv/Fm)的测定
取2 mL藻液, 暗适应15min后, 然后用便携式植物效率分析仪(PEA, Hansatech , UK)测定其光合活性。最大荧光时的饱和脉冲为1500 μE/(m2·s)。
1.4 叶绿素a含量的测定
叶绿素a含量的测定参照Lan等[12]的方法, 称取一定的干样, 然后置于研钵中, 在避光条件下,80%的丙酮溶液中研磨藻细胞, 4℃冰箱中避光放置一夜, 离心后测定上清液在663、490和384 nm波长下的吸光值。按公式叶绿素a含量=1000×(1.02×A663-0.0.027×A384+ 0.01×A490)/92.5 计算, 单位mg/g。
1.5 糖的测定
收集藻细胞后的培养基用于测定释放的多糖(Released polysaccharides, RPS)的含量[13]; 细胞荚膜多糖(Capsular polysaccharides, CPS)含量的测定参照葛红梅等[14]的方法, 将称重干藻加蒸馏水于80℃水浴6h, 离心(3000×g, 15min)后, 上清液用分子截留量3500 D的透析袋透析2d, 然后测定糖含量。总的胞外多糖(Extracellular polysaccharides, EPS)是RPS和CPS含量的总和。细胞内总糖的测定参照葛红梅等[14]的方法进行。RPS、CPS和细胞内总糖的定量测定均用苯酚硫酸法进行[15]。
糖原的测定参照Ge等[9]的方法, 将干藻样用80%乙醇清洗, 加入蒸馏水于120℃高压1h, 用α淀粉葡糖苷酶于57℃过夜, 然后按照测定葡萄糖的方法进行[16]。
1.6 数据分析
实验数值是3个平行的平均值, 数据利用Oneway ANOVA 进行方差分析, 在SPSS 18.0软件上进行。P<0.05为有显著性差异,P<0.01为有极显著性差异。
2 结果
2.1 营养缺失对生长的影响
如图1所示, 无论是在第4还是第8天,M. vaginatus在分别缺NO3-和Mg2+培养基的生物量明显低于对照(全营养培养基;P<0.05), 而在分别缺少Ca2+和Fe2+培养基中的生物量与对照的几乎相同(P>0.05; 图1); 在缺 P O34-培养基中的生物量在第8天时明显低于对照(P<0.05)。
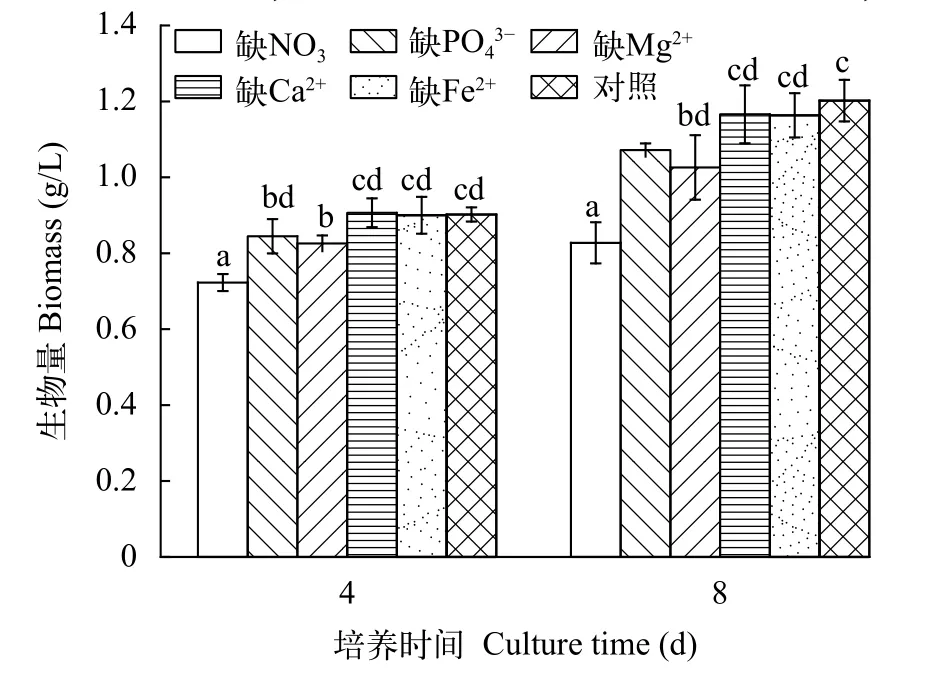
图1 营养缺失对具鞘微鞘藻生物量的影响Fig. 1 Effects of nutrient deficiency on biomass of M. vaginatus
2.2 营养缺失对Fv/Fm和叶绿素a含量的影响
如图2所示, 在培养的第4和第8天, 在缺NO3-的培养基中,M. vaginatusPSⅡ的最大光合效率(Fv/Fm)明显高于对照(P<0.01), 缺PO43-培养物的Fv/Fm值明显低于对照(P<0.01; 图2), 而缺Mg2+培养物的Fv/Fm值与对照无明显差异(P>0.05; 图2)。缺Ca2+或缺Fe2+培养物在第4天时的Fv/Fm值均明显高于对照(P<0.05; 图2), 而在第8天时, 与对照的无明显区别(P>0.05)。

图2 营养缺失对具鞘微鞘藻Fv/Fm的影响Fig. 2 Effects of nutrient deficiency on Fv/Fm of M. vaginatus
如图3所示, 无论是在培养的第4还是第8天, 缺NO3-或缺Mg2+的M. vaginatus培养物, 其叶绿素a含量均明显低于其他处理(P<0.01), 而缺Ca2+或缺Fe2+培养物的叶绿素a含量与对照的无明显差异(P>0.05; 图3)。缺PO43-培养物在培养第4天时的叶绿素a含量与对照无明显差异(P>0.05), 而到第8天时, 明显低于对照(P<0.01; 图3)。

图3 营养缺失对具鞘微鞘藻叶绿素a的影响Fig. 3 Effects of nutrient deficiency on chlorophyll a of M.vaginatus
2.3 营养缺失对EPS各部分及其总量的影响
图4a显示了在营养缺失条件下M. vaginatus释放到培养基中RPS的情况。与对照相比, 实验设定的营养缺失条件并未刺激M. vaginatus释放RPS, 相反, 第8天时, 在分别缺NO3-、PO43-、Mg2+或Ca2+培养基中的RPS量均明显低于对照(P<0.05), 缺Fe2+培养基中RPS量与对照几乎相同(P>0.05)。
如图4b所示, 无论是在培养的第4还是第8天,缺NO3-培养物的CPS含量明显低于对照(P<0.01),而缺PO43-或缺Mg2+培养物的CPS含量均与对照无明显差异(P>0.05), 缺Ca2+或缺Fe2+培养物的CPS含量均明显高于对照(P<0.05; 图4b)。各处理的RPS/CPS比值都小于1, 尤其在第8天时, 分别缺NO3-、PO43-、Mg2+或Ca2+培养物的RPS/CPS比值都明显低于对照(P<0.01; 图4c), 即表明在营养缺失条件下,M. vaginatus在胞外合成EPS过程中, 优先合成CPS, 较少合成RPS。
营养缺失对M. vaginatusEPS的影响如图4d所示。无论是在培养的第4还是第8天, 缺NO3-或缺PO43-培养物合成的EPS量均明显少于对照(P<0.01),而缺Mg2+、Ca2+或Fe2+培养物的EPS量均与对照无明显差异(P>0.05; 图4d)。

图4 营养缺失对具鞘微鞘藻RPS、CPS、RPS/CPS、EPS的影响Fig. 4 Effects of nutrient deficiency on RPS, CPS, RPS/CPS and EPS of M. vaginatus
2.4 营养缺失对细胞内总糖的影响
图5显示了在营养缺失条件下M. vaginatus细胞内总糖的情况。在培养第4天时, 各处理间的细胞内总糖无明显区别(P>0.05); 到第8天时, 缺NO3-培养物胞内总糖含量明显高于其他各处理组(P<0.01), 而缺PO43-、Mg2+、Ca2+或Fe2+培养物的胞内总糖含量均与对照无明显差异(P>0.05; 图5)。

图5 营养缺失对具鞘微鞘藻细胞内总糖的影响Fig. 5 Effects of nutrient depletion on total intracellular carbohydrate of M. vaginatus
2.5 营养缺失对糖原的影响
图6显示了在营养缺失条件下M. vaginatus合成糖原的情况。与对照相比, 无论是在培养的第4还是第8天, 缺NO3-、PO43-、Mg2+或Ca2+等营养盐均明显促进了M. vaginatus体内糖原的合成(P<0.01), 而缺Fe2+直到第8天时才明显促进了糖原的合成(P<0.01)。
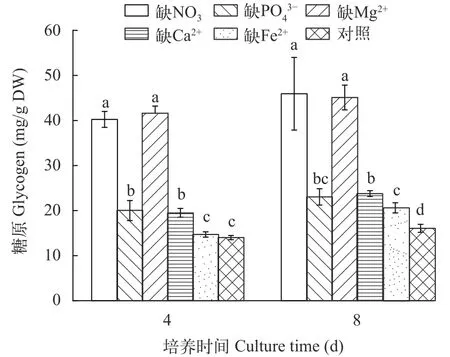
图6 营养缺失对具鞘微鞘藻糖原的影响Fig. 6 Effects of nutrient depletion on glycogen of M. vaginatus
2.6 营养缺失对EPS/糖原比值的影响
如图7所示, 无论在培养的第4还是第8天, 缺NO3-、PO43-、Mg2+或Ca2+的培养物其EPS/糖原比值在1.7—8.0, 且明显低于对照组(P<0.01), 而随着培养时间的延长, 各培养条件下EPS/糖原比值基本无变化(P>0.05)。
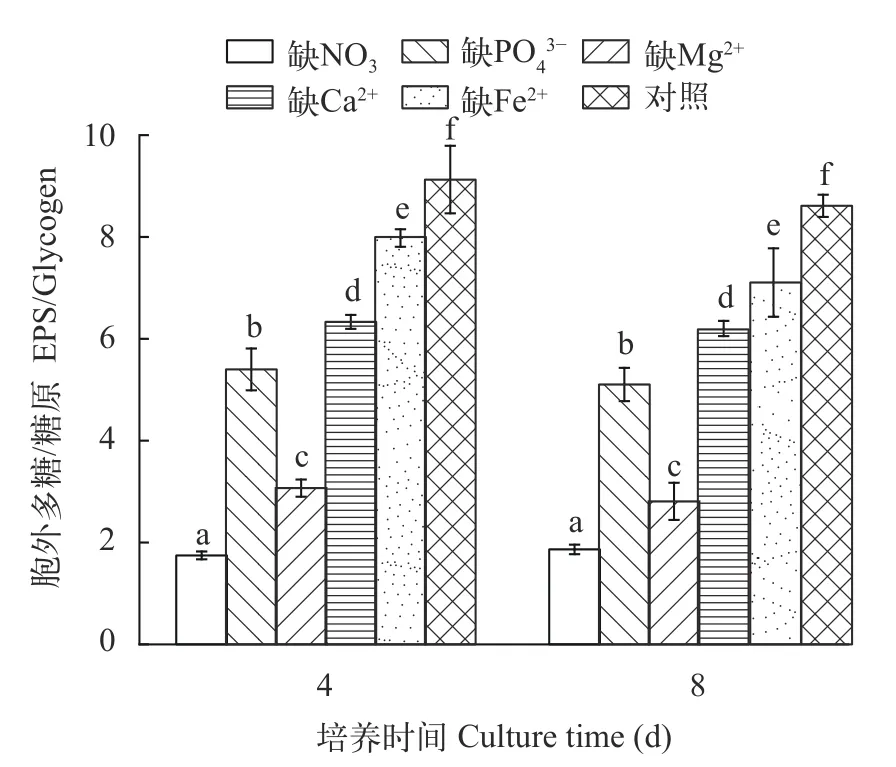
图7 营养缺失对具鞘微鞘藻EPS/糖原比值的影响Fig. 7 Effects of nutrient depletion on the ratio of EPS/glycogen in M. vaginatus
3 讨论
3.1 营养缺失对生长的影响
氮、磷、镁、钙等大量元素及铁等微量元素是非固氮藻类生长必需的营养元素, 当某种元素长期缺乏时, 生物体的生长和生理功能则受到一定抑制[17,18]。在本研究中, 缺NO3-、PO43-或Mg2+明显影响了藻体的生长和叶绿素a的合成, 而Ca2+或Fe2+的缺乏则对这两项指标无明显影响。氮和镁是叶绿素的主要组成元素, 因而可能对该藻的生长和叶绿素a合成影响更为明显, 而藻细胞内钙和铁元素在短时期内能满足自身生长和叶绿素a合成的需求。
3.2 营养缺失对EPS分泌的影响
有研究发现, 影响蓝藻EPS分泌的主要营养元素包括可利用的碳、氮、磷和硫[19,20], 其中碳和氮主要通过调节胞内的碳氮比例而影响EPS的分泌,即当碳氮比大于一定阈值时, 藻细胞向外分泌EPS[19,21]。一般氮限制因抑制藻类的生长, 造成体内碳的过剩, 而明显促进蓝藻EPS的分泌[19,21]。在多数情况下, 缺磷、低磷或缺硫条件可以刺激蓝藻胞外多糖的释放[22,22]。一般而言, 磷浓度的增加基本不影响胞外多糖的产量。盐浓度(NaCl)的增加促进EPS的分泌与藻细胞通过分泌EPS抵抗环境逆境有关[13,23]。我们的研究结果发现, 氮缺乏明显抑制M .vaginatus分泌RPS、CPS和EPS, 且限制了其生长, 这与以前的大多数研究结果相反, 但与Tiscner和Davis等[24]的研究结果相同。这可能是因为氮是M. vaginatus生长和体内物质合成的重要元素, 缺乏氮素时, 细胞内蛋白合成受到限制, 但胞内碳含量并未过剩, 将有限的能量用于生长和体内代谢等, 但不向外分泌RPS, 则就明显抑制了EPS的分泌。磷缺乏也抑制M. vaginatusRPS和EPS的分泌,与以前在鱼腥藻Anabaenaspp.、胶鞘藻Phormidiumsp.和曲壳藻Achnanthes brevipes中研究结果相似[25,27]。镁、钙或铁缺乏既不影响M. vaginatusEPS的分泌, 也不影响其生长, 这与在2种蓝杆藻Cyanothece16Som2和C.closterium中发现的结果相似[22,27]。这些结果说明EPS的分泌受培养基中不同营养元素的影响。氮、磷、镁、钙或铁的缺乏并未刺激M. vaginatus总EPS的分泌, 很可能是由于细胞倾向将能量优先存储在体内, 帮助其抵抗营养缺失时的不良环境, 使碳流较少向外输出。
3.3 营养缺失对RPS和CPS分配模式的影响
蓝藻的EPS是由紧密结合的CPS和松散结合的RPS组成, 它们对细胞的功能和重要性上也是有偏重[28], 合成胶鞘有利于保护藻细胞[29], 而分泌RPS是为改善细胞外界的环境, 如增加周围环境中有机碳含量和酶活性[1]。以前研究发现, 水华蓝藻Microcystis aeruginosa[30,31]在生长过程中分泌的EPS中以CPS为主, Nicolaus等[26]研究发现一些蓝藻以CPS为主, 而一些蓝藻以RPS为主。在我们的研究中, 与对照相比,M. vaginatus在营养元素缺失条件下, 在向胞外分泌的EPS中, 分泌更多的CPS, 而较少分泌RPS。这说明在营养元素受到限制时,M.vaginatus将有限的能量优先合成利于自身生存的CPS。这种经济合理的能量分配模式将十分有利于其在贫瘠沙漠地区生存。
3.4 营养缺失对糖原合成的影响
目前, 外界环境因素对糖原合成的影响已有很多报道, 主要集中在营养条件和培养条件方面。在蓝藻中, 当营养缺失抑制细胞生长时或突然增加能量输入时, 糖原会大量积累[4,5,32]。氮限制会明显促进蓝藻糖原的积累[4,5,33]。磷、硫磷限制同样会促进极大节旋藻Arthrospira maxima体内糖原的积累[33]。有研究发现高盐浓度同样会明显促进极大节旋藻Synechococcus elongatusPCC 7942和集胞藻Synechocystissp. PCC 6803糖原的积累[4,5]。在我们的研究中, 氮和磷缺乏也明显促进了蓝藻体内糖原的积累, 而且发现镁、钙或铁缺乏也明显促进糖原的合成, 尤其是氮或镁缺乏对糖原合成促进作用最明显。可能是因为氮和镁限制明显抑制了M. vaginatus的生长和叶绿素a的合成, 而光合活性并未受到抑制, 将过剩的碳用于体内糖原的积累, 因而氮和镁缺乏时的促进糖原合成作用最明显。而磷的缺乏限制了M. vaginatus的生长, 但对叶绿素a的合成没影响, 钙和铁的缺乏对M. vaginatus的生长和叶绿素a的合成都无明显影响, 因而磷、钙和铁的缺乏对糖原的积累作用要弱些。这些结果说明在短暂营养缺失条件下, 细胞会存储能量物质, 但不同的营养离子限制对其累积作用是有差异的。这些结果进一步表明糖原含量的增高可能与其抵抗逆境环境有关。
3.5 营养缺失对EPS和糖原分配模式的影响
在营养缺失时, 具鞘微鞘藻倾向存储糖原, 但仍将高于合成糖原的碳流用于合成EPS。尤其在氮缺乏时, EPS/糖原值最小, 细胞内总糖含量最高, 细胞分配能量更经济。营养缺失明显影响具鞘微鞘藻EPS和糖原的分配格局, 这种能量分配模式可能十分有利于其在贫瘠沙漠地区生存。
4 结论
(1) NO3-、PO43-或Mg2+缺乏明显抑制了M. va-ginatus的生长和叶绿素a的合成(P<0.05), 而Ca2+或Fe2+缺乏则这两个指标无明显影响(P>0.05)。(2)氮、磷、镁、钙或铁的缺乏均未刺激M. vaginatus总EPS的分泌(P>0.05), 而明显促进了糖原的合成(P<0.01)。营养缺失明显影响了该藻在合成EPS和糖原方面的能力和物质分配, 细胞倾向将固碳产物以糖原形式存储在体内, 帮助其抵抗营养缺失时的不良环境。(3)营养缺失时,M. vaginatus在合成EPS的过程中, 将有限的能量优先分配用于合成利于自身生存的CPS, 较少向外分泌RPS, 这种经济合理的能量分配模式将十分有利于其在贫瘠沙漠地区生存。(4)营养缺失明显影响具鞘微鞘藻EPS和糖原的分配模式, 这种能量分配模式可能十分有利于其抵抗贫瘠沙漠环境。
