基于基因芯片的miRNA表达差异在结核性脑膜炎与病毒性脑膜炎诊断中的价值
2022-03-14谌蒙蒙董静孙琦黄麦玲丁则昱史雨婷贾红彦杜博平魏荣荣邢爱英张宗德潘丽萍
谌蒙蒙 董静 孙琦 黄麦玲 丁则昱 史雨婷 贾红彦 杜博平 魏荣荣 邢爱英 张宗德 潘丽萍
结核性脑膜炎(tuberculous meningitis,TBM)是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的中枢神经系统结核病,是最严重的结核病类型[1]。由于TBM患者的临床症状特异性差,并缺乏有效的检测技术,使得TBM的早期诊断较为困难。目前,临床上使用的脑脊液(cerebrospinal fluid,CSF)涂片抗酸染色的分枝杆菌阳性率较低,仅为10%~20%;而MTB培养的敏感度也有限,且一般需要6~8周;尽管世界卫生组织推荐了GeneXpert MTB/RIF检测技术,但其敏感度仍低于60%[2]。因此,迫切需要开发新的检测技术以早期诊断TBM,而寻找新的生物标志物则成为目前研究的重要方向。
微小核糖核酸(miRNA)是一类由18~25个核苷酸组成的高度保守的非编码单链RNA分子,主要从转录后水平参与基因的表达调节,在细胞分化、增殖、器官发育和疾病发生发展等多种生物学过程中发挥着重要作用[3]。近年来,miRNA作为新的生物标志物已应用于多种疾病的诊断中,如癌症、糖尿病和乙型病毒性肝炎等疾病[4-6]。而在结核病的研究领域,虽然也发现miRNA的差异表达可以反映机体感染时的结核病进展情况,但在TBM中的相关研究还较少,特别是针对CSF的相关研究更为有限[7]。笔者通过表达谱筛选、分析、验证TBM与病毒性脑膜炎(viral meningitis,VM)患者CSF中差异表达的miRNA,旨在发现新的生物标志物,为后期TBM的发生发展机制研究提供参考。
对象和方法
一、研究对象
参照入组标准选取2017年12月至2019年9月在首都医科大学附属北京胸科医院和首都医科大学附属北京天坛医院治疗的28例TBM患者和27例VM患者;其中,TBM组中男性17例(60.7%)、女性11例(39.3%),中位年龄[M(Q1,Q3)]为26.5(19.0,47.0)岁;VM组中男性19例(70.4%)、女性8例(29.6%),中位年龄为45.0(26.0,55.0)岁;两组患者性别分布和年龄的差异均无统计学意义(χ2=0.567,P=0.452;Z=-1.643,P=0.100)。本研究通过首都医科大学附属北京胸科医院伦理委员会批准(YJS-2021-007号)。
将前期收集的8例TBM患者和5例VM患者作为基因芯片样本进行全基因组miRNA微阵列分析,其中,TBM组中男性5例、女性3例,中位年龄为27.0(22.5,45.0)岁;VM组中男性3例、女性2例,中位年龄为26.0(24.0,35.0)岁;两组患者性别分布和年龄的差异均无统计学意义(Fisher精确概率法,P=1.000;Z=-0.146,P=0.884)。将全部患者作为验证样本进行实时荧光定量逆转录PCR(qRT-PCR)验证。
二、研究方法
1.入组标准[8]:(1)TBM 组:纳入有以下至少一项脑膜炎症状和体征者,包括头痛、头晕、恶心、呕吐、发热、盗汗、乏力、消瘦、脑膜刺激征、颅内压增高、局灶性神经功能障碍、意识改变,以及CSF抗酸染色或MTB培养或PCR或GeneXpert MTB/RIF阳性者。排除化脓性脑膜炎、隐球菌性脑膜炎、病毒性脑膜脑炎、梅毒性脑膜炎、脑型疟疾、布鲁杆菌性脑膜炎、寄生虫性或嗜酸细胞性脑膜炎、脑弓形体病和细菌性脑脓肿、恶性肿瘤和自身免疫性脑炎。(2)VM 组:纳入确认病毒病因,或经抗病毒治疗效果良好,以及排除细菌、真菌和其他非感染性原因(恶性肿瘤、神经结节病、自身免疫性疾病)者。
2.样本采集及miRNA的提取:所有CSF标本均取自患者的常规诊断检查过程。先在4 ℃下2000×g离心10 min,再经4 ℃下16 000×g离心10 min后,吸取上清液至无菌聚丙烯微管中,分装后浓度为200 μl/管,在-80 ℃中保存备用。再按照血液/血浆RNA提取纯化试剂盒(miRNeasy Serum/Plasma Kit,德国Qiagen公司)说明书从CSF标本(200 μl)中提取总RNA,并按照说明书在提取时加入5.6×108个拷贝量的外源cel-miR-39-3p(德国Qiagen公司)作为内参。
3.微阵列基因芯片检测及差异性miRNA的筛选:将提取的总RNA样本送上海伯豪生物技术有限公司进行微阵列基因芯片检测。采用美国安捷伦科技有限公司的miRNA微阵列芯片V21(8×60 k;G4872A-070156)从每份样本中提取的总RNA(100 ng)作为样本进行标记和杂交,使用扫描控制软件将微阵列图像信息转换为光点强度值进行计算。再将原始样本数据标准化后得到TBM/VM的差异倍数(fold change,FC),以FC>2或<0.5且P<0.05为条件筛选出差异性miRNA。当FC>1时,表示miRNA在TBM组中的表达较VM组上调,且FC值越大,表示两病患者间表达差异越大;当FC<1时,表示miRNA在TBM组中的表达较VM组下调,且FC值越小,表示两病患者间表达差异越大。通过R语言制作差异表达的miRNA聚类分析热图,以对样本和基因分别进行分级聚类,并可直观地表现出基因在不同样本中的表达情况,红色表示高表达,绿色表示低表达。
4.差异性miRNA靶基因预测及基因本体(gene ontology, GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路分析:通过miRTarBase 8.0数据库(https://mirtarbase.cuhk.edu.cn/)预测差异性miRNA的靶基因。通过David 6.8数据库(https://david.ncifcrf.gov/)对靶基因进行GO富集分析和KEGG信号通路分析,并对KEGG信号通路分析中富集于免疫、炎症,或神经相关通路的靶基因进一步分析。
5.蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建及核心靶基因的筛选:通过STRING 11.5数据库(https://string-db.org/)对上述靶基因进行PPI网络分析,以了解基因间有无相互作用,以及平均基因间相互作用的关系度(即每个靶基因与其余靶基因相互作用程度的平均值,数值越高表示相互作用的程度越大)。运用Cytoscape 3.8.2软件构建PPI网络,再运用Cytohubba插件对PPI网络进行运算,根据degree水平筛选出前10个基因作为差异表达基因中的核心靶基因。其中degree是PPI网络中评估连接紧密程度的一个参数,该数值越高表示连接越紧密,在整个网络中与其他蛋白节点的相互作用程度越强,对整个网络的稳定性起着重要的作用。
6.qRT-PCR验证:按照miScript Ⅱ RT Kit(德国Qiagen公司)说明书将miRNA反转录成cDNA,再根据miScript SYBR PCR Kit(德国Qiagen公司)说明书进行荧光定量检测,以cel-miR-39-3p作为内参,计算2-△Ct值作为各样本中miRNA的相对表达量。
三、统计学处理

结 果
一、基因芯片筛选出组间差异的miRNA
通过微阵列基因芯片检测数据分析,筛选出TBM患者与VM患者之间存在26个差异性miRNA,分别为11、12、19号和X性染色体上各有3个差异性miRNA,1、3、10和17号染色体上各有2个差异性miRNA,2、5、9、16、20和22号染色体上各有1个差异性miRNA,hsa-miR-4281和hsa-miR-4516是在两组中表达差异最大的miRNA(FC>20),具体数据见表1(由上海伯豪生物技术有限公司进行微阵列基因芯片检测并提供最终结果)。其中,14个miRNA表达量上调,12个miRNA表达量下调,依此绘制差异性miRNA聚类分析热图(图1)。
二、miRNA的预测靶基因及GO富集分析和KEGG信号通路分析
通过miRTarBase 8.0数据库筛选出26个差异性miRNA对应的靶基因,共3217个,但在该数据库中能够进行荧光素酶报告实验、蛋白免疫印迹(Western blot)或qRT-PCR验证的只有6个miRNA靶基因,分别为hsa-miR-21-5p、hsa-miR-320d、hsa-miR-1273g-3p、hsa-miR-4496、hsa-miR-4516及hsa-miR-7515,其中hsa-miR-21-5p是经过实验验证最多的miRNA靶基因。
进一步对预测出的靶基因进行GO富集生物信息学分析。其中,生物学过程分析显示,靶基因主要富集于转录调控、凋亡过程的负调控和蛋白质的泛素化作用等过程中(图2);细胞组成分析显示,靶基因主要富集于细胞核、细胞质和细胞溶质等物质中(图3);分子功能分析显示,靶基因主要富集于蛋白结合、DNA结合和三磷酸腺苷(ATP)结合等(图4);KEGG信号通路分析显示,这些靶基因主要参与癌症相关通路、磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路和丝裂原活化蛋白激酶(MAPK)信号通路等,且有190个靶基因富集于免疫反应、炎症或神经营养素相关通路(图5)。
三、PPI网络构建及核心基因筛选
经初步PPI网络分析上述190个靶基因显示,PPI网络富集具有明显的交互作用(P<1×10-16),平均基因间相互作用关系度为28.9。进一步构建PPI网络,共计包含了其中的174个基因,组成了2633对相互作用关系(图6),经Cytohubba插件运算,将degree水平前10个基因作为核心靶基因,分别是丝氨酸/苏氨酸蛋白激酶1(AKT1)、肿瘤蛋白p53(TP53)、MYC基因、表皮生长因子受体(EGFR)、PTEN基因、丝裂原活化蛋白激酶1(MAPK1)、信号传导及转录激活因子3(STAT3)、血管内皮生长因子A(VEGFA)、丝裂原活化蛋白激酶14(MAPK14)和叉头框转录因子3(FOXO3),其degree值分别为128、116、97、96、88、88、88、78、76和73,并构建出核心靶基因PPI网络,显示了这10个核心靶基因组成的45对相互作用关系(图7)。
四、hsa-miR-21-5p的验证及诊断价值
对基因芯片检测样本的hsa-miR-21-5p相对表达量进行qRT-PCR验证,发现TBM患者hsa-miR-21-5p的表达水平[15.890(3.423,25.581)]较VM患者[0.807(0.614,0.955)]明显上调(Z=-2.355,P=0.019),FC(TBM/VM)在基因芯片和qRT-PCR中分别是4.817和4.660,两种检测方法结果基本一致。
进一步对28例TBM和27例VM患者的hsa-miR-21-5p进行qRT-PCR结果比较,发现hsa-miR-21-5p在TBM患者的相对表达量为4.825(2.433,21.362),明显高于VM患者[0.204(0.112,0.711)],差异有统计学意义(Z=-5.000,P=0.000),且ROC曲线区分TBM与VM患者的AUC为0.893(0.806~0.980),敏感度为85.7%,特异度为88.9%(图8)。
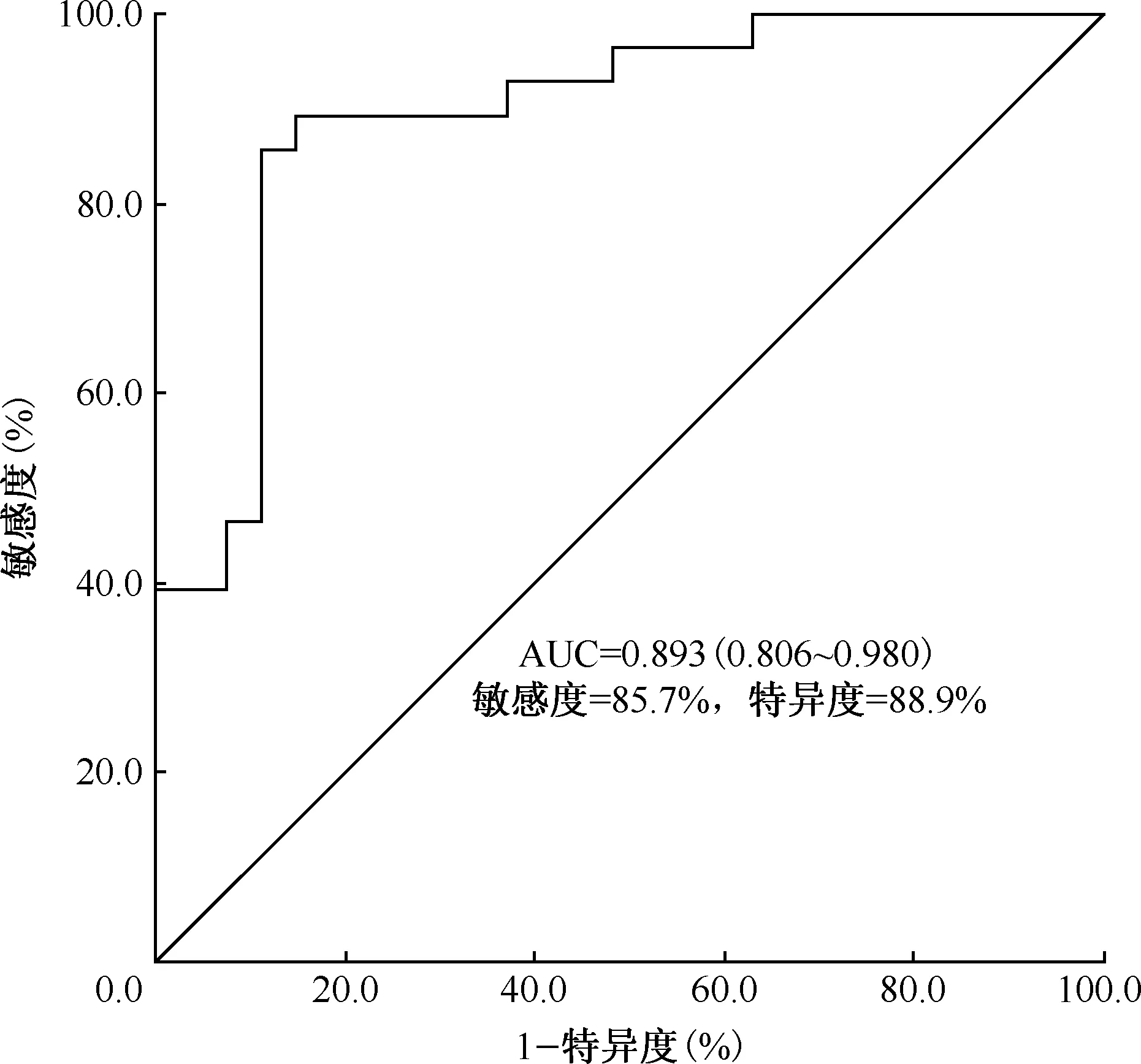
图8 hsa-miR-21-5p区分结核性脑膜炎和病毒性脑膜炎的受试者工作特征曲线
讨 论
当前,TBM的临床诊断仍然具有明显的挑战性,尤其是存在TBM与其他感染性脑膜炎鉴别困难,如细菌性脑膜炎、真菌性脑膜炎(主要是隐球菌性脑膜炎)和VM。细菌性脑膜炎在成年患者中的发病率较低,且抗生素应用效果良好。隐球菌性脑膜炎多发生在HIV感染者群体,且有较好的检测方法[9]。因此,TBM与这两种疾病的鉴别诊断并不复杂。但是,由于TBM和VM患者的CSF具有较多相似的特征,如CSF外观清晰、典型病原体培养阴性、白细胞计数正常和以单核细胞为主的细胞增多等,导致TBM与VM的鉴别诊断更加困难,迫切需要新的鉴别诊断指标[10]。由于miRNA具有高度保守性、组织特异性、反复冻融且不易降解的稳定性和易于检测等特征[11-13],已被认为是很有前景的候选生物标志物。基于此,本研究探索有助于区别TBM与VM可能的miRNA检测生物标志物。
目前,仅发现少量集中于TBM特异性miRNA的筛选和验证的研究[14-18]。这些研究大多是研究TBM患者CSF外泌体或外周血中特定miRNA与对照组之间的表达差异,或以血浆为研究对象开展miRNA特异表达谱分析研究,或仅筛选了TBM患者与健康对照组之间CSF中有差异的miRNA,但目前临床上主要存在TBM与其他感染性脑膜炎的鉴别困难,尤其是与VM更难以区分。因此,以往验证的部分miRNA虽然在TBM患者中的表达水平明显高于或低于健康对照,但这些miRNA在临床中的实际应用会相对有限。另外,相比于血浆和外周血,CSF是TBM病灶部位的直接相关体液,且不同体液中miRNA的表达谱存在一定的差异,认为直接检测TBM患者CSF中的miRNA表达水平变化可能对疾病诊断更具有意义[19],故本研究结果对鉴别TBM和VM具有较好的临床应用价值。
本研究通过基因芯片技术对TBM和VM患者CSF样本进行全基因组miRNA微阵列分析,筛选出26个差异性表达的miRNA,其中有14个miRNA表达上调,12个miRNA表达下调,揭示了TBM与VM之间miRNA表达谱的差异,发现miR-21-5p在TBM患者中表达显著上调,为TBM与VM的鉴别诊断提供了一个新的潜在的生物标志物。GO富集分析显示,这些miRNA的靶基因与转录调控、凋亡过程的负调控和蛋白质的泛素化作用等生物过程相关。细胞凋亡是机体抗结核免疫反应的重要过程,通过阻止细胞内MTB的释放、限制其传播以达到保护机体的作用[20]。本研究结果显示,TBM患者的细胞凋亡过程受到了抑制,可能会导致MTB的免疫逃逸,进而促进疾病的进展。在MTB感染过程中,蛋白质泛素化显示出了双重作用,表现为MTB与宿主泛素结合以抑制宿主的固有免疫,而泛素化现象又可以被宿主利用来针对MTB进行异源吞噬[21]。KEGG信号通路分析显示,这些靶基因主要富集于癌症相关通路、PI3K-Akt信号通路和MAPK信号通路等,且有190个靶基因富集于免疫反应、炎症或神经营养素相关通路。
众所周知,TBM疾病的发生发展与机体的免疫炎症反应和神经系统损伤密切相关。笔者通过PPI网络分析进一步筛选出前10个核心靶基因,分别是AKT1、TP53、MYC、EGFR、PTEN、MAPK1、STAT3、VEGFA、MAPK14和FOXO3,提示这些靶基因可能在TBM疾病发生发展中起着重要作用。其中,PTEN、STAT3和FOXO3已经显示出在结核免疫反应中产生一定的作用,如PTEN可能通过抑制PI3K/Akt/核因子κB(NF-κB)通路降低NF-κB的活性,抑制促炎细胞因子的释放[22],也可能通过抑制PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mTOR)途径下调自噬,提高细胞内细菌的存活率[23]。而STAT3可调节辅助性T 细胞17(Th17)的发育和功能,从而产生抗结核细胞免疫反应[24];而且,STAT3的下调可以抑制维生素D受体(VDR)相关环磷酸腺苷(cAMP)通路下游的多条抗分枝杆菌通路及白细胞介素32(IL-32)、诱导型一氧化氮合酶(iNOS)和自噬机制[25]。最后,FOXO3通过参与调节树突状细胞和T细胞及巨噬细胞的多种免疫功能来达到抗结核作用[26]。Lu等[27]发现FOXO3中rs12212067基因的G等位基因可能影响FOXO3的表达,从而影响活动性肺结核患者的结核病进展。另外,MAPK1与PI3K/Akt信号通路有关,该通路在免疫系统反应中具有不同的调节和效应功能[28]。VEGF是最重要和有效的血管生成刺激物,与缺血、创伤、肿瘤和感染相关的脑水肿的发生机制有关[29]。Misra等[30]发现脑梗塞与TBM患者CSF中VEGF浓度的相对增加有关。其他AKT1、TP53、MYC主要与癌症的发生发展相关,在结核病中的作用有待进一步研究。
近年来,miR-21在非小细胞肺癌、结核病、肺炎和其他肺部疾病中得到了广泛的研究[31]。Kathirvel等[32]发现,miR-21在活动性结核病患儿血浆中的表达水平明显高于健康对照组。Wang等[33]发现,初治肺结核患者血清中miR-21-5p表达水平较健康对照组明显升高,且治愈肺结核患者较初治肺结核患者的miR-21-5p水平明显降低。因此,可以认为miR-21在结核病中高表达。同样,本研究也发现,在TBM患者CSF中miR-21-5p的表达水平明显高于VM患者。Wu等[34]证明miR-21通过抑制IL-12表达来抑制宿主Th1对MTB的应答,并与B细胞淋巴瘤2(Bcl-2)相互作用诱导巨噬细胞凋亡。Zhao等[35]证明miR-21-5p可通过靶向MTB感染的巨噬细胞中的Bcl-2和Toll样受体4(TLR4)抑制细胞活力,促进细胞凋亡和MTB存活,抑制IL-1b、IL-6和肿瘤坏死因子α(TNF-α)的分泌。这提示miR-21-5p在MTB诱导的炎症反应中起着重要的调节作用。本研究通过qRT-PCR进一步分析了miR-21-5p在TBM与VM中的表达情况,发现miR-21-5p具有一定区分TBM与VM患者的能力,其诊断TBM的AUC为0.893(0.806~0.980),敏感度为85.7%,特异度为88.9%,提示miR-21-5p具有作为TBM鉴别诊断生物标志物的潜在价值。
本研究也存在一定局限。首先,由于TBM较低的确诊率限制了本研究招募的患者数量,研究结论需更大样本量的进一步验证。其次,研究通过基因芯片分析筛选出TBM与VM患者间存在的26个差异性miRNA,与既往发现的差异性miRNA重叠较少,可能是研究样本不同,或是所选取的对照人群不同所导致,但qRT-PCR验证与基因芯片筛选所获得的miR-21-5p在两病间的表达趋势和FC值基本一致,可说明基因芯片结果的可靠性。再者,进一步的验证研究仅选择了目前在多种疾病中较充分研究的miR-21-5p开展,并不能否定其他miRNA的潜在性能,其他miRNA的诊断价值仍有待进一步研究。
综上所述,本研究揭示了TBM与VM之间miRNA表达谱的差异性,并进一步验证了miR-21-5p在TBM中的诊断价值。这些结果不仅为鉴别TBM和VM提供了一个新的潜在的生物标志物,也为更好地了解TBM的发病机制提供了帮助。
