絮凝菌的筛选及乳制品废水培养条件优化
2022-03-13陈令薇马振林
魏 炜,陈令薇,马振林,崔 鹏
(沈阳建筑大学市政与环境工程学院,辽宁 沈阳 110168)
微生物絮凝剂(Microbial flocculant,MBF)是由絮凝微生物(Flocculating Microorganism,FM)即微生物絮凝剂产生菌在生长过程中产生的具有絮凝性能的天然高分子化合物[1]。MBF与无机絮凝剂、有机絮凝剂相比具有安全、廉价、高效、无毒、易生物降解、无二次污染等优点,是新型绿色环保水处理絮凝剂,应用前景广阔[2]。但由于FM的培养成本较高,导致了MBF的生产成本较高,发展受到一定程度的限制,还未达到大规模工业化生产和应用阶段,仍需不断地深入研究。因此,可利用有机废水作为培养基,降低生产成本,筛选高效FM。随着人们对身体健康的重视,乳制品的需求量在逐渐增加,其废水量也在快速增长。因此,笔者以乳制品废水作为廉价培养基筛选高效FM,并对其进行紫外诱变后再次筛选优势菌,并对其培养条件进行优化,旨在降低微生物絮凝剂的生产成本的同时筛选出更稳定的优势菌种,使得制备出的微生物絮凝剂活性更高更稳定,以废治废、变废为宝。
1 试 验
1.1 乳制品废水
乳制品废水主要来源于乳制品生产车间的容器、管道、设备的清洗水,可视为乳制品的稀释液,属于高浓度有机废水,主要污染成分为乳脂肪、乳蛋白以及乳糖等,其COD质量浓度通常在2 000~3 000 mg/L。
1.2 菌种来源
菌源取自沈阳建筑大学校园稻田土壤,沈阳市上夹河污水厂活性污泥。
1.3 培养基
种子培养基[3]:蒸馏水1 000 mL、葡萄糖10 g、尿素0.5 g、酵母膏0.5 g、NaCl 0.1 g、KH2PO42 g、K2HPO45 g、MgSO4·7H2O 0.2 g、pH为7.0,在121 ℃下灭菌30 min.添加15 g琼脂即为固体分离培养基。发酵培养基:乳品废水(COD质量浓度为2 875 mg/L)、尿素0.5 g、K2HPO45 g、KH2PO42 g、pH为7.0,在121 ℃下灭菌30 min。
1.4 试验方法
1.4.1 菌株的富集培养及分离
在无菌条件下,取采集到的样品于无菌水中,充分振荡后稀释至适宜浓度的菌悬液,并采用平板涂布法在分离培养基上进行接种。在30 ℃下倒置于恒温培养箱中培养24~48 h。用接种环挑取不同形态的单个菌落进行划线分离、纯化培养。将其接种于保藏培养基上,在4 ℃冰箱内保存备用。
1.4.2 菌株的初筛、复筛
在无菌条件下,用接种环从保藏培养基上挑取适量菌接种在装有100 mL种子液的锥形瓶中,放置在30 ℃,150 r/min的恒温振荡培养箱下培养24 h,获得菌株的种子液。在发酵培养基中加入适量种子液,放置在30 ℃,150 r/min的恒温振荡培养箱下培养48 h。吸取菌株的发酵液加入到装有高岭土悬浊液的锥形瓶中振荡,静置后进行菌株初筛,选取能产生沉淀或者层状或者片状的聚集物的菌株。进行复筛,通过测定絮凝率,选择絮凝效果较好的菌株。
1.4.3 絮凝率的测定
吸取2 mL菌株的发酵液加入到100 mL质量浓度为5 g/L的高岭土悬浊液中,再加入质量分数为1%的CaCl2溶液5 mL作为助凝剂,振荡20 min,静置10 min.取上清液于分光光度计550 nm处测定其吸光度值。同时,以未接种的发酵培养基作对照空白,在550 nm处测定吸光度值,并计算其絮凝率:
E=(A0-A1)/A0×100%.
(1)
式中:E为絮凝率,%;A0为空白对照组上清液的吸光度;A1为加入发酵液絮凝之后上清液的吸光度。
1.4.4 紫外诱变
生长曲线测定[4]:采用比浊法测定产絮菌的生长曲线。在30 ℃下,将筛选得到的优势菌活化培养,按照体积分数为5%的接种量接种到液体牛肉膏蛋白胨培养基中培养,前24 h每2 h取一次样,后每隔6 h取一次样。以未接种的培养基(采用相同的方法进行灭菌和培养)作为对照组,使用分光光度计在波长600 nm处测定吸光度值(OD600)。以OD600来表示产絮菌的生长曲线,确定菌株的生长对数期。
将筛选得到的絮凝率较好的菌株培养至对数生长期,用无菌水将稀释到1×10-6,取5 mL菌悬液于培养皿内,置于距紫外灯下方30 cm处,分别照射0 s、20 s、40 s、60s、80 s、100 s、120 s、140 s,避光条件下4 ℃冷藏2 h后,取0.1 mL菌液涂布于固体培养基上,做3组平行样,于30 ℃下,避光培养2~3 d,通过平板计数,计算不同紫外诱变时间对原始菌株的致死率[5]:
Z=(B0-B1)/B0×100%.
(2)
式中:Z为致死率,%;B0为对照组的菌落数,个;B1为紫外线处理后的菌落数,个。
对致死率为70%~80%的菌株发酵培养后测定絮凝率,选取一株絮凝性能最佳的菌株作为目标试验对象。
2 结果与分析
2.1 菌株的分离筛选
从土壤、活性污泥中共筛出24株菌,初筛后得到11株有明显絮凝效果的菌株,经过复筛,发现从活性污泥中筛选得到的编号为C2菌株的絮凝效果最好,絮凝率可达76.23%。因此,试验研究以C2为目标对象。
2.2 生长曲线
图1为C2菌株的生长曲线。由图1可以看出,OD600值在0~6 h基本不变,此时菌株C2处于迟缓期;在6~24 hOD600值迅速增加,菌株C2进入对数生长期;在24~48 hOD600值保持稳定,此时菌株C2到达稳定期;48 h后OD600值逐渐下降,菌株C2开始进入衰亡期。选择对数生长期的菌株C2进行诱变可以增加其正向突变的概率。经试验,选定培养18 h后的菌株进行紫外诱变。

图1 C2菌株的生长曲线Fig.1 Growth curve of strain C2
2.3 紫外诱变筛选优良菌
适合的致死率有利于优良产絮菌的挑选,通常菌株紫外诱变的致死率在70%~80%时,可达到最佳的诱变效果[4]。图2为C2菌株紫外诱变致死率。由图可知,C2的致死率随着照射时间的增加逐渐上升,照射时间少于100 s,菌株C2致死率低于70%;照射时间多于100 s,菌株C2致死率高于80%,均不在最佳诱变范围内。在100 s时菌株C2的致死率为77.24%,为最佳诱变时间。将菌株C2在紫外灯下照射100 s后培养,并测定絮凝率,筛选出一株絮凝性能较好的菌株C2-5,絮凝率可达80.42%。
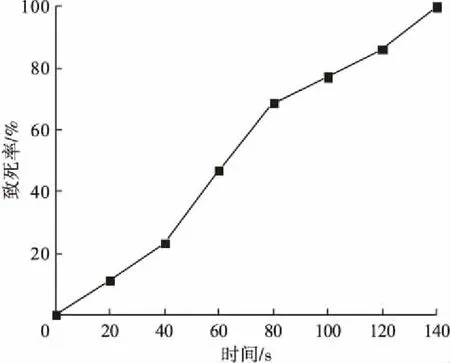
图2 C2菌株紫外诱变致死率Fig.2 UV mutagenic lethality of strain C2
2.4 产絮菌C2-5的发酵培养条件优化
2.4.1 外加不同量葡萄糖
通常大部分微生物对单糖的利用率更高,且单糖的成本较低。在微生物的发酵培养中,单糖中的葡萄糖是经常使用的外加碳源[6]。为了降低成本以及研究外加碳源对C2-5絮凝性能的影响,选定葡萄糖为外加碳源进行试验。按照2 g/L、4 g/L、6 g/L、8 g/L、10 g/L的质量浓度向乳制品废水中加入葡萄糖,其余培养条件不变,对其进行发酵培养并检测其絮凝性能。外加不同量葡萄糖对菌株C2-5絮凝率的影响如图3所示。

图3 葡萄糖对菌株C2-5絮凝率的影响Fig.3 Effect of glucose on the flocculation rate of strain C2-5
由图3可知,菌株C2-5的絮凝率随着葡萄糖质量浓度的提高小幅度的增加而后逐渐降低。投加质量浓度为4 g/L的葡萄糖时,絮凝率高达到81.54%,但增幅仅为1.12%,为降低经济成本,利用产絮菌C2-5制备MBF的过程中无需外加碳源。
2.4.2 外加不同量尿素
尿素是氮源中最有利于微生物生长繁殖以及MBF产生的物质。为了提高絮凝率,选定尿素为外加氮源进行试验。按照0.1 g/L、0.3 g/L、0.5 g/L、0.7 g/L、0.9 g/L的质量浓度加入尿素,其余培养条件不变,对C2-5发酵培养并检测其絮凝性能。外加不同量尿素对菌株C2-5絮凝率的影响如图4所示。

图4 尿素对菌株C2-5絮凝率的影响Fig.4 Effect of urea on flocculation rate of strain C2-5
由图4可知,随着尿素投加量的增加,菌株C2-5絮凝性能先提高后逐渐降低,说明均适量的氮源有利于产絮菌C2-5的生长以及MBF的合成。尿素质量浓度为0.5 g/L时,C2-5的絮凝率最佳,其值为84.58%。
2.4.3 外加不同量K2HPO4和KH2PO4
适量的磷酸盐有利于MBF的产生[7-8]。为了提升C2-5的絮凝性能,笔者以K2HPO4和KH2PO4为外加磷源进行试验。按照质量比为m(K2HPO4)∶m(KH2PO4)=2.5∶>1的比例添加磷源,按照3.5 g/L、7 g/L、10.5 g/L、14 g/L、17.5 g/L的质量浓度向乳制品废水中投加K2HPO4+KH2PO4,其余培养条件不变,对C2-5发酵培养并检测其絮凝性能。外加不同量K2HPO4+KH2PO4对菌株C2-5絮凝率的影响如图5所示。由图5可知,产絮菌C2-5絮凝性能随着K2HPO4+KH2PO4投加量的增加先上升后下降,当K2HPO4+KH2PO4质量浓度为7 g/L时,絮凝率达到85.13%,效果最佳。

图5 K2HPO4+KH2PO4对菌株C2-5絮凝率的影响Fig.5 Effect of K2HPO4+KH2PO4 on flocculation rate of strain C2-5
2.4.4 发酵培养pH值
试验采用浓度为1 mol/L的HCl和NaOH对乳制品废水的pH值进行调节。调节pH值为4、5、6、7、8、9,其余培养条件不变,对C2-5发酵培养并检测其絮凝性能。不同pH值对菌株C2-5发酵培养后的絮凝效果的影响如图6所示。

图6 pH值对菌株C2-5絮凝率的影响Fig.6 Effect of pH value on flocculation rate of strain C2-5
由图6可知,菌株C2-5的絮凝性能随发酵培养pH值的增加,呈现先增加后降低的趋势。pH值为7.0时,菌株C2-5的絮凝率最高,达到85.73%。pH值过低或过高的培养环境不利于C2-5对营养物质的吸收,影响其生长和MBF的产生,导致絮凝效果不佳。故培养基pH值为7.0时,菌株C2-5产MBF的条件最佳。
2.4.5 发酵培养时间
对菌株C2-5分别培养12 h、24 h、36 h、48 h、60 h、72 h,其余培养条件不变,其絮凝效果如图7所示。
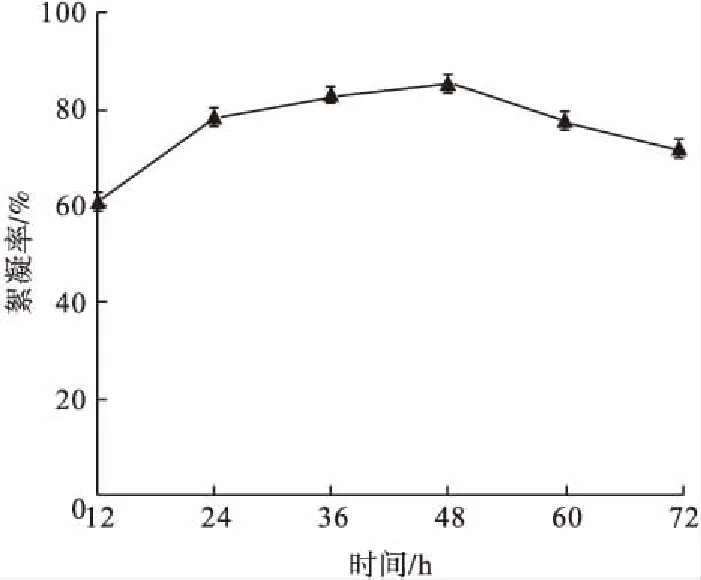
图7 发酵培养时间对菌株C2-5絮凝率的影响Fig.7 Effect of fermentation time on flocculation rate of strain C2-5
由图7可知,菌株C2-5随着发酵培养时间的增加,其絮凝性能也在提高,这可能是菌株C2-5充分吸收营养物质进行生长。菌株C2-5在36~48 h时间段内絮凝性能趋于稳定,在48 h时絮凝率达到85.47%,可能是C2-5菌体达到一定质量浓度,MBF产量逐渐稳定。48 h后,营养物质减少,菌株C2-5开始衰亡,MBF产量开始减少,其絮凝性能开始逐渐降低[9]。可见,合适的发酵培养时间利于菌体生长,C2-5的最佳发酵培养时间为48 h。
2.4.6 发酵培养温度
试验分别在温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃条件下,且保持其余培养条件不变,对菌株C2-5进行发酵培养。不同温度对C2-5絮凝能力的影响如图8所示。

图8 发酵培养温度对菌株C2-5絮凝率的影响Fig.8 Effect of fermentation temperature on flocculation rate of strain C2-5
由图8可知,在20~30 ℃温度内,絮凝率在不断提高,当培养温度在30 ℃时菌株C2-5的絮凝能力最强,絮凝率达到84.83%。说明了在一定范围内提升温度有利于C2-5的生长及其代谢物的产生,并且在最适温度下酶的活性可以达到最大。当温度高于时30 ℃,影响了C2-5产MBF,絮凝能力持续下降[10]。因此,30 ℃为菌株C2-5产絮的最佳发酵培养温度。
2.4.7 发酵培养转速
在转速分别为110 r/min、130 r/min、150 r/min、170 r/min、190 r/min条件下,且其余培养条件不变时进行试验。对C2-5絮凝能力的影响如图9所示。

图9 发酵培养转速对菌株C2-5絮凝率的影响Fig.9 Effect of fermentation speed on flocculation rate of strain C2-5
由图9可知,当发酵转速为150 r/min时,菌株C2-5的絮凝率最佳达85.72%。这是因为转速影响了培养过程的通气量以及溶解氧含量,发酵转速低于150 r/min时,会导致溶解氧含量较低,不利于菌株C2-5的生长;发酵转速过高于150 r/min时,培养基晃动剧烈,影响菌株C2-5吸取营养生长。这两种情况均会导致MBF产生量减少,以至于絮凝效果不佳[11]。因而,150 r/min为菌株C2-5产絮的最佳发酵培养转速。
2.4.8 发酵培养接种量
试验按照2%、4%、6%、8%、10%的接种量投加种子液,其余培养条件不变,对菌株C2-5进行发酵培养。不同接种量对菌株C2-5絮凝性能的影响如图10所示。从图10可知,合适的接种量有利于微生物的生长,并且能提高絮凝率[12-13]。接种量在2%~6%时,菌株C2-5絮凝能力不断增大,在6%时,絮凝率达到86.26%。接种量低于6%时,菌株C2-5在培养周期内不能达到适宜的菌体浓度,不利于MBF的积累;接种量高于6%时,菌株C2-5絮凝能力逐渐减弱,这可能是菌株C2-5初始浓度过高,吸收营养物质较快,影响了MBF的生成。因此,菌株C2-5产絮的最佳发酵培养接种量为6%。

图10 接种量对菌株C2-5絮凝率的影响Fig.10 Effect of inoculation concentration on flocculation rate of strain C2-5
3 结 论
(1)从校园稻田土壤和污水厂活性污泥中筛选出24株微生物絮凝剂产生菌,其中11株有明显絮凝效果。菌株C2的絮凝能力最强,絮凝率为76.23%。
(2)选择培养18 h的菌株C2进行紫外诱变,在紫外灯下照射100 s时,致死率达77.24%,为最佳诱变条件。并在该条件下筛选出一株高效产絮菌C2-5,絮凝率可达80.42%。
(3)通过单因素试验可得到诱变优势菌C2-5的最佳培养条件:外加质量浓度为0.5 g/L的尿素,质量浓度为5 g/L的K2HPO4,质量浓度为2 g/L的KH2PO4,pH值为7,发酵培养时间为48 h,发酵培养温度为30 ℃,发酵培养转速为150 r/min,接种量为6%。
