聚乙二醇洛塞那肽注射液联合二甲双胍片治疗肥胖2 型糖尿病的效果及对血清抗氧化因子、炎性因子的影响*
2022-03-12赵永强秦晓利田德增
赵永强,秦晓利,田德增
(1.濮阳市安阳地区医院内分泌科,河南 安阳 455000;2.安阳市疾病预防控制中心,河南 安阳 455000)
现如今,2 型糖尿病(Type 2 Diabetes Mellitus,T2DM)的发病率迅速增长,国际糖尿病联盟[l](International Diabetes Federation,IDF)发布的糖尿病流行病学调查显示,预计到2035 年,全世界将会有5.9 亿人口的DM 患者,共有4.7 亿人被诊断为糖耐量受损。据报道[2],2017 年,我国T2DM 的患病率已经攀升到了10.9%,患者总人数已达约1.16 亿,是全世界糖尿病患者最多的国家,可是该病的治愈率仅为25.8%,血糖的控制达标率仅为39.7%。糖尿病为全球公共卫生领域重大且复杂的疾病,具多基因遗传特征,其发病与老龄、饮食结构、肥胖等多因素相关,而胰岛β细胞损伤和胰岛素分泌缺乏为最根本原因。此外,研究显示[3],机体血清抗氧化因子[谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)]降低时,炎性因子[白介素-6(IL-6)、肿瘤坏死因子(TNF-α)、超敏C 反应蛋白(hs-CRP)]增高可损伤胰岛β 细胞功能,并对胰岛素结合受体后的信号传导形成干扰,进而引发胰岛素抵抗。二甲双胍作为一线首选和全程用药,因作用于肝脏,可抑制糖异生,减少肝糖输出,但随着病程延长,单用二甲双胍治疗对血糖控制效果欠佳,同时容易单药失效。聚乙二醇洛塞那肽注射液为去年国内上市的一种新型长效胰高糖素样肽-1 受体激动剂(GLP-1RAs),通过与胰岛β 细胞的GLP-1 受体结合促进胰岛素分泌和减少胰高血糖素分泌实现降糖,作用可达7 d,而联合二甲双胍,两药协同应用,可明显降低患者FPG 及2hPG 血糖。本研究主要探讨聚乙二醇洛塞那肽注射液联合二甲双胍片治疗肥胖2 型糖尿病的效果及对血清抗氧化因子、炎性因子的影响,现报道如下。
1 资料与方法
1.1 一般资料
从 我 院2020 年4 月—2020 年11 月 期 间 收治的糖尿病患者110 例作为研究对象,采用随机数表法分为观察组56 例和对照组54 例。观察组男29 例,女27 例;年龄36~61 岁,平均年龄(46.72±9.34)岁;病程1~3 年,平均病程(2.42±0.67)年。对照组男28 例,女26 例;年龄39~60 岁,平均年龄(47.89±8.95)岁;病程1~3 年,平均病程(2.38±0.70)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有研究者都签署知情同意书,并经过医院伦理委员会批准。
1.2 纳入及排除标准
纳入标准:①《中国2 型糖尿病防治指南》(2017 年版》[2]相关诊断标准符合;②肥胖,BMI(体质指数)≥28 kg/m2;③临床资料完整。排除标准:①1 型糖尿病、其他类型糖尿病、妊娠糖尿病及糖尿病严重急慢性并发症者,如糖尿病酮症酸中毒、高血糖、高渗性昏迷及低血糖昏迷等;②合并重要脏器严重功能不全者。
1.3 方法
对照组给予二甲双胍片(格华止国药准字H20023371,生产批号:ABM0206)口服治疗,850 mg/ 次、2 次/d。观察组在对照组基础上联合聚乙二醇洛塞那肽注射液(孚来美国药准字H20190024,生产批号:512191206)皮下注射治疗,0.2 mg/ 次,1 次/周。
1.4 观察指标
①比较两组治疗4、12 周血糖控制情况:包括空腹血糖(FBG)、餐后2 小时血糖(PBG)、糖化血红蛋白(HbA1c)、低血糖次数、体重、BMI、血脂;②比较两组治疗前及治疗4、12 周后血清因子抗氧化指标:包括GSH-Px、SOD、IL-6、TNF-α、hs-CRP;③比较两组治疗前及治疗4、12 周后胰岛β 细胞功能指标:对FBG、FINS(空腹胰岛素)检测,计数Homa-β(胰岛素分泌系数)和Homa-IR(胰岛素抵抗指数),公式为Homa-β=FBG×FINS/22.5,Homa-IR=20×FINS/(FBG-3.5)。
1.5 统计方法
选用SPSS 17.0 统计软件进行数据分析,符合正态分布的计量资料用(±s)表示,组间差异比较行t检验;计数资料用[n(%)]表示,组间差异比较行χ2检验;以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组血糖控制情况比较
治疗前,两组BMI、FBG、PBG、HbA1c、低血糖次数、TC、TG、LDL-C、HDL-C 比较,差异无统计学意义(P>0.05);观察组治疗4、12 周BMI、FBG、PBG、HbA1c、低血糖次数、TC、TG、LDL-C、HDL-C 均优于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者一般资料比较(±s)
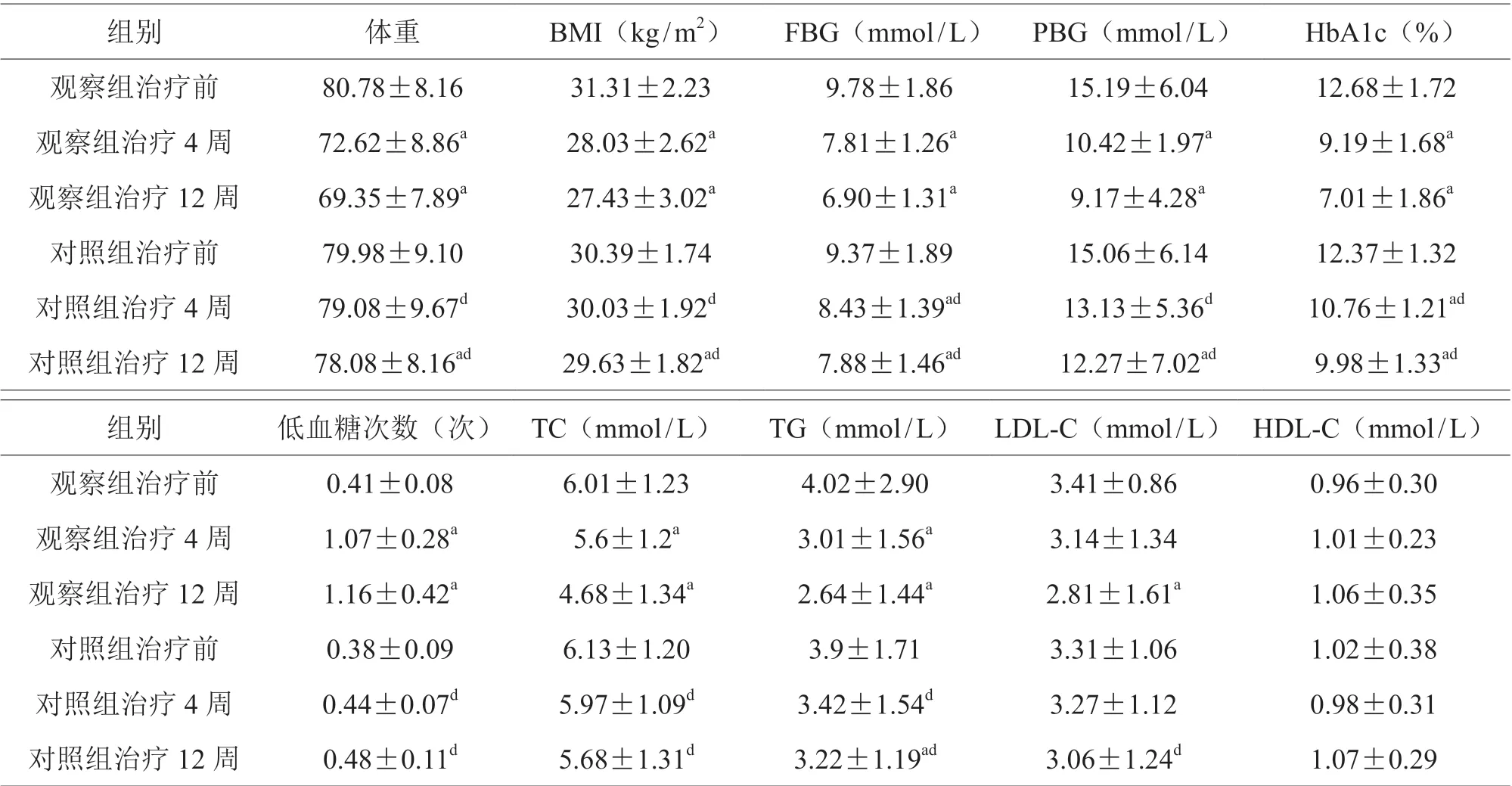
表1 两组患者一般资料比较(±s)
注:a 表示与治疗前比较,P<0.05;d 表示与观察组比较,P<0.05
组别 体重 BMI(kg/m2) FBG(mmol/L) PBG(mmol/L) HbA1c(%)观察组治疗前 80.78±8.16 31.31±2.23 9.78±1.86 15.19±6.04 12.68±1.72观察组治疗4 周 72.62±8.86a 28.03±2.62a 7.81±1.26a 10.42±1.97a 9.19±1.68a观察组治疗12 周 69.35±7.89a 27.43±3.02a 6.90±1.31a 9.17±4.28a 7.01±1.86a对照组治疗前 79.98±9.10 30.39±1.74 9.37±1.89 15.06±6.14 12.37±1.32对照组治疗4 周 79.08±9.67d 30.03±1.92d 8.43±1.39ad 13.13±5.36d 10.76±1.21ad对照组治疗12 周 78.08±8.16ad 29.63±1.82ad 7.88±1.46ad 12.27±7.02ad 9.98±1.33ad组别 低血糖次数(次) TC(mmol/L) TG(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L)观察组治疗前 0.41±0.08 6.01±1.23 4.02±2.90 3.41±0.86 0.96±0.30观察组治疗4 周 1.07±0.28a 5.6±1.2a 3.01±1.56a 3.14±1.34 1.01±0.23观察组治疗12 周 1.16±0.42a 4.68±1.34a 2.64±1.44a 2.81±1.61a 1.06±0.35对照组治疗前 0.38±0.09 6.13±1.20 3.9±1.71 3.31±1.06 1.02±0.38对照组治疗4 周 0.44±0.07d 5.97±1.09d 3.42±1.54d 3.27±1.12 0.98±0.31对照组治疗12 周 0.48±0.11d 5.68±1.31d 3.22±1.19ad 3.06±1.24d 1.07±0.29
2.2 两组血清抗氧化因子、炎性因子比较
治疗前,两组GSH-Px、SOD、IL-6、TNF-α、hs-CRP 水平比较,差异无统计学意义(P>0.05);治疗后,两组GSH-Px、SOD 较治疗前上升,IL-6、TNF-α、hs-CRP 较治疗前下降,且观察组优于对照组,差异有统计学意义(P<0.05), 见表2。
表2 两组血清抗氧化因子、炎性因子比较(±s)
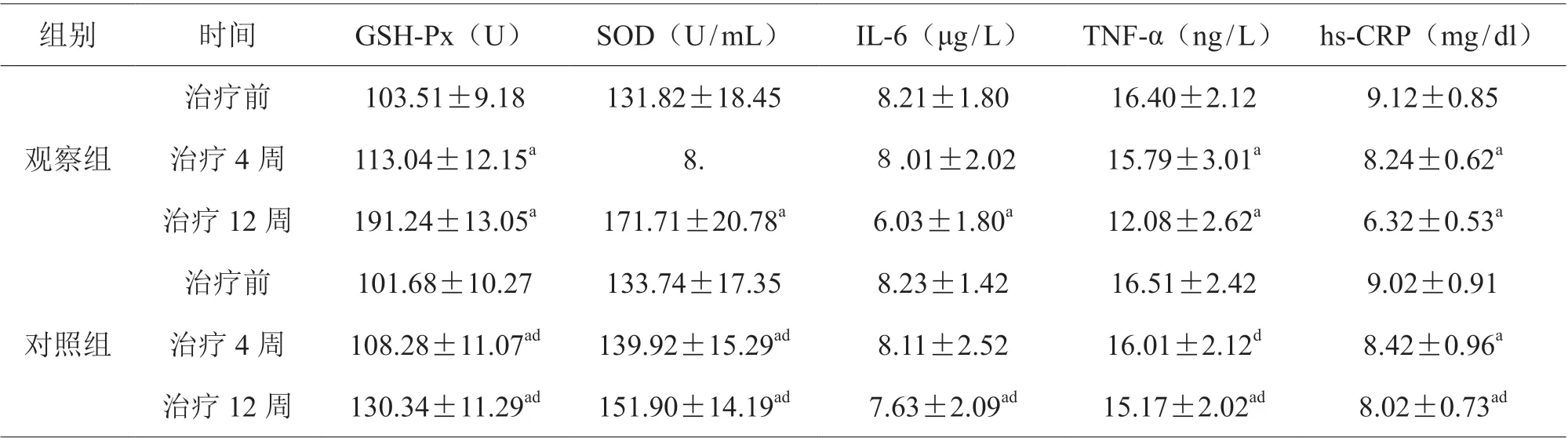
表2 两组血清抗氧化因子、炎性因子比较(±s)
注:a 表示与治疗前比较,P<0.05;d 表示与观察组比较,P<0.05
组别 时间 GSH-Px(U) SOD(U/mL) IL-6(μg/L) TNF-α(ng/L) hs-CRP(mg/dl)观察组治疗前 103.51±9.18 131.82±18.45 8.21±1.80 16.40±2.12 9.12±0.85治疗4 周 113.04±12.15a 8. 8.01±2.02 15.79±3.01a 8.24±0.62a治疗12 周 191.24±13.05a 171.71±20.78a 6.03±1.80a 12.08±2.62a 6.32±0.53a对照组治疗前 101.68±10.27 133.74±17.35 8.23±1.42 16.51±2.42 9.02±0.91治疗4 周 108.28±11.07ad 139.92±15.29ad 8.11±2.52 16.01±2.12d 8.42±0.96a治疗12 周 130.34±11.29ad 151.90±14.19ad 7.63±2.09ad 15.17±2.02ad 8.02±0.73ad
2.3 两组胰岛β 细胞功能指标比较
治疗前,两组Homa-β、Homa-IR 比较,差异无统计学意义(P>0.05);治疗后,两组Homa-β较治疗前上升,Homa-IR 较治疗前降低,且观察组优于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组胰岛β 细胞功能指标比较(±s)
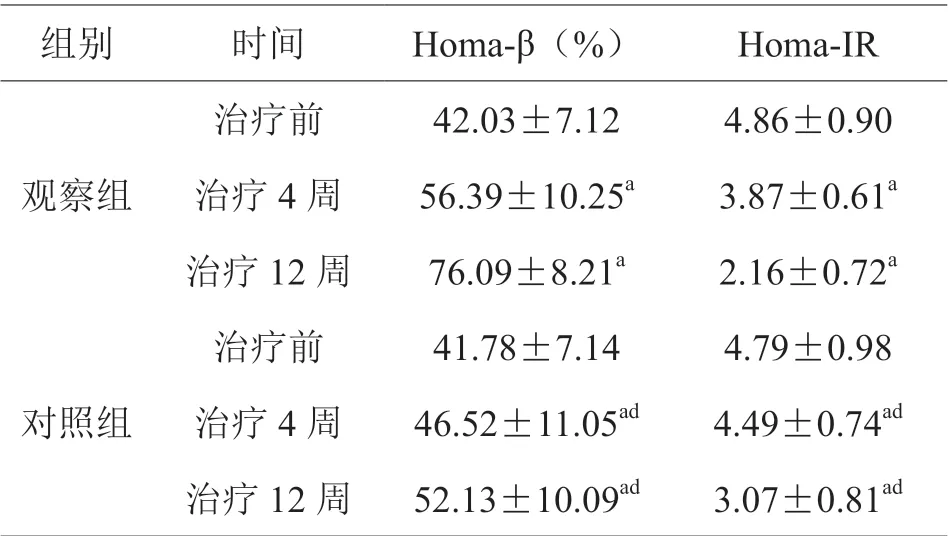
表3 两组胰岛β 细胞功能指标比较(±s)
注:a 表示与治疗前比较,P<0.05;d 表示与观察组比较,P<0.05
组别 时间 Homa-β(%) Homa-IR观察组治疗前 42.03±7.12 4.86±0.90治疗4 周 56.39±10.25a 3.87±0.61a治疗12 周 76.09±8.21a 2.16±0.72a治疗前 41.78±7.14 4.79±0.98治疗4 周 46.52±11.05ad 4.49±0.74ad治疗12 周 52.13±10.09ad 3.07±0.81ad对照组
3 讨论
3.1 2 型糖尿病治疗现状
2 型糖尿病伴肥胖患者,容易产生胰岛素抵抗、加速胰腺细胞凋亡,是脑血栓、冠心病等血管因素的重要危险因素,对患者健康水平及生命构成严重的威胁。多年来一直关注传统降糖药物,存在低血糖风险加大或体重增加等问题,且不能从根本上解决胰岛β 细胞衰竭,最重要的是无法改善心血管不良事件的发生率。聚乙二醇洛塞那肽注射液(孚来美)是豪森药业集团有限公司自主研发的,我国首个长效GLP-1 受体激动剂降糖药的周制剂,也是全球第一个聚乙二醇化的长效降糖药物,可以刺激胰岛素分泌,并降低胰高血糖素分泌,抑制胰岛β 细胞凋亡,改善胰岛素抵抗并减慢胃肠蠕动,从而增强饱腹感并促进体重减轻,但对长效GLP-1 受体激动剂如何调整血清抗氧化因子GSH-Px、SOD,炎性因子IL-6、TNF-α、hs-CRP,减少对胰岛β 细胞损害,研究较少,目前机制尚不明确,也是本研究的初衷。
3.2 联合用药对血糖、血脂优势
本研究结果显示,观察组治疗4、12 周BMI、FBG、PBG、HbA1c、 低 血 糖 次 数、TC、TG、LDL-C、HDL-C 优于对照组,差异有统计学意义(P<0.05),说明观察组治疗较对照组治疗能带来明显优势,观察组随着疗程的延长(12 周),这种优势更加明显,体重减轻约11.43 公斤,糖化血红蛋白降低达5.67%,比单纯应用GLP-1RAs(约1.66%)降低糖化血红蛋白更明显,与其他GLP-1RAs 比较,聚乙二醇洛塞那肽注射液作用时间更长,半衰期为5.5~5.8 d,4 周血药浓度达稳态,降低餐后及糖化血红蛋白作用明显[3]。虽然观察组低血糖发生率较对照组偏高,但都是轻微低血糖,未发生严重低血糖,这受益于GLP-1RAs 以葡萄糖依赖的方式降低血糖,即血糖水平越高,GLP-1RAs 促进胰岛素分泌的作用越大,当血糖下降至4.4 mmol/L 时,GLP-1RAs 就不再刺激胰岛素分泌,单独应用不引起低血糖,安全性较高。除降糖作用较强外,其还可改善体重、血脂,因GLP-1RAs 存在于肠道中,抑制胃肠蠕动延缓营养物质吸收,作用于中枢GLP-1R,因此可抑制食欲、减轻体重、调整血脂,特别是其具有减少内脏的脂肪的优势。另外,GLP-1RAs 存在于心肌细胞、血管内皮和动脉平滑肌细胞中,GLP-1RAs 通过各种机制减少动脉粥样硬化病变,改善内膜功能和心室收缩功能,减少梗死面积和改善冠状动脉缺血后左心室功能的变化[4]。
3.3 联合用药对抗氧化因子、炎性因子的影响
有研究显示[5],氧化应激为重要诱导胰岛细胞凋亡和引起胰岛素抵抗的因素。本研究中两组治疗后GSH-Px、SOD 较治疗前上升,IL-6、TNF-α、hs-CRP 较治疗前下降,且观察组优于对照组(P<0.05),表明聚乙二醇洛塞那肽注射液、二甲双胍片两药协同应用,可通过将抗氧化酶活性升高,降低炎性因子,来起到抗氧化应激效果,可使体内氧化应激程度降低,减轻细胞内皮损伤,与王薇等[6]研究报道一致,说明两种药联合可提升抗氧化、降低炎性因子对胰岛的损害,从而延缓胰岛凋亡。此外,本研究中两组治疗后Homa-β 较治疗前上升,Homa-IR 较治疗前降低,且观察组优于对照组(P<0.05)。Homa-β 是评估胰岛β 细胞功能的指标,测验结果与功能之间呈正相关;Homa-IR 可反映靶细胞抵抗胰岛素的程度,测验值与抵抗程度间呈正相关[7]。这两种胰岛β 细胞功能指标的改善,充分证明聚乙二醇洛塞那肽注射液、二甲双胍片两药协同作用减少胰岛素抵抗,增强机体对胰岛素敏感性,维持胰岛的正常功能。
综上所述,肥胖2 型糖尿病患者在二甲双胍片治疗的基础上,联合聚乙二醇洛塞那肽注射液可较好控制血糖,缩短病程,降低体重,改善血脂,无严重低血糖发生。同时,可提高抗氧化因子水平,降低炎性因子,减轻氧化应激,降低胰岛β 细胞损伤,提升Homa-β、降低Homa-IR,改善胰岛素抵抗,维持胰岛β 细胞功能,GLP-1RAs 长效制剂,增强了患者依从性,为病情控制创造了理想条件。
