热水处理对采后鲜食蚕豆荚褐变及活性氧代谢的影响
2022-03-11柳晓晨梁小环缪亚梅赵立艳王学军郑永华
柳晓晨 陈 宇 梁小环 缪亚梅 赵立艳 王学军 郑永华 金 鹏,*
(1 南京农业大学食品科技学院,江苏 南京 210095;2 江苏沿江地区农业科学研究所,江苏 南通 226541)
蚕豆(ViciafabaL.)是豆科野豌豆属农作物,既可以粮用又可作为经济作物。蚕豆丰产性优良,喜潮湿环境,在我国西南地区及长江流域地区多有栽培[1]。蚕豆种子营养丰富、口感鲜美,其中蛋白质含量高达25%~35%[2]。长江流域地区蚕豆通常在4月下旬至5月中旬成熟并采收,大部分以鲜荚形式进入市场。豆荚品质是整体果实状态的直观表现,良好的豆荚外观是消费者购买的首要因素。采后果实呼吸代谢旺盛且豆荚脆嫩极易褐变失水、由绿转黄,导致市场上鲜食蚕豆的货架期十分短暂,限制了蚕豆的鲜销市场。
目前蚕豆保鲜的研究主要集中于种子保鲜及微加工[3-4]。随着蚕豆产业调整及市场需求增加,传统弃豆荚只取干种子的单一模式已不能满足现代饮食营养需求,鲜食蚕豆越来越被大众所追捧,低温和壳聚糖技术为鲜食蚕豆保鲜提供了思路,但也存在着易发生冷害、处理过程繁琐等问题[5-6]。因此,提高蚕豆果实在常温条件下的耐贮性是应对市场新需求且急需解决的问题。
近年来,人们对食品营养与健康的重视程度不断提升,热处理凭借安全绿色、简便高效的优点再次成为保鲜领域的研究热点。研究表明,热处理技术可以维持农产品品质,提高抗氧化能力以及延缓衰老的作用已在枇杷[5-7]、西蓝花[8]、西葫芦[9]、双孢蘑菇[10]上得到证实,在鲜食蚕豆保鲜中尚鲜见报道。因此,本试验以鲜食蚕豆为材料,研究45℃热水处理10 min对蚕豆豆荚在常温贮藏条件下褐变、活性氧代谢以及对豆粒品质的影响,旨在为鲜食蚕豆提供有效的保鲜策略。
1 材料与方法
1.1 材料与试剂
以江苏南通启东生产的通蚕(鲜)6号蚕豆果实为材料,采摘后3 h内在常温条件下运送到位于南京的实验室。将蚕豆果实平铺于试验台,排除有机械伤及病虫害的果实并散去田间热,挑选外形优质、成熟度均一的果实进行试验。
氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)、核黄素、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl- 2-dinitrophenylhydrazine,DPPH),南京杰汶达试剂试材有限公司;5,6-二氨基-1,10-邻菲罗啉、牛血清蛋白、对氨基苯磺酸、考马斯亮蓝G-250,北京索莱宝生物科技有限公司;甲硫氨酸、愈创木酚、浓氨水(分析纯)、丙酮(分析纯)、乙醇(分析纯)、过氧化氢(分析纯)、硫代巴比妥酸、Folin酚试剂(BR级,1 mol·L-1)、 硫酸钛,国药集团化学试剂有限公司。
1.2 仪器与设备
DK-S26电热恒温水浴锅,上海森信实验仪器有限公司;FA1204B分析天平,赛多利斯科学仪器(北京)有限公司;MIR-253三洋恒温培养箱,上海恒逸实业有限公司;HZ602A电子天平,慈溪红钻衡器设备有限公司;H1850R台式高速冷冻离心机,湘仪离心机仪器有限公司;UV-1600分光光度计,上海美普达仪器有限公司。
1.3 试验方法
1.3.1 样品处理 将蚕豆果实随机分为两组,每组300个,分别进行以下处理:对照组(CK):将果实置于常温水(20℃)中浸泡10 min;热水处理组(HW):将果实置于45℃热水中浸泡10 min。取出浸泡过的果实平铺在桌面,留有一定空隙,自然晾干水分,用聚氯乙烯塑料保鲜袋进行分装,每袋放置20个果实。预先设置温度20±1℃(模拟常温市场条件)、相对湿度75%~80%的恒温箱,并将分装好的试验材料同时放入恒温箱。分别在贮藏0、2、4、6、8 d各取3袋样品,观察统计豆荚的褐变指数,对剥出的豆粒进行好粒率测定,同时将豆荚样品用液氮快速冷冻后保存在-20℃冰箱,用于测定Vc含量、叶绿素含量、丙二醛(malondialdehyde,MDA)含量、多酚氧化酶(polyphenol oxidase,PPO)活性、过氧化物酶(peroxidase,POD)活性、总酚含量、超氧阴离子生成速率、过氧化氢(hydrogen peroxide,H2O2)含量、DPPH自由基清除率、羟基自由基清除率以及活性氧相关酶活性。将豆粒样品液氮快速冷冻并保存于-20℃冰箱,用于后续测定Vc含量、叶绿素含量和蛋白含量。测定均进行3次重复。
1.3.2 褐变指数的测定 以豆荚表面褐变所占面积为标准,将果实分级:豆荚无褐变发生划分至0级褐变;豆荚褐变面积处于0%~20%划分至1级褐变;豆荚褐变面积处于20%~40%划分至2级褐变;豆荚褐变面积大于40%划分至3级褐变。褐变指数按公式(1)计算[11]:

(1)
1.3.3 PPO、POD活性和总酚含量的测定 PPO活性的测定参考Guo等[12]的方法。PPO活性单位定义为最终溶液体系在420 nm波长下每分钟吸光度变化0.01所需的酶量,以U·g-1FW(fresh weight,鲜重)表示。
POD活性的测定参考Srivastava等[13]的方法。POD活性单位定义为最终溶液体系在470 nm波长下每分钟吸光度变化0.001所需的酶量,以U·g-1FW表示。
总酚含量的测定参考福林酚法[14]。在室温条件下于765 nm波长处测定最终体系的吸光度,结果以mg·g-1FW表示。
1.3.4 Vc和叶绿素含量的测定 参考Denoya等[15]的方法测定Vc含量并略有修改。测定最终溶液在534 nm波长处的吸光值,利用抗坏血酸标准液制作标准曲线并计算样品中抗坏血酸的含量,结果以mg·100 g-1FW表示。
叶绿素含量的测定参照王晓等[16]的方法,记录最终溶液分别在649 nm和665 nm波长处吸光值,并根据公式(2)、(3)、(4)计算叶绿素含量,单位为mg·g-1FW。
Ca=13.95×A665-6.88×A649
(2)
Cb=24.96×A649-7.32×A665
(3)
(4)
式中,Ca、Cb分别代表叶绿素a、b的质量浓度,mg·L-1;CChl代表总叶绿素含量,mg·g-1FW;V为样品提取液体积,mL;m为样品质量,g。
1.3.5 蚕豆种子好粒率、蛋白质含量的测定 依据种子外观情况,出现任何褐变及腐烂症状均判定为坏粒,无明显外观瑕疵为好粒。按公式(5)计算好粒率:

(5)
采用考马斯亮蓝法[16]测定种子蛋白质含量。将最终反应液放置于595 nm波长处测定对应的吸光度数值,根据公式(6)计算蛋白质含量,单位为mg·g-1。

(6)
式中,V为样品提取液总体积,mL;VS为测定时所取样品提取液体积,mL;m′为标曲查得蛋白质质量,μg;m为样品质量,g。
c=6.45×(A2-A3)0.65×A1
(7)

(8)
式中,c为MDA含量,μmol·L-1;V为样品提取液总体积,mL;VS为测定所用上清液体积,mL;m0为样品质量,g。

参考Sabban-Amin等[18]的方法并略作修改测定H2O2含量。以预冷丙酮为提取液对豆荚(2 g)进行低温研磨提取上清。取最终体系在410 nm波长处测定吸光度值并计算含量,结果以μmol·g-1FW表示。
1.3.7 活性氧代谢相关酶活性的测定 超氧化物歧化酶(superoxide dismutase,SOD)活性的测定参考氮蓝四唑光还原法[19]。酶活性单位定义为560 nm波长处氮蓝四唑的光化还原反应每分钟抑制50%所需的酶量,结果表示为U·g-1FW。
过氧化氢酶(catalase,CAT)活性的测定参考Shi等[19]方法并稍作修改。酶活性单位定义为最终体系的吸光度在240 nm波长处每分钟变化0.01所需的酶量,结果表示为U·g-1FW。
抗坏血酸过氧化物酶(ascorbate peroxide,APX)参照Yao等[20]的方法略作改动。酶活性单位定义为反应液在290 nm波长处每分钟吸光度变化0.001所需的酶量,结果表示为U·g-1FW。
1.3.8 DPPH自由基清除率和羟基自由基清除率的测定 依据邵霜等[21]的方法进行DPPH自由基清除率的测定。以5 mL 50%乙醇提取2 g豆荚样品,低温条件下进行研磨及离心并获取上清液。反应体系分为3组:样品组:0.1 mL上清液,1.9 mL 120 μmol·L-1DPPH;对照组:0.1 mL上清液,1.9 mL 50%乙醇;空白组:0.1 mL 50%乙醇,1.9 mL 120 μmol·L-1DPPH。混合均匀后在暗处反应20 min,然后在525 nm波长处测定吸光度值,三组吸光度值依次记为A、B、A0。按照公式(9)计算清除率:
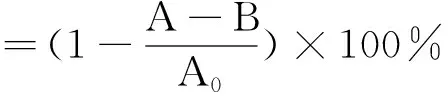
(9)
羟基自由基清除率的测定参照邵霜等[21]的方法。提取液同DPPH自由基清除能力。反应体系设置为:样品组:1.5 mL 180 mmol·L-1FeSO4、1.5 mL上清液、20 μL 0.1% H2O2、1.5 mL 180 mmol·L-1水杨酸;对照组:将上清液替换为提取液,其余不变。混合均匀后暗处进行37℃水浴30 min反应,然后在510 nm波长处测定吸光度值,两组吸光度值依次记为A、A0。按照公式(10)计算清除率:

(10)。
1.4 数据分析
各指标均进行3次重复测定,数据整理及分析采用Excel 2016与SAS软件完成,数据用平均值±标准差表示;选取Duncan多重比较法在0.05水平下对数据进行差异显著性分析;采用Origin 8.0软件进行制图。
2 结果与分析
2.1 热水处理对蚕豆荚表观情况和褐变指数的影响
由图1-A可知,常温贮藏8 d内的鲜食蚕豆荚表面褐变逐渐加重,热水处理组的豆荚褐变症状出现时间晚于对照组,且褐变程度轻于对照组。对照组豆荚第4天表面褐变情况明显,而经热水处理的鲜食蚕豆荚轻微褐变。贮藏第8天,对照组豆荚褐变情况加剧且出现腐烂症状,而热水处理组褐变症状明显较轻。由图1-B可知,蚕豆豆荚的褐变指数随着贮藏时间的延长逐渐升高,热水处理组豆荚的褐变指数始终低于对照组。贮藏第2天时,热水处理组(HW)与对照组(CK)的蚕豆都出现了褐变症状,褐变指数分别为3.70%和6.84%。与对照组相比,在贮藏第2、第6和第8天时,热水处理显著抑制了豆荚的褐变指数(P<0.05)。在贮藏结束时,热水处理组豆荚褐变指数为33.38%,对照组褐变指数为60.19%,差异显著(P<0.05)。说明热水处理可以显著抑制蚕豆豆荚贮藏过程中褐变的发生。
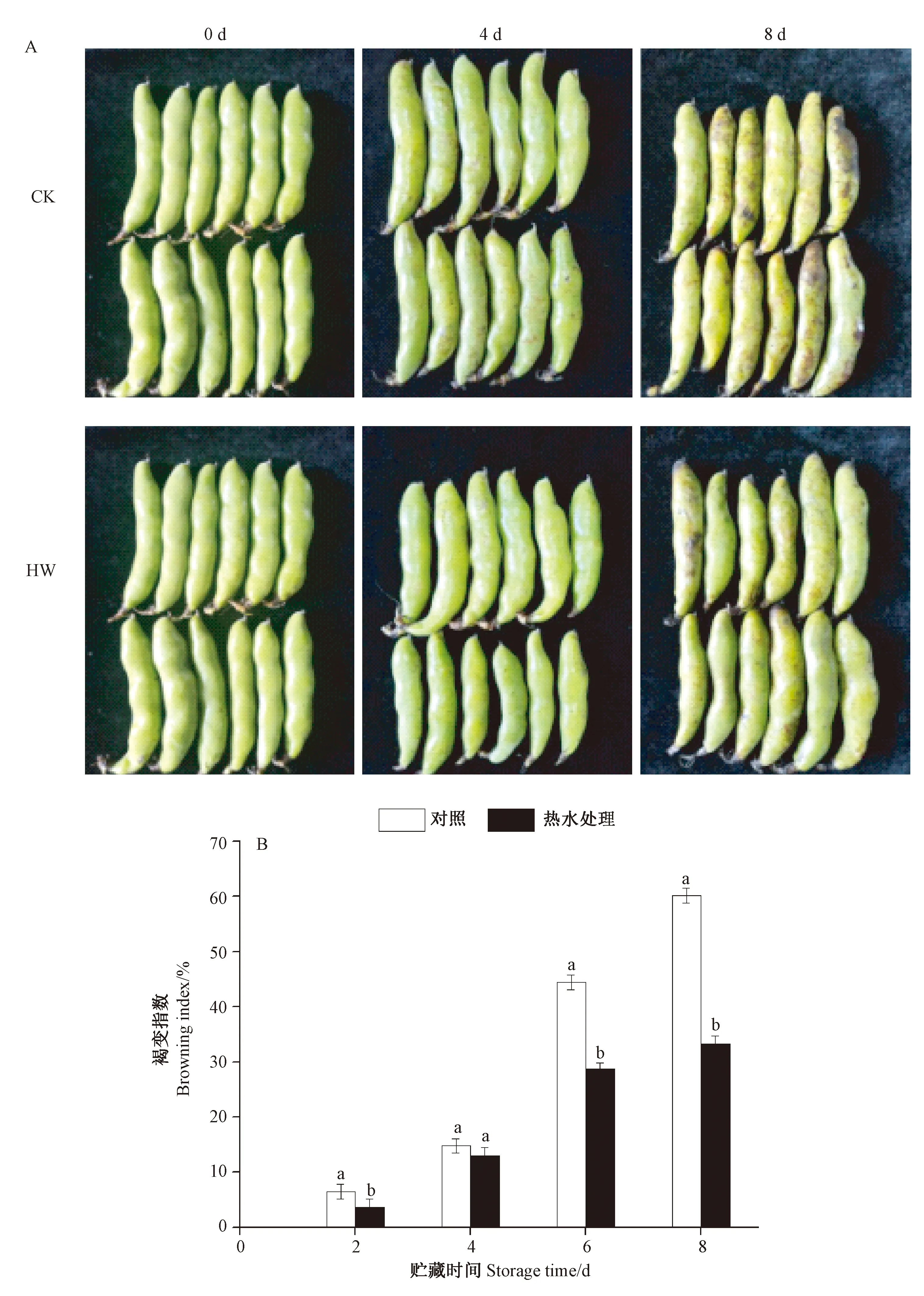
注: 同一时间下不同字母表示处理间差异显著(P<0.05)。下同。Note: Different letters at the same time indicate significant differences at 0.5 level among the treatments. The same as following.图1 热水处理对蚕豆荚的表观情况 (A) 和褐变指数 (B) 的影响Fig.1 Effect of hot water treatment on appearance and browning index of broad bean pods
2.2 热水处理对蚕豆荚Vc含量与叶绿素含量的影响
贮藏过程中蚕豆豆荚Vc含量变化情况如图2-A所示。对照组和热水处理组豆荚的Vc含量均呈现持续下降的趋势,但热水处理组豆荚的Vc含量始终高于对照组。在贮藏第8天时,热水处理组豆荚的Vc含量为5.02 mg·100g-1,对照组Vc含量为3.41 mg·100g-1, 差异显著(P<0.05),表明热水处理可以保持豆荚中的Vc含量。豆荚的叶绿素含量在贮藏期间不断减少(图2-B),热水处理组豆荚叶绿素含量在整个贮藏期间显著高于对照组(P<0.05)。在贮藏第8天时,热水处理组豆荚的叶绿素含量为0.06 mg·g-1FW,是对照组的1.25倍(P<0.05)。以上结果表明,热水处理能显著延缓Vc和叶绿素的降解。

图2 热水处理对蚕豆荚Vc含量 (A) 和叶绿素含量 (B) 的影响Fig.2 Effects of hot water treatment on Vc content (A) and chlorophyll content (B) of broad bean pods
2.3 热水处理对蚕豆荚PPO、POD活性和总酚含量的影响

图3 热水处理对蚕豆荚PPO(A)、POD(B)活性和总酚含量(C)的影响Fig.3 Effects of hot water treatment on PPO (A)、POD activity (B) and total phenolics content (C) of broad bean pods
PPO是果蔬中常见的一种褐变酶,与酚类物质发生褐变,降低果蔬的感官品质。POD在果蔬中可以清除活性氧自由基,参与褐变过程。如图3-A、B所示,鲜食蚕豆荚在贮藏期间的PPO与POD活性的变化趋势类似,总体呈先上升后下降趋势。贮藏第6天时,蚕豆豆荚PPO和POD活性达到最大值,热水处理组PPO和POD活性分别为74.02 U·g-1FW和48.76 U·g-1FW, 比对照组分别低了14.28%和18.68%,差异显著(P<0.05)。说明热水处理显著抑制了PPO和POD活性的上升。酚类物质是酶促褐变的主要底物。如图3-C所示,蚕豆豆荚总酚含量在贮藏前4 d迅速下降,第4至第8天下降趋势趋于平缓,而热水处理组总酚含量在贮藏期间显著高于对照组(P<0.05),说明热水处理组酚类物质的消耗量显著低于对照组。以上结果表明,热水处理显著抑制了PPO和POD对酚类物质氧化程度,从而减轻了豆荚褐变。
2.4 热水处理对蚕豆种子品质指标的影响
由表1可知,在常温贮藏8 d时,热水处理组鲜食蚕豆的种子好粒率为81.82%,显著高于对照组(P<0.05),是对照组的1.2倍。叶绿素是导致蚕豆种子呈现绿色的主要物质,Vc含量和蛋白质含量是蚕豆种子营养品质的关键指标。在贮藏末期,热水处理和对照组豆粒的叶绿素、Vc含量存在显著差异(P<0.05),而蛋白质含量无显著差异(P>0.05)。综上可知,45℃热水处理10 min能够保持鲜食蚕豆种子的好粒率,叶绿素及Vc含量,对蛋白质含量无显著影响。

表1 热水处理对常温贮藏8 d蚕豆种子品质指标的影响Table 1 Effects of hot water treatment on quality indexes of broad bean seeds stored at room temperature for 8 days
2.5 热水处理对蚕豆荚MDA含量、O2·-生成速率及H2O2含量的影响
MDA是一种与细胞膜脂过氧化相关的物质,其与细胞膜的完整性等因素密切相关。MDA含量增加,膜脂过氧化程度加剧,会导致细胞的衰老死亡加快。由图4-A可知,蚕豆豆荚贮藏期间MDA含量不断上升,而热水处理可以有效抑制MDA的积累。在贮藏结束时,热水处理组豆荚的MDA含量为0.31 nmol·g-1FW,比对照组低24.39%,差异显著(P<0.05)。如图4-B所示,蚕豆豆荚贮藏期间O2·-产生速率呈波动上升的趋势,贮藏第4和第8天时,O2·-产生速率较快,且热水处理组豆荚的O2·-产生速率显著低于对照组(P<0.05),分别为对照组的42.87%和77.62%。由图4-C可知,蚕豆豆荚H2O2含量在贮藏期间呈先上升后下降的趋势,在贮藏第6天达到最大值。热水处理组的H2O2含量在贮藏第2、第6和第8天显著低于对照组(P<0.05),说明热水处理组可以显著抑制鲜食蚕豆荚中O2·-产生速率和H2O2含量,减少活性氧的积累,从而减轻蚕豆的膜脂过氧化伤害。
2.6 热水处理对蚕豆荚SOD、CAT和APX活力的影响
如图5-A、B所示,蚕豆豆荚贮藏期间,SOD和CAT的活性均呈先上升后下降的趋势,在贮藏第2天达到最大值。整个贮藏期间,热水处理组豆荚的SOD活性始终显著高于对照组,而热水处理组CAT活性仅在贮藏第2至第4天显著高于对照组。在贮藏第2天时,热水处理组豆荚CAT活性是对照组的1.11倍,差异显著(P<0.05)。如图5-C所示,蚕豆豆荚APX活性在贮藏期间呈先上升后下降的趋势,并在贮藏第4天达到峰值。贮藏第2至第6天,热水处理组豆荚APX活性与对照组存在显著差异(P<0.05),贮藏第4天时,热水处理组APX活性为174.17 U·g-1FW, 是对照组的1.27倍,差异显著(P<0.05)。以上结果表明,与对照组相比,热水处理能够显著提高蚕豆荚中SOD、CAT和APX活性,从而增强活性氧的清除能力。
2.7 热水处理对蚕豆荚DPPH自由基清除能力和羟基自由基清除能力的影响
蚕豆豆荚贮藏期间DPPH自由基清除率整体呈先上升后下降的趋势(图6-A),于贮藏第4天达到峰值,且热水处理组蚕豆荚的DPPH清除率始终高于对照组,在贮藏第4至第8天期间差异显著(P<0.05)。贮藏结束时,热水处理组豆荚的DPPH自由基清除率仍保持较高水平,达到72.20%,对照组为68.35%,差异显著。如图6-B所示,贮藏期间热水处理组豆荚羟基自由基清除率呈先上升后下降的趋势,对照组在贮藏第0至第2天呈下降趋势,第2至第4天上升达最大值,第4天后下降。这可能是对照组贮藏初期豆荚中自由基含量较少,而在贮藏中期自由基的增加激发了豆荚的自由基清除能力。整个贮藏期间热水处理组的羟基自由基清除率始终显著高于对照组(P<0.05),在贮藏第4和第8天时,热水处理组的清除率分别比对照组高了6.81和3.11个百分点。表明热水处理可以有效保持高水平的DPPH自由基消除率和羟基自由基清除率,增强蚕豆豆荚的抗氧化能力。
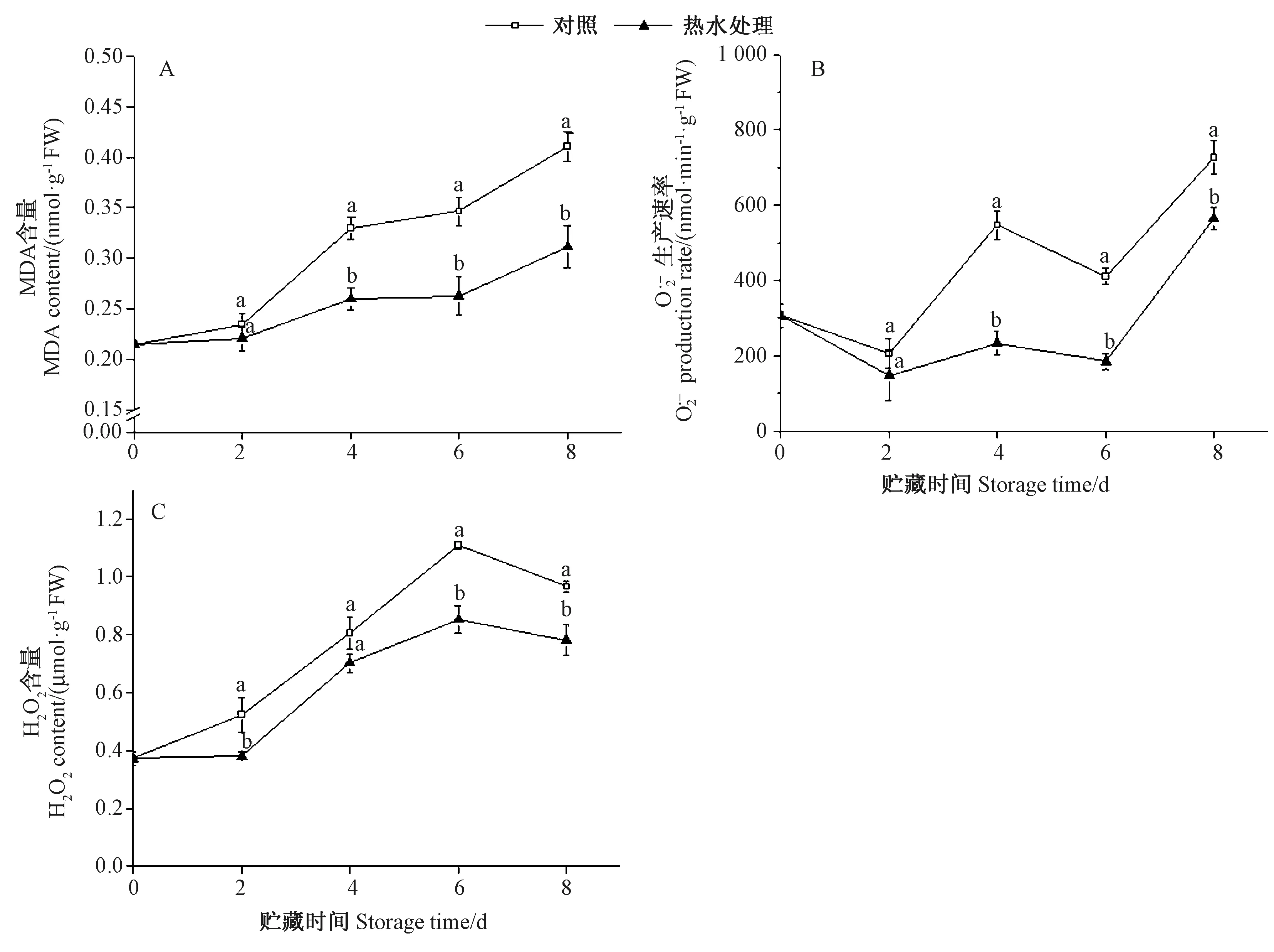
图4 热水处理对蚕豆荚MDA含量(A)、O2·-产生速率(B)和H2O2含量(C)的影响Fig.4 Effect of heat water treatment on MDA content (A)、O2·- production rate (B) and H2O2content (C) of broad bean pods

图5 热水处理对蚕豆荚SOD(A)、CAT(B)和APX(C)活性的影响Fig.5 Effect of heat water treatment on SOD (A)、CAT (B) and APX (C) activities of broad bean pods
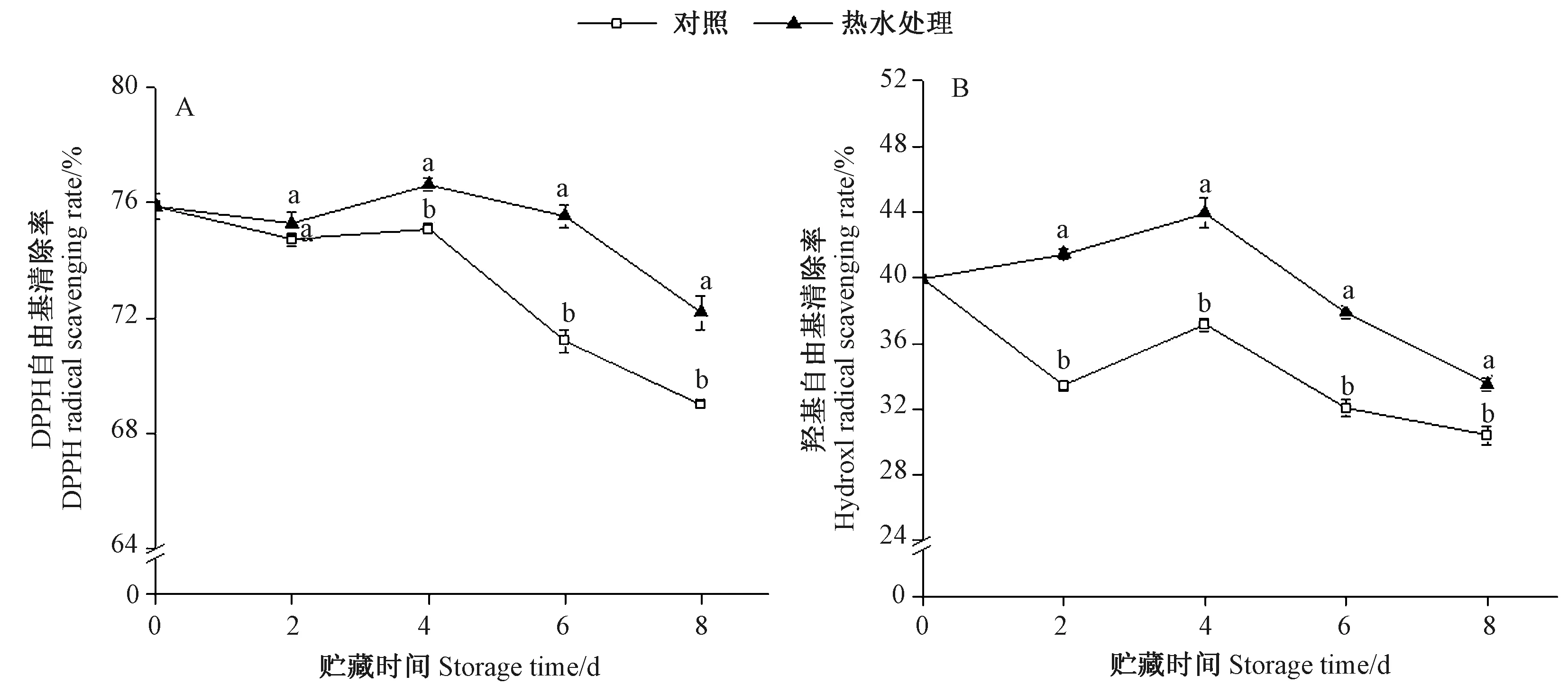
图6 热水处理对蚕豆荚DPPH自由基清除能力(A)和羟基自由基清除能力(B)的影响Fig.6 Effect of heat water treatment on DPPH radical scavenging capability (A) and hydroxyl radical scavenging capability (B) of broad bean pods
3 讨论
蚕豆在采后贮藏过程中易遭受生理与外界胁迫,导致多种酶促褐变和自由基活动加剧,加速蚕豆荚“锈斑”褐变和品质劣变。本试验发现,45℃热水处理10 min可以减轻蚕豆荚常温贮藏期间褐变的发生,保持较高的种子好粒率,同时维持豆荚和豆粒中较高的抗坏血酸和叶绿素含量,从而抑制蚕豆常温贮藏过程中的品质劣变。这与Kaewsuksaeng等[22]研究发现热处理能够显著抑制泰国柠檬果实叶绿素降解和酸度下降,从而维持酸橙较好的采后品质的结果类似。
酶促褐变属于果蔬生理贮藏性病害的一种,在果蔬贮藏中常表现为浅色组织出现褐色或原有的色泽转暗,如荔枝果皮褐变、槟榔心褐变等现象都属于酶促褐变范畴,不仅果实外观、风味会受到不良影响,而且营养价值和贮藏货架期也会大幅度下降[12, 23]。酶促褐变在果实遭受到外界胁迫如组织失水、渗透压失衡、不适温度等情况下,细胞膜系统的代谢异常透性增加,不同区室的褐变酶与底物酚类在氧存在的条件下产生醌类物质,进一步聚合或者与氨基酸、蛋白质反应都会导致果蔬褐变[24-25]。葛坤等[26]研究发现,热处理使外植体组培部分的总酚含量和PAL、PPO活性降低,明显抑制了大花蕙兰的褐变。此外,Min等[27]对莲藕褐变的研究发现,PAL、PPO和POD活性的增加会促进褐变的加剧。这些结果均表明,PPO、POD和总酚含量在植物褐变过程中发挥着重要作用。本研究结果也表明,热水处理显著降低了蚕豆荚中PPO和POD的活性,并且酚类物质的消耗量降低,这与热水处理抑制豆荚褐变指数的结果相一致。说明热水处理可以通过抑制PPO和POD的活性,减少底物酚类物质的消耗,从而抑制蚕豆豆荚常温贮藏期间褐变的发生。
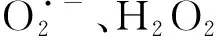
综上所述,45℃热水处理显著抑制了蚕豆荚的酶促褐变和氧化反应,抑制了蚕豆豆荚的褐变,维持了鲜食蚕豆的营养和品质。然而,热水处理对果蔬抗褐变和抗氧化能力之间的具体生理代谢复杂,需要从不同代谢途径及蛋白质、细胞分子水平等多领域进行深入研究探讨,以更好地为鲜食蚕豆的贮藏保鲜提供理论依据。
4 结论
本试验研究了45℃热水处理10 min对蚕豆荚采后褐变、活性氧代谢以及蚕豆种子营养品质的影响,结果表明,热水处理组显著降低了蚕豆荚的褐变指数、PPO和POD活性,减少了总酚消耗量,维持了蚕豆荚的抗坏血酸含量与叶绿素含量。同时,热水处理减少了豆荚中活性氧和MDA的积累,提高了抗氧化酶的活性、DPPH自由基和羟基自由基清除率。表明热水处理能通过增强豆荚的抗氧化酶活性和自由基清除能力抑制豆荚褐变的发生并维持蚕豆的贮藏品质。
