SlBES1调节番茄叶片形态的机制研究
2022-03-11梁冬怡刘丽红陈珊珊苗慧莹刘浩然孟凡亮邵志勇汪俏梅
梁冬怡 刘丽红 陈珊珊 苗慧莹 刘浩然 孟凡亮 邵志勇 汪俏梅
(浙江大学园艺系/农业农村部园艺植物生长发育与品质控制重点开放实验室,浙江 杭州 310058)
油菜素甾醇(brassinosteroid,BR)是调节植物生长发育和逆境适应性的一类重要的植物激素,可以调控植物的微管分化、衰老、应激反应和光形态建成等[1-2]。BR生物合成或信号转导受阻会导致植物生长迟缓,从而使BR相关的突变体有矮化表型[2-3]。目前,在模式植物拟南芥(Arabidopsisthaliana)中,BR信号的转导途径相关研究已经比较透彻,已知BR信号主要由膜定位的BRI1-BAK1受体复合物感知,通过关键信号转导组分BZR1/BES1调控目标基因表达[4]。通过甲基磺酸乙酯(ethyl methanesulfonate, EMS)诱变处理拟南芥BR受体突变体bri1-119,筛选到对BR超敏感的功能获得性突变体bes1-D,该突变体中BES1基因第698位胞嘧啶(C)替换为胸腺嘧啶(T),导致去磷酸化状态的活性BES1蛋白积累,从而产生叶柄长而弯曲和叶片窄而卷曲的表型[5]。与螺旋和卷曲生长相关的突变往往与微管功能相关,这些卷曲生长突变体通常有α微管蛋白或β微管蛋白基因的显性负突变[6]。微管(microtubules)是α微管和β微管聚合而成的高度保守的极性聚合物,是真核细胞骨架的关键成分,在调节细胞内运输、细胞分裂,特别是细胞形态建成中发挥重要作用[7-10]。微管的固有极性为其提供了一个动态较弱的负端和一个动态较强的正端。在聚合过程中,微管蛋白分子被定位在微管内,使得α微管蛋白的微管面向缓慢增长的负端,而β微管蛋白面向快速增长的正端,细胞骨架的动态变化在植物的生长和发育过程中有重要作用。
BR信号转导的一些上游组分,如BSKs和BSU1,可以通过改变BZR1/BES1的磷酸化或去磷酸化调节下胚轴细胞的伸长。BR信号转导途径中的负向组分——BIN2激酶通过磷酸化微管调节铺板细胞形态和植物生长发育[11]。拟南芥中BZR1可以通过微管去稳定蛋白MDP40(microtubule destablizing protein 40)调控微管介导的下胚轴细胞伸长[11-12]。番茄(Solanumlycopersicum)作为世界范围内广泛栽培的蔬菜作物和发育研究的模式植物,探究番茄中BR通过微管影响其生长发育具有较大创新性,并有重要的经济价值和科学意义。本研究通过构建番茄mSlBES1基因过表达植株(mSlBES1-OX),并进行表型分析和功能研究;与SlTub6-eGFP转基因材料杂交,生成荧光标记微管的mBES1过表达植株(mSlBES1-OX×SlTub6-eGFP,B×T),探究mBES1过表达对微管蛋白量和稳定性的影响,旨在揭示BR通过信号转导组分BES1调节微管进而影响叶片形态的分子机制。
1 材料与方法
1.1 mSlBES1-OX与SlTub6-eGFP载体构建与番茄的遗传转化
将番茄SlBES1(Solyc04g079980)的核苷酸序列第695位胞嘧啶(C)突变为胸腺嘧啶(T),使SlBES1第232位氨基酸由脯氨酸(Proline)突变为亮氨酸(Leucine),形成BR超敏响应基因mSlBES1。取种植在浙江大学紫金港校区温室的野生型番茄(wildtype,WT,ACu)叶片cDNA为模版,利用SlBES1-F和SlBES1-R引物通过PCR反应获得编码序列(coding sequence, CDS)全长,将胶回收后获得产物连接到pQB-V3载体上。以构建的pQB-V3-SlBES1为模版,利用重叠聚合酶链式反应(overlapping PCR)方法获得mBES1全长。具体如下:以SlBES1-F和mSlBES1-R及mSlBES1-F和SlBES1-R的引物组合方式使用PrimerSTAR高保真酶(TaKaRa,日本)分别扩增出两段PCR产物。再以这两段PCR产物为模板,以SlBES1-F和SlBES1-R为引物,扩增出mBES1全长。利用LR反应将mBES1的全长从pQB-V3初始载体中重组到带有pGWB17表达载体上,获得35S:mSlBES1-Myc质粒。将过表达载体35S:mSlBES1-Myc转化到农杆菌LBA4404中,并侵染番茄子叶最终获得潮霉素抗性植株利用PCR和实时荧光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)检测目的基因及其表达水平,最终获得过表达株系。pSlTUB6:SlTub6-eGFP以及SlTub6-eGFP转基因材料由浙江大学蔬菜生理实验室构建。番茄转基因方法参考Shao等[13]的研究。

表1 mSlBES1-OX载体构建引物Table 1 Primers for mSlBES1-OX construction
1.2 形态学和组织细胞学观察
取生长30 d的WT与mSlBES1-OX同一位置叶片,做成石蜡切片,置于光学显微镜下观察组织细胞学变化。该步骤由杭州浩克生物公司完成。
1.3 mSlBES1-OX 和SlTub6-eGFP杂交材料的构建
将mSlBES1-OX 和SlTub6-eGFP进行杂交得到F1代植株,F1代自交获得F2代植株。取F2代适量番茄幼嫩叶片研磨至粉末,加入1 mL按体积比9∶1混合的现配Tris-EDTA缓冲液(10 mmol·L-1Tris HCl,1 mmol·L-1EDTA,pH值8)和提取缓冲液(200 mmol·L-1Tris HCl,pH值7.5),250 mmol·L-1NaCl,25 mmol·L-1EDTA,0.5% SDS按9∶1的体积比混合,10 000 r·min-1离心2 min,取2 μL混合液进行PCR鉴定。以构建完成的载体作为阳性对照,野生型DNA作为阴性对照。

表2 杂交材料鉴定引物Table 2 Primers for hybrid material identification
1.4 铺板细胞形态观察
选取生长5周的B×T和SlTub6-eGFP同一叶位平整的幼嫩叶片制作装片。在激光共聚焦显微镜下(Nikon A1,日本)观察,激发波长488 nm,检测的发射波长为480~520 nm。使用Image J软件测量铺板细胞的周长和面积、圆度值、突起数。样本量≥70,用SPSS软件进行One-way ANOVA显著性分析。
1.5 蛋白质免疫印迹(Western Blot)试验
取生长6周的WT,mSlBES1-OX、SlTub6-eGFP 和PCR鉴定呈阳性的B×T同一叶位的叶片材料进行试验。叶片经液氮磨成细粉,溶解于RIPA缓冲液[25 mmol·L-1Tris-HCl,pH值7.4,140 mmol·L-1NaCl,1%聚乙二醇辛基苯基醚(TritonX-100),0.1%脱氧胆酸钠(sodium deoxycholate),0.1%十二烷基硫酸钠(SDS),1 mmol·L-1乙二胺四乙酸(EDTA),0.5 mmol·L-1乙二醇二乙醚二胺四乙酸(EGTA),2 mmol·L-1苯甲基磺酰氟(PMSF)现配现用]中。取上清进行Western Blot试验,然后用相应的兔源微管蛋白多克隆一抗(Tubulin4,友科生物,上海)和羊抗兔标记二抗(康为世纪,泰州)进行检测。蛋白条带灰度值分析参考Fu等[14]的研究。
1.6 微管解聚剂外源处理
取生长6周的生长状态较一致的SlTub6-eGFP和B×T材料同样叶位的叶片置于装有80 μmol·L-1氨磺乐灵(Oryzalin,美国)溶液注射器中,抽真空处理,暗培养30 min,每10 min用激光扫描共聚焦显微镜拍照记录1次。
2 结果与分析
2.1 mSlBES1-OX 和SlTub6-eGFP杂交材料的鉴定和表型分析
2.1.1 杂交材料鉴定及表型分析 提取mSlBES1-OX和SlTub6-eGFP杂交材料F2代番茄植株叶片的基因组DNA,进行PCR扩增,如图1所示。mSlBES1-OX的扩增条带为454 bp,SlTub6-eGFP的扩增条带为850 bp。杂交成功(mSlBES1-OX×SlTub6-eGFP,B×T)的株系如图2所示,mSlBES1-OX的叶片沿主脉卷曲,叶色变浅;与mSlBES1-OX相比,B×T杂交材料叶片的卷曲程度降低,且叶片颜色加深,部分恢复到野生型的表型。

注:M:DL 2000 DNA Marker;C:阳性对照mSlBES1-OX植株;T: 阳性对照 SlTub6-eGFP;WT:背景型,wild type;1~22:番茄杂交植株编号。Note: M: DL 2000 DNA Marker. C: Positive control (mSlBES1-OX). T: Positive control (SlTub6-eGFP). WT: Negetive control, wild type. 1 to 22: Number of the obtained mSlBES1-OX×SlTub6-eGFP.图1 杂交材料鉴定Fig.1 Identification of the hybrid plants

图2 B×T杂交材料及父母本植株表型Fig.2 Phenotypic characterization of B×T tomato hybrid and parent plants
2.1.2mSlBES1-OX转基因材料的显微观察 取生长30 d的mSlBES1-OX转基因材料番茄叶片进行横切,做成石蜡切片,在光学显微镜下拍照,结果如图3所示。mSlBES1-OX与WT维管束形态相似,较完整;WT中栅栏组织与海绵组织排列整齐,mSlBES1-OX叶边缘弯曲,且栅栏组织与海绵组织细胞形状不规则。

注:*表示在P<0.05水平差异显著。Note:* indicates significant difference at 0.05 level.图5 SlTub6-eGFP和B×T铺板细胞的表面积、圆度值和突起数Fig.5 The area, circularity and lobe number of SlTub6-eGFP and B×T pavement cells
2.2 过表达mBES1对番茄植株叶片铺板细胞的影响
通过激光扫描共聚焦显微镜观察杂交材料铺板细胞,如图4所示。与SlTub6-eGFP相比,mSlBES1-OX杂交材料(B×T)铺板细胞的锯齿状形态更加明显。用Image J比较表皮铺板细胞的突起数量、表面积、周长及圆度值,mSlBES1-OX杂交材料的突起数显著高于SlTub6-eGFP,而表面积和圆度值均显著小于SlTub6-eGFP(图5)。
2.3 mSlBES1-OX卷叶分子生物学机制探究
2.3.1mSlBES1-OX调控微管蛋白表达水平 为探究mBES1过表达改变叶形和铺板细胞形态与微管蛋白的表达关系,本研究用Western Blot方法检测WT、mSlBES1-OX、SlTub6-eGFP和B×T株系中微管蛋白表达水平,如图6所示。mSlBES1-OX的微管蛋白表达量低于WT,表明mSlBES1-OX过表达降低了微管蛋白的水平。与之对应的,杂交材料B×T的微管蛋白表达水平少于SlTub6-eGFP。上述结果表明BES1可能通过减少微管蛋白的表达量来调控叶片的形态。
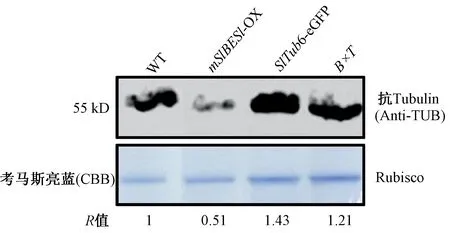
注:R值表示微管蛋白相对于内参Rubisco水平的积累,WT中的微管蛋白的相对含量记作为标准1。Note: The R value represents the tubulin protein accumulation relative to the Rubisco level, and the protein accumulation in WT normalized to rubisco as standard 1.图6 WT、mSlBES1-OX、 SlTub6-eGFP 和B×T的微管蛋白水平Fig.6 The tubulin protein levels in WT, mSlBES1-OX, SlTub6-eGFP and B×T
2.3.2mSlBES1-OX调控微管蛋白的稳定性 为探究mSlBES1对微管蛋白稳定性的影响,使用80 μmol·L-1氨磺乐灵外源处理B×T并观察其微管排列情况。如图7所示。在微管解聚剂处理之前,SlTub6-eGFP和B×T铺板细胞中的微管排列清晰可见,用80 μmol·L-1氨磺乐灵处理10 min后,杂交材料细胞中的微管几乎全部消失;而SlTub6-eGFP铺板细胞中的微管部分消失,20 min以后,SlTub6-eGFP和杂交材料铺板细胞中的微管全部被解聚剂破坏(图7-B)。结果表明,BES1介导的BR信号增强破坏了微管的稳定性,使微管对解聚剂更加敏感。
3 讨论
叶片在感知光质、光量和日照时间方面起着重要作用,是植物进行光合作用的主要器官。叶片形态的变化会影响光合能力,扁平的叶片光合作用效率较高,而在干旱条件下,适当的卷叶可以最大限度地捕捉光线,减少叶片辐射和蒸腾作用[14-16]。如卷叶是水稻理想株型的重要指标,在水稻育种中中度卷叶有利于叶片直立和紧凑的植株结构,在高密度种植下具有重要农业生产价值[17]。除光合作用外,叶片作为源组织调控糖向库的运输,不同叶形通过对糖分布的调节实现对产量和含糖量的平衡控制。
植物的极性生长对植物激素的响应和细胞分裂之间的协调是叶片形态建成和发育所必不可少的,这种协调性如失去平衡则会导致叶片形状的改变,导致叶片卷曲、皱缩、扭曲、呈放射状或萎缩等[18-21]。本研究构建的番茄BR信号转导关键组分BESl过表达材料叶肉细胞形态呈多边形(图3),铺板细胞突起变多且表面积显著低于野生型(图5),与拟南芥bes1-D突变体表型相似[11],表明BES1对细胞形态的调控功能在不同物种中具有保守性。拟南芥微管蛋白突变体和番茄微管结合蛋白IQ67的亚型SUN的过表达株系,其叶形均受到影响[22],预示可能存在通过微管蛋白调控番茄叶片形态的途径。本研究发现mBES1基因的过表达减少了微管蛋白表达量,这与拟南芥中的研究结果一致[11]。本研究中mSlBES1-OX和SlTub6-eGFP杂交材料与mSlBES1-OX相比卷曲程度减弱,部分恢复到野生型的表型,原因可能是杂交材料部分补充了微管蛋白的表达量,这也与Western Blot结果中杂交材料的微管蛋白表达量多于mSlBES1-OX相对应(图2、6)。破坏微管结合蛋白(microtubules associated proteins,MAPs)造成的微管排列缺陷会生成卷曲螺旋状的叶片,该蛋白包括SPR1(SPIRAL1)、SPR2(SPIRAL2)、EB1(ENDBINDING1)、MOR1(MICROTUBULE ORGANIZATION1)、ARK2(ARMADILLO REPEAT KINESIN2)[23-28]。皮质微管动态变化与螺旋卷曲生长之间存在很强的相关性,本研究采用微管解聚剂处理杂交材料发现,mBESl基因的过表达降低了微管的稳定性,所以BES1介导的BR信号通路既影响微管蛋白的表达量又影响其稳定性,并以此调控细胞形态建成并生成卷叶表型。
除本研究发现的BR对叶片卷曲的调控,生长素与叶片平坦度之间也存在一定的关系。例如,番茄生长素响应因子4(AUXIN RESPONSE FACTOR 4)的RNA干扰(SlARF4-RNAi)株系会产生向上卷曲的叶片[29],番茄生长素转运蛋白4(PIN-FORMED)的RNA干扰(SlPIN4-RNAi)株系叶片不平整从而改变了植物结构[30],生长素流入载体基因SlLAX1(LIKE AUXIN RESISTANT 1)通过平衡叶片上下铺板细胞的生长控制叶片平整度,该基因突变导致番茄卷曲叶片的生成[31]。BR和生长素作为不同植物激素种类,很可能通过不同的机制调控植物的生长;同时,植物激素的信号转导途径存在着复杂的互作网络,不同激素间相互协调从而共同调控植物叶片形态建成的具体原理仍有待进一步研究。
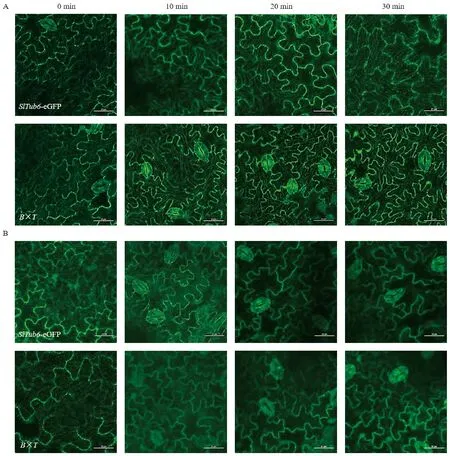
注:A: DMSO对照处理0~30 min后铺板细胞中微管的观察情况;B: 80 μmol·L-1 氨磺乐灵处理0~30 min后铺板细胞中微管的观察情况。Note: A: Microtubules were observed in the cotyledon pavement cells after treatment with DMSO as control for 0~30 min. B: Microtubules were observed in the cotyledon pavement cells after treatment with 80 μmol·L-1 oryzalin for 0~30 min.图7 微管解聚剂处理后铺板细胞的微管动态平衡(标尺=25 μm)Fig.7 The dynamic balance of microtubule in the pavement cells under oryzalin treatment(bar=25 μm)
4 结论
本研究首先构建了番茄mSlBES1-OX过表达材料,与野生型相比,mSlBES1-OX转基因植株具有明显的卷叶表型。为探究其调控机制,本研究将mSlBES1-OX转基因材料和荧光标记微管材料进行杂交,得到番茄荧光标记微管的mSlBES1-OX过表达材料B×T。在细胞层面,mSlBES1基因过表达改变了细胞形态从而调控叶片形态;在分子机制层面,mBES1基因的过表达减少了微管蛋白表达量并降低了微管的稳定性,从而改变叶片的形态,使叶片卷曲。这些结果表明BESl可以调控微管蛋白介导的细胞形态进而影响叶片形态建成。
