水杨酸调控芥菜芽苗生理及褪黑素代谢研究
2022-03-11尹永祺
张 静 尹永祺 陶 俊
(1 扬州市职业大学,江苏 扬州 225009;2 扬州大学园艺与植物保护学院,江苏 扬州 225009; 3 扬州大学食品科学与工程学院,江苏 扬州 225127)
褪黑素(melatonin,MT)是一种吲哚胺类神经激素,特异的天然抗氧化能力[1],使其具有延缓衰老[2]、抗击肿瘤[3]、改善睡眠[4]、调节免疫[5]等多种生理功效。同时褪黑素具备脂溶性和水溶性两种性质,因而易透过各种生理屏障到达体内任何部位从而发挥独特的药理作用[6]。褪黑素广泛存在于大多数生命体中,其在植物机体中含量显著高于动物体内[7]。褪黑素在植物中主要是由色氨酸经色氨酸脱羧酶(tryptophan decarboxylase,TDC)催化形成色胺,然后经色胺5-羟化酶(tryptamine 5-hydroxylase,T5H)催化形成5-羟色胺,5-羟色胺由血清素N-乙酰转移酶(serotonin N-acetyltransferase,SNAT)转化为N-乙酰基-5-羟色胺,最后经N-乙酰基-5-羟色胺-甲基转移酶(N-acetylserotonin methyltransferase,ASMT)催化形成褪黑素[8]。在植物籽粒发芽阶段,褪黑素合成关键酶被激活,褪黑素含量显著增加,且生长环境改变会诱导褪黑素合成关键酶相关基因的表达及酶活性提高,进一步促进褪黑素的生物合成[9-10]。因此,通过控制的籽粒发芽条件以使芽苗中的褪黑素富集是一种有效的方式。
水杨酸(salicyliCAcid,SA)是普遍存在于植物体内常见的小分子酚类物质[11]。研究发现,外源SA处理会影响植物多种生理活动,对植物的生长和发育具有重要的调控作用,是植物应对逆境胁迫的关键信号传导因子[12-13]。褪黑素与SA具有共同的合成前体且相似性较高,在植物生理学中,尤其是在应对生物和非生物胁迫等方面,均发挥着重要的作用[14-16]。然而,有关SA处理对芥菜芽苗生理及褪黑素代谢影响的研究鲜见报道。
本研究以芥菜(BrassicajunceaL.)为试材,研究SA处理下芥菜芽苗主要生理生化和褪黑素代谢的变化,以期从生理生化代谢及基因水平探讨SA处理对芥菜芽苗中褪黑素代谢的调控机理,为开发富含褪黑素的芸薹属芽类食品提供理论依据和技术支撑,推动芽菜的产业化发展。
1 材料与方法
1.1 试验材料
芥菜籽粒(长合甜脆大肉芥菜),2017年购自广州长合种子有限公司,-20℃保存。
褪黑素标准品(纯度>95%),购自美国Sigma公司;TB Green Premix Dimer Eraser(RR091A),购自日本TaKaRa公司。
1.2 试验设计
称取2.0 g(约500粒)芥菜种子,置于1%(v/v)次氯酸钠水溶液中,浸泡消毒15 min后,用蒸馏水冲洗至pH值呈中性,置于蒸馏水中30℃浸泡4 h。将浸泡后种子置于铺有蛭石的小盒中,喷施60 mL蒸馏水,置于30℃培养箱内发芽,16 h光照/8 h黑暗。分别设置SA处理和对照,SA浓度及芽苗处理时间根据前期预试验研究筛选确定,SA处理为芥菜种子正常发芽2 d后,其后每天喷施20 mL 1 mmol·L-1SA溶液,对照处理为每天喷施20 mL蒸馏水,分别于发芽4和7 d取样测定芽长、褪黑素含量及相关基因表达等指标。每处理设3次生物学重复,指标测定进行3次平行试验。
1.3 测定项目与方法
1.3.1 形态指标
1.3.1.1 形态特征 从各处理组中随机选取15株芥菜芽苗,摆放整齐后,观察其形态特征。
1.3.1.2 芽长 随机选取15株发芽芥菜芽苗,用游标卡尺测定其地上部分芽长,并取平均值。
1.3.1.3 单株芽苗鲜重 随机选取30株发芽芥菜芽苗测定其鲜重,并取平均值。
1.3.2 电解质渗透率 参照Dionisio-Sese等[17]的方法并加以修改。称取0.3 g芽苗并切至3 mm的长度,转移至20 mL去离子水中,于37℃水浴条件下振荡1 h后,测定其电导率记为EC1;随后沸水浴处理10 min,经冷却后调整最终体积为30 mL,测定煮沸后电导率记为EC2,根据公式计算电解质渗透率:
电解质渗透率=(EC1/EC2)×100%
1.3.3 可溶性蛋白含量 采用考马斯亮蓝G250法测定,以牛血清白蛋白为标准[18]。
1.3.4 褪黑素含量 参照Arnao等[19]的方法并加以修改。准确称取0.2 g芥菜芽苗切片处理(3~5 mm),转移至棕色小瓶中,加入3 mL氯仿∶甲醇(30∶1,v/v),4℃条件下震荡16 h。萃取液于12 000×g离心10 min,取下层清液在真空浓缩器中40℃浓缩蒸干,加入100 μL 35%甲醇复溶,通过用高效液相色谱法测定褪黑素。色谱柱:ZORBAX SB-C18柱(5 μm粒径,4.6 mm×250 mm);流动相A为超纯水,流动相B为纯甲醇(色谱级),洗脱程序:0 min~27 min~35 min,42%甲醇~50%甲醇~50%甲醇;流速:0.3 mL·min-1;通过FLD检测器检测,检测器温度:30℃;激发波长:280 nm,发射波长:348 nm。
1.3.5 总抗氧化能力和谷胱甘肽过氧化物酶活性 采用总抗氧化能力检测试剂盒(A015-1,南京建成生物试剂公司)测定总抗氧化能力;采用GPX试剂盒(A005-1-2,南京建成生物试剂公司)测定谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性。
1.3.6 褪黑素合成关键基因表达 参考文献[20]进行引物设计,引物序列见表1。参照植物RNA提取试剂盒(R6827,美国OMEGA公司)说明书提取芥菜芽苗中RNA并按RNA反转录试剂盒(RR047A,日本TaKaRa公司)进行cDNA反转录试验,参考Ma等[21]的方法构建荧光定量PCR体系,实时荧光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)扩增程序:95℃预变性30 s;95℃变性30 s,55℃退火30 s,72℃延伸30 s,循环40次,绘制溶解曲线,检测各褪黑素合成关键基因表达水平。

表1 qRT-PCR中使用的引物Table 1 The primers used in qRT-PCR
1.4 统计分析
采用Microsoft Excel 2013软件处理数据,SigmaPlot 12.5软件进行绘图,SPSS 17.0软件进行统计分析,采用Tukey多重比较法进行数据的差异显著性分析(P<0.05表示差异显著)。
2 结果与分析
2.1 SA处理对芥菜芽苗外部形态的影响
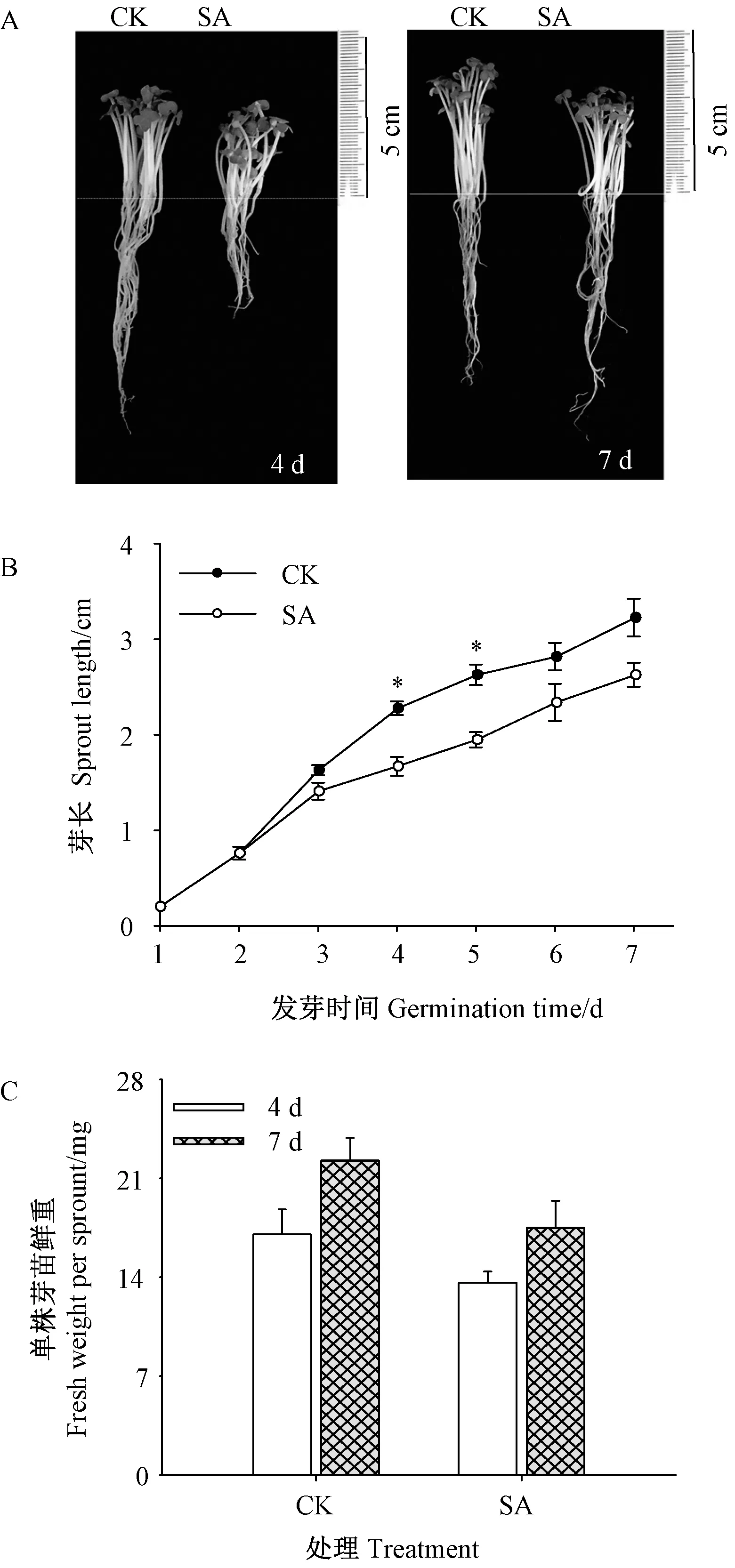
注:*表示同一时期不同处理间差异显著性(P<0.05)。下同。Note: * indicates significant difference amonGTreatments at 0.05 level aTThe same time. The same as following.图1 SA处理下芥菜芽苗形态、芽长及单株鲜重的变化Fig.1 Changes of sprout morphology, length and per fresh weight of mustard sprouts under SATreatment
由图1可知,与对照相比,经SA处理的芥菜芽苗形态和生理特征均发生变化。图1-A直观显示出,芥菜芽苗在经SA处理后,芽苗整体长势较对照出现明显的差异,SA抑制了芽苗的生长,随着发芽时间延长,SA处理处于快速生长阶段,至发芽7 d时与对照差异减小。SA处理组地上部芽长在发芽4和7 d时分别为对照的81.6%和81.4%(图1-B),单株鲜重与对照相比分别降低了38.12%和20.80%(图1-C)。
2.2 SA处理对芥菜芽苗电解质渗透率的影响
由图2可知,芥菜芽苗在受到SA处理后,电解质渗透率提高。芽苗生长7 d时,SA处理的电解质渗透率显著高于对照,是对照的1.27倍。
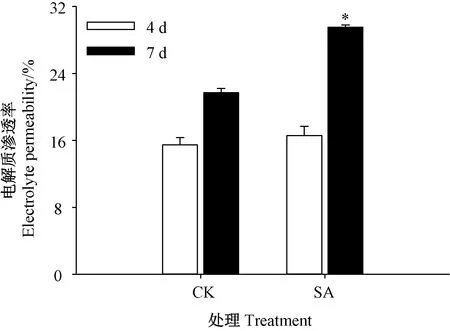
图2 SA处理对芥菜芽苗电解质渗透率的影响Fig.2 Effects of SATreatment on electrolyte permeability of mustard sprouts
2.3 SA处理对芥菜芽苗可溶性蛋白含量的影响
由图3可知,随着发芽时间延长,SA处理下芥菜芽苗中可溶性蛋白含量均较对照处理组显著提高,SA处理组可溶性蛋白含量在发芽4和7 d时分别为对照的1.86和1.29倍。
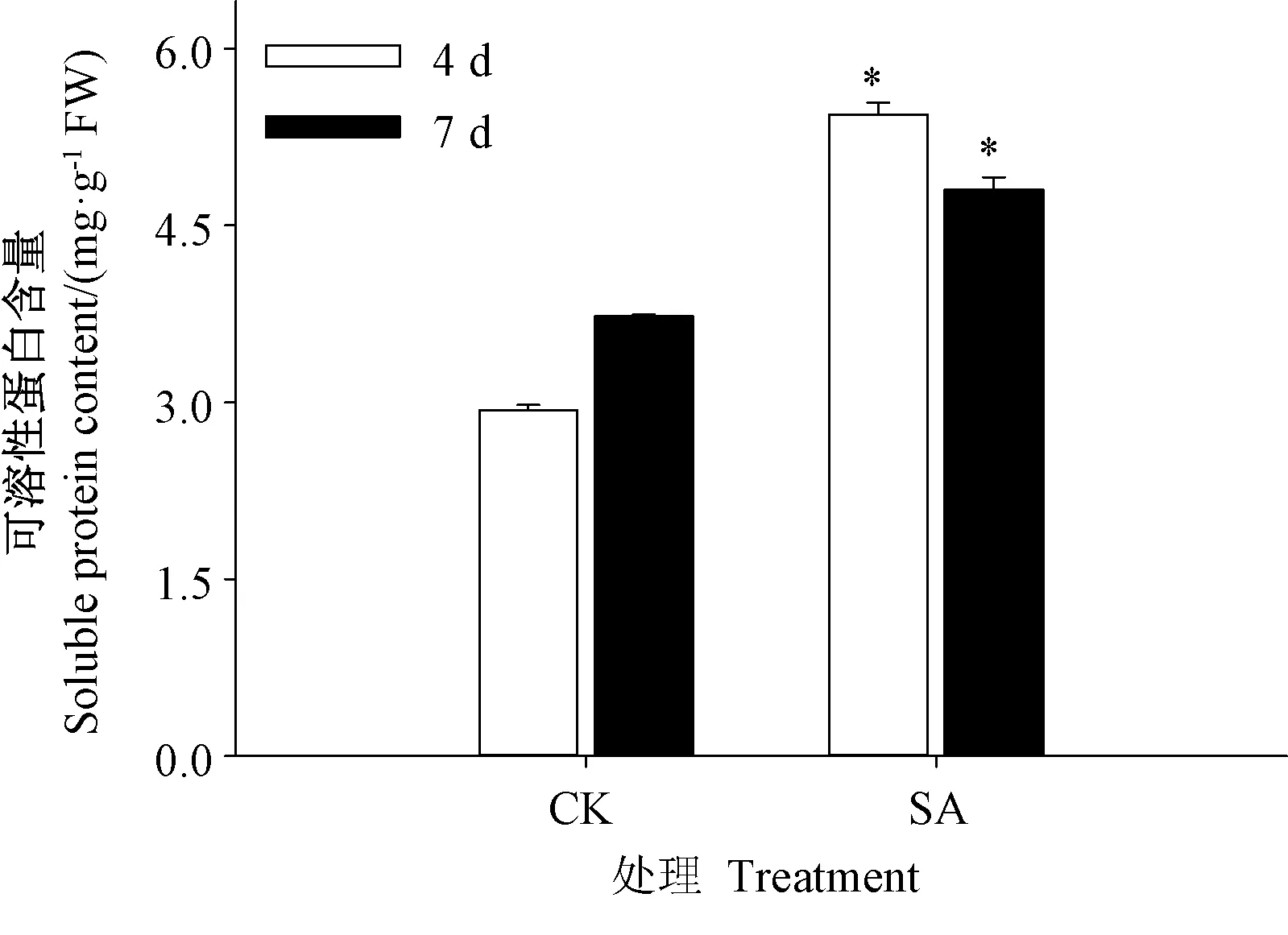
图3 SA处理对芥菜芽苗可溶性蛋白含量的影响Fig.3 Effects of SATreatment on soluble protein content of mustard sprouts
2.4 SA处理对芥菜芽苗褪黑素含量的影响
由图4可知,芥菜种子在发芽期间经SA处理后,其褪黑素含量发生显著变化,发芽时间也会影响褪黑素的含量。SA处理组发芽4和7 d时其褪黑素含量分别为42.75 ng·g-1FW和27.56 ng·g-1FW,是对照的1.88和1.96倍。随发芽时间延长,发芽7 d时对照和SA处理芥菜芽苗褪黑素含量较4 d时分别下降38.27%和35.53%。
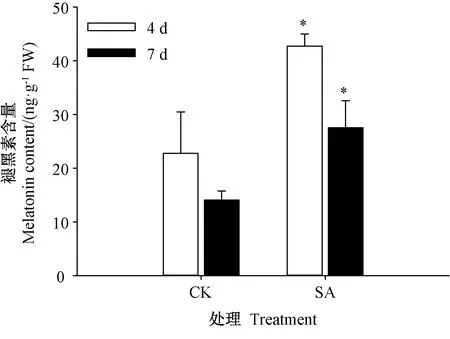
图4 SA处理对芥菜芽苗褪黑素含量的影响Fig.4 Effects of SATreatment on melatonin content of mustard sprouts
2.5 SA处理对芥菜芽苗总抗氧化能力及谷胱甘肽过氧化物酶活性的影响
由图5-A可知,芥菜经SA处理后,芽苗总抗氧化活性显著高于对照,芽苗生长4和7 d时分别为对照的2.21和1.93倍。此外,芽苗中谷胱甘肽过氧化物酶活性在发芽4和7 d时均显著高于对照,分别较对照提高了33.95%和13.77%。
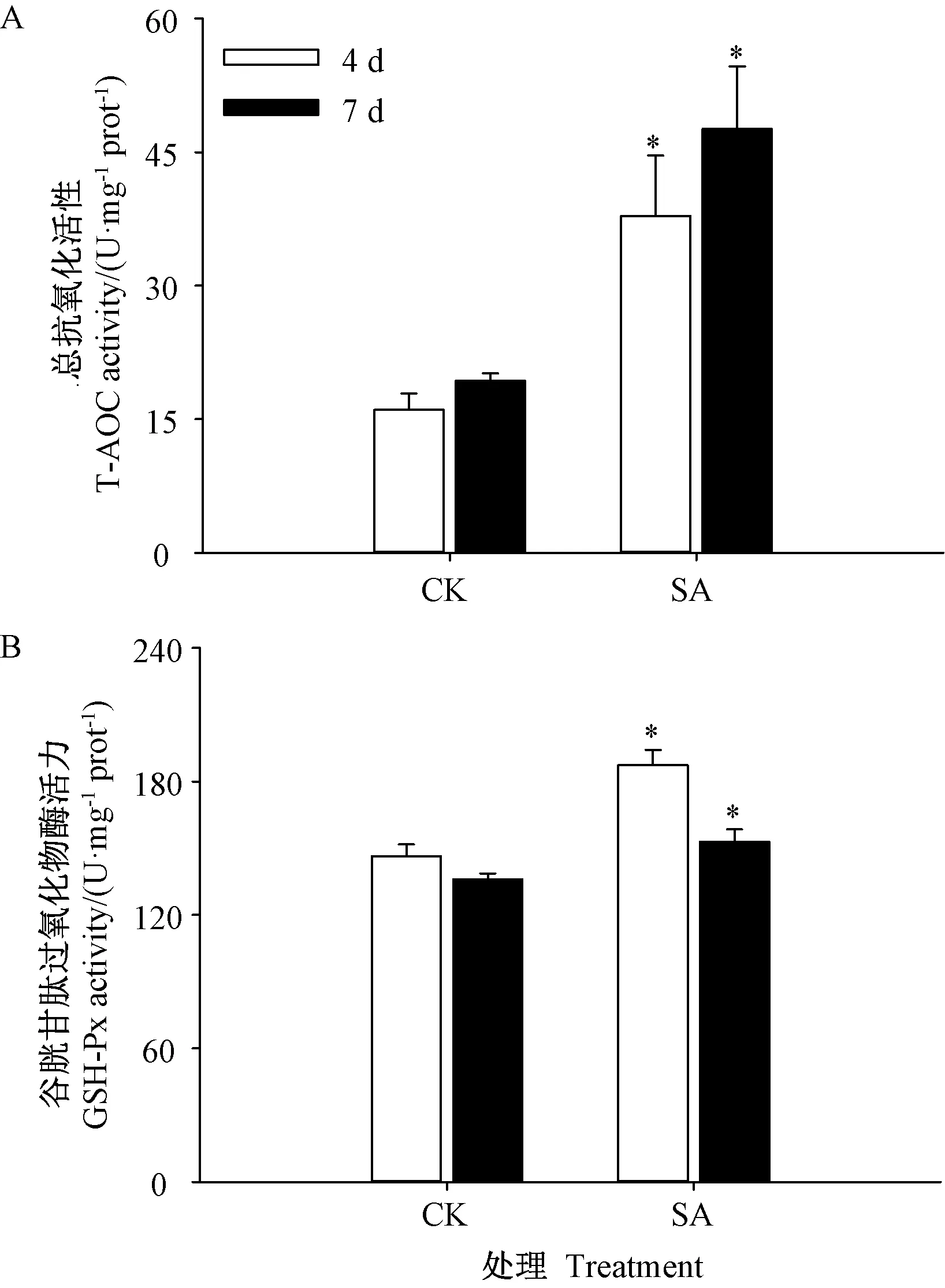
图5 SA处理对芥菜芽苗总抗氧化能力 及谷胱甘肽过氧化物酶活性的影响Fig.5 Effects of SATreatment on T-AOCAnd glutathione peroxidase activity of mustard sprouts
2.6 SA处理对芥菜芽苗褪黑素合成关键酶基因表达的影响
由图8可看出,发芽期间,喷施SA影响芥菜芽苗褪黑素合成关键酶基因的表达。与对照相比,发芽4 d后,SA处理显著上调芥菜芽苗中BjTDC2基因相对表达水平,且在发芽7 d时BjTDC1和BjTDC2基因的相对表达量均显著上调;此外,BjT5H1和BjT5H2基因在发芽4 d时相对表达量均显著提高,而在发芽7 d时BjT5H2基因的相对表达量显著下调。芥菜芽苗经SA处理BjSNAT1和BjSNAT4基因在发芽4 d时相对表达量均较对照显著上调,而BjSNAT2和BjSNAT3基因相对表达量均显著下调。另外,SA处理较对照上调了发芽4 d时BjASMT1基因的表达,却抑制了BjASMT2和BjASMT3基因的表达;发芽7 d时则上调了BjASMT3基因的表达。
3 讨论
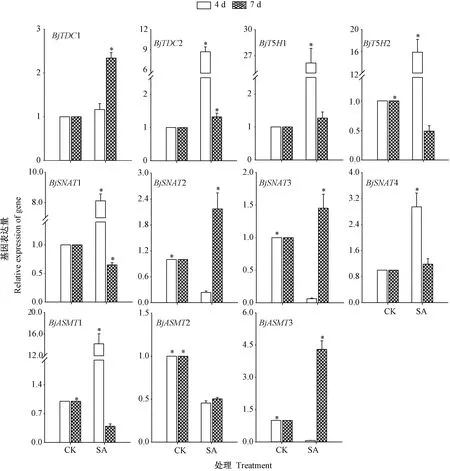
图6 SA处理下芥菜芽苗褪黑素合成关键酶基因表达变化Fig.6 Changes of genes expression of key enzymes for melatonin synthesis in mustard sprouts under SATreatment
植物籽粒在发芽期间,植物中的内源酶系统被激活,具有多种生理作用的功能性物质得以富集[22]。SA作为一种植物激素,参与大多数植物活性成分的生物合成[23]。本研究通过SA处理芥菜芽苗,结果表明,SA处理后,芽苗中内源褪黑素水平相对于对照显著提高,芽苗的生理指标也发生一系列明显变化,芽长及鲜重较对照均明显降低,表明SA处理抑制了芥菜芽苗的生命活动,减缓了相关代谢,从而引起一系列生理活动发生改变;另外,SA处理导致芽苗电解质渗透率提高。电解质渗透率作为植物细胞膜损伤指标,能够反映细胞的完整性[24]。有研究表明,细胞膜损伤会导致H2O2产生,H2O2在植物中起到信号分子作用,促进褪黑素生物合成中色氨酸脱羧酶(tryptophan decarboxylase, TDC)和色胺5-羟化酶(tryptamm 5-hydroxylase, TSH)等酶活性,从而诱导植物的褪黑素含量上升[25]。含氮化合物、蛋白质等含量的变化可以反映胁迫下植物代谢过程中蛋白质的损伤程度[26]。本研究中,芥菜芽苗经SA处理后可溶性蛋白含量显著增加,表明SA处理加速了蛋白质的合成以维持正常生命活动。SA处理提高了芥菜芽苗的总抗氧化活性和谷胱甘肽过氧化物酶活性,这与孙彤彤[27]关于外源SA提高了黄瓜幼苗抗氧酶活性的研究结果一致。说明外源SA可能通过调控抗氧化酶系统,减少活性氧在芥菜芽苗体内的积累,从而维持生命大分子正常的功能。
褪黑素在植物中的生物合成途径及合成关键酶尚不完全清楚。水稻中部分褪黑素合成酶基因已被克隆,然而芥菜芽苗中有关于褪黑素代谢相关酶基因的表达的研究较少[28]。外界胁迫处理可以诱导褪黑素合成酶基因转录以合成褪黑素[29]。水稻突变体缺失TDC基因,其内源5-羟色胺及褪黑素含量显著下降[30],表明褪黑素的生物合成与TDC基因的转录密切相关。芥菜芽苗经SA处理上调了BjTDC基因的表达,有助于色氨酸脱羧酶的合成,其中,芽苗中褪黑素含量与BjTDC2基因表达的变化趋势一致,SA可能通过上调TDC基因的表达,促进5-羟色胺的积累,以提高褪黑素的生物合成。过表达T5H基因的水稻植株内源色胺水平下降,抑制T5H基因表达可以提高水稻中褪黑素的含量,表明T5H基因的转录与褪黑素的生物合成存在特殊关系[31],然而本研究发现,SA处理均显著提高了发芽4 d时芥菜芽苗BjT5H1和BjT5H2基因表达水平及褪黑素含量,这可能是由于研究物种及处理方式不同。芥菜芽苗中部分BjSNAT基因的相对表达量与褪黑素含量变化并不一致,这与Lee等[32]关于过表达OsSNAT基因的转基因水稻植株在Cd胁迫下,其褪黑素含量与OsSNAT基因存在负相关的研究结果相似。另外,SA处理可显著调控芥菜芽苗BjASMT基因的表达水平。物种之间的同源序列表明,高等植物都可能存在ASMT基因的同源序列,这与物种均含有褪黑素一致[33],表明ASMT基因可能在调控植物合成褪黑素以响应非生物胁迫过程中发挥重要作用。尽管褪黑素与其合成关键酶基因表达关系密切,但褪黑素在植物中的形成可能由多种因素共同调控,仍需要进一步研究。
4 结论
芥菜芽苗经SA处理后,其生长受到抑制,生物量显著下降,电解质渗透率显著上升。芥菜芽苗通过加速合成蛋白质,提高总抗氧化能力以及过氧化物谷胱甘肽酶活性,以维持芽苗正常的生命活动。SA处理后发芽4 d的芥菜芽苗BjTDC1基因、BjTDC2基因、BjT5H1基因和BjT5H2基因的相对表达水平均不同程度上调,部分基因表达与褪黑素含量变化趋势一致,表明SA通过调控BjTDC和BjT5H基因表达诱导褪黑素的生物合成,而BjSNAT与BjASMT的相对表达水平与褪黑素合成的相关性较低。芥菜芽苗经SA处理后内源褪黑素含量在第4天达42.75 ng·g-1FW,表明SA处理是富集芥菜芽苗中褪黑素的有效方式。
