姜黄素抑制轮状病毒感染猪肠上皮细胞的作用研究
2022-03-10卓儒浩吴嘉敏许梦慧陶生祥
卓儒浩 吴嘉敏 许梦慧 陶生祥 孟 闯 钟 翔,*
(1.南京农业大学动物科技学院,南京210095;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
猪轮状病毒(porcine rotavirus,PRV)属于呼肠孤病毒科轮状病毒属,是引起60日龄内仔猪急性肠道传染病的主要病原体[1-2]。PRV感染仔猪可损坏肠道黏膜结构与功能,搅乱正常新陈代谢,引起脱水性腹泻,抑制仔猪生长,甚至导致高达100%的死亡率,严重威胁仔猪健康和猪群生产力[3-5]。近年来,PRV感染呈现全球流行趋势,严重制约养猪业的发展,给全球畜牧业造成严重的经济损失。迄今为止,疫苗接种是防控PRV感染的唯一方法,但病毒的变异重组可降低疫苗的保护率[6]。因此,在研发更高效疫苗的基础上,迫切需要寻求并开发新型抗病毒药物抑制PRV感染,从而保障仔猪健康,促进畜牧业平稳发展。
姜黄素是从天然植物姜黄的根茎中提取的一种多酚类化合物,已被大量研究证明具有广泛且有益的生物学特性,包括抗氧化、消炎、抗肿瘤、抑菌以及抗病毒等作用[7-8]。近年来,姜黄素被证实在人类免疫缺陷病毒(HIV)[9]、甲型流感病毒(IAV)[10]、丙型肝炎病毒(HCV)[11]、寨卡病毒(ZIKV)[12]和基孔肯雅病毒(CHIKV)[12]等多种病毒的感染过程中发挥了重要的抗病毒作用。在机制上,姜黄素可通过直接靶向病毒关键成分或影响细胞代谢通路来抑制病毒的吸附或复制。然而,目前有关姜黄素对PRV感染的影响尚未见报道。因此,本研究探讨PRV对猪肠上皮细胞(IPEC-J2)的影响、姜黄素可否缓解PRV感染对细胞的不利影响以及姜黄素剂量与作用效果的关系等问题,从而揭示姜黄素在IPEC-J2细胞中对PRV的抗病毒作用,为今后研发防控PRV感染的相关药物或饲料添加剂提供科学依据。
1 材料与方法
1.1 材料与试剂
G9P7型PRV毒株NJ2012由江苏省农业科学院兽医研究所人兽共患病防控研究室李彬研究员惠赠;IPEC-J2细胞和非洲绿猴肾细胞(Vero)均由本实验室保存传代所得。

1.2 病毒感染与扩繁试验
细胞培养24~48 h,长满至单层贴壁。取适量溶于DMEM/F12中的PRV[感染复数(MOI)=0.1],加入胰蛋白酶并使其终浓度为10 μg/mL,37 ℃金属浴30 min激活PRV。用1×PBS润洗细胞2次,弃净残液,加入病毒-胰蛋白酶混合液,置于37 ℃和5% CO2条件下吸附1 h,期间每隔20 min摇动细胞培养瓶或培养板,使病毒均匀吸附。吸附结束后,再用1×PBS润洗细胞1次,弃净残液,加入含1 μg/mL胰蛋白酶的适量DMEM/F12作为细胞维持液,置于37 ℃和5% CO2条件下维持细胞至出现85%以上细胞病变效应(CPE)。将病变细胞置于-80 ℃反复冻融3次,随后5 000 r/min离心10 min,去除细胞沉淀,取上清液即为扩繁后的病毒。测定并记录扩繁后的病毒滴度,置于-80 ℃保存。
1.3 病毒滴度测定
将提取的病毒溶于DMEM/F12中并连续作10倍梯度稀释,从10-1稀释至10-10。将稀释后的病毒分别接种至96孔板的Vero细胞中,每一稀释度接种1列8孔,每孔接种100 μL。设置2列未接种正常细胞作为阴性对照。接种病毒后24 h观察CPE,按照Reed-Muench两氏法[13]计算半数细胞培养物感染量(TCID50)作为病毒滴度。计算方式如下:
病毒滴度(-lg TCID50/mL)=(高于50%的
病变率-50%)/(高于50%的病变率-低于50%的
病变率)×稀释度对数差+高于50%病变率的
稀释度对数。
1.4 病毒感染对细胞存活率的影响
按照CCK-8试剂说明书进行操作,方法如下:在96孔板中接种1×104个IPEC-J2细胞,置于37 ℃和5% CO2条件下培养24 h。分别设置未感染组和感染组,每组4个重复,分别设置空白孔和对照孔。取PRV(MOI=0.1)感染各组细胞,感染后用细胞维持液于37 ℃和5% CO2条件下分别维持细胞6、12和24 h。向每个孔中加入10 μL CCK-8试剂,置于37 ℃和5% CO2条件下孵育1~4 h,然后使用酶标仪测量450 nm处的吸光度。
1.5 病毒感染对细胞内ROS含量的影响
在6孔板中接种1×106个IPEC-J2细胞,置于37 ℃和5% CO2条件下培养24~48 h。分别设置未感染组和感染组,每组3个重复。取PRV(MOI=0.1)感染细胞,感染后用细胞维持液于37 ℃和5% CO2条件下维持细胞24 h。按照ROS检测试剂盒说明书进行操作,方法如下:按照1∶1 000的比例用DMEM/F12稀释荧光探针2′,7′-二氯荧光黄双乙酸盐(DCFH-DA),使其终浓度为10 μmol/L。收集细胞后悬浮于稀释好的DCFH-DA中,37 ℃孵育25 min。每隔3~5 min颠倒混匀一下,使DCFH-DA和细胞充分接触。用1×PBS润洗细胞3次,以充分去除未进入细胞内的DCFH-DA。通过流式细胞仪检测装载DCFH-DA后的各组细胞内ROS的含量。
1.6 姜黄素对细胞活力检测
将姜黄素溶于DMSO中配制成100 mmol/L的贮存液,置于-20 ℃保存。按照CCK-8试剂说明书进行操作,方法如下:在96孔板中接种1×104个IPEC-J2细胞,置于37 ℃和5% CO2条件下培养24 h。将姜黄素用DMSO稀释至5、10、20、40、60、80、100 μmol/L。将不同浓度的姜黄素加入到96孔板中,每种浓度设置4个重复,分别设置含DMSO的对照孔和空白孔。将96孔板置于37 ℃和5% CO2条件下继续培养24 h。向每个孔中加入10 μL CCK-8试剂,置于37 ℃和5% CO2条件下孵育1~4 h,然后使用酶标仪测量450 nm处的吸光度。
1.7 姜黄素对PRV复制的影响
为了探究姜黄素对PRV在细胞内复制的影响,分别设置低剂量(5 μmol/L)姜黄素组和高剂量(20 μmol/L)姜黄素组,每组均先添加不同浓度姜黄素预处理IPEC-J2细胞24 h,随后PRV(MOI=0.1)与不同浓度姜黄素共同加入细胞中,感染后再用含不同浓度姜黄素的细胞维持液置于37 ℃和5% CO2条件下维持24 h,每组3个重复。设置只接种PRV的阳性对照。分别收取细胞和病毒上清液,检测各组病毒基因组拷贝数和病毒滴度。
1.8 不同时间段加入姜黄素对PRV感染的影响
为了进一步探究姜黄素抑制病毒复制的具体过程,分别在PRV(MOI=0.1)感染的不同时间段添加姜黄素(20 μmol/L)处理IPEC-J2细胞。分组设置如下:1)感染前阶段(P1):在PRV感染前添加姜黄素预处理细胞24 h,1×PBS润洗后接种PRV,置于37 ℃和5% CO2条件下维持24 h;2)病毒吸附阶段(P2):姜黄素和PRV共同加入细胞中,吸附1 h,1×PBS润洗后置于37 ℃和5% CO2条件下维持24 h;3)感染后阶段(P3):PRV感染细胞后,用含姜黄素的细胞维持液在37 ℃和5% CO2条件下维持24 h;4)感染前和后2阶段(P4):在PRV感染前添加姜黄素预处理细胞24 h,1×PBS润洗后接种PRV,再用含姜黄素的细胞维持液在37 ℃和5% CO2条件下维持24 h;5)全阶段(P5):感染前、病毒吸附和感染后阶段,细胞培养液和维持液中均含有姜黄素,置于37 ℃和5% CO2条件下维持24 h。每组3个重复。设置只接种PRV的阳性对照。观察各组CPE,分别收取细胞和病毒上清液,检测各组病毒基因组拷贝数和病毒滴度。
1.9 姜黄素直接对PRV感染性的影响
将姜黄素(20 μmol/L)与溶于DMEM/F12中的PRV(MOI=0.1)直接混合,37 ℃孵育30 min,然后将混合物接种至IPEC-J2细胞中。设置不添加姜黄素的阳性对照。接种后置于37 ℃和5% CO2条件下维持24 h。观察CPE,分别测定病毒基因组拷贝数和病毒滴度。
1.10 荧光定量PCR检测基因表达量
采用荧光定量PCR方法检测病毒基因组拷贝数和IPEC-J2细胞免疫相关基因的表达量。按照总RNA提取试剂盒说明书提取细胞总RNA,测定浓度后取1 μg总RNA作为模板反转录成cDNA,加入ddH2O对cDNA进行5倍稀释,配制PCR体系。PCR体系如下:2×ChamQ SYBR qPCR Master Mix 5.0 μL,50×ROX Reference Dye I 0.2 μL,上、下游引物(10 μmol/L)各0.2 μL,cDNA 2.0 μL,ddH2O 2.4 μL,共10 μL。PCR反应程序如下:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,40个循环后进行熔解曲线分析。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因对样本进行归一化处理,每个样本重复3次。采用2-ΔΔCt法计算目的基因mRNA相对表达量。本试验所用引物序列如表1所示。
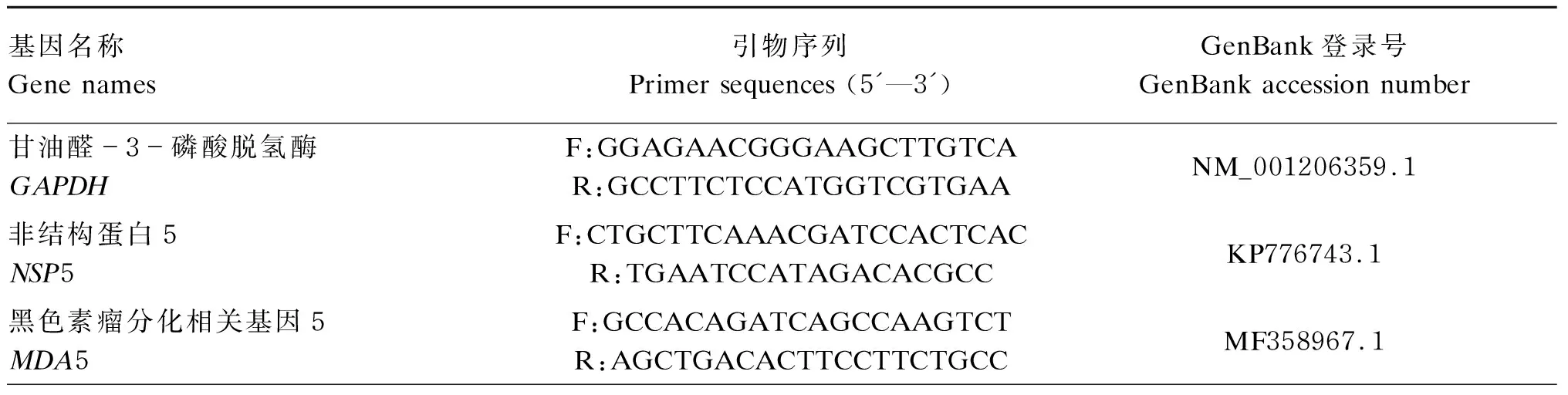
表1 荧光定量PCR所用引物序列

续表1基因名称Gene names引物序列Primer sequences (5'—3')GenBank登录号GenBank accession number线粒体抗病毒信号蛋白MAVSF:CTACTGCCTCCTCCTCCACTR:CAAATGCTGAGTTGGTGGGCMK302496.1髓样分化因子88MYD88F:GATGGTAGCGGTTGTCTCTGATR:GATGCTGGGGAACTCTTTCTTCMK302494.1Toll样受体适配器分子TRIFF:TGACGTCACAGACCAGAAGCR:GGGGAGCTGAAGAAAGGGTCMK302497.1干扰素诱导蛋白44样蛋白抗体 IFI44LF:GGCCCTATGCAGACTTGGTTR:CTATGGCCTGGCGAGTCAAAXM_021096421.1干扰素-βIFN-βF:CTTCGAGGTCCCTGAGGAGAR:TGACGGTTTCATTCCAGCCANM_001003923.1
1.11 数据结果统计与分析
利用SPSS 20软件对试验结果进行单因素ANOVA分析和Student-t检验,分析各组数据之间是否具有显著性差异。利用GraphPad(Prism 8.0)软件对统计结果进行图表绘制。其中,P<0.05表示差异显著并具有统计学意义;P<0.01表示差异极显著并具有统计学意义。
2 结果与分析
2.1 PRV感染破坏细胞形态并抑制细胞活力
在PRV感染IPEC-J2细胞后,分别于感染后6、12和24 h利用倒置光学显微镜观察CPE。结果显示,与对照组未感染细胞相比,PRV感染后6 h细胞开始出现皱缩变圆,12 h出现聚集拉网并部分脱落死亡,24 h完全病变,表现为细胞膜融合,细胞核固缩并空泡化,同时细胞大量脱落死亡,成碎片状漂浮于维持液中,结果如图1所示。收取病变细胞检测感染后病毒基因组复制水平,发现PRVNSP5基因拷贝数显著升高(P<0.05),并具有时间依赖性,结果如图2所示。通过CCK-8法对PRV感染后不同时间的细胞活力进行检测,发现细胞存活率在病毒感染后显著降低(P<0.05),并具有时间依赖性,结果如图3所示。
2.2 PRV感染显著提高细胞内ROS含量
在PRV感染IPEC-J2细胞后24 h收取病变细胞,利用流式细胞术检测细胞内ROS含量。结果显示,与正常未感染细胞相比,PRV感染后细胞内ROS含量极显著升高(P<0.01),结果如图4所示。
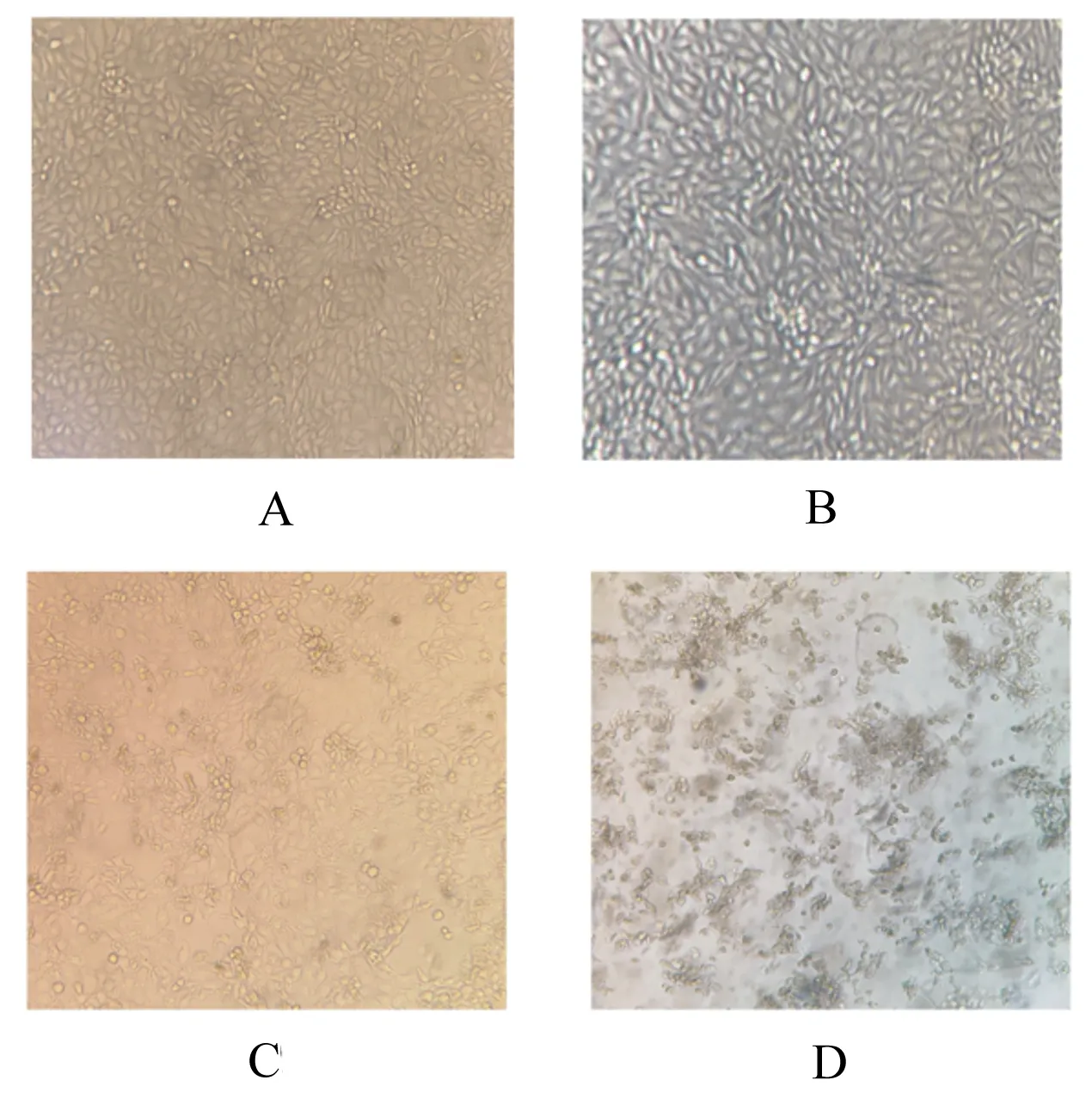
A:正常未感染;B:感染后6 h;C:感染后12 h;D:感染后24 h。
2.3 姜黄素对细胞活力的检测
将不同浓度的姜黄素处理IPEC-J2细胞24 h,通过CCK-8法检测不同浓度的姜黄素对细胞活力的影响。结果表明,0~20 μmol/L的姜黄素对IPEC-J2细胞的增殖没有明显影响,结果如图5所示。因此,本研究选择5和20 μmol/L作为工作浓度进行后续姜黄素相关试验。
2.4 姜黄素抑制PRV的复制与增殖
将不同浓度的姜黄素与PRV共同加入IPEC-J2细胞中,均于感染后24 h检测病毒基因组拷贝数和病毒滴度。结果表明,姜黄素显著抑制了PRV基因组复制,显著降低了病毒滴度(P<0.05),抑制了病毒在细胞内的增殖,并且抑制作用在20 μmol/L时最显著,结果如图6和图7所示。
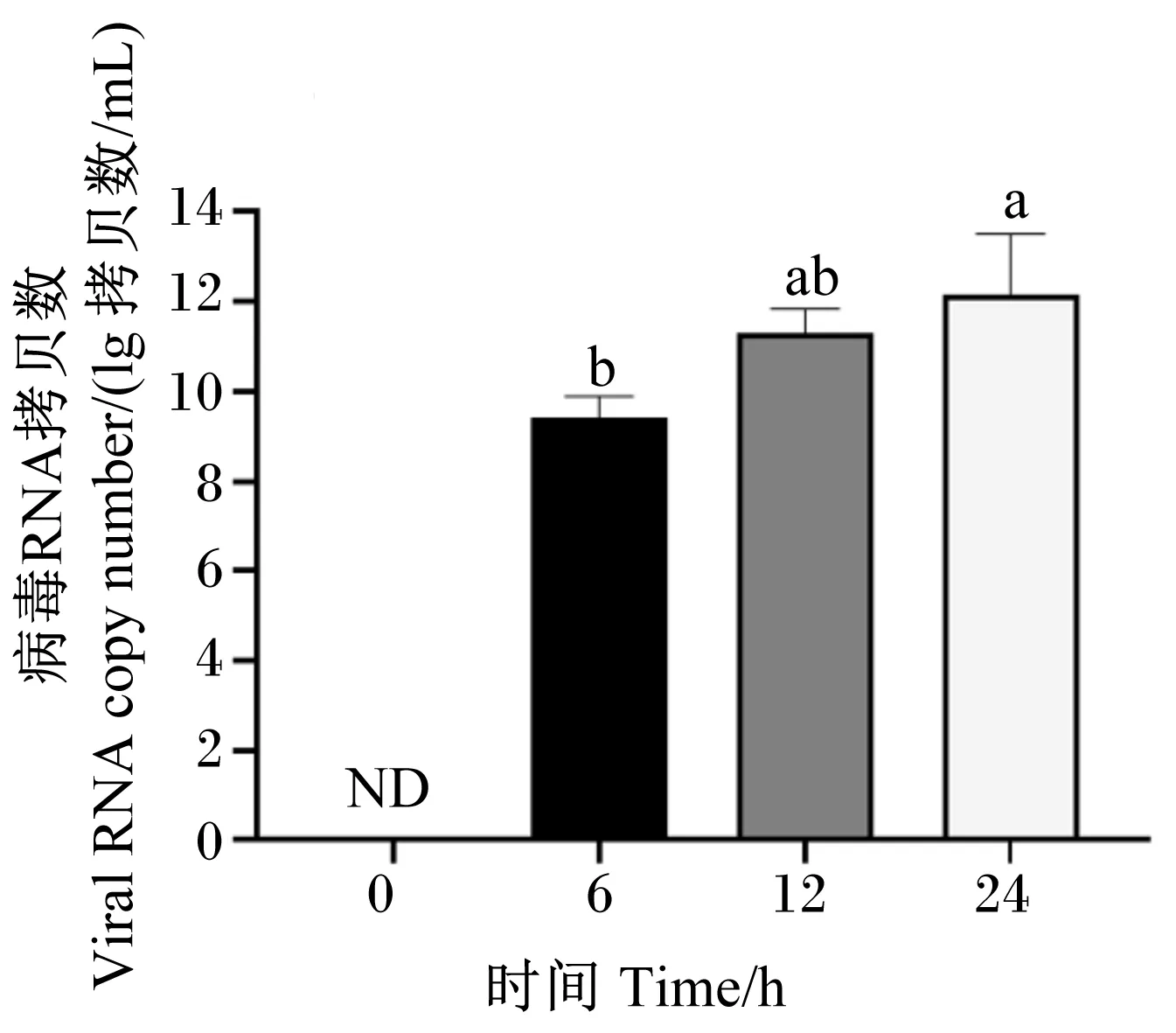
ND表示未检出;数据柱标注不同小写字母表示差异显著(P<0.05)。图3、图6、图7、图9、图10、图13同。
2.5 姜黄素在PRV吸附阶段发挥抑制作用
为了探究姜黄素在PRV感染过程中具体发挥作用的阶段,本研究设置了5个不同阶段的处理方式,均于感染后24 h观察CPE并检测病毒基因组拷贝数和病毒滴度。结果显示,在感染前阶段添加姜黄素预处理和病毒吸附阶段添加姜黄素均能在一定程度上抑制PRV感染,维持细胞形态,并显著降低病毒滴度,尤其是在吸附阶段抑制作用最为显著,而在感染后病毒复制阶段添加姜黄素对PRV复制无明显影响,结果如图8、图9和图10所示。
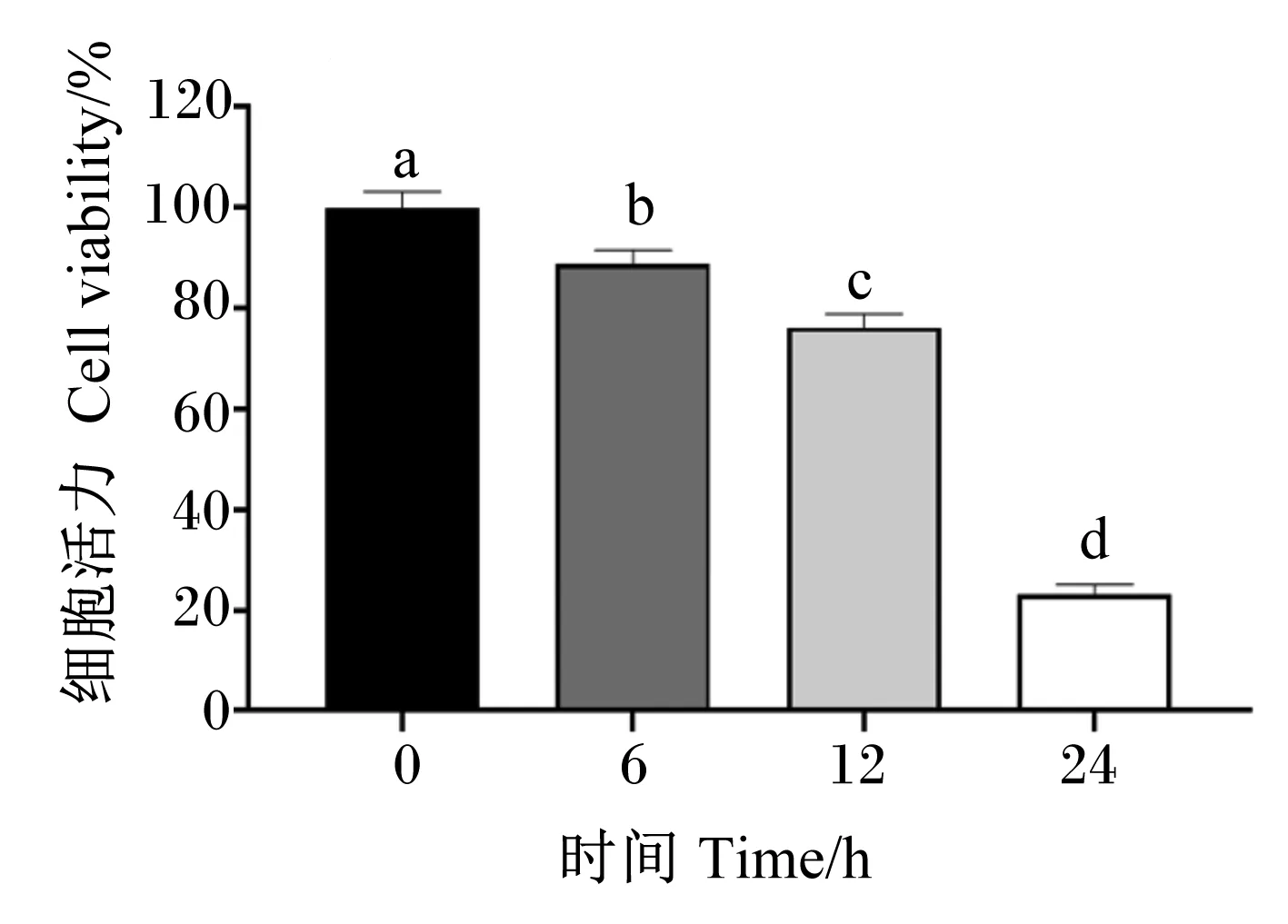
图3 PRV感染后IPEC-J2细胞活力
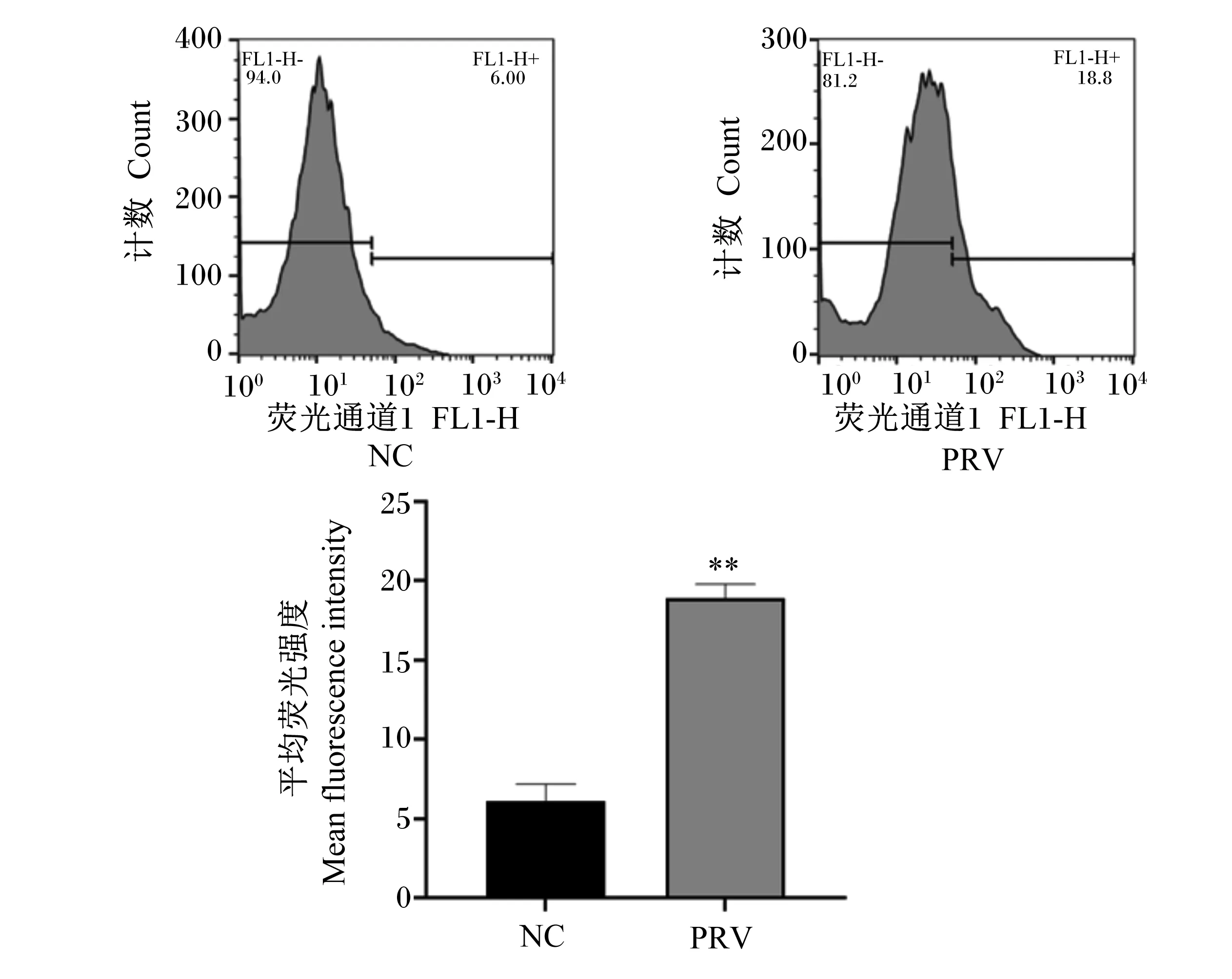
NC:正常未感染;PRV:感染后24 h;**表示差异极显著(P<0.01)。图12同。
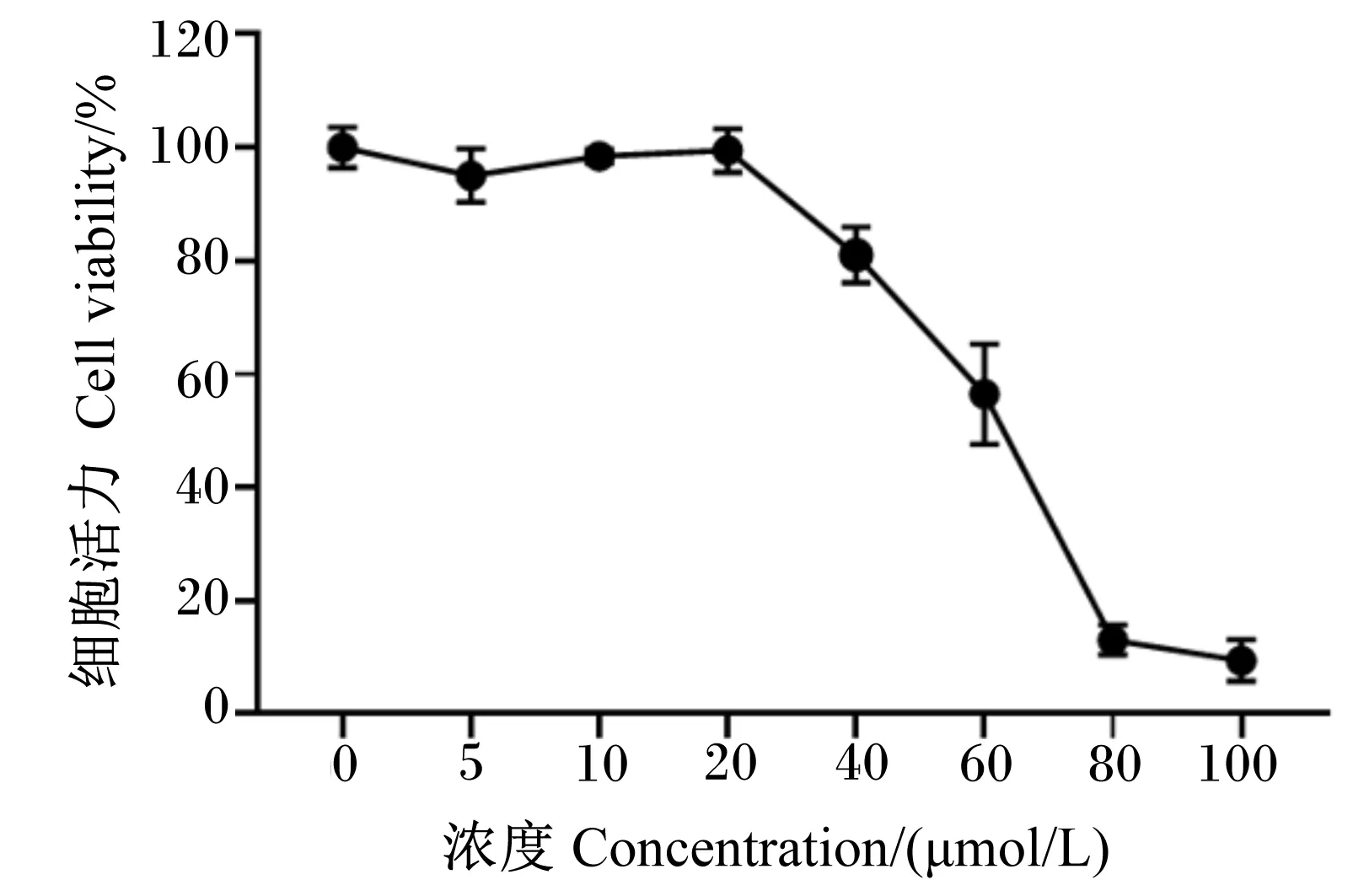
图5 姜黄素对IPEC-J2细胞活力的影响
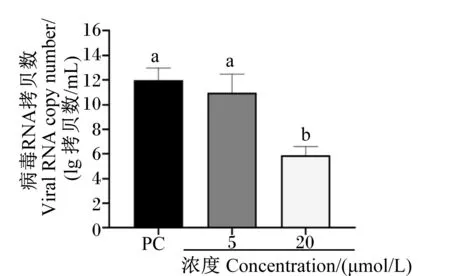
PC:阳性对照。
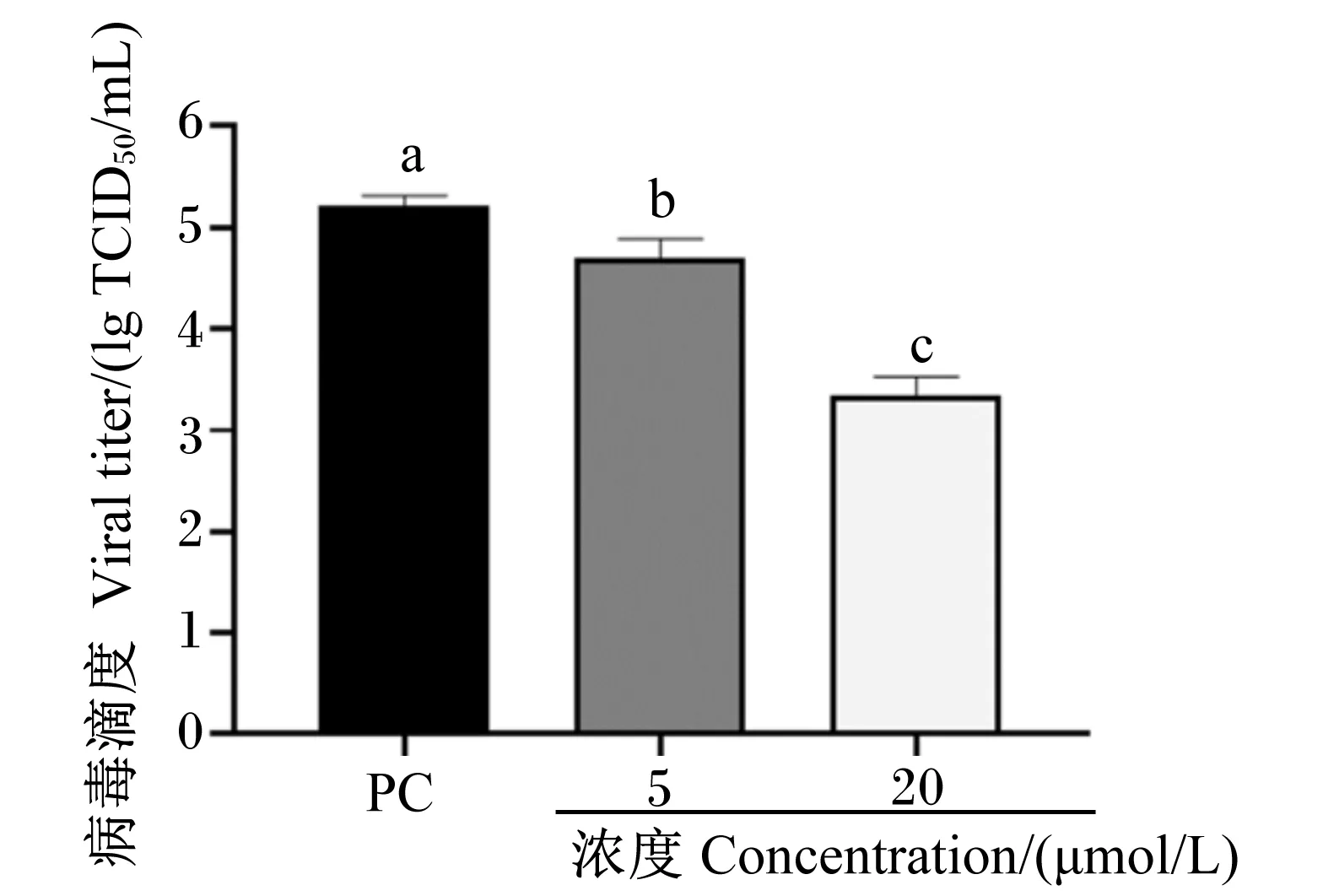
图7 姜黄素抑制PRV增殖呈剂量依赖性
2.6 姜黄素对PRV的直接影响
为了进一步明确姜黄素对PRV感染性的影响,将姜黄素与PRV在37 ℃条件下孵育30 min,然后感染IPEC-J2细胞。结果显示,与仅接种PRV的阳性对照相比,姜黄素处理后PRV的复制没有受到明显影响,但病毒滴度显著下降(P<0.05),提示姜黄素在一定程度上能直接影响病毒的感染性,结果如图11和图12所示。

PC:阳性对照;P1:感染前阶段;P2:病毒吸附阶段;P3:感染后阶段;P4:感染前和后2阶段;P5:全阶段。图9和图10同。

图9 不同阶段添加姜黄素对PRV基因组复制的影响
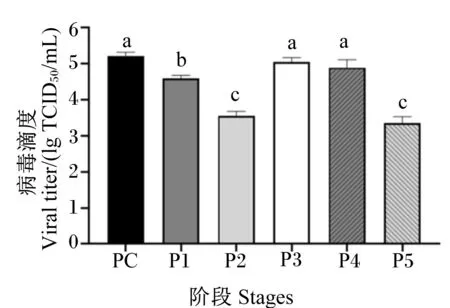
图10 不同阶段添加姜黄素对PRV滴度的影响

PC:阳性对照;CUR:姜黄素处理。图12同。
2.7 姜黄素影响感染PRV后细胞内免疫相关因子的表达
本研究通过荧光定量PCR检测了添加姜黄素对感染PRV后IPEC-J2细胞内免疫相关因子表达的影响。结果表明,与正常未感染细胞相比,感染PRV后细胞内模式识别受体黑色素瘤分化相关基因5(MDA5)、干扰素诱导因子干扰素诱导蛋白44样蛋白抗体(IFI44L)和干扰素-β(IFN-β)的mRNA相对表达量显著升高(P<0.05),但细胞内干扰素调节因子Toll样受体适配器分子1(TRIF)、抗病毒因子线粒体抗病毒信号蛋白(MAVS)和炎症因子髓样分化因子88(MYD88)的mRNA相对表达量显著降低(P<0.05)。与此相反的是,添加姜黄素后这些因PRV感染导致显著上调或下调的免疫相关因子的mRNA表达水平得到了显著恢复,结果如图13所示。该研究结果表明,PRV感染后,宿主通过识别病毒基因组激活干扰素信号通路抵抗病毒入侵,而姜黄素在细胞内发挥了抗病毒作用,缓解了因病毒感染导致的宿主免疫与炎症相关因子表达的失调。

图12 姜黄素直接影响PRV的感染性
3 讨 论
3.1 PRV感染对宿主细胞的影响
PRV感染导致的仔猪病毒性腹泻已成为阻碍全球养猪业健康发展的主要因素之一。研究表明,空肠和回肠的上皮细胞胞浆是PRV的主要感染和复制场所,可导致细胞变性死亡、肠绒毛萎缩和变短、阻碍水分吸收及电解质功能障碍等病理变化,从而造成仔猪脱水性死亡[14]。本研究发现PRV感染后显著破坏IPEC-J2细胞形态,进一步抑制了细胞的增殖,导致细胞大量死亡。同时,随着感染后时间的增加,PRVNSP5基因组拷贝数显著升高,证实病毒在细胞内大量复制。此外,病毒感染诱导的宿主氧化应激已在HIV[15]、IAV[16]、乙型肝炎病毒(HBV)[17]、HCV[18]和呼吸道合胞体病毒(RSV)[19]等的研究中被报道。类似的,本研究发现PRV感染可导致细胞内ROS含量显著升高,而过量的ROS已被证实是细胞内氧化应激的诱因之一[20],因此我们推测PRV感染通过上调ROS含量诱导细胞内氧化应激,进一步导致了细胞的裂解死亡,提示ROS可能参与病毒复制与细胞反应,从而促进病毒的感染。
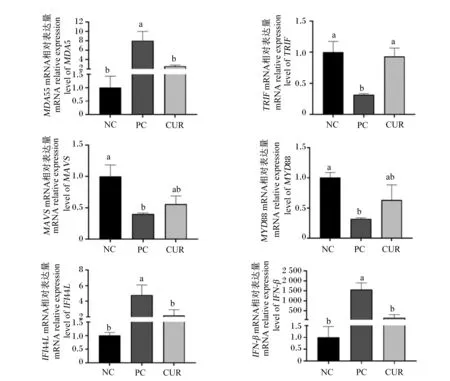
NC:正常未感染;PC:阳性对照;CUR:姜黄素处理。
3.2 姜黄素对PRV感染的影响
既往研究表明,源自植物的天然化合物可成为新型抗病毒药物研发的重要来源[8]。值得注意的是,作为源自姜科植物姜黄的一种天然化合物,姜黄素近年来被广泛报道具有抵御不同病毒科的病毒感染的强大抗病毒作用。大量研究证实姜黄素能影响病毒整合酶、蛋白酶和反式转录激活因子蛋白等多种病毒蛋白的功能,从而抑制HIV的复制[21-23]。Dutta等[24]研究指出姜黄素通过失调的泛素蛋白酶体系统和泛素化蛋白的积累抑制乙型脑炎病毒的复制。有趣的是,姜黄素被发现可通过抑制囊膜病毒与细胞表面的吸附从而抑制ZIKV、HCV和CHIKV的复制[11-12]。本研究结果表明,姜黄素能够抑制PRV在IPEC-J2细胞内的复制与增殖,并具有剂量依赖性。通过分析姜黄素对病毒生命周期的影响,本研究发现姜黄素主要在PRV吸附和穿透细胞阶段发挥抑制作用,但并未影响感染后期病毒的复制,这与最近报道的姜黄素对猪传染性胃肠炎病毒(TGEV)[25]和马立克氏病病毒(MDV)[26]的抑制作用类似,提示姜黄素或许可以作为一种预防初始感染的有效手段,但对控制已发生的感染无效。此外,Du等[27]研究报道姜黄素与猪繁殖与呼吸综合征病毒(PRRSV)直接孵育后可防止Marc-145细胞被感染,而本研究结果表明姜黄素与PRV直接孵育也具有一定的抗感染效果。
3.3 姜黄素对感染后细胞内免疫相关因子的影响
越来越多的证据显示姜黄素通过调控宿主的抗病毒信号通路及免疫相关因子发挥抗病毒作用。冯春等[26]研究显示姜黄素显著影响了感染MDV后细胞内IFN-β、ISG12-2、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等免疫和炎症因子的mRNA表达。本研究结果表明,PRV感染后刺激了细胞内MDA5、IFI44L和IFN-β的mRNA高度表达,同时抑制了部分抗病毒和炎症因子的mRNA表达,但姜黄素能显著缓解上述因子表达的失调,提示姜黄素可能通过影响MDA5-IFN信号通路的激活在细胞内发挥了特定的抗病毒作用,在一定程度上抵御了病毒对细胞的侵袭。然而,鉴于PRV的感染及传播机制尚不明晰,因此姜黄素在病毒与宿主细胞的互作中发挥作用的具体机制还有待今后进一步研究。
4 结 论
本研究结果表明,PRV感染导致猪肠上皮细胞出现明显病变,诱导细胞ROS含量升高并造成细胞大量死亡,首次证实姜黄素具有显著抑制PRV感染猪肠上皮细胞的抗病毒作用,显著缓解了PRV感染对猪肠上皮细胞活力和免疫相关因子的不利影响,有望开发成新型抗病毒药物或新型饲料添加剂,为我国养猪生产提供重要的保障。
