丁酸钠对脂多糖诱导的奶牛乳腺上皮细胞系炎性损伤的修复作用
2022-03-10宫彬彬许长锋李建嫄唐伟斌
李 林 宫彬彬 许长锋 曹 萌 李建嫄 赵 梅 唐伟斌
(1.邢台学院生物科学与工程学院,邢台054001;2.河北医科大学附属邢台人民医院病理科,邢台054001)
随着人们生活水平的不断提高和营养结构的改变,人们的饮食习惯正逐步向更健康、更营养的方向发展。牛奶作为一种天然的营养食品,人们对牛奶的需求也发生了量到质的转变。在奶牛养殖业中,经常用高精料饲粮喂养泌乳期的奶牛以获得更高的产奶量。但是,高精料饲粮与粗饲料相比,其有效纤维含量有限,所以往往会引起瘤胃pH的降低,导致瘤胃微生物的裂解,提高瘤胃壁的渗透能力,使大量细菌组分,如脂多糖(lipopolysaccharide,LPS)等得以转运进入血液循环,造成奶牛的亚急性瘤胃酸中毒(subacute rumen acidosis,SARA)。蹄叶炎、胃肠道损伤、肝脓肿和乳腺炎是SARA常见的临床症状。研究发现,LPS作为大肠杆菌等革兰氏阴性菌的外膜成分,能够通过血液循环从乳管侵入乳腺,改变乳腺上皮细胞内稳态,提高炎症因子的表达,并对乳腺组织造成严重损伤[1]。
丁酸钠作为一种新型的饲料添加剂,有效成分是丁酸,其作为挥发性脂肪酸的一种,主要由膳食纤维的肠道微生物发酵产生,是中枢神经系统中重要的神经调节剂[2-3]。研究发现,丁酸钠作为饲料添加剂能够增强新生牛犊的抗氧化能力[4],并且对机体生长性能和肠道完整性具有非常显著的作用[5-7]。此外,丁酸钠还具有刺激机体氧化磷酸化、保护线粒体和加速脂肪酸氧化的功能[8-10]。体内研究已经证实丁酸钠对奶牛组织器官的抗炎、抗损伤方面发挥着相当重要的作用,但其在奶牛乳腺组织方面的研究较少,且不深入。因此,本试验在丁酸钠作为新型饲料添加剂的基础上,初次运用于奶牛乳腺上皮细胞系(MAC-T细胞),通过向MAC-T细胞中添加丁酸钠,分析丁酸钠对MAC-T细胞的修复作用与调节机制,为丁酸钠在改善泌乳期奶牛健康方面的研究提供理论依据。
1 材料与方法
1.1 细胞来源
MAC-T细胞由南京农业大学张源淑教授馈赠。
1.2 试验设计
1.2.1 MAC-T细胞的培养、传代
MAC-T细胞培养于DMEM培养基中(10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素及4.5 g/L葡萄糖),每隔24 h更换1次新培养基,在37 ℃、含5% CO2的细胞培养箱中进行培养。当融合度达到80%~90%时,用含0.25%胰酶和0.02%乙二胺四乙酸(EDTA)的消化液消化,1 500×g离心3 min,小心弃掉上清,将MAC-T细胞分别接种于6孔板、12孔板以及96孔板中。
1.2.2 LPS诱导MAC-T细胞损伤模型的建立
将MAC-T细胞接种于96孔板内(5×104个/孔),分别加入含有不同浓度(0、1、10、100、1 000、10 000 ng/mL)LPS的无血清培养基;在37 ℃、含5% CO2的细胞培养箱中分别培养6 h(预试验结果)。然后每孔加入20 μL的5 mg/mL四甲基偶氮唑盐(MTT)溶液,继续培养4 h后,将上清弃去,每孔分别加入150 μL二甲基亚砜(DMSO)溶液,微量振荡器振荡,于RT-6000半自动生化分析仪上检测各孔490 nm处的吸光度值,每组设置8个平行孔。
根据MTT检测结果,确定LPS诱导MAC-T细胞损伤模型的适宜浓度为1 000 ng/mL。
1.3 试验方法
1.3.1 流式细胞术检测细胞凋亡
将MAC-T细胞培养于6孔板当中,当细胞融合度达到80%~90%时,用不同浓度(0、2、4、8、16、32 μmol/L)的丁酸钠处理细胞24 h(预试验结果)。收集细胞后加入200 μL的Annexin V-异硫氰酸荧光素(FITC)原液重悬细胞,4 ℃避光孵育30 min,再加入10 μL碘化丙啶(PI),避光孵育15 min,采用美国BD FACS Calibur型流式细胞术检测荧光强度,计算细胞凋亡率。
根据检测结果,确定16 μmol/L丁酸钠对MAC-T细胞无不良影响。
1.3.2 丁酸钠对LPS作用下MAC-T细胞生长的影响
将MAC-T细胞培养于12孔板当中,用1 000 ng/mL的LPS预处理6 h,然后清洗细胞,再用16 μmol/L丁酸钠处理24 h,用显微镜观察细胞生长状况并拍照。
1.3.3 丁酸钠对LPS作用下MAC-T细胞氧化应激相关指标检测
当MAC-T细胞在6孔板中融合度达到80%~90%时,用1 000 ng/mL的LPS预处理6 h,然后清洗细胞,再用16 μmol/L丁酸钠处理24 h,收集细胞用超声破碎仪进行破碎,2 500×g、4 ℃离心10 min,收集上清液,暂保存至-20 ℃。超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量及总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒均购于南京建成生物工程研究所(批号分别为20201010、20201121、20210210),分别严格按照试剂盒说明书进行操作测定,每个样品重复测定5次。
1.3.4 丁酸钠对LPS作用下MAC-T细胞凋亡蛋白mRNA的表达
总RNA提取与cDNA合成:将处理完收集的MAC-T细胞用TRIzol试剂根据RNA提取试剂盒说明书提取总RNA。用紫外可见分光光度计检测总RNA的纯度和浓度,取1 μg总RNA根据cDNA合成试剂盒进行反转录得到cDNA。
目的基因及内参基因β-肌动蛋白(β-actin)引物设计:目的基因及内参基因β-actin引物根据GenBank序列,用Primer Premier 5软件自行设计,引物由上海生工公司合成,目的基因及β-actin引物序列见表1。
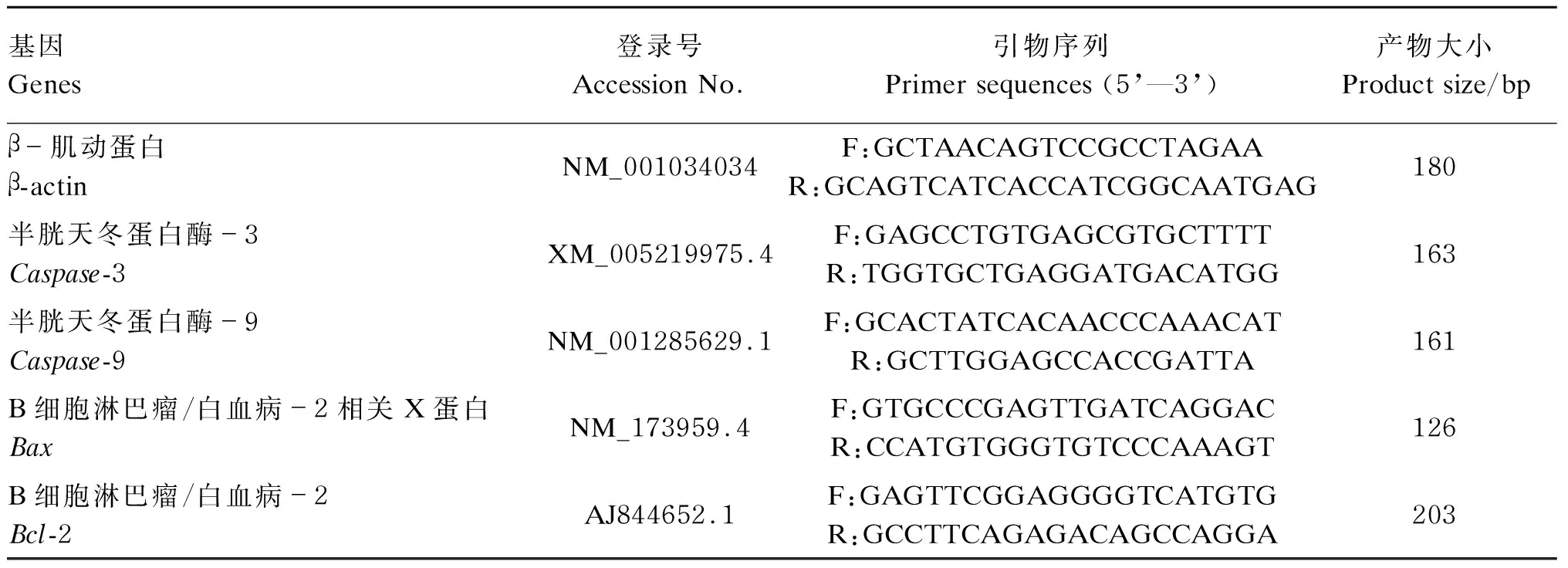
表1 目的基因及β-actin引物序列
1.4 数据统计分析
采用SPSS 18.0软件进行单因素方差分析(one-way ANOVA)和LSD多重比较,以P<0.05表示差异显著,P<0.01表示差异极显著。数据均用平均值±标准差(mean±SD)表示。
2 结 果
2.1 LPS对MAC-T细胞活力的影响
由图1所示,用不同浓度LPS处理MAC-T细胞6 h后,与对照组相比,在100 ng/mL的LPS处理下,MAC-T细胞活力显著下降(P<0.05);在1 000、10 000 ng/mL的LPS处理下,MAC-T细胞活力极显著下降(P<0.01)。而预试验结果显示,丁酸钠对10 000 ng/mL的LPS处理下MAC-T细胞无修复作用。因此,本试验选用1 000 ng/mL的LPS来建立MAC-T细胞的损伤模型。
2.2 丁酸钠对MAC-T细胞凋亡率的影响
由图2所示,用不同浓度丁酸钠处理MAC-T细胞24 h后,与对照组相比,在32 μmol/L的丁酸钠处理下,MAC-T细胞凋亡率显著上升(P<0.05);而在2~16 μmol/L的丁酸钠处理下,MAC-T细胞凋亡率差异不显著(P>0.05)。因此,选用16 μmol/L的丁酸钠进行后续试验。

*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。图2同。
2.3 丁酸钠对LPS诱导的MAC-T细胞形态的影响
由图3所示,对照组MAC-T细胞呈扁平的无规则形态,贴壁状态良好;而1 000 ng/mL LPS处理6 h后,与对照组相比,LPS处理组MAC-T细胞核固缩、破裂,细胞内颗粒较多,并出现大面积死亡脱落现象;而用16 μmol/L丁酸钠处理24 h后,与LPS处理组相比,LPS+丁酸钠处理组MAC-T细胞边缘清楚,胞内颗粒较少,死亡脱落现象明显减少。
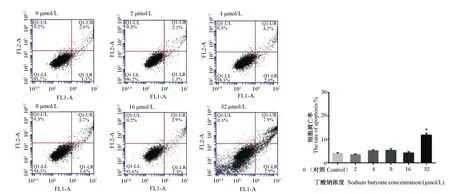
图2 丁酸钠对MAC-T细胞凋亡率的影响
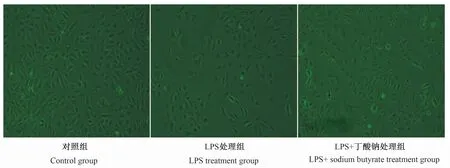
图3 丁酸钠对LPS诱导的MAC-T细胞形态的影响
2.4 丁酸钠对LPS诱导的MAC-T细胞氧化应激指标的影响
由表2所示,用1 000 ng/mL的LPS处理6 h后,与对照组相比,LPS处理组MAC-T细胞中SOD活性和T-AOC显著降低(P<0.05),而MDA含量显著升高(P<0.05);而用16 μmol/L丁酸钠处理24 h后,与LPS处理组相比,LPS+丁酸钠处理组MAC-T细胞中SOD活性和T-AOC显著升高(P<0.05),而MDA含量显著降低(P<0.05)。
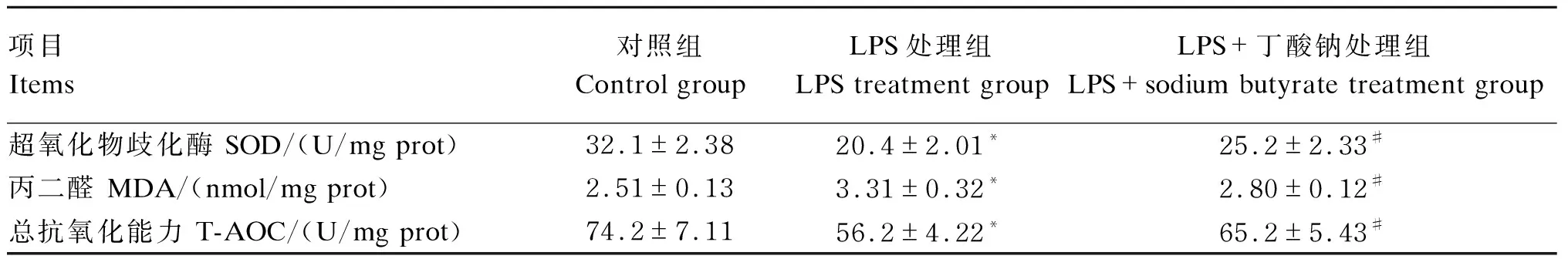
表2 丁酸钠对LPS诱导的MAC-T细胞氧化应激指标的影响
2.5 丁酸钠对LPS诱导的MAC-T细胞凋亡蛋白mRNA表达水平的影响
如图4所示,用1 000 ng/mL的LPS处理6 h后,与对照组相比,LPS处理组MAC-T细胞中半胱天冬蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、半胱天冬蛋白酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)、B细胞淋巴瘤/白血病-2相关X蛋白(B-cell lymphoma/leukaemia-2-associated X protein,Bax)mRNA表达水平显著或极显著升高(P<0.05或P<0.01),而B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukaemia-2,Bcl-2)mRNA表达水平极显著降低(P<0.01);而用16 μmol/L丁酸钠处理24 h后,与LPS处理组相比,LPS+丁酸钠处理组MAC-T细胞中Caspase-3、Caspase-9 mRNA表达水平显著下降(P<0.05),而Bcl-2 mRNA表达水平显著升高(P<0.05)。
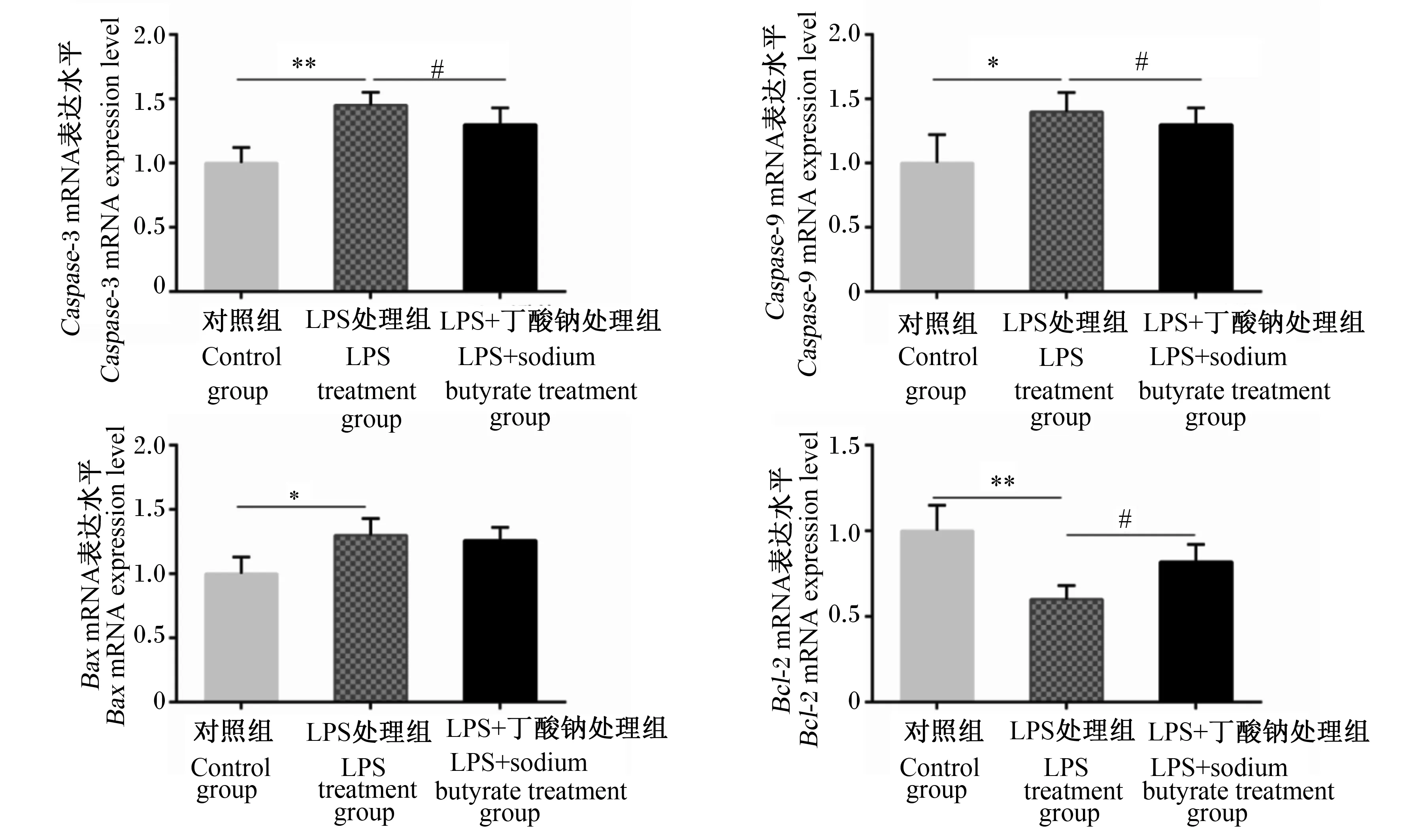
*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01),#表示与LPS处理组相比差异显著(P<0.05)。
3 讨 论
泌乳期奶牛长期饲喂高精料饲粮会往往会引发许多机体健康问题,如机体酸中毒、乳腺炎、蹄叶炎等。其主要原因是由于高精料饲粮会导致瘤胃挥发性脂肪酸含量增加,瘤胃pH下降。这种较低的瘤胃pH会对瘤胃造成不利影响,扰乱瘤胃微生物群的组成[11-12]。而且,低瘤胃pH会引起革兰氏阴性菌菌体裂解产生内毒素[13],其可以通过胃肠道进入体循环,引起全身的炎症反应[14]。研究发现,高精料饲粮会导致泌乳期奶牛机体健康受损,抗氧化应激能力下降,最终导致乳品质的降低[15]。乳品质的降低主要与奶牛乳腺炎的发生有关,而造成乳腺炎的根因往往是由于外源性或内源性的细菌如LPS的感染而引起的氧化应激,从而触发了免疫应答,诱导了乳腺细胞内抗原的产生[16]。
体外培养的MAC-T细胞由于缺乏机体系统性的保护机制,因此极容易发生氧化损伤,LPS作为细胞凋亡诱导剂已在体外模型中得到广泛应用[17]。Wang等[18]用不同浓度的LPS诱导小鼠乳腺上皮细胞,发现1 000和10 000 ng/mL LPS可造成小鼠乳腺上皮细胞的炎性损伤。Zhang等[19]研究发现,1 000 ng/mL LPS可造成MAC-T细胞存活率显著降低,并且炎症水平明显升高。在本试验中,通过LPS诱导的MAC-T细胞损伤模型发现,在LPS处理细胞6 h后,随着LPS浓度的升高,MAC-T细胞活力下降。并且,100 ng/mL LPS处理可显著降低细胞存活率,1 000和10 000 ng/mL LPS处理可极显著降低细胞存活率。本试验和前人研究结果一致。根据预试验结果,发现丁酸钠对10 000 ng/mL LPS处理造成的细胞损伤不具备修复作用。因此,在后续试验中我们选择1 000 ng/mL的LPS作为适宜的处理浓度。
丁酸盐作为一种安全的抗生素替代品,在养殖业受到广泛关注。但丁酸盐有异味且不稳定,而丁酸钠由于其稳定、无臭的特性而被广泛用于畜牧生产中。研究表明,丁酸钠对胃肠道上皮细胞的能量来源具有重要作用,并且还具有抗菌、抗炎和抗氧化特性。最近研究表明,丁酸钠还可以通过改善肉鸡的生长性能、抗氧化能力和肉品质来缓解LPS对肉鸡的不利影响[20]。Zhou等[21]研究发现,丁酸钠可以通过改善肠道微生物群和胃肠道屏障,减轻高脂饮食诱导的小鼠脂肪性肝炎。Qiu等[22]用不同浓度的丁酸钠处理猪小肠上皮细胞(IPEC-J2细胞),结果发现低浓度的丁酸钠对细胞增殖无显著影响,而高浓度的丁酸钠会通过诱导细胞周期阻滞(G0/G1期)来增加细胞凋亡。本试验用不同浓度的丁酸钠处理MAC-T细胞24 h后,通过流式细胞术分析发现,适当浓度(2~16 μmol/L)的丁酸钠对细胞无不良影响,而在32 μmol/L丁酸钠处理下,其细胞凋亡率显著上升。这表明高浓度的丁酸钠会造成细胞的非正常凋亡,其结果与前人研究一致。因此,我们选用16 μmol/L的丁酸钠作为适宜的处理浓度进行后续试验。
氧化反应对身体至关重要,但过量的氧化反应可能造成组织损伤。活性氧(reactive oxygen,ROS)是线粒体生理代谢的副产物,可参与多种细胞信号通路以及组织损伤和病理生理过程。当ROS的产生超过抗氧化防御能力或缺乏最佳水平的抗氧化剂,这些物质可能就会引起氧化应激[23-25]。在家畜中,几种疾病如肺炎、小肠的炎症和乳腺炎都与氧化应激有关,且有研究报道认为乳腺氧化损伤和乳腺炎是随着血清中氧化应激的相关指标如MDA、一氧化氮(NO)等含量的增加而发生的。Salimi等[26]试验发现,丁酸钠可以通过ROS的形成和线粒体损伤促进乳腺癌细胞凋亡。Sun等[27]研究发现,丁酸钠可以保护大鼠肝脏免受高脂饮食诱导的机体氧化应激反应。因此,我们通过检测细胞的抗氧化酶类的活性,确认丁酸钠的抗氧化能力是否与细胞环境中ROS清除有关。SOD作为一种抗氧化酶,能够及时清除具有活性的氧自由基,可以通过降低细胞外刺激(如紫外线照射)诱导的细胞内高水平超氧化物自由基而发挥作用。本试验研究发现,对照组MAC-T细胞呈扁平的无规则形态,贴壁状态良好;而1 000 ng/mL LPS处理6 h后,与对照组相比,MAC-T细胞的细胞核固缩、破裂,并出现大面积死亡脱落现象,MDA含量显著升高,而SOD活性和T-AOC显著降低;而用16 μmol/L丁酸钠处理24 h后,与LPS处理组相比,细胞死亡脱落现象明显减少,MDA含量显著降低,SOD活性和T-AOC显著升高。以上结果提示,丁酸钠能够缓解LPS造成的MAC-T细胞的氧化应激状态。
ROS在衰老、炎症和癌症中发挥重要作用。ROS也可以通过刺激质膜死亡受体来启动细胞凋亡。细胞凋亡是一种程序化的细胞死亡形式,导致受损细胞(如DNA损伤或发育过程中产生的细胞)的有序和有效清除。细胞凋亡可以由细胞的内部信号(如基因毒性应激)或外部信号(如配体与细胞表面死亡受体的结合)触发。Bcl-2家族是最具代表性的参与凋亡细胞死亡调控的蛋白家族,包括抗凋亡和促凋亡成员[28]。Zhou等[29]研究发现,丁酸钠可以通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,抑制大脑中动脉闭塞模型小鼠Bax等凋亡因子的上升。本试验发现,在LPS诱导的MAC-T细胞中,Caspase-3、Caspase-9、BaxmRNA表达水平显著或极显著升高,而Bcl-2 mRNA表达水平却极显著降低。但是,当向细胞中添加丁酸钠以后,与LPS处理组相比,MAC-T细胞中的凋亡蛋白Caspase-3、Caspase-9 mRNA表达水平显著降低,而抗凋亡的蛋白Bcl-2 mRNA水平表达显著升高。另外,LPS+丁酸钠处理组中Caspase-3、Caspase-9和BaxmRNA表达水平高于对照组,而Bcl-2 mRNA表达水平却低于对照组。以上结果提示,丁酸钠对LPS造成的MAC-T细胞损伤起到了一定的修复作用,减少了细胞的凋亡,其作用机制可能与凋亡相关的信号通路有关,具体原因有待进一步分析。
4 结 论
用1 000 ng/mL LPS处理MAC-T细胞会造成MAC-T细胞的非正常凋亡和氧化应激损伤;而16 μmol/L丁酸钠可以抑制MAC-T细胞的凋亡,并对LPS造成的氧化应激损伤起到一定的修复作用。
